Method Article
İn Vivo Yaprak Aşılaması: Kök Pamukçuk Hastalığının Kavak Yetiştiriciliğinde Hibrit Klonların Hastalık Direncini Değerlendirmek İçin Alternatif Bir Yöntem
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bir in vivo yaprak aşılama yöntemi kullanarak kavağın kök pamukçuk patojenlerine karşı direncini değerlendirmek için adım adım bir protokol sunuyoruz. Bu yöntem özellikle Çin'deki kavak damızlık döllerde Cytospora chrysosperma ve Botryosphaeria dothidea pamukçuk hastalığı direncinin büyük ölçekli değerlendirmesi için uygundur.
Özet
Cytospora chrysosperma (Pers.) Fr.) ve Botryosphaeria dothidea (Moug. ex Fr.) Ces. Çin'deki kavak plantasyonlarında bulunan ve bazen tüm kavak fidelerini yok edebilen veya olgun kavak ormanlarına ciddi şekilde zarar verebilen iki büyük orman hastalığıdır. Hibrit ıslah, ağaç hastalıklarını kontrol etmenin ve yönetmenin en doğrudan ve etkili yöntemidir. Bununla birlikte, in vitro kök inokülasyonuna dayalı olarak hastalık direncinin değerlendirilmesi veya hastalığa dirençli klonların seçilmesi verimsiz, zaman alıcı ve pahalıdır ve kavak sapı pamukçuk hastalığının melez üremesinin gelişimini sınırlar. Bu çalışmada, in vivo yaprak aşılaması yoluyla kök pamukçuk patojenlerine karşı hastalık direncini değerlendirmek için alternatif bir yöntem önerdik. Bu yöntemde kullanılan test malzemeleri, 1 yaşındaki kavak fidanları üzerinde olabileceği gibi, serada veya tarlada bulunan çok yıllık kavakların tek yıllık dalları üzerinde de olabilir. Bu alternatif yöntemin kritik adımı, aşılayıcı yaprakların seçimidir: 5-7. yeni olgunlaşmış yapraklar en uygun olanı olabilir. Yaprak aşılama yönteminin ikinci kritik adımı, iğne delikleri yoluyla bitki yapraklarında yaralar açmak ve hastalık şiddetini ölçmek için yeterli lezyonları sağlamaktır. Kavak ıslahının erken aşamasında üretilen yeterli sayıda yaprak için, bu in vivo yaprak aşılaması, hastalığa dirençli kavak klonlarının pamukçuk patojenlerini köklendirmek için hızlı, doğru ve büyük ölçekli taramasına katkıda bulunur. Ayrıca, bu yaprak aşılama yöntemi, kök pamukçuk hastalığı patojeni C. chrysosperma, B. dothidea veya diğer kavak sapı pamukçuk patojenlerinin patotiplerinin taranması için de etkili bir yöntem olarak hizmet edecektir.
Giriş
Esas olarak iki nekrotrofik patojenin neden olduğu kavak sapı pamukçuk hastalıkları, Cytospora chrysosperma (Pers.) Fr. ve Botryosphaeria dothidea (Moug. ex Fr.) Ces. Çin'in Kuzeydoğu, Kuzey ve Kuzeybatı (Üç Kuzey) bölgelerindeki kavak tarlalarının gelişimini ve hayatta kalmasını ciddi şekilde tehdit ediyor. Hibrit ıslah, ağaç hastalıklarını kontrol etmek ve yönetmek için en doğrudan ve verimli yöntemdir; Bununla birlikte, yüksek verimli, hızlı büyüyen veya diğer kavak melezi klonları için ıslahtaki ilerleme ile karşılaştırıldığında, kavak pamukçuk hastalığı için direnç ıslahı üzerine araştırmalar azdır. Hastalığa dirençli melez ıslahı ile ilgili sadece sınırlı sayıda çalışma bildirilmiştir 1,2,3 ve kavak ağaçlandırmasında pamukçuğa dirençli hibrit klon yetiştirilmemiştir.
Düzenli melez ıslahının en önemli adımı, melez döllerin fenotip edinimine dayalı klon seçimidir. Ancak patolojik fenotiplerin (patotiplerin) edinimi zaman alıcı, zahmetli, yorucu, pahalı ve uzmana bağlı bir süreçtir. Odunsu bitkiler için, uzun yaşam döngüleri, yavaş büyümeleri ve iri gövdelerinin neden olduğu zaman, emek ve ekonomi tüketen doğası nedeniyle daha zordur. Örneğin, kavakta, melez döllerin pamukçuk direnci taraması, konvansiyonel in vitro gövde aşılama yöntemleri ile hibridizasyondan 5-7 yıl sonra gerçekleştirilmiştir 1,2,3. Dahası, bu düşük verimli ve yüksek tüketen hastalığa dirençli tarama yöntemiyle sınırlı olan araştırmacılar, pamukçuğa dirençli klonları, tüm melez soylardan değil, küçük bir alt gruptan (örneğin, seçilen yüksek verimli veya hızlı büyüyen kavak klonları) yeniden seçtiler. Bu nedenle, düzenli kök aşılama yöntemlerini kullanarak, otantik dirençli klonları tanımlamaktan emin değildir ve üreyen döllerin hastalığa dirençli çeşitliliğini ortaya çıkaramaz, bu nedenle hastalık direnci ile ilgili genlerin veya gen modüllerinin araştırılmasını sınırlar. Kavak hızlı büyüyen/yüksek verimli ıslahın hızlı gelişimi ile karşılaştırıldığında, bu ıslah programları, ıslahın ilk iki yılında fenotipik seleksiyon ve hatta genomik seleksiyon yoluyla melezler elde edebilir4, kavak pamukçuğuna dirençli ıslah yavaş gelişmiştir. Melez döllerin hastalığa dirençli taraması (veya tespiti) veya patojen aşılama yöntemi, kavak pamukçuk hastalığına dirençli ıslahta çok önemli hız sınırlayıcı adım haline gelmiştir.
Bu protokolde, kavak sapı aft patojenleri için yeni bir aşılama yöntemi olan in vivo yaprak aşılama yöntemi tanıtılmıştır. Bu yöntemi kullanarak, onlarca kavak türünün (çeşitler veya klonlar) pamukçuk hastalığına direncini 5-7 gün içinde hızlı ve verimli bir şekilde test edebiliriz. Doğrulama testi, in vivo yaprak aşılamasının, kök pamukçuk hastalığının direnç tespitinde geleneksel in vitro gövde aşılaması ile tutarlı olduğunu göstermiştir, bu da yaprak aşılama yönteminin, kök pamukçuk hastalığının ıslahında direnç döllerinin tüm genotip seçimi gibi kavak pamukçuk hastalıklarının büyük ölçekli direnç taraması için uygun olduğunu düşündürmektedir. Bu yöntem, kavak pamukçuk hastalıklarının melez ıslahında dirençli yavru seçiminin patolojik problemini çözmektedir.
Protokol
1. Aft patojeni için mantar kültürü
- Mantar suşları için patates dekstroz agar (PDA; patates ekstraksiyonu 6.0 g, dekstroz 20.0 g, agar 20.0 g) kültür ortamını hazırlayın; Yukarıdaki malzemeleri 1000 mL'ye kadar suda çözün, ortamı 100 ° C'de 10 dakika boyunca tamamen çözün.
- PDA ortamını 25 mL'lik tüplere dökün (her biri 15.0 mL içerir); Tüm tüpleri 121.1 °C'de 30 dakika sterilize edin. Ortamı kültür plakalarına (9.0 cm çapında) dökün ve plakaları oda sıcaklığında (RT) soğutun.
- PDA ortamında 28 ° C'de 7 gün boyunca kültürlenen mantar patojeninin miselyumunu ~ 0,5 cm kare küpler halinde kesin; Mantar küplerini PDA plakalarının merkezine aşılayın (miselyum tarafları ortama bakar).
- Mantar patojenlerini 7-10 gün boyunca termostatik bir inkübatörde (28 ° C, karanlıkta) kültürleyin.
- Mantar miselyumlu PDA ortamını kare küpler halinde kesin (kenar uzunluğu 1.0-1.2 cm).
2. Kavak malzemelerinin hazırlanması
- 1 yaşındaki kavak klonları için (3 aydan > yetiştirilen), ana dalların yeni olgunlaşmış, tamamen uzamış yapraklarını (her zaman fida/dalların tepesinden 5-7. yapraklar) aşılanan materyal olarak seçin, zararlılardan, hastalıklardan ve mekanik hasarlardan arınmış olduklarından emin olun.
- Çok yıllık kavak melezi klonlarının 1 yaşındaki dalları için (2 ay > yetiştirilir), aşılanmış materyaller olarak seçilen dalların en üstteki 5-7. yapraklarını seçin. Yaprakların sağlıklı olduğundan ve test edilen tüm kavak klonları arasında aynı ışık durumuna (gölge veya ışık) sahip olduğundan emin olun.
3. Aşılama yapraklarının ön muamelesi
- Kavak yapraklarına temiz su püskürtün ve kuruduktan sonra, seçilen yaprakları aşılama manipülasyonlarından 1 saat veya 1 gün önce% 75 alkolle silin.
4. İn vivo yaprak aşılaması
- Küçük yapraklar için (yaprak genişliği < 8.0 cm), iki kare mantar miselyum küpü ve PDA (veya su agar, WA) küplerini (yan uzunlukta 1.0-1.2 cm) kavak klonlarının üst 5-7 yaprağının üst yüzeyine aşılayın; Miselyum yapraklara bakar. Aşılama bölgelerinin yarım yaprakların merkezinde, merkezi damarlardan ~ 1-2 cm uzakta olduğundan emin olun ve ikincil damarları gizlemekten kaçının. Her klon 6 yaprakta 12 bölge aşılar (miselyum için 10 bölge ve PDA aşılaması için 2 bölge).
- Büyük yapraklar için (yaprak genişliği 8.0 cm≥), üstteki 5-7 kavak yaprağına dört kare mantar miselyum küpü ve PDA (veya WA) küpü aşılayın. Her klon 3 yaprakta 12 bölgeyi aşılar (miselyum için 10 bölge ve PDA aşılaması için 2 bölge).
- Aşılanmış yaprakları şeffaf yapışkan bantla (6.0 cm genişliğinde) sarın ve yapraklara yapışmalarını sağlamak için hafifçe bastırın, böylece deney sırasında miselyum (veya PDA) küplerinin hareket etmesini ve su kaybını önleyin.
- Yaprakları ve miselyum (veya PDA) küplerini, iğneler küplere kavak yapraklarının üst yüzeyinden alt yüzeyine nüfuz edene kadar beş bölgede delin. Bir bölge merkezde, diğer dördü ise küplerin dört köşesine 1-2 mm yakındır.
NOT: Mantar aşılama manipülasyonu için 3 kişilik bir ekip işbirliği önerilir. Kavak melezi bir popülasyonun (>100 genotip) aşılama manipülasyonu, ekip çalışması ile 4 saat içinde gerçekleştirilebilir. Delici manipülasyonlar, farklı delme sürelerinin hastalık şiddeti üzerindeki etkisini hafifletmek için test edilen tüm yapraklar aşılandıktan ve sarıldıktan sonra gerçekleştirildi. - Miselyum aşılayıcılarının yer kaymasını ve su kaybını inceleyin ve aşılamanın 3. gününe kadar yaprakların alt yüzeyinden delinen yara bölgelerinin etrafındaki nekrotik lezyonların başlangıcını gözlemleyin.
- Aşılamadan sonraki 3 gün içinde miselyum küplerinin yer kaymasını ve su kaybını gözlemleyin. Taşınan ve kurutulan miselyum küplerini etkisiz aşılamalar olarak tanımlayın ve işaretleyin ve diğer küpleri etkili aşılar olarak tanımlarken bunları patotiplerin nihai tanımlamasından atın.
NOT: Bu protokol, beşten fazla etkili aşılama küpü ile test edilen kavak klonlarını geçersiz aşılanmış klonlar olarak tanımlar; Bu nedenle, her kavak klonu, 30 bağımsız nekrotik noktaya dönüşecek en az 30 etkili aşılama bölgesi sağlamıştır.
- Aşılamadan sonraki 3 gün içinde miselyum küplerinin yer kaymasını ve su kaybını gözlemleyin. Taşınan ve kurutulan miselyum küplerini etkisiz aşılamalar olarak tanımlayın ve işaretleyin ve diğer küpleri etkili aşılar olarak tanımlarken bunları patotiplerin nihai tanımlamasından atın.
- Deneyin sonunda (aşılamadan ~ 5-7 gün sonra) aşılanmış tüm yaprakları toplayın, plastik numune torbalarında laboratuvara geri getirin ve 4 ° C'de saklayın.
5. Yaprak patotip tayini ve kavak direncinin laboratuvarda kök pamukçuk hastalıklarına karşı değerlendirilmesi
- Şeffaf yapışkan bantları ve miselyum (veya PDA) aşılayıcılarını yapraklardan dikkatlice çıkarın.
- Nekrotik lekelerin şekli ve rengi de dahil olmak üzere her bir kavak klonunun yaprak patotiplerini gözlemleyin ve tanımlayın ve delinme bölgelerinin etrafındaki yaprakların yüzeyinde oluşan mantar hif benzeri yapıyı, piknidia ve conidia'yı içerebilir.
- Yaprakları bir kamerayla (ek bir cetvel ile) fotoğraflayın veya 300 dpi'nin üzerinde çözünürlüğe sahip görüntüler elde etmek için bir tarayıcı kullanarak yaprakları (ek bir cetvel ile) tarayın ve ardından görüntüleri JPEG, TIFF veya PNG formatında kaydedin.
6. Hastalık oluşumunun tanımlanması ve istatistiksel analizi
- Hastalıklı yaprakların görüntülerini ImageJ 1.54g (http://imagj.org) yazılımında açın.
- Ölçeği yaprak görüntülerindeki cetvele göre ayarlayın.
- Değnek (izleme) aracıyla lezyonları tanımlayın ve ölçün.
- Tüm nekrotik noktaların alanları ölçüldükten sonra alan değerlerini bir elektronik tablo olarak kaydedin ve dışa aktarın.
- Hastalık belirleme kriterlerini belirleyin:
- Miselyum küplerinin kapladığı delik bölgelerinin etrafındaki lezyon alanı, PDA küplerinin kapladığından önemli ölçüde daha büyükse, bu bölgeleri hastalık bölgeleri olarak tanımlayın.
- Miselyum küplerinin kaplı delme bölgelerinin morfolojik özellikleri, lezyonun renkleri, hif benzeri yapı, piknidia ve konidia üreten lezyonun renkleri de dahil olmak üzere PDA kaplı bölgelerle karşılaştırıldığında önemli ölçüde değiştiyse, bölgeyi aynı zamanda bir hastalık bölgesi olarak tanımlayın.
- Her kavak melez klonunun etkili PDA lezyon noktalarının ortalama alanlarını hesaplayın. Ortalama alanlara göre, bir kavak klonunun tüm miselyum aşılanmış noktalarını iki kategoriye ayırın: başlangıçlı ve başlangıçsız. Ardından, test edilen kavak klonunun hastalık insidans oranını hesaplayın (Formül 1: Hastalık insidans hızı (%) = Hastalıklı prick sitelerinin sayısı / Toplam verimli prick sitelerinin sayısı × 100).
- Yapraklardaki hastalıklı lekelerin ortalama alanını hesaplayın (n = 50). Test edilen tüm kavak klonlarında hastalıklı yaprak lekelerinin ortalama alanlarının değerlerine göre, 5 seviyeli bir hastalık derecelendirme standardı belirleyin.
- Yukarıdaki hastalık derecelendirme standardına göre her bir kavak klonunun (Formül 2) hastalık indeksini hesaplayın (Formül 2: Hastalık indeksi = ∑(Seviyeye göre diken yeri sayısı × Tüm seviyelerde şiddet değerleri)/(En yüksek şiddet düzeyinin değeri × Toplam verimli dikme bölgesi sayısı) × 100).
- Herhangi bir uygun veri analiz yazılımı kullanarak Shapiro-Wilk testini kullanarak kavak klonlarının sayısının farklı direnç seviyelerindeki normal dağılımını doğrulayın.
- Hastalık indeksine göre, test edilen tüm kavak klonlarını beş (veya yedi) grup olarak tanımlayın: çok yüksek direnç (VHR), yüksek direnç (HR), direnç ( R ), direnç yok ve duyarlılık yok (NRNS), duyarlılık (S), yüksek duyarlılık (HS) ve çok yüksek duyarlılık (VHS) grup5.
Sonuçlar
Bu protokolde, kök pamukçuk patojeni C. chrysosperma ile enfekte olmuş 48 kavak melezi klonda şematik iş akışı gerçekleştirilmiştir (Şekil 1). Kavak melezi klonları, Pekin'deki Çin Ormancılık Akademisi'ndeki (CAF) fidanlıkta yetiştirilen P. deltoides'in melezleme soyunun bir parçasıdır.
Kök pamukçuk patojeni C. chrysosperma izolatı CZC, kavak pamukçuk hastalığının 6,7,8,9 fizyolojik araştırması için kullanılan ve laboratuvarımızda biriktirilen tipik bir mantar türüdür (orta patojeniteye sahip). Sonuçlar, kök pamukçuk patojeni C. chrysosperma'nın inokülasyonunun nekrotik lezyonlara (Şekil 2B,C) ve hatta kavak yapraklarında piknidi benzeri yapılara (Şekil 2D-F) neden olduğunu göstermiştir. Ayrıca, sonuçlar ayrıca yaprak pozisyonlarının (veya yaprak yaşları ve yaprak ontogenezi) (Şekil 2G-I) ve yaprakların ışık koşullarının (Şekil 2J-L), kök pamukçuk patojeni C. chrysosperma izolatı CZC tarafından aşılanan yaprakların hastalık şiddetini etkilediğini göstermiştir.
Mantar aşılayıcılarının patojenitesi, bilinmeyen hibrit popülasyonların direnç taramasında çok önemli bir faktördür. Bununla birlikte, ıslahta virülan suşların seçimi konusunda iki karşıt görüş olmuştur: en öldürücü suş10 ve orta derecede virülan suşlar11. Bu protokolün ön deneyinde, melez kavak "Bofeng 3" içindeki 10 mantar izolatının patojenite tespitinden CZC'yi izole etmek için C. chrysosperma'yı seçtik. Cesaret verici bir şekilde, sonuçlar, SPSS'deki Shapiro-Wilk test analizi ile onaylandığı gibi, kavak klonlarının 48 kavak hibrit klonundaki farklı direnç seviyeleri arasındaki dağılımının normal olduğunu göstermektedir, bu da bu izolatın bu mevcut kavak hibridizasyon popülasyonunun direnç taraması için favori olduğunu düşündürmektedir. 48 adet kavak klonunun direnç taramasının kısmi sonuçları Şekil 3A-C'de gösterilmiştir. Ayrıca, sonuçlar, altı patojen B. dothidea izolatının melez kavak "Bofeng 3" e göre diferansiyel virülansa sahip olduğunu ve SD47 ve SD60 izolatlarının test edilen mantar suşlarındaki en virülan izolatlar olduğunu göstermiştir (Şekil 3D-F), yaprak aşılama yönteminin kavak sapı pamukçuk hastalığı patojeninin virülans taramasında da kullanılacağını düşündürmektedir.
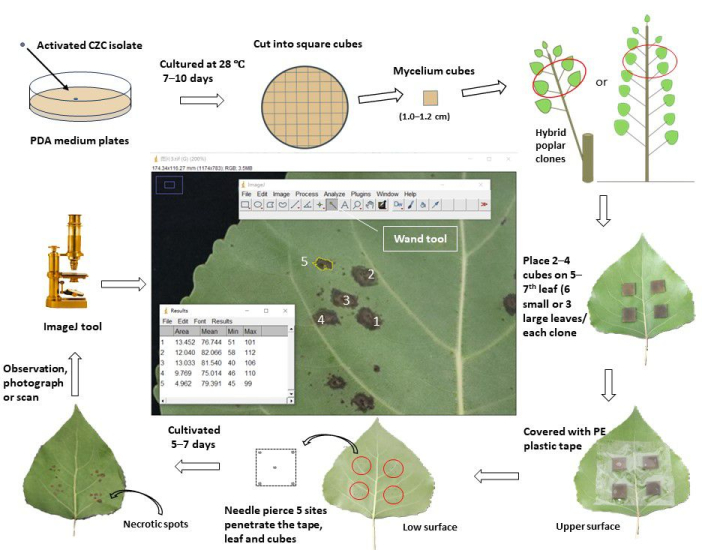
Şekil 1: Kavak klonlarında in vivo yaprak aşılaması yoluyla kök pamukçuk direncinin değerlendirilmesine yönelik şematik bir iş akışı. Aktive edilmiş kök pamukçuk patojeni Cytospora chrysosperma izolatı CZC, PDA plakalarında 28 ° C'de, karanlıkta, 10 gün boyunca kültürlendi. Daha sonra C. chrysosperma mycelium kare küpler halinde (kenar uzunluğu 1.0-1.2 cm) kesilerek 1 yıllık kavak fidanlarında veya çok yıllık kavaklar üzerine dallanmış 1 yaşında kavak şeklinde üst 5-7. yaprakların üst yüzeyine aşılanmıştır. Miselyum küplerinin hif tarafı yapraklara bakıyordu. Küçük yapraklar için (yaprak genişliği 8.0 cm'<) bir yaprağa iki miselyum küpü, büyük yapraklara ise dört miselyum küpü aşılanmıştır (yaprak genişliği 8.0 cm'≥). Bununla birlikte, küçük ve büyük yapraklar, on miselyum küpü ve 2 PDA orta boy küp fidan/dallara aşılanmıştır. Daha sonra aşılanan yapraklar 6.0-8.0 cm genişliğinde plastik koruyucu bant ile sarılarak küplerin sabitlenmesi ve su kaybı olmaması sağlandı. Yapraklar ve küpler, merkezde ve karelerin dört köşesinde yara yerleri oluşturmak için iğnelerle delinmiştir. Aşılanan yapraklar tarlada/serada yetiştirildi ve aşılamadan 5-7 gün sonra gözlemlendi, fotoğraflandı/tarandı. Daha sonra, her bir kavak klonunun delinmiş yara bölgelerinden gelişen nekrotik noktaların ortalama alanlarını ölçmek için görüntüler ImageJ yazılımına yüklendi. Son olarak, hastalık insidans oranı ve hastalık indeksi, her bir kavak klonunun nekrotik lekelerinin ortalama alanlarına göre hesaplanmıştır. Hastalık indeksine göre, test edilen tüm kavak klonları farklı direnç gruplarına ayrıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
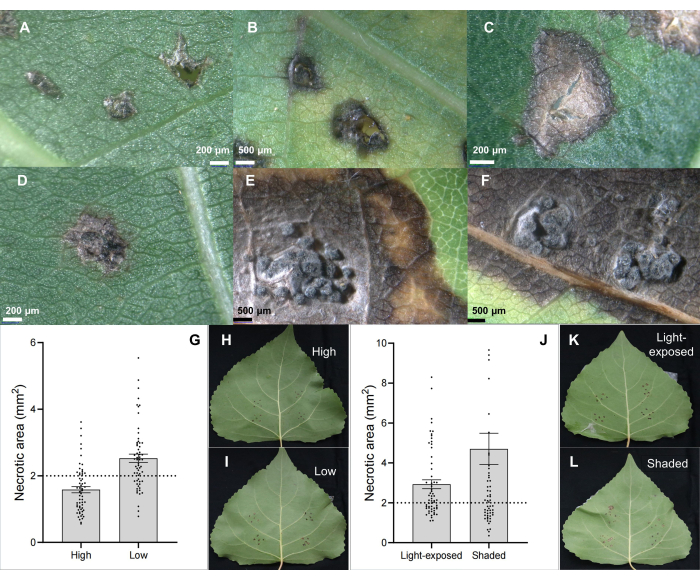
Şekil 2: Yaprak aşılaması yoluyla pamukçuk patojeni C. chrysosperma ile enfekte olmuş melez kavak klonu B246 üzerindeki klasik yaprak lezyonu özellikleri. (A) PDA aşılayıcıları ile aşılanmış; (B,C) nekrotik noktalar; (D-F) piknidia yapılı nekrotik noktalar; (G-I) 1 yaşındaki fidan/dallarda aşılanmış yaprağın pozisyonları, melez kavak çeşidi "Bofeng 3" üzerindeki kök pamukçuk patojeni C. chrysosperma'nın hastalık şiddetini etkiler; (JL) ışık koşulları, kavak çeşidi "Bofeng 3" üzerindeki hastalık şiddetini etkiler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Direnç taraması ve duyarlı algılama. (AC) hibrit kavak klonlarının direnç taraması ve (DF) hibrit kavak klonu "Bofeng 3"te patojen Botryosphaeria dothidea izolatlarının in vivo yaprak aşılama yöntemi kullanılarak duyarlı tespiti. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Önem derecesi | Derecelendirme kriterleri | Düzey |
| Hastalık yok | Belirti yok, nekrotik alan 0–2,0 mm² | 0 |
| Son derece hafif | Nekrotik alan 2,0–4,0 mm² | 1 |
| Hafif hastalık | Nekrotik alan 4,0–6,0 mm² | 2 |
| Orta derecede hastalık | Nekrotik alan 6,0–8,0 mm² | 3 |
| Orta derecede şiddetli hastalık | Nekrotik alan 8,0–10,0 mm² | 4 |
| Ağır hastalık | 10,0 mm²'den büyük nekrotik alan | 5 |
Tablo 1: Yapraklarda aft patojenlerinin neden olduğu nekrotik semptomların şiddet derecesi.
Tartışmalar
Bu protokol, kavak kanserine dirençli patojenler için hızlı ve etkili bir aşılama yöntemi sağlar ve kavak kanserine dirençli patojenlerin hibrit ıslahı ve kök pamukçuk patojenlerinin patojenite taraması gibi büyük ölçekli hastalık direnci taraması gerektiren araştırma alanları için uygundur.
Yöntemin ilk kilit noktası, olgunlaşmış gövde/dallar yerine yeni olgunlaşmış yaprak aşılaması ile hastalık direncinin değerlendirilmesidir. Sonuç olarak, kök pamukçuk hastalığına dirençli klonların seçimi, yaprak aşılama yöntemi kullanılırken kavak hibrit ıslahının 1-2 yılında gerçekleştirilebilir, kök aşılama yolundaki zaman alıcı direnç taraması ile karşılaştırıldığında (üremeden 5-7 yıl sonra), yaprak yöntemi kavak sapı pamukçuk hastalığının üreme döngüsünü keskin bir şekilde kısaltır. Yaprak yönteminin ikinci önemli adımı yaprak seçimidir. Yaprakların hastalık direnci, ontogenezilerine (yaşları veya dallardaki pozisyonları) göre değişir, yaprak evresine bağlı direncin yaprak ontogenezi direnciolarak adlandırılır 12,13. Bu nedenle, test edilen yapraklar ve gövde/dallar arasındaki bitki direncinin korelasyonu, yaprak aşılama yönteminin etkinliği için çok önemlidir. "Beş orta yaprak" üzerindeki yaprak lekesi direnci, melez kavak-Septoria etkileşimindeki gövde pamukçuk direnci ile ilişkili değildir13; bununla birlikte, Wei ve ark.'nın çalışması14 ve araştırmamız, yeni olgunlaşan üst yapraklardaki veya üst 5-7. yapraklardaki yaprak lekesi direncinin, Malus-V. ceratosperma ve kavak-C. chrysosperma etkileşimleri. Bu nedenle, in vivo yaprak aşılama yöntemi, sapın kavak ıslahında kullanılabilir ve en üstteki 5-7 yaprak mevcut aşılama materyalleridir. Bu yöntemin üçüncü kilit noktası, patojen aşılamasından sonra tekrarlanan iğne delme işlemi ile yeterli yara yerlerinin (bu protokolde 30 bölge ve 50 bölge önerilir) oluşturulması, teorik olarak hangi yara bölgelerinin üç kavak yaprağı üzerinde 50 bağımsız nekrotik noktaya dönüşeceği ve kavak döllerinde pamukçuk hastalığına karşı direncin daha doğru bir şekilde değerlendirilmesini sağlar. Ek olarak, yapraklardaki nemin korunması ve ışık koşullarının15 seçilmesi, kavak sapı pamukçuk hastalıklarına karşı daha kararlı ve doğru bir direnç değerlendirmesi elde edilmesinde faydalıdır.
Bu protokolde aşılama materyali olarak hem 1 yıllık kavak fidanları (3 aylık > yetiştirilmiş) hem de çok yıllık kavak ağaçlarının 1 yıllık dalları (2 aylıktan > yetiştirilmiş) kullanılmıştır. Kavak fidanları, daha tutarlı ve kullanımı daha kolay olduğu için hastalığa direnç taraması için idealdir. Aksine, kavak dallarını veya yapraklarını (zararlılardan, hastalıklardan ve mekanik hasarlardan arındırılmış olması ve aydınlatma veya gölgeleme gibi aynı çevresel koşullara sahip olması gereken) seçmek zordur.
Geleneksel in vitro gövde aşılama yöntemi ile karşılaştırıldığında, in vivo yaprak aşılama yöntemi, kavak pamukçuğuna dirençli ıslahı birçok açıdan keskin bir şekilde geliştirir: 1) kavak sapı pamukçuk hastalıklarının melez ıslahı için uygulanabilir bir hastalık direnci tarama yöntemi sağlar. Tecrübelerimize göre 3 kişilik bir ekip 1 günde 200'den fazla kavak melezi klonunun mantar aşılamasını yapabilmekte ve sonuçları 5-7 gün sonra elde edebilmektedir. Böylece yetiştiriciler, 3-6 kişinin işbirliği ile kısa bir süre içinde (örneğin 1.000 genotip) büyük bir hibrit popülasyonun (örneğin 1.000 genotip) hastalık direncini tarayabilirler. 2) Yaprak aşılama yöntemi, pamukçuğa dirençli klonlar için ilk seçim süresini (üremeden sonra 5-7 yıldan 1-2 yıla kadar) önemli ölçüde artırır, bu da kök pamukçuk hastalıklarına dirençli klonların erken seçimine ve fidan seçimine fayda sağlar. 3) Araştırmacılar, yaprak aşılama yöntemini kullanarak, tüm hibrit döllerin direnç yapısını ve çeşitliliğini derinlemesine ortaya çıkarabilir ve üretim veya ıslah için aday direnç klonları elde edebilir. 4) Ayrıca, yüksek verimli dizileme teknolojisi ile birleştiğinde, yaprak aşılama yöntemi, dirençle ilgili genlerin ve gen modüllerinin4madenciliğine fayda sağlar ve genomik seleksiyon (GS) teknolojisine dayalı kavak hastalığına dirençli ıslahta kullanılabilir4. Son olarak, kavağın büyüme mevsimi boyunca en üstteki 5-7. yaprakların sürekli üretimi için, yetiştiriciler kavağın farklı patojen suşlarına veya farklı hastalık patojenlerine karşı direncini tarayabilir; daha sonra, yaprak aşılama yöntemi aynı zamanda kavağın çok projeli ıslahı için uygun bir yol sağlar, örneğin, C. chrysosperma ve B. dothidea pamukçuk hastalıklarına aynı anda direnen hibrit klon(lar) elde edilir. Bununla birlikte, yaprak aşılama yönteminin, nispeten küçük bir melez kavak döllerinde (48 genotip) pamukçuk direncinin taranmasından geliştirildiğine dikkat edilmelidir. Daha sonra, kavak pamukçuk direnci ıslahı için kritik bir strateji olarak, bu yöntemin etkinliğinin daha büyük bir kavak melezi popülasyonundan veya ekili kavak plantasyonlarından daha sağlam bir doğrulamaya ihtiyacı vardır.
Bu protokol, Çin ve Kuzey Amerika'daki kavak ağaçlandırmasında dirençli kavak melezi klonları sağlayarak, kavak aft hastalıklarının (örneğin, Cytospora, Botryosphaeria ve Septoria hastalıkları) hibrit ıslahının geliştirilmesine katkıda bulunacaktır. Ayrıca, bu protokol kök pamukçuk hastalıklarının patojenitesini anlamamıza katkıda bulunacak, genetik tahlilleri ve gen madenciliğini kolaylaştıracak ve kavak moleküler ıslahının gelişimini iyileştirecektir. Ek olarak, yaprak aşılama yöntemi, pamukçuk patojenlerinin duyarlılığını taramak ve mantar patojenitesi ile ilgili genleri belirlemek için doğru ve stabil bir değerlendirme yöntemi anlamına da gelir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu araştırma, Merkezi Kamu Yararına Bilimsel Kurum, Devlet Anahtar Ağaç Genetiği ve Islahı Laboratuvarı Temel Araştırma Fonu (hibe numarası CAFYBB2020ZY001-2) ve Çin Ulusal Doğa Bilimleri Vakfı (hibe numarası 32171776) tarafından Jiaping Zhao'ya ortaklaşa finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
Referanslar
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır