Method Article
Инокуляция листьев in vivo: альтернативный метод оценки устойчивости к болезням гибридных клонов при селекции тополя Болезнь стеблевого рака
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы предоставляем пошаговый протокол оценки устойчивости тополя к возбудителям стеблевого рака с использованием метода инокуляции листьев in vivo . Этот метод особенно подходит для широкомасштабной оценки устойчивости к болезням Cytospora chrysosperma и Botryosphaeria dothidea в потомстве тополя в Китае.
Аннотация
Болезни стволового рака, вызванные возбудителями Cytospora chrysosperma (Pers.) Fr.) и Botryosphaeria dothidea (Moug. ex Fr.) Ces. Это две основные болезни лесов на плантациях тополей в Китае, которые иногда могут уничтожить все саженцы тополя или серьезно повредить зрелые тополиные леса. Гибридная селекция является наиболее прямым и эффективным методом борьбы с болезнями деревьев. Тем не менее, оценка устойчивости к болезням или отбор устойчивых к болезням клонов на основе инокуляции стеблей in vitro является неэффективным, трудоемким и дорогостоящим, что ограничивает развитие гибридной селекции болезни стебля тополя. В этом исследовании мы предложили альтернативный метод оценки устойчивости к болезням к возбудителям стеблевого рака с помощью инокуляции листьев in vivo . Тестовые материалы, используемые в этом методе, могут быть на 1-летних саженцах тополя или однолетних ветвях многолетних тополей в теплице или поле. Важнейшим этапом этого альтернативного метода является выбор прививочных листьев:5-7-е только что созревшие листья могут быть наиболее подходящими. Вторым важным этапом метода инокуляции листьев является нанесение ран на листьях растений через проколы иглой, обеспечивая достаточные повреждения для измерения тяжести заболевания. Для достаточного количества листьев, образующихся на ранней стадии селекции тополя, эта инокуляция листьев in vivo способствует быстрому, точному и широкомасштабному скринингу устойчивых к болезням клонов тополя на патогены стеблевого рака. Кроме того, этот метод инокуляции листьев также послужит эффективным методом скрининга патогенов стеблевого рака C . chrysosperma, B.dothidea или других патогенов стеблевого рака.
Введение
Болезни стеблевого рака тополя, вызываемые в основном двумя некротрофными возбудителями: Cytospora chrysosperma (Pers.) Fr. и Botryosphaeria dothidea (Moug. ex Fr.) Ces. & de not., серьезно угрожают развитию и выживанию тополиных плантаций на северо-востоке, севере и северо-западе (три севера) Китая. Гибридная селекция является наиболее прямым и эффективным методом борьбы с болезнями деревьев; Тем не менее, по сравнению с прогрессом в селекции высокоурожайных, быстрорастущих или других гибридных клонов тополя, исследования по селекции устойчивости к болезни тополя скудны. Сообщалось лишь об ограниченных исследованиях селекции устойчивых к болезням гибридов 1,2,3, и в лесоразведении тополей не было выращено ни одного гибридного клона, устойчивого к раку.
Важнейшим этапом регулярной селекции гибридов является отбор клонов на основе приобретения фенотипа гибридного потомства. Тем не менее, приобретение патологических фенотипов (патотипов) является трудоемким, трудоемким, утомительным и дорогостоящим процессом, зависящим от экспертов. Для древесных растений это сложнее из-за затратного времени, труда и экономики, вызванного их длительным жизненным циклом, медленным ростом и массивным телом. Например, у тополя скрининг на устойчивость гибридного потомства к раку проводили через 5-7 лет после гибридизации с помощью традиционных методов инокуляции стеблей in vitro 1,2,3. Более того, ограниченные этим низкоэффективным и устойчивым к болезням методом скрининга, исследователи повторно отобрали устойчивые к раку клоны из небольшой подгруппы (например, выбранные высокоурожайные или быстрорастущие клоны тополя), а не из всего гибридного потомства. Таким образом, при использовании обычных методов инокуляции стеблей невозможно с уверенностью идентифицировать подлинные устойчивые клоны и не может выявить устойчивое к болезням разнообразие селекционного потомства, что ограничивает исследование генов или генов, связанных с устойчивостью к болезням, или генных модулей. По сравнению с быстрым развитием быстрорастущей/высокоурожайной селекции тополя, эти селекционные программы могут получить гибриды путем фенотипической селекции или даже геномной селекции в первые двагода селекции. Устойчивый к болезням скрининг (или обнаружение) гибридного потомства, или метод инокуляции патогенов, стал важнейшим этапом ограничения скорости в селекции тополевого рака, устойчивого к болезням.
В этом протоколе мы представляем новый метод инокуляции для патогенов стебля тополя, метод инокуляции листьев in vivo . Используя этот метод, мы можем быстро и эффективно проверить устойчивость к раку десятков видов тополей (сортов или клонов) в течение 5-7 дней. Валидационный анализ показал, что инокуляция листьев in vivo согласуется с традиционной инокуляцией стеблей in vitro по выявлению резистентности к стеблевому раку, предполагая, что метод инокуляции листьев подходит для широкомасштабного скрининга резистентности к болезням тополя, таких как отбор всего генотипа резистентного потомства при селекции стеблевого рака. Этот метод решает патологическую проблему отбора резистентного потомства при гибридной селекции болезней тополя рака.
протокол
1. Грибковая культура на возбудителя афтозного стоматита
- Приготовьте агар картофельной декстрозы (КПК; экстракт картофеля 6,0 г, декстроза 20,0 г, агар 20,0 г) питательную среду для штаммов грибов; растворить вышеуказанные материалы в воде до 1000 мл, полностью растворить среду при 100 °С в течение 10 мин.
- Налейте среду PDA в пробирки объемом 25 мл (каждая по 15,0 мл); стерилизовать все пробирки при температуре 121,1 °C в течение 30 минут. Разлейте среду по культуральным пластинам (диаметром 9,0 см) и охладите пластины при комнатной температуре (RT).
- Разрезать мицелий грибкового патогена, который культивируется в среде PDA при 28 °C в течение 7 дней, на квадратные кубики ~0,5 см; инокулируйте грибные кубики в центре пластин КПК (стороны мицелия обращены к среде).
- Культивировать грибковых патогенов в термостатическом инкубаторе (28 °C, в темноте) в течение 7-10 дней.
- Нарежьте среду КПК с грибковым мицелием квадратными кубиками (длина стороны 1,0-1,2 см).
2. Заготовка тополиных материалов
- Для клонов тополя возрастом 1 год (культивируемых > 3 месяцев) выберите вновь созревшие, полностью вытянувшиеся листья (всегда5-7-е листья, с верхней части саженца/ветвей) основных ветвей в качестве инокулированного материала, убедитесь, что они свободны от вредителей, болезней и механических повреждений.
- Для 1-летних ветвей гибридных клонов многолетнего тополя (возделываемых > 2 месяцев) в качестве привитого материала отбирают верхние5-7-е листья выбранных ветвей. Убедитесь, что листья здоровы и имеют одинаковые условия освещения (тень или свет) среди всех протестированных клонов тополя.
3. Предварительная обработка прививочных листьев
- Опрыскайте листья тополя чистой водой, а после высыхания протрите выбранные листья 75% спиртом за 1 ч или 1 сутки до проведения инокуляционных манипуляций.
4. Инокуляция листьев in vivo
- Для мелких листьев (ширина листа < 8,0 см) привить два квадратных кубика мицелия гриба и кубики КПК (или водяного агара, WA) (1,0-1,2 см по длине стороны) на верхнюю поверхность верхних 5-7 листьев клонов тополя; Грибница обращена к листьям. Убедитесь, что места прививки расположены в центре полулистьев, на расстоянии ~1-2 см от центральных жилок, избегая затенения вторичных жилок. Каждый клон инокулирует 12 сайтов на 6 листьев (10 сайтов для мицелия и 2 сайта для инокуляции PDA).
- Для крупных листьев (ширина листа ≥ 8,0 см) привите четыре квадратных кубика мицелия гриба и кубики PDA (или WA) на верхние 5-7 листьев тополя. Каждый клон инокулирует 12 сайтов на 3 листья (10 сайтов для мицелия и 2 сайта для инокуляции PDA).
- Оберните привитые листья прозрачной клейкой лентой (шириной 6,0 см) и аккуратно прижмите их, чтобы они прилипли к листьям, предотвращая перемещение и потерю воды кубиками мицелия (или КПК) во время эксперимента.
- Прокалывайте листья и кубики мицелия (или КПК) в пяти местах, пока иголки не проникнут в кубики от верхней до нижней поверхности листьев тополя. Один участок лежит в центре, а четыре других лежат на расстоянии 1-2 мм от четырех вершин кубов.
ПРИМЕЧАНИЕ: Для манипуляций с грибковой инокуляцией рекомендуется совместная работа в команде из 3 человек. Манипуляция с инокуляцией гибридной популяции тополя (>100 генотипов) может быть проведена за 4 ч при условии командной работы. Манипуляции с пирсингом проводились после того, как все испытуемые листья были привиты и обернуты, чтобы смягчить влияние разного времени прокола на тяжесть заболевания. - Проверьте смещение местоположения и потерю влаги инокулянтами мицелия, а также наблюдайте за возникновением некротических поражений вокруг мест прокалывания раны с нижней поверхности листьев до3-го дня посева.
- В течение 3 дней после прививки наблюдайте за смещением местоположения и потерей воды кубиками мицелия. Определите и отметьте перемещенные и высушенные кубики мицелия как неэффективные инокуляции и исключите их из окончательной идентификации патогенов, в то время как другие кубы определите как эффективные инокуляции.
ПРИМЕЧАНИЕ: Этот протокол определяет протестированные клоны тополя с более чем пятью эффективными кубами инокуляции как недействительные инокулированные клоны; Таким образом, каждый клон тополя обеспечивал не менее 30 эффективных участков инокуляции, которые разовьются в 30 самостоятельных некротических пятен.
- В течение 3 дней после прививки наблюдайте за смещением местоположения и потерей воды кубиками мицелия. Определите и отметьте перемещенные и высушенные кубики мицелия как неэффективные инокуляции и исключите их из окончательной идентификации патогенов, в то время как другие кубы определите как эффективные инокуляции.
- В конце эксперимента (~5-7 дней после инокуляции) сорвите все инокулированные листья, верните их в лабораторию в пластиковых пакетах для образцов и храните при температуре 4 °C.
5. Получение патотипа листьев и оценка устойчивости тополя к болезням стеблевого рака в лабораторных условиях
- Осторожно удалите с листьев прозрачные клейкие ленты и инокулянты мицелия (или КПК).
- Наблюдайте и определяйте патотипы листьев каждого клона тополя, включая форму и цвет некротических пятен, и могут включать грибковую гифовидную структуру, пикнидии и конидии, которые образовались на поверхности листьев вокруг мест прокола.
- Сфотографируйте листья (с помощью дополнительной линейки) с помощью фотоаппарата или отсканируйте листья (с помощью дополнительной линейки) с помощью сканера для получения изображений с разрешением более 300 dpi, а затем сохраните изображения в формате JPEG, TIFF или PNG.
6. Выявление и статистический анализ возникновения заболеваний
- Откройте изображения больных листьев в программе ImageJ 1.54g (http://imagj.org).
- Установите масштаб в соответствии с линейкой на изображениях листьев.
- Определите и измерьте поражения с помощью палочки (инструмента для отслеживания).
- Запишите и экспортируйте значения площади в виде электронной таблицы после того, как будут измерены площади всех некротических пятен.
- Установите критерии для определения заболевания:
- Если площадь поражения вокруг участков прокалывания кубиков мицелия значительно больше, чем площадь поражения кубиками ОАП, то определите эти участки как участки заболевания.
- Если морфологические характеристики участков, покрытых кубиками мицелия, значительно изменились по сравнению с участками, покрытыми ОАП, включая цвета поражения, образующие гифообразную структуру, пикниды и конидии, определите участок также как участок заболевания.
- Рассчитайте средние площади эффективных пятен поражения ОАП каждого гибридного клона тополя. В соответствии со средними площадями разделите все привитые мицелием пятна одного клона тополя на две категории: начало и неначало. Затем рассчитайте частоту заболеваемости тестируемого клона тополя (Формула 1: Частота заболеваемости (%) = Количество пораженных участков прикола/Общее количество эффективных участков прикола × 100).
- Рассчитайте среднюю площадь больных мест на листьях (n = 50). По значениям средних площадей пораженных пятнистостью листьев у всех испытанных клонов тополя установлен 5-уровневый стандарт классификации по болезни.
- Рассчитайте индекс заболеваемости каждого клона тополя (Формула 2) на основе приведенного выше стандарта классификации болезней (Формула 2: Индекс заболеваемости = ∑(Количество участков прикола по уровню × Значения тяжести на всех уровнях)/(Значение наивысшего уровня тяжести × Общее количество эффективных участков прикола) × 100).
- Проверьте нормальное распределение числа клонов тополя по различным уровням устойчивости с помощью теста Шапиро-Уилка с использованием любого подходящего программного обеспечения для анализа данных.
- В соответствии с индексом заболеваемости определите все протестированные клоны тополя в пять (или семь) групп: очень высокая резистентность (VHR), высокая резистентность (HR), резистентность (R), отсутствие резистентности и восприимчивости (NRNS), восприимчивость (S), высокая восприимчивость (HS) и очень высокая восприимчивость (VHS) группа5.
Результаты
В этом протоколе схематический рабочий процесс проводился на 48 гибридных клонах тополя, инфицированных возбудителем ракообразного рака C. chrysosperma (рис. 1). Гибридные клоны тополя являются частью гибридизационного потомства P. deltoides, культивируемого в питомнике Китайской академии лесного хозяйства (CAF) в Пекине.
Изолят C. chrysosperma CZC является типичным грибковым штаммом (со средней патогенностью), используемым для физиологических исследований болезни тополя 6,7,8,9 и депонированным в нашей лаборатории. Результаты показали, что инокуляция возбудителя стеблевого рака C. chrysosperma индуцировала некротические поражения (рисунок 2B, C) и даже пикнидоподобные структуры на листьях тополя (рисунок 2D-F). Кроме того, результаты также показали, что положение листьев (или возраст листьев и онтогенез листьев) (рисунок 2G-I) и условия освещения листьев (рисунок 2J-L) влияют на тяжесть заболевания листьев, инокулированных возбудителем стеблевого рака изолятом C. chrysosperma CZC.
Патогенность грибковых инокулянтов является решающим фактором в скрининге резистентности неизвестных гибридных популяций. Тем не менее, существуют две противоположные точки зрения на отбор вирулентных штаммов в селекции: использование наиболее вирулентного штамма10 и умеренно вирулентного штамма11. В предварительном эксперименте по этому протоколу мы выбрали C. chrysosperma для выделения CZC из обнаружения патогенности 10 грибковых изолятов гибридного тополя «Бофенг 3». Обнадеживает то, что результаты указывают на то, что распределение клонов тополя по различным уровням резистентности у 48 гибридных клонов тополя является нормальным, что подтверждается анализом теста Шапиро-Уилка в SPSS, что позволяет предположить, что этот изолят является фаворитом для скрининга резистентности нынешней популяции гибридизации тополя. Частичные результаты скрининга резистентности 48 клонов тополя представлены на рисунке 3A-C. Кроме того, результаты показали, что шесть изолятов патогена B. dothidea имеют дифференциальную вирулентность по сравнению с гибридным тополем «Бофенг 3», а изоляты SD47 и SD60 являются наиболее вирулентными изолятами среди протестированных штаммов грибов (рис. 3D-F), что позволяет предположить, что метод инокуляции листьев также должен использоваться для скрининга вирулентности возбудителя болезни тополя стеблевого рака.
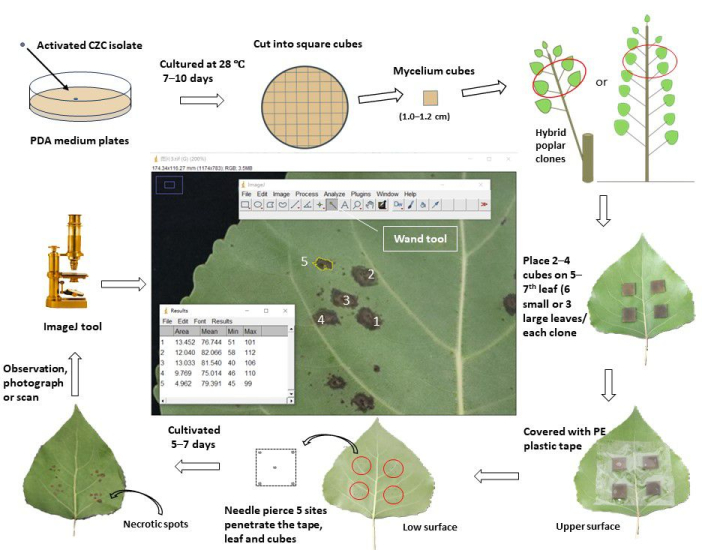
Рисунок 1: Схематический рабочий процесс оценки устойчивости стебля к раку путем инокуляции листьев in vivo у клонов тополя. Изолят Cytospora chrysosperma CZC культивировали в планшетах ОАП при температуре 28 °С, в темноте, в течение 10 дней. Затем мицелий C. chrysosperma разрезали на квадратные кубики (1,0-1,2 см в длину) и прививали на верхнюю поверхность верхних5-7-х листьев у 1-летних саженцев тополя или 1-летнего тополя, разветвленного на многолетних тополях. Гифовой стороной кубики мицелия обращены к листьям. Для мелких листьев (ширина листа < 8,0 см) два куба мицелия были привиты на один лист, а четыре куба мицелия были привиты на крупные листья (ширина листа ≥ 8,0 см). Тем не менее, маленькие и большие листья, десять кубиков мицелия и 2 средних куба PDA были привиты на саженцы/ветви. Затем привитые листья обматывали пластиковой защитной лентой шириной 6,0-8,0 см для фиксации кубиков и предотвращения их потери воды. Листья и кубы прокалывались иглами, чтобы получить раневые участки в центре и на четырех вершинах квадратов. Привитые листья культивировались в поле/теплице и наблюдались, фотографировались/сканировались через 5-7 дней после прививки. Затем изображения были загружены в программное обеспечение ImageJ для измерения средних площадей некротических пятен, которые развились из проколотых ран каждого клона тополя. Наконец, уровень заболеваемости и индекс заболеваемости рассчитывались на основе средних площадей некротических пятен каждого клона тополя. По индексу заболеваемости все исследованные клоны тополя были разделены на разные группы резистентности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
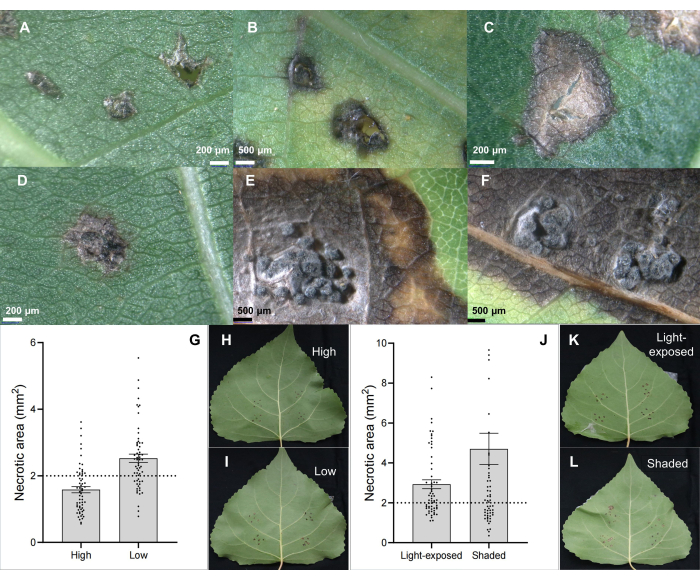
Рисунок 2: Классические характеристики поражения листьев у гибридного клона тополя B246, инфицированного возбудителем рака C. chrysosperma в результате инокуляции листьев. (A) инокулированным инокулянтами PDA; (В,В) некротические пятна; (D-F) некротические пятна со структурой пикнид; (G-I) положение привитого листа у 1-летнего саженца/ветвей влияет на тяжесть заболевания возбудителя стеблевого рака C. chrysosperma на гибридном сорте тополя "Бофенг 3"; (J-L) условия освещения влияют на тяжесть заболевания на сорте тополя "Бофенг 3". Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Скрининг резистентности и обнаружение восприимчивости. Скрининг резистентности (A-C) гибридных клонов тополя и обнаружение чувствительных изолятов патогена Botryosphaeria dothidea в (D-F) гибридном клоне тополя "Bofeng 3" с использованием метода инокуляции листьев in vivo. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Степень тяжести | Критерии классификации | Уровень |
| Отсутствие болезней | Симптомов нет, площадь некроза 0–2,0 мм² | 0 |
| Чрезвычайно мягкий | Некротическая площадь 2,0–4,0 мм² | 1 |
| Заболевание в легкой форме | Некротическая площадь 4,0–6,0 мм² | 2 |
| Заболевание средней тяжести | Некротическая площадь 6,0–8,0 мм² | 3 |
| Заболевание средней тяжести | Некротическая площадь 8,0–10,0 мм² | 4 |
| Тяжелое течение заболевания | Некротическая площадь более 10,0 мм² | 5 |
Таблица 1: Степень тяжести некротических симптомов, вызванных патогенами рака на листьях.
Обсуждение
Этот протокол обеспечивает быстрый и эффективный метод инокуляции патогенов устойчивости к тополиному раку, который подходит для областей исследований, требующих широкомасштабного скрининга устойчивости к болезням, таких как гибридное разведение устойчивости к тополиному раку и скрининг патогенности патогенов стеблевого рака.
Первым ключевым моментом метода является оценка устойчивости к болезням путем инокуляции вновь созревших листьев, а не созревших стеблей/ветвей. В результате, селекция клонов устойчивости к стеблевым болезням может быть проведена через 1-2 года селекции гибрида тополя при использовании метода прививки листьев, по сравнению с трудоемким скринингом устойчивости в пути прививки стебля (5-7 лет после селекции), листовым методом, резко сокращающим цикл размножения болезни стебля тополя. Вторым ответственным этапом листового метода является выбор листьев. Устойчивость листьев к болезням изменяется в зависимости от их онтогенеза (возраста или положения на ветвях), называемой устойчивостью листьев к стадии листа12,13. Таким образом, корреляция устойчивости растений между испытуемыми листьями и стеблем/ветвями имеет решающее значение для эффективности метода инокуляции листьев. Устойчивость к пятнистости листьев на «пяти средних листьях» не связана с устойчивостью к раку стебля при гибридном взаимодействии тополя и септориоза 13; тем не менее, исследование Wei et al.14 и наше исследование показали, что устойчивость к пятнистости листьев на верхних недавно созревших листьях или верхних5-7-х листьях согласуется с устойчивостью к раку стебля при взаимодействии Malus-V. ceratosperma и тополей-C. chrysosperma. Поэтому метод инокуляции листьев in vivo может быть использован при разведении стебля тополя, а верхние 5-7 листьев являются доступными материалами для инокуляции. Третьим ключевым моментом этого метода является получение достаточного количества раневых участков (рекомендуется 30 участков и 50 участков в этом протоколе) путем повторного прокалывания иглой после инокуляции возбудителя, теоретически при этом места ранения разовьются в 50 независимых некротических пятен на трех листьях тополя, обеспечивая более точную оценку устойчивости к ракообразному раку у потомства тополя. Кроме того, сохранение влаги и выбор световых условий15 в листьях полезны для получения более стабильной и точной оценки устойчивости к болезням стебля тополя.
В данном протоколе в качестве прививочного материала использовались как 1-летние саженцы тополя (окультуренные > 3 месяцев), так и 1-летние ветви (окультуренные > 2 месяцев) многолетних тополей. Саженцы тополя идеально подходят для скрининга устойчивости к болезням, потому что они более стабильны и просты в эксплуатации. Напротив, выбор ветвей или листьев тополя (которые должны быть свободны от вредителей, болезней и механических повреждений и иметь те же условия окружающей среды, такие как освещение или затенение) является сложной задачей.
По сравнению с традиционным методом инокуляции стеблей in vitro , метод инокуляции листьев in vivo значительно улучшает селекцию устойчивости тополя к раку во многих аспектах: 1) обеспечение осуществимого метода скрининга устойчивости к болезням для гибридной селекции болезней стебля тополя. По нашему опыту, команда из 3 человек может провести грибковую инокуляцию более 200 гибридных клонов тополя за 1 день, а затем получить результаты через 5-7 дней. Таким образом, селекционеры могут провести скрининг устойчивости к болезням большой гибридной популяции (например, 1000 генотипов) за короткий период (например, 1 месяц) за счет сотрудничества 3-6 человек. 2) Метод инокуляции листьев значительно опережает время первого отбора клонов, устойчивых к раку, (с 5-7 лет до 1-2 лет после селекции), что способствует раннему отбору и отбору саженцев устойчивых клонов к болезням стеблевого рака. 3) Используя метод инокуляции листьев, исследователи могут глубоко раскрыть структуру и разнообразие устойчивости всех гибридных потомков и получить клоны-кандидаты на устойчивость для производства или селекции. 4) Кроме того, в сочетании с высокопроизводительной технологией секвенирования, метод инокуляции листьев способствует добыче генов, связанных с резистентностью, и генных модулей4и может быть использован в селекции тополя, устойчивых к болезням, на основе технологии геномной селекции (GS)4. Наконец, для непрерывного производства верхних5-7-х листьев в течение вегетационного периода тополя, селекционеры могут проверять устойчивость тополя к различным штаммам патогенов или различным патогенам болезней; Кроме того, метод инокуляции листьев также обеспечивает возможный путь для мультипроективного разведения тополя, например, для получения гибридных клонов, устойчивых к болезням раком C. chrysosperma и B. dothidea одновременно. Однако следует отметить, что метод инокуляции листьев был разработан на основе скрининга устойчивости к раку у относительно небольшого гибридного потомства тополя (48 генотипов). Затем, в качестве критически важной стратегии для селекции устойчивости к тополиному раку, эффективность этого метода все еще нуждается в более надежной проверке на более широкой популяции гибридов тополей или культурных плантациях тополей.
Этот протокол будет способствовать развитию гибридной селекции болезней тополя (например, Cytospora, Botryosphaeria и Septoria ), обеспечивая устойчивые гибридные клоны тополей в лесонасаждениях тополей в Китае и Северной Америке. Кроме того, этот протокол будет способствовать нашему пониманию патогенности стволовых заболеваний, облегчать генетические анализы и добычу генов, а также улучшит развитие молекулярной селекции тополя. Кроме того, метод инокуляции листьев также подразумевает точный и стабильный метод оценки для скрининга восприимчивости патогенов рака и определения генов, связанных с патогенностью грибов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было совместно профинансировано Центральным общественным научным учреждением «Фонд базальных исследований» Государственной ключевой лаборатории генетики и селекции деревьев (грант No CAFYBB2020ZY001-2) и Национальным фондом естественных наук Китая (грант No 32171776) для Цзяпин Чжао.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
Ссылки
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены