Method Article
تلقيح الأوراق في الجسم الحي: طريقة بديلة لتقييم مقاومة الأمراض للمستنسخات الهجينة في تربية الحور لمرض تقرح الساق
* These authors contributed equally
In This Article
Summary
نحن نقدم بروتوكولا خطوة بخطوة لتقييم مقاومة الحور لمسببات الأمراض الجذعية باستخدام طريقة تلقيح الأوراق في الجسم الحي . هذه الطريقة مناسبة بشكل خاص للتقييم واسع النطاق لمقاومة مرض التقرح الخلوي و Botryosphaeria dothidea في ذرية تربية الحور في الصين.
Abstract
أمراض التقرح الجذعية التي يسببها العامل الممرض Cytospora chrysosperma (Pers.) Fr.) و Botryosphaeria dothidea (Moug. ex Fr.) Ces. & de Not. هما مرضان رئيسيان للغابات في مزارع الحور في الصين ، وأحيانا يمكن أن يدمروا جميع شتلات الحور أو يلحقون أضرارا بالغة بغابات الحور الناضجة. التربية الهجينة هي الطريقة الأكثر مباشرة وفعالية للسيطرة على أمراض الأشجار وإدارتها. ومع ذلك ، فإن تقييم مقاومة الأمراض أو اختيار المستنسخة المقاومة للأمراض بناء على تلقيح الساق في المختبر غير فعال ويستغرق وقتا طويلا ومكلفا ، مما يحد من تطور التكاثر الهجين لمرض تقرح جذع الحور. في هذه الدراسة ، اقترحنا طريقة بديلة لتقييم مقاومة الأمراض لمسببات الأمراض الجذعية من خلال تلقيح الأوراق في الجسم الحي. يمكن أن تكون مواد الاختبار المستخدمة في هذه الطريقة على شتلات الحور البالغة من العمر 1 عاما أو الفروع السنوية لأشجار الحور المعمرة في الدفيئة أو الحقل. الخطوة الحاسمة لهذه الطريقة البديلة هي اختيار أوراق التلقيح: قد تكون الأوراق الناضجة حديثا 5-7 هي الأنسب. الخطوة الثانية الحاسمة لطريقة تلقيح الأوراق هي إحداث جروح على أوراق النبات من خلال ثقوب الإبر ، مما يوفر آفات كافية لقياس شدة المرض. بالنسبة للعدد الكافي من الأوراق المنتجة في المرحلة المبكرة من تربية الحور ، يساهم تلقيح الأوراق في الجسم الحي في الفحص السريع والدقيق والواسع النطاق لاستنساخ الحور المقاوم للأمراض لوقف مسببات الأمراض في التقرح. علاوة على ذلك ، ستعمل طريقة تلقيح الأوراق هذه أيضا كطريقة فعالة لفحص الأنماط المرضية لمسببات مرض تقرح الساق C. chrysosperma أو B.dothidea أو غيرها من مسببات أمراض آفة جذع الحور.
Introduction
أمراض تقرح جذع الحور ، التي تسببها بشكل رئيسي اثنين من مسببات الأمراض الميتة ، Cytospora chrysosperma (Pers.) Fr. و Botryosphaeria dothidea (Moug. ex Fr.) Ces. & de Not. ، تهدد بشدة تطوير وبقاء مزارع الحور في الشمال الشرقي والشمال والشمال الغربي (ثلاثة شمال) من الصين. التربية المهجنة هي الطريقة الأكثر مباشرة وفعالية للسيطرة على أمراض الأشجار وإدارتها. ومع ذلك ، بالمقارنة مع التقدم المحرز في تربية المستنسخة عالية الغلة أو سريعة النمو أو غيرها من المستنسخة الهجينة من الحور ، فإن الأبحاث حول تربية المقاومة لمرض آفة الحور نادرة. تم الإبلاغ عن دراسات محدودة فقط للتكاثر الهجين المقاوم للأمراض1،2،3 ، ولم يتم زراعة أي استنساخ هجين مقاوم للقرحة في تشجير الحور.
الخطوة الحاسمة للتربية الهجينة المنتظمة هي اختيار الاستنساخ بناء على اكتساب النمط الظاهري للذرية الهجينة. ومع ذلك ، فإن اكتساب الأنماط الظاهرية المرضية (الأنماط المرضية) يستغرق وقتا طويلا وشاقا ومتعبا ومكلفا ويعتمد على الخبراء. بالنسبة للنباتات الخشبية ، يكون الأمر أكثر صعوبة بسبب الطبيعة المستهلكة للوقت والعمالة والاقتصاد بسبب دورة حياتها الطويلة ونموها البطيء وجسمها الضخم. على سبيل المثال ، في الحور ، تم إجراء فحص مقاومة القرحة للذرية الهجينة بعد 5-7 سنوات من التهجين من خلال طرق التلقيح التقليدية في الساق في المختبر 1،2،3. علاوة على ذلك ، نظرا لمحدودية طريقة الفحص منخفضة الكفاءة وعالية الاستهلاك المقاومة للأمراض ، أعاد الباحثون اختيار المستنسخة المقاومة للآفة من مجموعة فرعية صغيرة (على سبيل المثال ، استنساخ الحور المختار عالي الغلة أو سريع النمو) ، وليس من جميع النسل الهجين. لذلك ، باستخدام طرق التلقيح الجذعية العادية ، ليس من المؤكد تحديد المستنسخة المقاومة الأصلية ولا يمكن الكشف عن التنوع المقاوم للأمراض لذرية التكاثر ، مما يحد من استكشاف الجينات أو وحدات الجينات المرتبطة بمقاومة الأمراض. بالمقارنة مع التطور السريع لتربية الحور سريعة النمو / عالية الغلة ، يمكن لبرامج التربية هذه الحصول على الهجينة من خلال الانتقاء الظاهري أو حتى الانتقاء الجينومي في العامين الأولين من التكاثر4 ، تطورت تربية مقاومة تقرح الحور ببطء. أصبح الفحص المقاوم للأمراض (أو الكشف) للذرية الهجينة ، أو طريقة تلقيح مسببات الأمراض ، الخطوة الحاسمة للحد من السرعة في تربية مقاومة مرض تقرح الحور.
في هذا البروتوكول ، نقدم طريقة تلقيح جديدة لمسببات الأمراض آفة جذع الحور ، في طريقة تلقيح الأوراق في الجسم الحي . باستخدام هذه الطريقة ، يمكننا اختبار مقاومة مرض القرحة بسرعة وكفاءة لعشرات الأنواع من الحور (الأصناف أو المستنسخة) في غضون 5-7 أيام. أوضح اختبار التحقق أن تلقيح الأوراق في الجسم الحي يتوافق مع التلقيح التقليدي في الساق في المختبر بشأن الكشف عن مقاومة مرض تقرح الساق ، مما يشير إلى أن طريقة تلقيح الأوراق مناسبة لفحص المقاومة على نطاق واسع لأمراض تقرح الحور ، مثل اختيار النمط الوراثي الكامل لذرية المقاومة في تربية مرض تقرح الساق. هذه الطريقة تحل المشكلة المرضية لاختيار ذرية مقاومة في تربية الهجين من أمراض آفة الحور.
Protocol
1. ثقافة فطرية لمسببات الأمراض آفة
- تحضير أجار سكر العنب للبطاطس (PDA ؛ استخراج البطاطس 6.0 جم ، سكر العنب 20.0 جم ، أجار 20.0 جم) وسط استزراع للسلالات الفطرية ؛ قم بإذابة المواد المذكورة أعلاه في ماء يصل إلى 1000 مل ، وقم بإذابة الوسط تماما عند 100 درجة مئوية لمدة 10 دقائق.
- صب وسط المساعد الرقمي الشخصي في أنابيب 25 مل (يحتوي كل منها على 15.0 مل) ؛ تعقيم جميع الأنابيب عند 121.1 درجة مئوية لمدة 30 دقيقة. صب الوسط في ألواح الاستزراع (قطرها 9.0 سم) وقم بتبريد الألواح في درجة حرارة الغرفة (RT).
- قطع أفطورة العامل الممرض الفطري ، الذي يتم استزراعه في وسط PDA عند 28 درجة مئوية لمدة 7 أيام ، إلى ~ 0.5 سم مكعبات مربعة ؛ تلقيح المكعبات الفطرية في وسط لوحات المساعد الشخصي الرقمي (تواجه جوانب الفطريات الوسط).
- استزرع مسببات الأمراض الفطرية في حاضنة ثرموستاتية (28 درجة مئوية ، في الظلام) لمدة 7-10 أيام.
- قطع وسط المساعد الشخصي الرقمي مع الفطريات الفطرية إلى مكعبات مربعة (طول الجانب 1.0-1.2 سم).
2. تحضير مواد الحور
- بالنسبة لاستنساخ الحور البالغ من العمر 1 عاما (المزروع > 3 أشهر) ، حدد الأوراق الناضجة حديثا والممتدة بالكامل (دائما 5-7أوراق ، من أعلى الشتلات / الفروع) للفروع الرئيسية كمواد ملقحة ، وتأكد من خلوها من الآفات والأمراض والأضرار الميكانيكية.
- بالنسبة للفروع البالغة من العمر 1 سنة من استنساخ الحور الهجين الدائم (المزروعة > 2 أشهر) ، حددأعلى 5-7 أوراق من الفروع المختارة كمواد ملقحة. تأكد من أن الأوراق صحية ولها نفس حالة الإضاءة (الظل أو الضوء) بين جميع مستنسخات الحور التي تم اختبارها.
3. المعالجة المسبقة لأوراق التلقيح
- رش أوراق الحور بالماء النظيف ، وبعد التجفيف ، امسح الأوراق المحددة بنسبة 75٪ كحول 1 ساعة أو يوم واحد قبل التلاعب بالتلقيح.
4. تلقيح أوراق الجسم الحي
- بالنسبة للأوراق الصغيرة (عرض الورقة < 8.0 سم) ، قم بتلقيح مكعبين فطريين مربعين ومكعبات PDA (أو أجار الماء ، WA) (1.0-1.2 سم في طول الجانب) على السطح العلوي لأعلى 5-7 أوراق من استنساخ الحور ؛ تواجه الفطريات الأوراق. تأكد من أن مواقع التلقيح تقع في وسط نصف الأوراق ، ~ 1-2 سم بعيدا عن الأوردة المركزية ، وتجنب حجب الأوردة الثانوية. يقوم كل استنساخ بتلقيح 12 موقعا على 6 أوراق (10 مواقع للفطريات وموقعين لتلقيح PDA).
- للأوراق الكبيرة (عرض الورقة ≥ 8.0 سم) ، قم بتلقيح أربعة مكعبات فطرية مربعة ومكعبات PDA (أو WA) على أعلى 5-7 أوراق حور. يقوم كل استنساخ بتلقيح 12 موقعا في 3 أوراق (10 مواقع للفطريات و 2 مواقع لتلقيح PDA.
- لف الأوراق الملقحة بشريط لاصق شفاف (بعرض 6.0 سم) واضغط عليها برفق لجعلها لاصقة بالأوراق ، مما يمنع تحريك مكعبات الميسيليوم (أو PDA) وفقدانها للماء أثناء التجربة.
- اثقب الأوراق ومكعبات الفطريات (أو PDA) في خمسة مواقع حتى تخترق الإبر المكعبات من السطح العلوي إلى السطح السفلي لأوراق الحور. يقع موقع واحد في المركز ، والأربعة الأخرى تقع 1-2 مم بالقرب من الرؤوس الأربعة للمكعبات.
ملاحظة: يوصى بالتعاون مع فريق مكون من 3 أشخاص لمعالجة التلقيح الفطري. يمكن إجراء معالجة التلقيح لمجموعة هجينة من الحور (>100 نمط وراثي) في 4 ساعات من خلال العمل الجماعي. تم إجراء عمليات التلاعب بالثقب بعد تلقيح جميع الأوراق المختبرة ولفها للتخفيف من تأثير أوقات الثقب المختلفة على شدة المرض. - افحص تحول الموقع وفقدان الماء للقاحات الفطريات ، ولاحظ ظهور الآفات الميتة حول مواقع جرح الثقب من السطح السفلي للأوراق حتى يوم 3من التلقيح.
- في غضون 3 أيام من التلقيح ، لاحظ تحول الموقع وفقدان الماء لمكعبات الفطريات. حدد وميز مكعبات الميسيليوم المنقولة والمجففة على أنها تلقيحات غير فعالة وتجاهلها من التحديد النهائي للأنماط المرضية مع تعريف المكعبات الأخرى على أنها تلقيحات فعالة.
ملاحظة: يعرف هذا البروتوكول استنساخ الحور المختبر مع أكثر من خمسة مكعبات تلقيح فعالة على أنها مستنسخات ملقحة غير صالحة ؛ لذلك ، قدم كل استنساخ حور ما لا يقل عن 30 موقعا فعالا للتلقيح ، والتي ستتطور إلى 30 بقعة نخرية مستقلة.
- في غضون 3 أيام من التلقيح ، لاحظ تحول الموقع وفقدان الماء لمكعبات الفطريات. حدد وميز مكعبات الميسيليوم المنقولة والمجففة على أنها تلقيحات غير فعالة وتجاهلها من التحديد النهائي للأنماط المرضية مع تعريف المكعبات الأخرى على أنها تلقيحات فعالة.
- التقط جميع الأوراق الملقحة في نهاية التجربة (~ 5-7 أيام بعد التلقيح) ، وأعدها إلى المختبر في أكياس عينات بلاستيكية ، وقم بتخزينها في درجة حرارة 4 درجات مئوية.
5. اكتساب النمط المرضي للأوراق وتقييم مقاومة الحور لأمراض التقرح الجذعية في المختبر
- قم بإزالة الأشرطة اللاصقة الشفافة ولقاحات الفطريات (أو PDA) بعناية من الأوراق.
- راقب وحدد الأنماط المرضية للأوراق لكل استنساخ حور ، بما في ذلك شكل ولون البقع الميتة ، وقد تشمل البنية الشبيهة بالخيوط الفطرية ، والبيكنيديا ، والكونيديا التي تشكلت على سطح الأوراق حول مواقع الثقب.
- قم بتصوير الأوراق (باستخدام مسطرة إضافية) باستخدام كاميرا، أو امسح الأوراق ضوئيا (باستخدام مسطرة إضافية) باستخدام ماسح ضوئي للحصول على صور بدقة تزيد عن 300 نقطة في البوصة، ثم احفظ الصور بتنسيق JPEG أو TIFF أو PNG.
6. تحديد والتحليل الإحصائي لحدوث المرض
- افتح صور الأوراق المريضة في البرنامج ImageJ 1.54g (http://imagj.org).
- اضبط المقياس وفقا للمسطرة في صور الورقة.
- تحديد وقياس الآفات باستخدام أداة العصا (التتبع).
- قم بتسجيل وتصدير قيم المنطقة كجدول بيانات بعد قياس مناطق جميع البقع الميتة.
- ضع معايير تحديد المرض:
- إذا كانت مساحة الآفة حول مكعبات الفطريات المغطاة بمواقع الثقب أكبر بكثير من تلك التي تغطيها مكعبات PDA ، فقم بتحديد هذه المواقع كمواقع مرض.
- إذا تغيرت الخصائص المورفولوجية لمكعبات الفطريات المغطاة بمواقع الثقب بشكل كبير عند مقارنتها بالمواقع المغطاة بالمساعد الرقمي الشخصي ، بما في ذلك ألوان الآفة ، وإنتاج بنية تشبه الخيوط ، والبيكنيديا ، والكونيديا ، حدد الموقع أيضا كموقع مرض.
- احسب متوسط مساحات كل بقع آفة PDA الفعالة لكل استنساخ هجين من الحور. وفقا لمتوسط المناطق ، قسم جميع البقع الملقحة بالفطريات لاستنساخ واحد من الحور إلى فئتين: بداية وغير بداية. بعد ذلك ، احسب معدل الإصابة بمرض استنساخ الحور الذي تم اختباره (الصيغة 1: معدل الإصابة بالمرض (٪) = عدد مواقع الوخز المريضة / إجمالي عدد مواقع الوخز الفعالة × 100).
- احسب متوسط مساحة البقع المريضة في الأوراق (ن = 50). وفقا لقيم متوسط مناطق البقع المريضة من الأوراق في جميع استنساخ الحور التي تم اختبارها ، قم بتعيين معيار تصنيف المرض من 5 مستويات.
- احسب مؤشر المرض لكل استنساخ حور (الصيغة 2) بناء على معيار تصنيف المرض أعلاه (الصيغة 2: مؤشر المرض = ∑ (عدد مواقع الوخز حسب المستوى × قيم الشدة على جميع المستويات) / (قيمة أعلى مستوى خطورة × إجمالي عدد مواقع الوخز الفعالة) × 100).
- تحقق من التوزيع الطبيعي لأعداد استنساخ الحور عبر مستويات المقاومة المختلفة باستخدام اختبار Shapiro-Wilk باستخدام أي برنامج مناسب لتحليل البيانات.
- وفقا لمؤشر المرض ، حدد جميع مستنسخات الحور التي تم اختبارها على أنها خمس (أو سبعة) مجموعات: مقاومة عالية جدا (VHR) ، مقاومة عالية (HR) ، مقاومة (R) ، لا مقاومة ولا حساسية (NRNS) ، حساسية (S) ، حساسية عالية (HS) ، وحساسية عالية جدا (VHS) المجموعة5.
النتائج
في هذا البروتوكول ، تم إجراء سير العمل التخطيطي في 48 نسخة هجينة من الحور مصابة بمسببات الأمراض الجذعية C. chrysosperma (الشكل 1). المستنسخة الهجينة من الحور هي جزء من ذرية التهجين من P. deltoides ، المزروعة في الحضانة في الأكاديمية الصينية للغابات (CAF) ، بكين.
ممرض آفة الساق C. chrysosperma isolate CZC هو سلالة فطرية نموذجية (مع إمراضية متوسطة) تستخدم في البحث الفسيولوجي لمرض آفة الحور6،7،8،9 وتترسب في مختبرنا. أظهرت النتائج أن تلقيح ممرض التقرح الجذعي C. chrysosperma تسبب في آفات نخرية (الشكل 2B ، C) وحتى الهياكل الشبيهة بالبيكنيديا على أوراق الحور (الشكل 2D-F). علاوة على ذلك ، أوضحت النتائج أيضا أن مواضع الأوراق (أو أعمار الأوراق وتطور الأوراق) (الشكل 2G-I) وظروف ضوء الأوراق (الشكل 2J-L) تؤثر على شدة مرض الأوراق الملقحة بواسطة ممرض تقرح الساق C. chrysosperma عزل CZC.
تعد إمراضية اللقاحات الفطرية عاملا حاسما في فحص مقاومة المجموعات الهجينة غير المعروفة. ومع ذلك ، كان هناك رأيان متعارضان حول اختيار السلالات الخبيثة في التكاثر: استخدام السلالة الأكثر ضراوة10 والسلالات المعتدلة الضراوة11. في التجربة الأولية لهذا البروتوكول ، اخترنا C. chrysosperma لعزل CZC من الكشف عن الإمراضية ل 10 عزلات فطرية في الحور الهجين "Bofeng 3". ومن الأمور المشجعة أن النتائج تشير إلى أن توزيع استنساخ الحور عبر مستويات مقاومة مختلفة في 48 مستنسخا هجينا من أشجار الحور أمر طبيعي، كما أكد تحليل اختبار Shapiro-Wilk في SPSS، مما يشير إلى أن هذه العزلة مفضلة لفحص المقاومة لسكان تهجين الحور الحاليين. تظهر النتائج الجزئية لفحص المقاومة ل 48 نسخة من الحور في الشكل 3A-C. علاوة على ذلك ، أظهرت النتائج أن ست عزلات من مسببات الأمراض B. dothidea لها ضراوة تفاضلية لحور الهجين "Bofeng 3" ، والعزلات SD47 و SD60 هي العزلات الأكثر ضراوة في السلالات الفطرية المختبرة (الشكل 3D-F) ، مما يشير إلى أن طريقة تلقيح الأوراق تستخدم أيضا في فحص الفوعة لمسببات مرض تقرح جذع الحور.
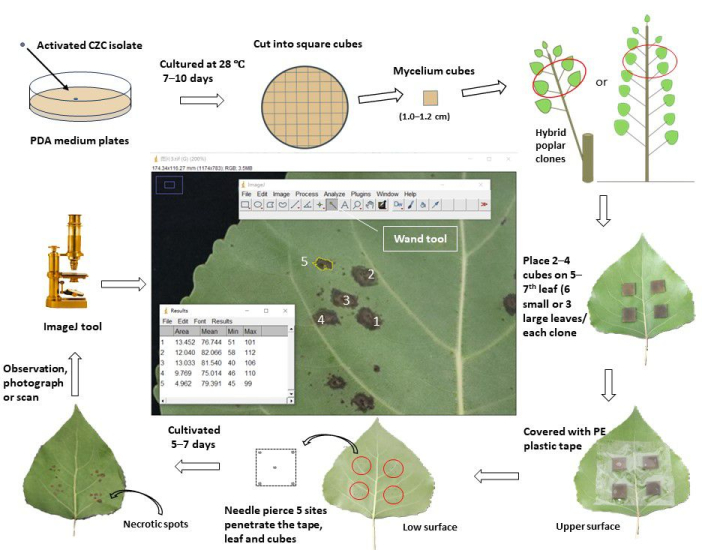
الشكل 1: سير عمل تخطيطي لتقييم مقاومة تقرح الساق من خلال تلقيح الأوراق في الجسم الحي في مستنسخات الحور. تم استزراع ممرض تقرح الساق المنشط Cytospora chrysosperma المعزول CZC في ألواح PDA عند 28 درجة مئوية ، في الظلام ، لمدة 10 أيام. بعد ذلك ، تم تقطيع فطريات C. chrysosperma إلى مكعبات مربعة (1.0-1.2 سم في طول الجانب) وتلقيحها على السطح العلويللأوراق العلوية 5-7 في شتلات الحور البالغة من العمر عاما واحدا أو الحور البالغ من العمر عاما واحدا متفرعة على أشجار الحور المعمرة. واجه جانب الخيوط من مكعبات الفطريات الأوراق. بالنسبة للأوراق الصغيرة (عرض الورقة < 8.0 سم) ، تم تلقيح مكعبين من الفطريات على ورقة واحدة ، بينما تم تلقيح أربعة مكعبات من الفطريات على الأوراق الكبيرة (عرض الورقة ≥ 8.0 سم). ومع ذلك ، تم تلقيح الأوراق الصغيرة والكبيرة ، وعشرة مكعبات mycelium ، و 2 مكعبات متوسطة PDA على الشتلات / الفروع. بعد ذلك ، تم لف الأوراق الملقحة بشريط واقي بلاستيكي بعرض 6.0-8.0 سم لإصلاح المكعبات ومنعها من فقدان الماء. تم ثقب الأوراق والمكعبات بالإبر لإنتاج مواقع الجرح في المركز والرؤوس الأربعة للمربعات. تمت زراعة الأوراق الملقحة في الحقل / الدفيئة وتمت ملاحظتها وتصويرها / مسحها ضوئيا بعد 5-7 أيام من التلقيح. بعد ذلك ، تم تحميل الصور في برنامج ImageJ لقياس متوسط مساحات البقع الميتة التي تطورت من مواقع الجرح المثقوبة لكل استنساخ حور. أخيرا ، تم حساب معدل الإصابة بالمرض ومؤشر المرض بناء على متوسط مناطق البقع الميتة لكل استنساخ حور. وفقا لمؤشر المرض ، تم تقسيم جميع استنساخ الحور الذي تم اختباره إلى مجموعات مقاومة مختلفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
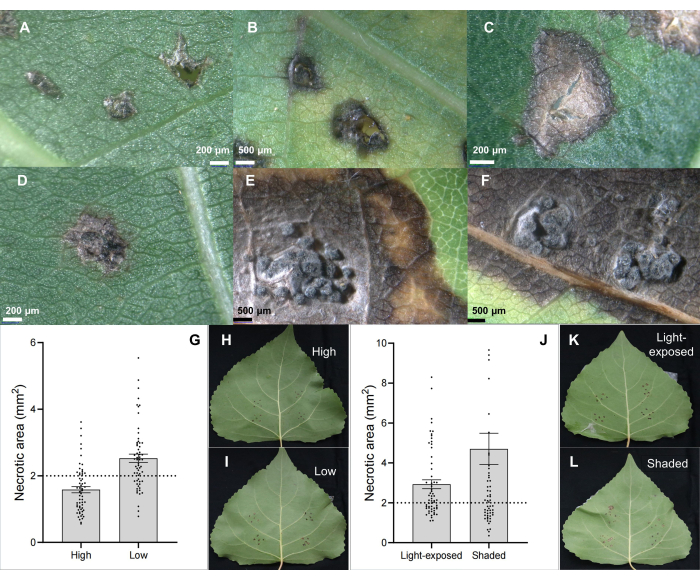
الشكل 2: خواص آفة الأوراق الكلاسيكية على مستنسخ الحور الهجين B246 المصاب بمسببات مرض القرحة C. chrysosperma من خلال تلقيح الأوراق. (أ) تلقيح بلقاحات القناة الشريانية السالكة ؛ (ب ، ج) البقع الميتة. (D-F) بقع نخرية مع بنية pycnidia ؛ (G-I) تؤثر مواقع الأوراق الملقحة في الشتلات / الفروع البالغة من العمر 1 عاما على شدة مرض ممرض تقرح الساق C. chrysosperma على صنف الحور الهجين "Bofeng 3" ؛ تؤثر ظروف الضوء (J-L) على شدة المرض على صنف الحور "Bofeng 3". يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: فحص المقاومة والكشف عن الحساسية. فحص مقاومة استنساخ الحور الهجين (A-C) والكشف عن مسببات الأمراض عزلات Botryosphaeria dothidea في استنساخ الحور الهجين (D-F) "Bofeng 3" باستخدام طريقة تلقيح الأوراق في الجسم الحي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| درجة الخطورة | معايير الدرجات | مستوى |
| لا مرض | لا توجد أعراض ، منطقة نخرية 0-2.0 مم² | 0 |
| خفيف للغاية | منطقة نخرية 2.0-4.0 مم² | 1 |
| مرض خفيف | منطقة نخرية 4.0-6.0 مم² | 2 |
| مرض معتدل | منطقة نخرية 6.0-8.0 مم² | 3 |
| مرض شديد الشدة | منطقة نخرية 8.0-10.0 مم² | 4 |
| مرض شديد | مساحة نخرية أكبر من 10.0 مم² | 5 |
الجدول 1: تصنيف شدة الأعراض الميتة التي تسببها مسببات الأمراض آفة على الأوراق.
Discussion
يوفر هذا البروتوكول طريقة تلقيح سريعة وفعالة لمسببات الأمراض المقاومة لآفة الحور ، وهي مناسبة لمجالات البحث التي تتطلب فحصا واسع النطاق لمقاومة الأمراض ، مثل التربية الهجينة لمقاومة آفة الحور وفحص الإمراضية لمسببات الأمراض في تقرح الساق.
النقطة الرئيسية الأولى للطريقة هي تقييم مقاومة الأمراض عن طريق تلقيح الأوراق الناضجة حديثا بدلا من السيقان / الفروع الناضجة. نتيجة لذلك ، يمكن إجراء اختيار المستنسخة المقاومة لمرض تقرح الساق في 1-2 سنوات من تربية الحور الهجين عند استخدام طريقة تلقيح الأوراق ، مقارنة بفحص المقاومة الذي يستغرق وقتا طويلا في مسار تلقيح الساق (5-7 سنوات بعد التكاثر) ، طريقة الأوراق تقصر بشكل حاد دورة تكاثر مرض آفة جذع الحور. الخطوة الثانية الحاسمة في طريقة الأوراق هي اختيار الأوراق. تختلف مقاومة الأوراق للأمراض باختلاف جنينها (الأعمار أو الموضع على الفروع) ، وتسمى مقاومة الأوراق الجنين للمقاومة المرتبطة بمرحلة الأوراق12,13. لذلك ، فإن ارتباط مقاومة النبات بين الأوراق المختبرة والساق / الفروع أمر بالغ الأهمية لفعالية طريقة تلقيح الأوراق. لا ترتبط مقاومة بقعة الأوراق على "الأوراق الوسطى الخمسة" بمقاومة تقرح الساق في تفاعل الحور الهجين - سبتوريا 13 ؛ ومع ذلك ، أوضحت دراسة Wei et al.14 وبحثنا أن مقاومة بقعة الأوراق على الأوراق الناضجة حديثا أو الأوراق العلوية 5-7 تتوافق مع مقاومة تقرح الساق في Malus-V. سيراتوسبيرما والحور - C. تفاعلات كريسوسبيرما. لذلك ، يمكن استخدام طريقة تلقيح الأوراق في الجسم الحي في تربية الحور للساق ، وتتوفر أعلى 5-7 أوراق من مواد التلقيح. النقطة الرئيسية الثالثة لهذه الطريقة هي إنتاج مواقع جرح كافية (يوصى باستخدام 30 موقعا و 50 موقعا في هذا البروتوكول) من خلال ثقب الإبرة المتكرر بعد تلقيح مسببات الأمراض ، نظريا ، والتي ستتطور مواقع الجرح إلى 50 بقعة نخرية مستقلة على ثلاث أوراق حور توفر تقييما أكثر دقة لمقاومة مرض التقرح في ذرية الحور. بالإضافة إلى ذلك ، فإن الحفاظ على الرطوبة واختيار ظروف الإضاءة15 في الأوراق مفيد في الحصول على تقييم مقاومة أكثر استقرارا ودقة لأمراض تقرح جذع الحور.
في هذا البروتوكول ، تم استخدام كل من شتلات الحور البالغة من العمر 1 عاما (المزروعة > 3 أشهر) والفروع البالغة من العمر 1 عاما (المزروعة > 2 أشهر) من أشجار الحور المعمرة كمواد تلقيح. تعتبر شتلات الحور مثالية لفحص مقاومة الأمراض لأنها أكثر اتساقا وأسهل في التشغيل. على العكس من ذلك ، فإن اختيار أغصان أو أوراق الحور (التي يجب أن تكون خالية من الآفات والأمراض والأضرار الميكانيكية ولها نفس الظروف البيئية ، مثل الإضاءة أو التظليل) يمثل تحديا.
بالمقارنة مع طريقة تلقيح الساق التقليدية في المختبر ، فإن طريقة تلقيح الأوراق في الجسم الحي تحسن بشكل حاد من تكاثر مقاومة تقرح الحور في العديد من الجوانب: 1) توفير طريقة فحص مجدية لمقاومة الأمراض للتكاثر الهجين لأمراض تقرح جذع الحور. وفقا لتجربتنا ، يمكن لفريق مكون من 3 أشخاص إجراء التلقيح الفطري لأكثر من 200 استنساخ هجين من الحور في يوم واحد ثم الحصول على النتائج بعد 5-7 أيام. وبالتالي ، يمكن للمربين فحص مقاومة الأمراض لمجموعة هجينة كبيرة (على سبيل المثال ، 1000 نمط وراثي) في فترة قصيرة (على سبيل المثال ، شهر واحد) من خلال تعاون 3-6 أشخاص. 2) تقدم طريقة تلقيح الأوراق بشكل كبير وقت الاختيار الأول لاستنساخ مقاومة الآفة (من 5-7 سنوات إلى 1-2 سنوات بعد التكاثر) ، مما يفيد الاختيار المبكر واختيار الشتلات للاستنساخ المقاوم لوقف أمراض التقرح. 3) باستخدام طريقة تلقيح الأوراق ، يمكن للباحثين الكشف بعمق عن بنية مقاومة وتنوع جميع النسل الهجين والحصول على استنساخ مقاومة مرشح للإنتاج أو التكاثر. 4) علاوة على ذلك ، جنبا إلى جنب مع تقنية التسلسل عالية الإنتاجية ، تفيد طريقة تلقيح الأوراق في تعدين الجينات ووحدات الجينات المرتبطة بالمقاومة4ويمكن استخدامها في تربية مقاومة أمراض الحور على أساس تقنية الانتقاء الجينومي (GS)4. أخيرا ، من أجل الإنتاج المستمر لأعلى 5-7أوراق خلال موسم نمو الحور ، يمكن للمربين فحص مقاومة الحور لسلالات مسببات الأمراض المختلفة أو مسببات الأمراض المختلفة ؛ بعد ذلك ، توفر طريقة تلقيح الأوراق أيضا مسارا مجديا للتكاثر متعدد الإسقاط للحور ، على سبيل المثال ، الحصول على استنساخ (نسخ) هجين يقاوم أمراض C. chrysosperma و B. dothidea canker في وقت واحد. ومع ذلك ، تجدر الإشارة إلى أن طريقة تلقيح الأوراق تطورت من فحص مقاومة التقرح في ذرية حور هجينة صغيرة نسبيا (48 نمطا وراثيا). بعد ذلك ، كاستراتيجية حاسمة لتربية مقاومة تقرح الحور ، لا تزال فعالية هذه الطريقة بحاجة إلى تحقق أكثر قوة من عدد أكبر من هجن الحور أو مزارع الحور المزروعة.
سيساهم هذا البروتوكول في تطوير أمراض تقرح الحور (على سبيل المثال ، أمراض Cytospora و Botryosphaeria و Septoria ) ، مما يوفر استنساخا هجينا مقاوما للحور في تشجير الحور في الصين وأمريكا الشمالية. علاوة على ذلك ، سيساهم هذا البروتوكول في فهمنا لإمراضية أمراض التقرح الجذعية ، وتسهيل المقايسات الجينية وتعدين الجينات ، وتحسين تطوير التربية الجزيئية للحور. بالإضافة إلى ذلك ، تتضمن طريقة تلقيح الأوراق أيضا طريقة تقييم دقيقة ومستقرة لفحص حساسية مسببات الأمراض آفة وتحديد الجينات المرتبطة بإمراض الفطريات.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا البحث بشكل مشترك من قبل صندوق البحوث القاعدية للمؤسسة العلمية المركزية ذات المصلحة العامة التابع لمختبر الدولة الرئيسي لعلم الوراثة وتربية الأشجار (رقم المنحة CAFYBB2020ZY001-2) والمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم المنحة 32171776) إلى Jiaping Zhao.
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
References
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved