Method Article
In vivo葉接種:茎潰瘍病のポプラ育種におけるハイブリッドクローンの耐病性を評価するための代替法
* これらの著者は同等に貢献しました
要約
私たちは、 in vivo の葉接種法を使用して、茎潰瘍病原体に対するポプラの耐性を評価するための段階的なプロトコルを提供します。この方法は、中国のポプラ育種子孫における Cytospora chrysosperma および Botryosphaeria dothidea 潰瘍病抵抗性の大規模な評価に特に適しています。
要約
病原体 Cytospora chrysosperma (Pers.)Fr.)および Botryosphaeria dothidea (Moug.exFr.)Cesによって引き起こされる茎潰瘍病。中国のポプラ農園における2つの主要な森林病害は、時にはすべてのポプラの苗木を破壊したり、成熟したポプラの森に深刻なダメージを与えることがあります。雑種育種は、樹木の病気を制御および管理するための最も直接的で効率的な方法です。しかし、 In vitro ステム接種に基づいて耐病性を評価したり、耐病性クローンを選択したりすることは、非効率的で、時間と費用がかかり、ポプラステム潰瘍病のハイブリッド育種の開発を制限する。本研究では、 in vivo 葉接種により茎潰瘍病原体に対する耐病性を評価する代替法を提案した。この方法で使用される試験材料は、1歳のポプラの苗木、または温室または野外にある多年生ポプラの一年生の枝にすることができます。この代替方法の重要なステップは、接種する葉の選択です:新しく成熟した5〜7番目の 葉が最も適しているかもしれません。葉の接種方法の2番目の重要なステップは、針の穴を通して植物の葉に傷を作り、病気の重症度を測定するのに十分な病変を提供することです。ポプラ育種の初期段階で十分な数の葉が生産されるため、この in vivo 葉接種は、潰瘍病原体を食い止めるための耐病性ポプラクローンの迅速、正確、かつ大規模なスクリーニングに貢献します。さらに、この葉の接種方法は、茎潰瘍病の病原体である C.chrysosperma、 B.dothidea、またはその他のポプラ茎潰瘍病原体の病理型をスクリーニングするための効率的な方法としても役立ちます。
概要
主に2つの壊死性病原体、Cytospora chrysosperma (Pers.) Fr. と Botryosphaeria dothidea (Moug. ex Fr.) Ces.& de Not.は、中国の北東部、北部、北西部(3北)のポプラプランテーションの開発と生存を深刻に脅かしています。雑種育種は、樹木の病気を制御および管理するための最も直接的で効率的な方法です。しかし、高収量クローンや急成長性などのポプラ雑種クローンの育種が進んでいるのに比べると、ポプラ潰瘍病に対する抵抗性育種の研究は少ないのが現状です。病害抵抗性雑種育種に関する限られた研究のみが報告されており1,2,3、ポプラ植林では潰瘍抵抗性雑種クローンは培養されていません。
通常の雑種育種の重要なステップは、雑種子孫の表現型獲得に基づくクローン選択です。しかし、病理学的表現型(パトタイプ)の獲得は、時間がかかり、手間がかかり、面倒で、費用がかかり、専門家に依存するプロセスです。木本植物の場合、その長いライフサイクル、遅い成長、および巨大な体によって引き起こされる時間、労力、および経済を消費する性質のために、それはより困難です。例えば、ポプラでは、ハイブリッド子孫の潰瘍抵抗性スクリーニングは、従来のin vitroステム接種法1,2,3により、ハイブリッド化の5〜7年後に実施された。さらに、この低効率で高消費性の疾患抵抗性スクリーニング法によって制限され、研究者は、すべての雑種子孫からではなく、小さなサブグループ(たとえば、選択した高収量または成長の速いポプラクローン)から潰瘍抵抗性クローンを再選択しました。したがって、通常の茎接種法では、本物の耐性クローンを特定することは確実ではなく、繁殖子孫の耐病性の多様性を明らかにすることができず、したがって、耐病性関連遺伝子または遺伝子モジュールの探索が制限されます。ポプラの急成長性・高収量育種の急速な発展と比較すると、これらの育種プログラムは、育種の最初の2年間で表現型選択やゲノム選択によってさえ雑種を得ることができる4、ポプラの潰瘍抵抗性育種はゆっくりと進行した。雑種の子孫の耐病性スクリーニング(または検出)、または病原体接種法は、ポプラ潰瘍の病害抵抗性育種における重要な速度制限ステップとなっています。
このプロトコルでは、ポプラ茎潰瘍病原体に対する新しい接種方法である in vivo 葉接種法を紹介します。この方法を使用すると、5〜7日以内に数十のポプラ種(栽培品種またはクローン)の潰瘍病抵抗性を迅速かつ効率的にテストできます。この検証アッセイは、 in vivo 葉接種が茎潰瘍疾患の耐性検出に関する従来の in vitro 茎接種と一致していることを示しており、葉接種法がポプラ潰瘍病の大規模な耐性スクリーニングに適していることを示唆しています。この方法は、ポプラ潰瘍病の雑種繁殖において抵抗性子孫を選択する病理学的問題を解決します。
プロトコル
1. 潰瘍性病原体に対する真菌培養
- ジャガイモデキストロース寒天培地(PDA;ジャガイモ抽出6.0 g、デキストロース20.0 g、寒天20.0 g)を真菌株用の培地として調製します。上記の材料を1000mLまでの水に溶解し、培地を100°Cで10分間完全に溶解します。
- PDA培地を25 mLチューブ(それぞれ15.0 mLを含む)に注ぎます。すべてのチューブを121.1°Cで30分間滅菌します。培地を培養プレート(直径9.0cm)に注ぎ、プレートを室温(RT)で冷却します。
- PDA培地で28°Cで7日間培養した真菌病原体の菌糸体を~0.5cm四方の立方体に切ります。PDAプレートの中央にある真菌キューブを接種します(菌糸体の側面が培地に面しています)。
- 真菌病原体をサーモスタットインキュベーター(28°C、暗所)で7〜10日間培養します。
- 真菌菌糸体を含むPDA培地を正方形の立方体(一辺の長さ1.0〜1.2 cm)に切ります。
2.ポプラ材の調製
- 1歳のポプラクローン(3か月>栽培)の場合、接種材料として、主枝の新しく成熟した完全に伸びた葉(常に苗木/枝の上部から5〜7番目の 葉)を選択し、害虫、病気、および機械的損傷がないことを確認します。
- 多年生ポプラハイブリッドクローンの1歳の枝(2か月>栽培)の場合、選択した枝の上部5〜7番目の 葉を接種材料として選択します。葉が健康で、テストされたすべてのポプラクローン間で同じ光の状態(日陰または光)を持っていることを確認してください。
3.接種葉の前処理
- ポプラの葉にきれいな水をスプレーし、乾燥させた後、接種操作の1時間または1日前に選択した葉を75%アルコールで拭きます。
4. in vivo での葉の接種
- 小さな葉(葉幅<8.0 cm)の場合は、ポプラクローンの上部5〜7枚の葉の上面に、2つの正方形の真菌菌糸体キューブとPDA(または水寒天、WA)キューブ(辺の長さ1.0〜1.2 cm)を接種します。菌糸体は葉に面しています。接種部位が中心静脈から1~2cm離れて、半葉の中央に位置していることを確認して、二次静脈を覆い隠さないようにします。各クローンは、6枚の葉に12サイト(菌糸体用10サイト、PDA接種用2サイト)に接種します。
- 大きな葉(葉幅≥8.0cm)の場合は、上部の5〜7枚のポプラの葉に4つの正方形の真菌菌糸体キューブとPDA(またはWA)キューブを接種します。各クローンは、3葉に12サイト(菌糸体10サイト、PDA接種2サイト)に接種します。
- 接種した葉を透明粘着テープ(幅6.0cm)で包み、優しく押して葉に接着させることで、実験中の菌糸体(またはPDA)キューブの移動や水分損失を防ぎます。
- 針がポプラの葉の上面から下面に立方体を貫通するまで、葉と菌糸体(またはPDA)キューブを5か所で突き刺します。1 つのサイトは中央にあり、他の 4 つのサイトはキューブの 4 つの頂点の近くに 1 〜 2 mm あります。
注:真菌接種の操作には、3人のチームコラボレーションが推奨されます。ポプラ雑種集団(>100遺伝子型)の接種操作は、チームワークにより4時間で行うことができます。ピアス操作は、テストされたすべての葉が接種され、包まれた後に行われ、異なるピアス時間が病気の重症度に与える影響を軽減しました。 - 菌糸体接種剤の位置移動と水分損失を検査し、葉の下面から接種3日目 まで穿刺創部位周辺の壊死性病変の発症を観察します。
- 接種後3日以内に、菌糸体の位置移動と水分損失を観察します。移動および乾燥した菌糸体の立方体を効果のない接種として定義してマークし、病理型の最終的な同定からそれらを破棄する一方で、他の立方体を効果的な接種として定義します。
注:このプロトコルは、5つ以上の有効な接種キューブを持つテスト済みのポプラクローンを無効な接種クローンとして定義します。したがって、各ポプラクローンは少なくとも30の効果的な接種部位を提供し、それは30の独立した壊死スポットに発展します。
- 接種後3日以内に、菌糸体の位置移動と水分損失を観察します。移動および乾燥した菌糸体の立方体を効果のない接種として定義してマークし、病理型の最終的な同定からそれらを破棄する一方で、他の立方体を効果的な接種として定義します。
- 実験終了時(接種後5~7日後)に接種した葉をすべて取り除き、プラスチックサンプル袋に入れて実験室に持ち帰り、4°Cで保管します。
5. 研究室における葉の病型取得と茎潰瘍病に対するポプラ抵抗性の評価
- 透明な粘着テープと菌糸体(またはPDA)接種剤を葉から慎重に取り除きます。
- 壊死斑の形状や色など、各ポプラクローンの葉の病理型を観察して特定し、ピアスサイトの周りの葉の表面に形成された真菌性の菌糸様構造、ピクニジウム、および分生子が含まれる場合があります。
- カメラで葉を撮影(定規を追加)するか、スキャナーで葉をスキャン(定規を追加)して300dpi以上の解像度の画像を取得し、画像をJPEG、TIFF、またはPNG形式で保存します。
6. 疾病発生の特定と統計解析
- ImageJ 1.54g(http://imagj.org)で罹患葉の画像を開きます。
- 葉の画像の定規に従ってスケールを設定します。
- ワンド(トレース)ツールで病変を特定し、測定します。
- すべての壊死スポットの面積が測定された後、面積値をスプレッドシートとして記録してエクスポートします。
- 疾患判定の基準を設定します。
- 穿孔部位を覆う菌糸体キューブの周囲の病変領域がPDAキューブで覆われている領域よりも大幅に大きい場合は、これらの部位を疾患部位として定義します。
- PDAで覆われた穿孔部位を覆う菌糸体の立方体の形態学的特性が、病変の色、菌糸様構造、ピクニジウム、および分生子の生成を含む有意に変化した場合、その部位は疾患部位としても定義されます。
- 各ポプラハイブリッドクローンの有効なPDA病変スポットの平均面積を計算します。平均的な面積に従って、1つのポプラクローンのすべての菌糸体接種スポットを、発症と非発症の2つのカテゴリに分けます。次に、テストしたポプラクローンの疾患発生率を計算します(式1:疾患発生率(%)=病気の刺し傷部位の数/効率的な刺し傷部位の総数×100)。
- 葉の病気の斑点の平均面積を計算します(n = 50)。すべてのテストされたポプラクローンの葉の病気の斑点の平均面積の値に従って、5レベルの病気の等級付け基準を設定します。
- 上記の疾病等級付け基準(式2)に基づき、各ポプラクローンの疾病指数を算出(式2)します(式2:疾病指数=∑(レベル別刺し部位数×全段階における重症度の値)/(重症度が最も高い値×効率的な刺し傷部位の総数)×100)。
- 適切なデータ分析ソフトウェアを使用したShapiro-Wilkテストを使用して、さまざまな抵抗レベルにわたるポプラクローンの数の正規分布を確認します。
- 疾患指数に従って、試験されたすべてのポプラクローンを5つ(または7つ)のグループとして特定します:非常に高い耐性(VHR)、高い耐性(HR)、耐性(R)、耐性なしおよび感受性なし(NRNS)、感受性(S)、高感受性(HS)、および非常に高い感受性(VHS)グループ5。
結果
このプロトコルでは、幹潰瘍病原体 C.chrysosperma に感染した48のポプラハイブリッドクローンで概略ワークフローを実施しました(図1)。ポプラ雑種クローンは、北京の中国林業院(CAF)の苗床で栽培された P.deltoidesの交配子孫の一部です。
茎潰瘍病原体C.chrysosperma分離株CZCは、ポプラ潰瘍病6,7,8,9の生理学的研究に使用され、当研究室に寄託された典型的な真菌株(中病原性)です。その結果、茎潰瘍病原体C.chrysospermaの接種は、壊死性病変(図2B、C)とポプラ葉上のピクニジウム様構造(図2D-F)を誘発することを示しました。さらに、結果は、茎潰瘍病原体C.chrysospermaがCZCを分離することによって接種された葉の病害性に影響を与えることを示した葉の位置(または葉の年齢と葉の個体発生)(図2G-I)と葉の光の状態(図2J-L)も示しました。
真菌接種剤の病原性は、未知の雑種集団の耐性スクリーニングにおける重要な要素です。しかし、育種における毒性のある株の選択については、最も毒性の高い株10と中程度の毒性の株11を使用することという2つの対立する見解がありました。このプロトコルの予備実験では、ハイブリッドポプラ「Bofeng 3」の10の真菌分離株の病原性検出からCZCを分離するためにC.chrysospermaを選択しました。心強いことに、結果は、SPSSのShapiro-Wilkテスト分析によって確認されたように、48のポプラハイブリッドクローンの異なる耐性レベルにわたるポプラクローンの分布が正常であることを示しており、この分離株がこの現在のポプラハイブリダイゼーション集団の耐性スクリーニングに好まれていることを示唆しています。48個のポプラクローンの耐性スクリーニングの部分的な結果を図3A-Cに示します。さらに、病原体B.dothideaの6つの分離株は、ハイブリッドポプラ「Bofeng3」とは異なる病原性を持ち、分離株SD47およびSD60は、試験された真菌株の中で最も毒性の高い分離株であることが示されました(図3D-F)ことから、葉の接種法はポプラ茎潰瘍病病病原体の病原性スクリーニングにも使用されることが示唆されています。
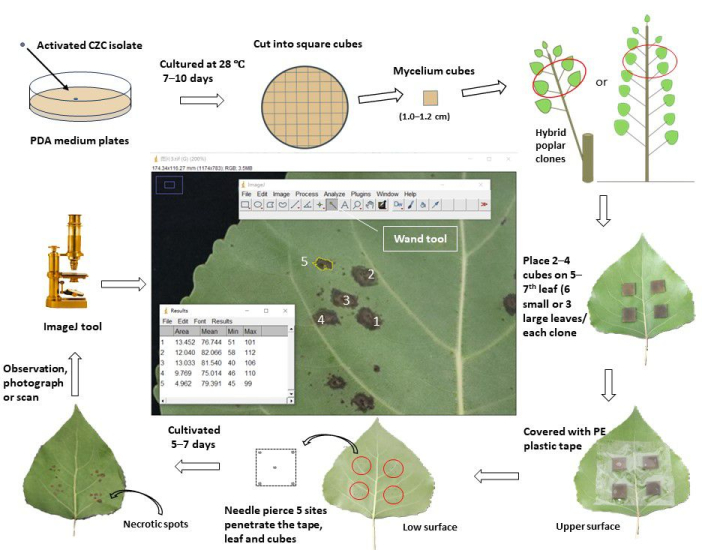
図1:ポプラクローンの in vivo 葉接種による茎潰瘍耐性を評価する概略ワークフロー。 活性化された茎潰瘍性病原体 Cytospora chrysosperma isolate CZCを、28°Cの暗闇でPDAプレートで10日間培養しました。次に、 C. chrysosperma 菌糸体を正方形の立方体(一辺の長さ1.0〜1.2 cm)に切断し、1年生のポプラの苗木または多年生のポプラに枝分かれした1年生のポプラを上部の5〜7番目の 葉の上面に接種しました。菌糸体の立方体の菌糸側は葉に面していました。小葉(葉幅<8.0cm)には1枚の葉に菌糸体を2個、大葉(葉幅≥8.0cm)には菌糸体を4個接種しました。ただし、大小の葉、10個の菌糸体キューブ、および2個のPDAミディアムキューブが苗木/枝に接種されました。次に、接種した葉を幅6.0〜8.0cmのプラスチック保護テープで包み、キューブを固定し、水分の損失を防ぎます。葉と立方体に針を刺して、正方形の中心と4つの頂点に傷口を作りました。接種した葉は、野外/温室で栽培し、接種後5〜7日で観察、撮影/スキャンしました。次に、画像をImageJソフトウェアにロードして、各ポプラクローンの穿孔された傷口から発生する壊死斑の平均面積を測定しました。最後に、疾患発生率と疾患指数は、各ポプラクローンの壊死スポットの平均面積に基づいて計算されました。疾病指数によると、試験されたすべてのポプラクローンは、異なる耐性グループに分けられました。 この図の拡大版を表示するには、ここをクリックしてください。
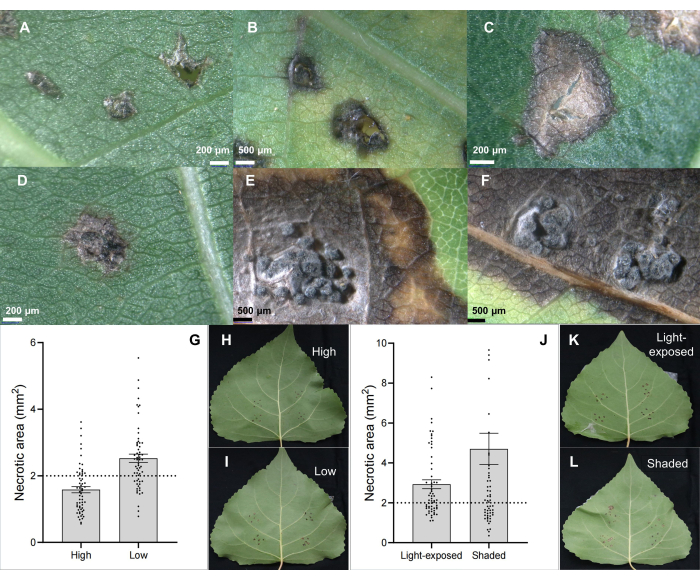
図2:潰瘍性病原体C.クリソスペルマに感染したハイブリッドポプラクローンB246の葉接種による古典的な葉の病変特性。(B、C)壊死斑;(D-F)ピクニジア構造を持つ壊死斑;(G-I)1歳の苗木/枝における接種葉の位置は、ハイブリッドポプラ品種「Bofeng 3」の茎潰瘍病原体C.chrysospermaの疾患の重症度に影響を与えます。(J-L)光条件は、ポプラ品種「Bofeng 3」の病気の重症度に影響を与えます。この図の拡大版を表示するには、ここをクリックしてください。

図3:抵抗スクリーニングと感受性検出。(A-C)ハイブリッドポプラクローンの耐性スクリーニングと、(D-F)ハイブリッドポプラクローン「Bofeng 3」における病原体Botryosphaeria dothidea分離株のin vivo葉接種法による検出。この図の拡大版を表示するには、ここをクリックしてください。
| 深刻度グレード | 採点基準 | レベル |
| 病気はありません | 症状なし、壊死領域0〜2.0mm² | 0 |
| 非常にマイルド | 壊死領域 2.0–4.0 mm² | 1 |
| 軽度の病気 | 壊死領域 4.0–6.0 mm² | 2 |
| 中等度の病気 | 壊死領域 6.0–8.0 mm² | 3 |
| 中等度重症の疾患 | 壊死領域 8.0–10.0 mm² | 4 |
| 重篤な疾患 | 壊死領域が10.0mm²を超える | 5 |
表1:葉の潰瘍性病原体によって誘発される壊死症状の重症度等級付け。
ディスカッション
このプロトコルは、ポプラ潰瘍耐性病原体に対する迅速かつ効率的な接種方法を提供し、ポプラ潰瘍耐性のハイブリッド育種や茎潰瘍性病原体の病原性スクリーニングなど、大規模な耐病性スクリーニングを必要とする研究分野に適しています。
この方法の最初の重要なポイントは、成熟した茎/枝の代わりに新たに成熟した葉の接種によって病害抵抗性を評価することです。その結果、茎潰瘍病抵抗性クローンの選択は、葉接種法を使用する場合、ポプラハイブリッド育種の1〜2年で実施でき、茎接種経路での時間のかかる抵抗性スクリーニング(育種後5〜7年)と比較して、葉法はポプラ茎潰瘍病の繁殖サイクルを大幅に短縮します。リーフメソッドの2番目の重要なステップは、リーフの選択です。葉の耐病性は、その個体発生(年齢または枝の位置)によって異なり、葉の段階に関連する抵抗性の葉個体発生抵抗性と呼ばれます12,13。したがって、テストされた葉と茎/枝との間の植物抵抗性の相関関係は、葉の接種方法の有効性にとって非常に重要です。「5つの中葉」の葉の斑点抵抗性は、ハイブリッドポプラ-セプトリア相互作用13の茎潰瘍抵抗性とは関係ありません。しかし、Weiらの研究14と私たちの研究は、新しく成熟した葉の上部または上部の5〜7番目の葉の葉の斑点抵抗性が、Malus-V.ceratospermaとポプラ-C.chrysospermaの相互作用における茎の潰瘍抵抗性と一致することを示しました。したがって、茎のポプラ育種にはin vivo葉接種法を使用でき、上位5〜7枚の葉が接種材料として利用できます。この方法の3番目の重要なポイントは、病原体接種後に針を繰り返し刺すことにより、十分な傷部位(30部位が推奨され、このプロトコルでは50部位)を生成することであり、理論的には、どの傷部位が3つのポプラ葉に50の独立した壊死スポットに発達し、ポプラ子孫の潰瘍病に対する耐性をより正確に評価します。さらに、葉の中の光条件15の水分保存および選択は、ポプラ茎潰瘍病に対するより安定した正確な耐性評価を獲得するのに有益である。
このプロトコルでは、多年生ポプラの木の樹齢1年>苗木(3か月栽培)と1年生ポプラ樹の枝(2か月>栽培)の両方を接種材料として使用しました。ポプラの苗木は、一貫性があり、操作が簡単なため、耐病性スクリーニングに最適です。それどころか、ポプラの枝や葉(害虫、病気、機械的な損傷がなく、照明や日陰などの環境条件が同じである)を選択することは困難です。
従来の in vitro 茎接種法と比較して、 in vivo 葉接種法は、多くの面でポプラ潰瘍耐性育種を急激に改善します:1)ポプラ茎潰瘍疾患のハイブリッド育種のための実行可能な耐病性スクリーニング方法を提供します。私たちの経験によると、3人のチームが1日で200以上のポプラハイブリッドクローンの真菌接種を行い、5〜7日後に結果を得ることができます。したがって、ブリーダーは、3〜6人の協力を通じて、短期間(たとえば1か月)で大規模な雑種集団(たとえば、1,000の遺伝子型)の耐病性をスクリーニングできます。2)葉の接種法は、潰瘍抵抗性クローンの最初の選択の時間を大幅に進めます(繁殖後5〜7年から1〜2年)ため、潰瘍病を予防する抵抗性クローンの早期選択と苗木選択に有利です。3)葉の接種法により、研究者はすべての雑種子孫の抵抗性構造と多様性を深く明らかにし、生産または育種のための候補耐性クローンを得ることができます。4)さらに、ハイスループットシーケンシング技術と組み合わせることで、葉接種法は耐性関連遺伝子および遺伝子モジュール4のマイニングに有益であり、ゲノム選択(GS)技術4に基づくポプラ病抵抗性育種に使用することができます4。最後に、ポプラの成長期に上位5〜7番目の 葉を連続生産するために、ブリーダーは、さまざまな病原体株またはさまざまな病気の病原体に対するポプラの耐性をスクリーニングできます。次に、葉の接種方法は、ポプラの多射影育種のための実行可能な経路も提供し、例えば、 C. chrysosperma と B. dothidea canker病に同時に抵抗するハイブリッドクローンを取得します。しかし、葉の接種法は、比較的小さな雑種ポプラの子孫(48遺伝子型)における潰瘍抵抗性のスクリーニングから発展したことに注意する必要があります。次に、ポプラ潰瘍抵抗性育種の重要な戦略として、この方法の有効性は、ポプラ雑種のより大きな集団または栽培されたポプラプランテーションからのより堅牢な検証が必要です。
このプロトコルは、ポプラ潰瘍病(例えば、 サイトスポラ病、ボツリオスファリア病、 セプトリア 病)の雑種育種の開発に貢献し、中国と北米のポプラ植林で耐性ポプラ雑種クローンを提供します。さらに、このプロトコルは、幹潰瘍疾患の病原性の理解に貢献し、遺伝的アッセイと遺伝子マイニングを促進し、ポプラ分子育種の開発を改善します。さらに、葉の接種法は、潰瘍性病原体の感受性をスクリーニングし、真菌の病原性関連遺伝子を決定するための正確で安定した評価方法も意味します。
開示事項
著者は何も開示していません。
謝辞
本研究は、中央公益科学機関国家樹木遺伝育種研究研究所基礎研究基金(助成金番号CAFYBB2020ZY001-2)と中国国家自然科学基金会(助成金番号32171776)から趙嘉平市に共同で資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
参考文献
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved