Method Article
Inoculazione fogliare in vivo: un metodo alternativo per valutare la resistenza alle malattie dei cloni ibridi nell'allevamento dei pioppi del cancro del fusto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Forniamo un protocollo passo-passo per valutare la resistenza del pioppo ai patogeni del cancro del fusto utilizzando un metodo di inoculazione fogliare in vivo . Questo metodo è particolarmente adatto per la valutazione su larga scala della resistenza al cancro di Cytospora chrysosperma e Botryosphaeria dothidea nella progenie riproduttiva di pioppo in Cina.
Abstract
Cancro del fusto causato dal patogeno Cytospora chrysosperma (Pers.) Fr.) e Botryosphaeria dothidea (Moug. ex Fr.) Ces. Sono le due principali malattie forestali nelle piantagioni di pioppo in Cina, a volte che possono distruggere tutte le piantine di pioppo o danneggiare gravemente le foreste di pioppi mature. L'allevamento ibrido è il metodo più diretto ed efficiente per controllare e gestire le malattie degli alberi. Tuttavia, la valutazione della resistenza alle malattie o la selezione di cloni resistenti alle malattie sulla base dell'inoculazione in vitro dello stelo è inefficiente, dispendiosa in termini di tempo e costosa, limitando lo sviluppo dell'allevamento ibrido della malattia del cancro dello stelo di pioppo. In questo studio, abbiamo proposto un metodo alternativo per valutare la resistenza della malattia ai patogeni del cancro dello stelo attraverso l'inoculazione in vivo delle foglie. I materiali di prova utilizzati in questo metodo possono essere su alberelli di pioppo di 1 anno o sui rami annuali di pioppi perenni in serra o sul campo. Il passaggio critico di questo metodo alternativo è la selezione delle foglie inoculanti: le 5-7foglie appena maturate potrebbero essere le più adatte. Il secondo passaggio critico del metodo di inoculazione delle foglie consiste nel praticare ferite sulle foglie delle piante attraverso fori di ago, fornendo lesioni sufficienti per misurare la gravità della malattia. Per il numero adeguato di foglie prodotte nella fase iniziale dell'allevamento del pioppo, questa inoculazione fogliare in vivo contribuisce allo screening rapido, accurato e su larga scala dei cloni di pioppo resistenti alle malattie per i patogeni del cancro del fusto. Inoltre, questo metodo di inoculazione delle foglie servirà anche come metodo efficiente per lo screening dei patotipi del patogeno del cancro del fusto C. chrysosperma, B. dothidea o altri patogeni del cancro del fusto di pioppo.
Introduzione
Cancro del fusto di pioppo, causate principalmente da due patogeni necrotrofi, Cytospora chrysosperma (Pers.) Fr. e Botryosphaeria dothidea (Moug. ex Fr.) Ces. & de Not., minacciano gravemente lo sviluppo e la sopravvivenza delle piantagioni di pioppi nel nord-est, nel nord e nel nord-ovest (Three-north) della Cina. L'allevamento ibrido è il metodo più diretto ed efficiente per controllare e gestire le malattie degli alberi; Tuttavia, rispetto ai progressi nell'allevamento di cloni ibridi di pioppo ad alto rendimento, a crescita rapida o di altro tipo, la ricerca sull'allevamento a resistenza per il cancro del pioppo è scarsa. Sono stati riportati solo studi limitati sull'allevamento di ibridi resistenti alle malattie 1,2,3 e nessun clone ibrido resistente al cancro è stato coltivato nell'imboschimento dei pioppi.
La fase cruciale dell'ibridazione regolare è la selezione dei cloni basata sull'acquisizione del fenotipo della progenie ibrida. Tuttavia, l'acquisizione dell'acquisizione di fenotipi patologici (patotipi) è un processo che richiede tempo, laborioso, faticoso, costoso e che dipende dagli esperti. Per le piante legnose, è più impegnativo a causa della natura dispendiosa in termini di tempo, manodopera ed economia causata dal loro lungo ciclo di vita, dalla crescita lenta e dal corpo massiccio. Ad esempio, nel pioppo, lo screening della resistenza al cancro della progenie ibrida è stato condotto 5-7 anni dopo l'ibridazione attraverso metodi convenzionali di inoculazione in vitro dello stelo 1,2,3. Inoltre, limitati da questo metodo di screening resistente alle malattie a bassa efficienza e ad alto consumo, i ricercatori hanno riselezionato i cloni resistenti al cancro da un piccolo sottogruppo (ad esempio, i cloni di pioppo selezionati ad alto rendimento o a crescita rapida), non da tutta la progenie ibrida. Pertanto, utilizzando i normali metodi di inoculazione degli steli, non è sicuro di identificare i cloni resistenti autentici e non può rivelare la diversità resistente alle malattie della progenie riproduttiva, limitando così l'esplorazione di geni o moduli genici correlati alla resistenza alle malattie. Rispetto al rapido sviluppo dell'allevamento del pioppo a crescita rapida/ad alto rendimento, questi programmi di allevamento possono ottenere ibridi attraverso la selezione fenotipica o anche la selezione genomica nei primi due anni di allevamento4, l'allevamento resistente al cancro del pioppo si è sviluppato lentamente. Lo screening (o rilevamento) della progenie ibrida resistente alla malattia, o il metodo di inoculazione del patogeno, è diventato il passo cruciale per limitare la velocità nell'allevamento resistente al cancro del pioppo.
In questo protocollo, introduciamo un nuovo metodo di inoculazione per i patogeni del cancro del fusto di pioppo, il metodo di inoculazione delle foglie in vivo . Utilizzando questo metodo, possiamo testare in modo rapido ed efficiente la resistenza al cancro di dozzine di specie di pioppo (cultivar o cloni) entro 5-7 giorni. Il test di convalida ha dimostrato che l'inoculazione fogliare in vivo è coerente con l'inoculazione tradizionale in vitro dello stelo per il rilevamento della resistenza della malattia del cancro del fusto, suggerendo che il metodo di inoculazione delle foglie è adatto per lo screening della resistenza su larga scala delle malattie del cancro del pioppo, come l'intera selezione del genotipo della progenie di resistenza nell'allevamento della malattia del cancro del pioppo. Questo metodo risolve il problema patologico della selezione di una prole resistente nell'allevamento ibrido delle malattie del cancro del pioppo.
Protocollo
1. Coltura fungina per l'agente patogeno del cancro
- Preparare il terreno di coltura per l'agar destrosio di patate (PDA; estrazione di patate 6,0 g, destrosio 20,0 g, agar 20,0 g) per ceppi fungini; sciogliere i materiali di cui sopra in acqua fino a 1000 mL, sciogliere completamente il terreno a 100 °C per 10 minuti.
- Versare il terreno PDA in provette da 25 mL (ciascuna contenente 15,0 mL); sterilizzare tutte le provette a 121,1 °C per 30 min. Versare il terreno nelle piastre di coltura (9,0 cm di diametro) e raffreddare le piastre a temperatura ambiente (RT).
- Tagliare il micelio del patogeno fungino, che viene coltivato in terreno PDA a 28 °C per 7 giorni, in cubetti quadrati di ~0,5 cm; inoculare i cubi fungini al centro delle piastre PDA (i lati del micelio sono rivolti verso il terreno).
- Coltivare i patogeni fungini in un incubatore termostatico (28 °C, al buio) per 7-10 giorni.
- Tagliare il terreno PDA con micelio fungino in cubetti quadrati (lunghezza lato 1,0-1,2 cm).
2. Preparazione dei materiali di pioppo
- Per i cloni di pioppo di 1 anno (coltivati > 3 mesi), selezionare le foglie appena maturate e completamente estese (sempre 5-7foglie , dalla sommità dell'alberello/rami) dei rami principali come materiali inoculati, assicurarsi che siano prive di parassiti, malattie e danni meccanici.
- Per i rami di 1 anno di cloni ibridi di pioppo perenne (coltivati > 2 mesi), selezionare le prime 5-7foglie dei rami selezionati come materiali inoculati. Assicurati che le foglie siano sane e abbiano la stessa condizione di luce (ombra o luce) tra tutti i cloni di pioppo testati.
3. Pretrattamento delle foglie di inoculazione
- Spruzzare le foglie di pioppo con acqua pulita e, dopo l'asciugatura, pulire le foglie selezionate con alcool al 75% 1 ora o 1 giorno prima delle manipolazioni di inoculazione.
4. Inoculazione in vivo delle foglie
- Per le foglie piccole (larghezza fogliare < 8,0 cm), inoculare due cubi quadrati di micelio fungino e cubi PDA (o agar d'acqua, WA) (1,0-1,2 cm di lunghezza laterale) sulla superficie superiore delle 5-7 foglie superiori di cloni di pioppo; Il micelio è rivolto verso le foglie. Assicurarsi che i siti di inoculazione si trovino al centro delle mezze foglie, a ~1-2 cm di distanza dalle nervature centrali, evitando di oscurare le nervature secondarie. Ogni clone inocula 12 siti su 6 foglie (10 siti per il micelio e 2 siti per l'inoculazione del PDA).
- Per foglie grandi (larghezza fogliare ≥ 8,0 cm), inoculare quattro cubi quadrati di micelio fungino e cubi PDA (o WA) sulle 5-7 foglie di pioppo superiori. Ogni clone inocula 12 siti in 3 foglie (10 siti per il micelio e 2 siti per l'inoculazione del PDA).
- Avvolgere le foglie inoculate con del nastro adesivo trasparente (6,0 cm di larghezza) e premerle delicatamente per renderle adesive alle foglie, impedendo il movimento e la perdita d'acqua dei cubi di micelio (o PDA) durante l'esperimento.
- Forare le foglie e i cubi di micelio (o PDA) in cinque siti fino a quando gli aghi penetrano nei cubi dalla superficie superiore a quella inferiore delle foglie di pioppo. Un sito si trova al centro e gli altri quattro giacciono a 1-2 mm vicino ai quattro vertici dei cubi.
NOTA: Si consiglia una collaborazione di team di 3 persone per la manipolazione dell'inoculazione fungina. La manipolazione dell'inoculazione di una popolazione ibrida di pioppo (>100 genotipi) può essere condotta in 4 ore attraverso il lavoro di squadra. Le manipolazioni del piercing sono state condotte dopo che tutte le foglie testate sono state inoculate e avvolte per alleviare l'impatto dei diversi tempi di piercing sulla gravità della malattia. - Ispezionare lo spostamento della posizione e la perdita d'acqua degli inoculanti di micelio e osservare l'insorgenza di lesioni necrotiche attorno ai siti della ferita perforata dalla superficie inferiore delle foglie fino al 3° giorno di inoculazione.
- Entro 3 giorni dall'inoculazione, osservare lo spostamento della posizione e la perdita d'acqua dei cubetti di micelio. Definire e contrassegnare i cubi di micelio spostati ed essiccati come inoculazioni inefficaci e scartarli dall'identificazione finale dei patotipi definendo gli altri cubi come inoculazioni efficaci.
NOTA: Questo protocollo definisce i cloni di pioppo testati con più di cinque cubi di inoculazione efficaci come cloni inoculati non validi; Pertanto, ogni clone di pioppo ha fornito almeno 30 siti di inoculazione efficaci, che si svilupperanno in 30 punti necrotici indipendenti.
- Entro 3 giorni dall'inoculazione, osservare lo spostamento della posizione e la perdita d'acqua dei cubetti di micelio. Definire e contrassegnare i cubi di micelio spostati ed essiccati come inoculazioni inefficaci e scartarli dall'identificazione finale dei patotipi definendo gli altri cubi come inoculazioni efficaci.
- Raccogliere tutte le foglie inoculate alla fine dell'esperimento (~5-7 giorni dopo l'inoculazione), riportarle in laboratorio in sacchetti di plastica per campioni e conservarle a 4 °C.
5. Acquisizione del patotipo fogliare e valutazione della resistenza del pioppo alle oncologie del fusto in laboratorio
- Rimuovere con cura i nastri adesivi trasparenti e gli inoculanti di micelio (o PDA) dalle foglie.
- Osservare e identificare i patotipi fogliari di ciascun clone di pioppo, compresa la forma e il colore delle macchie necrotiche, e può includere la struttura fungina simile alle ife, i picnidi e i conidi che si sono formati sulla superficie delle foglie intorno ai siti di perforazione.
- Fotografa le foglie (con un righello aggiuntivo) con una fotocamera o scansiona le foglie (con un righello aggiuntivo) utilizzando uno scanner per ottenere immagini con una risoluzione superiore a 300 dpi, quindi salva le immagini in formato JPEG, TIFF o PNG.
6. Identificazione e analisi statistica dell'insorgenza della malattia
- Apri le immagini delle foglie malate nel software ImageJ 1.54g (http://imagj.org).
- Imposta la scala in base al righello nelle immagini delle foglie.
- Identificare e misurare le lesioni con lo strumento a bacchetta (tracciamento).
- Registra ed esporta i valori dell'area come foglio di calcolo dopo aver misurato le aree di tutti i punti necrotici.
- Stabilire i criteri per la determinazione della malattia:
- Se l'area della lesione attorno ai cubi di micelio coperti dai siti di perforazione è significativamente più grande di quella coperta dai cubi PDA, allora definisci questi siti come siti di malattia.
- Se le caratteristiche morfologiche dei cubi di micelio ricoperti di fori sono cambiate significativamente rispetto ai siti ricoperti di PDA, compresi i colori della lesione, che producono strutture simili alle ife, picnidi e conidi, definiscono il sito anche come sito della malattia.
- Calcola le aree medie delle macchie di lesione PDA efficaci di ciascun clone ibrido di pioppo. In base alle aree medie, dividere tutte le macchie di micelio inoculate di un clone di pioppo in due categorie: ad insorgenza e non insorgenza. Quindi, calcolare il tasso di incidenza della malattia del clone di pioppo testato (Formula 1: Tasso di incidenza della malattia (%) = Numero di siti di puntura malati/Numero totale di siti di puntura efficienti × 100).
- Calcola l'area media delle macchie malate nelle foglie (n = 50). In base ai valori delle aree medie di macchie malate delle foglie in tutti i cloni di pioppo testati, stabilire uno standard di classificazione della malattia a 5 livelli.
- Calcolare l'indice di malattia di ciascun clone di pioppo (Formula 2) in base allo standard di classificazione della malattia di cui sopra (Formula 2: Indice di malattia = ∑(Numero di siti di puntura per livello × Valori di gravità a tutti i livelli)/(Valore del livello di gravità più alto × Numero totale di siti di puntura efficienti) × 100).
- Verificare la normale distribuzione del numero di cloni di pioppo attraverso diversi livelli di resistenza utilizzando il test di Shapiro-Wilk utilizzando qualsiasi software di analisi dei dati appropriato.
- In base all'indice di malattia, identificare tutti i cloni di pioppo testati in cinque (o sette) gruppi: resistenza molto alta (VHR), alta resistenza (HR), resistenza (R), nessuna resistenza e nessuna suscettibilità (NRNS), suscettibilità (S), alta suscettibilità (HS) e suscettibilità molto alta (VHS) gruppo5.
Risultati
In questo protocollo, il flusso di lavoro schematico è stato condotto in 48 cloni ibridi di pioppo infettati dal patogeno del cancro del fusto C. chrysosperma (Figura 1). I cloni ibridi di pioppo fanno parte della progenie di ibridazione di P. deltoides, coltivata nel vivaio presso l'Accademia Forestale Cinese (CAF), Pechino.
L'agente patogeno del cancro del fusto C. chrysosperma isolato CZC è un tipico ceppo fungino (con patogenicità media) utilizzato per la ricerca fisiologica del cancro del pioppo 6,7,8,9 e depositato nel nostro laboratorio. I risultati hanno mostrato che l'inoculazione del patogeno del cancro del fusto C. chrysosperma ha indotto lesioni necrotiche (Figura 2B, C) e persino strutture simili a picnidi su foglie di pioppo (Figura 2D-F). Inoltre, i risultati hanno anche dimostrato che le posizioni fogliari (o età fogliare e ontogenesi fogliare) (Figura 2G-I) e le condizioni di luce delle foglie (Figura 2J-L) influiscono sulla gravità della malattia delle foglie inoculate dal patogeno del cancro dello stelo C. chrysosperma isolato CZC.
La patogenicità degli inoculanti fungini è un fattore cruciale nello screening della resistenza di popolazioni ibride sconosciute. Tuttavia, ci sono stati due punti di vista opposti sulla selezione dei ceppi virulenti nell'allevamento: l'utilizzo del ceppo più virulento10 e i ceppi moderatamente virulenti11. Nell'esperimento preliminare di questo protocollo, abbiamo selezionato C. chrysosperma per isolare CZC dal rilevamento della patogenicità di 10 isolati fungini in pioppo ibrido "Bofeng 3". I risultati indicano che la distribuzione dei cloni di pioppo attraverso diversi livelli di resistenza nei 48 cloni ibridi di pioppo è normale, come confermato dall'analisi del test di Shapiro-Wilk in SPSS, suggerendo che questo isolato è il preferito per lo screening della resistenza di questa attuale popolazione di ibridazione del pioppo. I risultati parziali dello screening di resistenza di 48 cloni di pioppo sono mostrati nella Figura 3A-C. Inoltre, i risultati hanno mostrato che sei isolati del patogeno B. dothidea hanno una virulenza differenziale rispetto al pioppo ibrido "Bofeng 3", e gli isolati SD47 e SD60 sono gli isolati più virulenti nei ceppi fungini testati (Figura 3D-F), suggerendo che il metodo di inoculazione fogliare è utilizzato anche nello screening della virulenza del patogeno del cancro del fusto di pioppo.
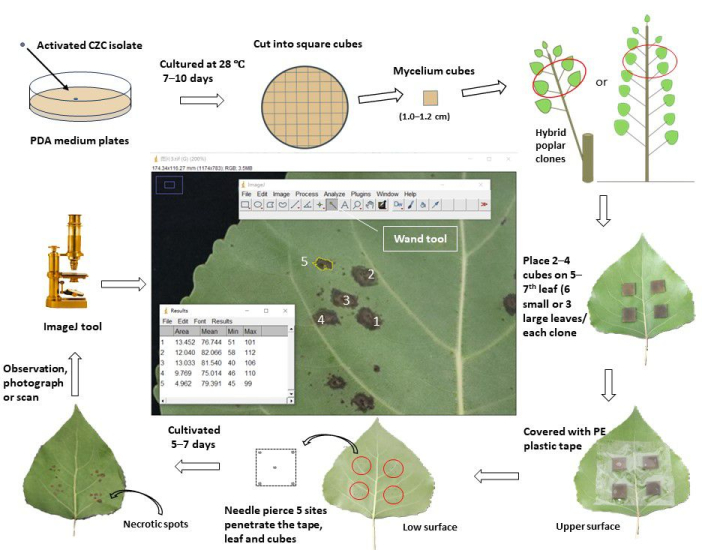
Figura 1: Un flusso di lavoro schematico per la valutazione della resistenza al cancro dello stelo attraverso l'inoculazione in vivo di foglie in cloni di pioppo. Il patogeno attivato del cancro dello stelo Cytospora chrysosperma isolato CZC è stato coltivato in piastre PDA a 28 °C, al buio, per 10 giorni. Quindi, il micelio di C. chrysosperma è stato tagliato in cubi quadrati (1,0-1,2 cm di lunghezza laterale) e inoculato sulla superficie superiore delle 5-7foglie superiori in alberelli di pioppo di 1 anno o pioppo di 1 anno ramificato su pioppi perenni. Il lato delle ife dei cubi di micelio era rivolto verso le foglie. Per le foglie piccole (larghezza fogliare < 8,0 cm), sono stati inoculati due cubi di micelio su una foglia, mentre quattro cubi di micelio sono stati inoculati sulle foglie grandi (larghezza fogliare ≥ 8,0 cm). Tuttavia, le foglie piccole e grandi, dieci cubi di micelio e 2 cubi medi PDA sono stati inoculati sugli alberelli/rami. Quindi, le foglie inoculate sono state avvolte con nastro protettivo di plastica largo 6,0-8,0 cm per fissare i cubetti e impedirne la perdita d'acqua. Le foglie e i cubi venivano forati con aghi per produrre punti di ferita al centro e ai quattro vertici dei quadrati. Le foglie inoculate sono state coltivate nel campo/serra e osservate, fotografate/scansionate 5-7 giorni dopo l'inoculazione. Quindi, le immagini sono state caricate nel software ImageJ per misurare le aree medie delle macchie necrotiche che si sono sviluppate dai siti di ferita perforati di ciascun clone di pioppo. Infine, il tasso di incidenza della malattia e l'indice di malattia sono stati calcolati sulla base delle aree medie delle macchie necrotiche di ciascun clone di pioppo. Secondo l'indice di malattia, tutti i cloni di pioppo testati sono stati divisi in diversi gruppi di resistenza. Clicca qui per visualizzare una versione più grande di questa figura.
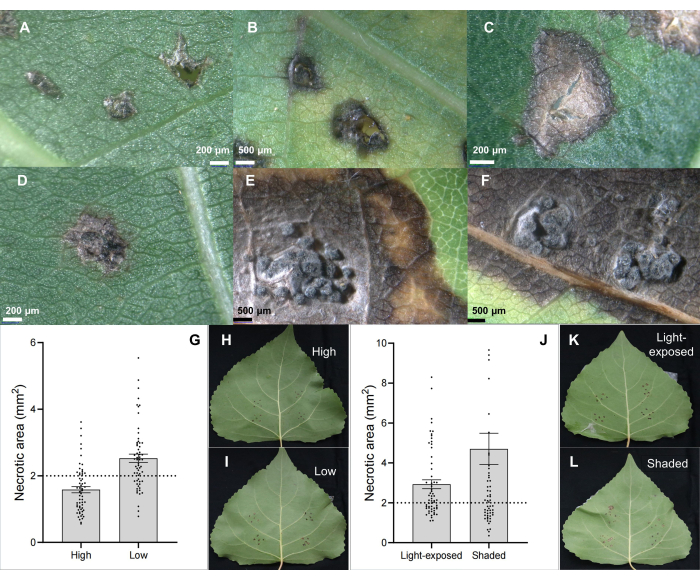
Figura 2: Caratteristiche classiche della lesione fogliare su clone ibrido di pioppo B246 infettato dal patogeno del cancro C. chrysosperma attraverso inoculazione fogliare. (A) inoculata da inoculanti PDA; (B,C) macchie necrotiche; (D-F) macchie necrotiche con struttura picnidiale; (G-I) le posizioni della foglia inoculata nell'alberello/rami di 1 anno influenzano la gravità della malattia del patogeno del cancro del fusto C. chrysosperma sulla cultivar ibrida di pioppo "Bofeng 3"; Le condizioni di luce (J-L) influenzano la gravità della malattia sulla cultivar di pioppo "Bofeng 3". Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Screening della resistenza e rilevamento della suscettibilità. Screening della resistenza di cloni ibridi di pioppo (A-C) e rilevamento suscettibile dell'agente patogeno Botryosphaeria dothidea isolati nel clone ibrido di pioppo (D-F) "Bofeng 3" utilizzando il metodo di inoculazione fogliare in vivo. Clicca qui per visualizzare una versione più grande di questa figura.
| Grado di gravità | Criteri di valutazione | Livello |
| Nessuna malattia | Nessun sintomo, area necrotica 0–2,0 mm² | 0 |
| Estremamente delicato | Area necrotica 2,0–4,0 mm² | 1 |
| Malattia lieve | Area necrotica 4,0–6,0 mm² | 2 |
| Malattia moderata | Area necrotica 6,0–8,0 mm² | 3 |
| Malattia moderatamente grave | Area necrotica 8,0–10,0 mm² | 4 |
| Malattia grave | Area necrotica superiore a 10,0 mm² | 5 |
Tabella 1: Classificazione della gravità dei sintomi necrotici indotti da agenti patogeni del cancro sulle foglie.
Discussione
Questo protocollo fornisce un metodo di inoculazione rapido ed efficiente per i patogeni resistenti al cancro del pioppo, adatto per i campi di ricerca che richiedono lo screening della resistenza alle malattie su larga scala, come l'allevamento ibrido della resistenza al cancro del pioppo e lo screening della patogenicità dei patogeni del cancro del fusto.
Il primo punto chiave del metodo è valutare la resistenza alle malattie mediante inoculazione di foglie appena maturate invece di steli/rami maturi. Di conseguenza, la selezione dei cloni resistenti alla malattia del cancro del fusto può essere condotta in 1-2 anni di allevamento ibrido di pioppo quando si utilizza il metodo di inoculazione fogliare, rispetto allo screening della resistenza che richiede tempo nel percorso di inoculazione del fusto (5-7 anni dopo l'allevamento), il metodo fogliare accorcia notevolmente il ciclo riproduttivo della malattia del cancro del fusto di pioppo. Il secondo passo cruciale del metodo fogliare è la selezione delle foglie. La resistenza alle malattie delle foglie varia con la loro ontogenesi (età o posizione sui rami), chiamata resistenza all'ontogenesi fogliare della resistenza associata allo stadio fogliare12,13. Quindi, la correlazione della resistenza delle piante tra le foglie testate e il fusto/rami è fondamentale per l'efficacia del metodo di inoculazione delle foglie. La resistenza alle macchie fogliari sulle "cinque foglie centrali" non è correlata alla resistenza al cancro dello stelo nell'interazione ibrida pioppo-Septoria 13; tuttavia, lo studio14 di Wei et al. e la nostra ricerca hanno illustrato che la resistenza alle macchie fogliari sulle foglie superiori appena maturate o sulle prime 5-7foglie sono coerenti con la resistenza al cancro dello stelo nelle interazioni Malus-V. ceratosperma e pioppi-C. chrysosperma. Pertanto, il metodo di inoculazione delle foglie in vivo può essere utilizzato nell'allevamento del fusto del pioppo e le prime 5-7 foglie sono materiali di inoculazione. Il terzo punto chiave di questo metodo è la produzione di un numero sufficiente di siti di ferita (30 siti sono raccomandati e 50 siti in questo protocollo) attraverso ripetute perforazioni dell'ago dopo l'inoculazione del patogeno, in teoria, quali siti di ferita si svilupperanno in 50 macchie necrotiche indipendenti su tre foglie di pioppo fornendo una valutazione più accurata della resistenza alla malattia del cancro nella progenie del pioppo. Inoltre, la conservazione dell'umidità e la selezione delle condizioni di luce15 nelle foglie sono utili per acquisire una valutazione più stabile e accurata della resistenza alle malattie del cancro del fusto del pioppo.
In questo protocollo, come materiali di inoculazione sono stati utilizzati sia alberelli di pioppo di 1 anno (coltivati > 3 mesi) che rami di 1 anno (coltivati > 2 mesi) di pioppi perenni. Gli alberelli di pioppo sono ideali per lo screening della resistenza alle malattie perché sono più coerenti e più facili da usare. Al contrario, la selezione di rami o foglie di pioppo (che devono essere privi di parassiti, malattie e danni meccanici e avere le stesse condizioni ambientali, come l'illuminazione o l'ombreggiatura) è impegnativa.
Rispetto al tradizionale metodo di inoculazione del fusto in vitro , il metodo di inoculazione delle foglie in vivo migliora notevolmente l'allevamento resistente al cancro del pioppo sotto molti aspetti: 1) fornendo un metodo di screening della resistenza alle malattie fattibile per l'allevamento ibrido delle malattie del cancro del fusto del pioppo. Secondo la nostra esperienza, un team di 3 persone può condurre l'inoculazione fungina di oltre 200 cloni ibridi di pioppo in 1 giorno e quindi ottenere i risultati dopo 5-7 giorni. Pertanto, gli allevatori possono esaminare la resistenza alla malattia di un'ampia popolazione ibrida (ad esempio, 1.000 genotipi) in un breve periodo (ad esempio, 1 mese) attraverso la collaborazione di 3-6 persone. 2) Il metodo di inoculazione fogliare anticipa significativamente il tempo della prima selezione per i cloni resistenti al cancro (da 5-7 anni a 1-2 anni dopo l'allevamento), il che avvantaggia la selezione precoce e la selezione dell'alberello di cloni resistenti alle malattie del cancro dello stelo. 3) Utilizzando il metodo dell'inoculazione delle foglie, i ricercatori possono rivelare in profondità la struttura e la diversità di resistenza di tutta la progenie ibrida e ottenere cloni di resistenza candidati per la produzione o l'allevamento. 4) Inoltre, combinato con la tecnologia di sequenziamento ad alto rendimento, il metodo di inoculazione fogliare favorisce l'estrazione di geni e moduli genici correlati alla resistenza4e può essere utilizzato nell'allevamento di resistenza alla malattia del pioppo basato sulla tecnologia di selezione genomica (GS)4. Infine, per la produzione continua delle 5-7foglie superiori durante la stagione di crescita del pioppo, gli allevatori possono esaminare la resistenza del pioppo a diversi ceppi patogeni o a diversi patogeni patogeni; quindi, il metodo di inoculazione fogliare fornisce anche un percorso fattibile per l'allevamento multiproiettivo del pioppo, ad esempio, ottenere cloni ibridi che resistono contemporaneamente alle malattie del cancro di C. chrysosperma e B. dothidea . Tuttavia, va notato che il metodo di inoculazione fogliare si è sviluppato dallo screening per la resistenza al cancro in una progenie di pioppo ibrido relativamente piccola (48 genotipi). Quindi, come strategia critica per l'allevamento di resistenza al cancro del pioppo, l'efficacia di questo metodo necessita ancora di una convalida più solida da parte di una popolazione più ampia di ibridi di pioppo o piantagioni di pioppo coltivate.
Questo protocollo contribuirà allo sviluppo dell'allevamento ibrido delle malattie del cancro del pioppo (ad esempio, malattie da Cytospora, Botryosphaeria e Septoria ), fornendo cloni ibridi di pioppo resistenti nell'imboschimento del pioppo in Cina e Nord America. Inoltre, questo protocollo contribuirà alla nostra comprensione della patogenicità delle malattie del cancro del fusto, faciliterà i saggi genetici e l'estrazione genica e migliorerà lo sviluppo dell'allevamento molecolare del pioppo. Inoltre, il metodo di inoculazione fogliare implica anche un metodo di valutazione accurato e stabile per lo screening della suscettibilità dei patogeni del cancro e la determinazione dei geni correlati alla patogenicità dei funghi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata congiuntamente dall'Istituto Scientifico Centrale di Interesse Pubblico, dal Fondo di Ricerca Base dello Stato, dal Laboratorio Chiave di Genetica e Allevamento degli Alberi (numero di sovvenzione CAFYBB2020ZY001-2) e dalla Fondazione Nazionale di Scienze Naturali della Cina (numero di sovvenzione 32171776) a Jiaping Zhao.
Materiali
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
Riferimenti
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon