Method Article
חיסון עלי Vivo: שיטה חלופית להערכת עמידות המחלה של שיבוטים היברידיים בגידול צפצפה של מחלת אפטות גזע
* These authors contributed equally
In This Article
Summary
אנו מספקים פרוטוקול שלב אחר שלב להערכת עמידות צפצפה לפתוגנים של אפטות גזע באמצעות שיטת חיסון עלי in vivo . שיטה זו מתאימה במיוחד להערכה בקנה מידה גדול של עמידות למחלת Cytospora chrysosperma ו- Botryosphaeria dothidea canker בצאצאי גידול צפצפה בסין.
Abstract
מחלות אפטות גזע הנגרמות על ידי הפתוגן Cytospora chrysosperma (Pers.) Fr.) ו - Botryosphaeria dothidea (Moug. ex Fr.) Ces. ודה נוט הן שתי מחלות היער העיקריות במטעי הצפצפה בסין, שלעיתים יכולות להרוס את כל שתילי הצפצפה או לפגוע קשות ביערות צפצפה בוגרים. השבחה היברידית היא השיטה הישירה והיעילה ביותר לשליטה וניהול מחלות עצים. עם זאת, הערכת עמידות למחלות או בחירת שיבוטים עמידים למחלות המבוססים על חיסון גזע חוץ גופי אינה יעילה, גוזלת זמן ויקרה, ומגבילה את התפתחות הרבייה ההיברידית של מחלת אפטות גזע הצפצפה. במחקר זה, הצענו שיטה חלופית להערכת עמידות המחלה לפתוגנים של אפטות גזע באמצעות חיסון עלי in vivo . חומרי הבדיקה המשמשים בשיטה זו יכולים להיות על שתילי צפצפה בני שנה או על ענפים שנתיים של צפצפה רב שנתית בחממה או בשדה. השלב הקריטי בשיטה חלופית זו הוא בחירת העלים המחוסנים: 5-7 העליםהחדשים שהבשילו עשויים להיות המתאימים ביותר. השלב הקריטי השני של שיטת חיסון העלים הוא יצירת פצעים על עלי הצמח דרך פירסי מחט, מתן נגעים מספיקים כדי למדוד את חומרת המחלה. עבור המספר המספיק של עלים המיוצרים בשלב המוקדם של גידול הצפצפה, חיסון זה של עלי in vivo תורם לסריקה מהירה, מדויקת ובקנה מידה גדול של שיבוטי צפצפה עמידים למחלות כדי לעצור פתוגנים של אפטות אפטות. יתר על כן, שיטת חיסון עלים זו תשמש גם כשיטה יעילה לסינון פתוטיפים של מחלת אפטות גזע C. chrysosperma, B.dothidea, או פתוגנים אחרים של אפטות גזע צפצפה.
Introduction
מחלות אפטות גזע צפצפה, הנגרמות בעיקר על ידי שני פתוגנים נקרוטרופיים, Cytospora chrysosperma (Pers.) Fr. ו- Botryosphaeria dothidea (Moug. ex Fr.) Ces. &דה נוט., מאיימים קשות על התפתחותם והישרדותם של מטעי צפצפה בצפון-מזרח, צפון וצפון-מערב (שלושה צפון) של סין. גידול היברידי הוא השיטה הישירה והיעילה ביותר לשליטה וניהול מחלות עצים; עם זאת, בהשוואה להתקדמות ברבייה של שיבוטים היברידיים צפצפה בעלי תפוקה גבוהה, גידול מהיר או שיבוטים היברידיים אחרים של צפצפה, המחקר על גידול עמידות למחלת אפטות צפצפה הוא נדיר. רק מחקרים מוגבלים על רבייה היברידית עמידה למחלות דווחו 1,2,3, ואף שיבוט היברידי עמיד לאפטות לא טופח בייעור צפצפה.
השלב המכריע של רבייה היברידית רגילה הוא בחירת השיבוט המבוססת על רכישת פנוטיפ של צאצאים היברידיים. עם זאת, רכישת פנוטיפים פתולוגיים (פתוטיפים) היא תהליך גוזל זמן, מייגע, מעייף, יקר ותלוי מומחים. עבור צמחים עציים, זה מאתגר יותר בשל הטבע הגוזל זמן, עבודה וכלכלה שנגרם על ידי מחזור החיים הארוך שלהם, צמיחה איטית, וגוף מסיבי. לדוגמה, בצפצפה, בדיקת העמידות לאפטות של צאצאים היברידיים נערכה 5-7 שנים לאחר הכלאה באמצעות שיטות חיסון גזע חוץ גופיות קונבנציונליות 1,2,3. יתר על כן, כשהם מוגבלים על ידי שיטת סינון זו העמידה למחלות ביעילות נמוכה ובצריכה גבוהה, החוקרים בחרו מחדש את השיבוטים העמידים לאפטות מתת-קבוצה קטנה (לדוגמה, שיבוטי הצפצפה שנבחרו בעלי תפוקה גבוהה או גידול מהיר), ולא מכל צאצאי הכלאיים. לכן, באמצעות שיטות החיסון הרגילות, הוא אינו בטוח לזהות את השיבוטים העמידים האותנטיים ואינו יכול לחשוף את המגוון העמיד למחלות של צאצאי הרבייה, ובכך להגביל את חקר הגנים או מודולי הגנים הקשורים לעמידות למחלות. בהשוואה להתפתחות המהירה של גידול מהיר של צפצפה / יבול גבוה, תוכניות רבייה אלה יכולות להשיג הכלאות באמצעות ברירה פנוטיפית או אפילו ברירה גנומית בשנתיים הראשונות של הרבייה4, הרבייה העמידה לאפטות צפצפה התפתחה לאט. הסינון (או האיתור) העמיד למחלות של צאצאים היברידיים, או שיטת החיסון נגד פתוגנים, הפך לשלב הגבלת המהירות המכריע ברבייה של אפטות צפצפה עמידות למחלות.
בפרוטוקול זה, אנו מציגים שיטת חיסון חדשנית לפתוגנים של אפטות גזע צפצפה, בשיטת חיסון עלי vivo . באמצעות שיטה זו אנו יכולים לבדוק במהירות וביעילות את עמידותם של עשרות מיני צפצפה (זנים או שיבוטים) תוך 5-7 ימים. בדיקת התיקוף המחישה כי חיסון עלי in vivo עולה בקנה אחד עם החיסון המסורתי בגזע חוץ גופי על זיהוי עמידות של מחלת אפטות גזע, דבר המצביע על כך ששיטת חיסון העלים מתאימה לבדיקת עמידות בקנה מידה גדול של מחלות אפטות צפצפה, כגון בחירת גנוטיפ שלם של צאצאי עמידות ברבייה של מחלת אפטות גזע. שיטה זו פותרת את הבעיה הפתולוגית של בחירת צאצאים עמידים ברבייה היברידית של מחלות אפטות צפצפה.
Protocol
1. תרבות פטרייתית לפתוגן אפטות
- מכינים את אגר דקסטרוז תפוחי אדמה (PDA; מיצוי תפוחי אדמה 6.0 גרם, דקסטרוז 20.0 גרם, אגר 20.0 גרם) מדיום תרבית לזנים פטרייתיים; ממיסים את החומרים הנ"ל במים עד 1000 מ"ל, ממיסים לחלוטין את המדיום ב 100 ° C למשך 10 דקות.
- יוצקים מדיום PDA לתוך צינורות 25 מ"ל (כל אחד מכיל 15.0 מ"ל); יש לעקר את כל הצינורות בטמפרטורה של 121.1°C למשך 30 דקות. יוצקים את המדיום לצלחות תרבית (בקוטר 9.0 ס"מ) ומקררים את הצלחות בטמפרטורת החדר (RT).
- חותכים את התפטיר של הפתוגן הפטרייתי, אשר תרבית בינוני PDA ב 28 ° C במשך 7 ימים, לתוך ~ 0.5 ס"מ קוביות מרובעות; לחסן את קוביות הפטרייה במרכז לוחות PDA (דפנות התפטיר פונות למדיום).
- תרבית את הפתוגנים הפטרייתיים באינקובטור תרמוסטטי (28 מעלות צלזיוס, בחושך) במשך 7-10 ימים.
- חותכים את מדיום כף היד עם תפטיר פטרייתי לקוביות מרובעות (אורך צד 1.0-1.2 ס"מ).
2. הכנת חומרי צפצפה
- עבור שיבוטים של צפצפה בת שנה (מעובדים > 3 חודשים), בחרו את העלים החדשים שהובגרו והמורחבים במלואם (תמיד 5-7עלים , מראש השתיל/ענפים) של הענפים העיקריים כחומרים מחוסנים, וודאו שהם נקיים ממזיקים, מחלות ונזקים מכניים.
- עבור ענפים בני שנה של שיבוטים היברידיים רב-שנתיים של צפצפה (מעובדים > חודשיים), בחר את 5-7העלים העליונים של הענפים שנבחרו כחומרים מחוסנים. ודא שהעלים בריאים ובעלי אותו מצב אור (צל או אור) בין כל שיבוטי הצפצפה שנבדקו.
3. טיפול מקדים בעלי חיסון
- רססו את עלי הצפצפה במים נקיים, ולאחר הייבוש, נגבו את העלים שנבחרו עם 75% אלכוהול שעה או יום אחד לפני מניפולציות החיסון.
4. חיסון עלי In vivo
- לעלים קטנים (רוחב העלה < 8.0 ס"מ), יש לחסן שתי קוביות תפטיר פטרייתי מרובעות וקוביות PDA (או אגר מים, WA) (באורך צד 1.0-1.2 ס"מ) על פני השטח העליונים של 5-7 העלים העליונים של שיבוט צפצפה; התפטיר פונה לעלים. יש לוודא כי אתרי החיסון ממוקמים במרכז חצאי העלים, ~1-2 ס"מ מהמרחק בין הוורידים המרכזיים, תוך הימנעות מטשטוש הוורידים המשניים. כל שיבוט מחסן 12 אתרים על 6 עלים (10 אתרים לתפטיר ו-2 אתרים לחיסון PDA).
- לעלים גדולים (רוחב העלה ≥ 8.0 ס"מ), חסנו ארבע קוביות תפטיר פטרייתי מרובעות וקוביות PDA (או WA) על 5-7 עלי הצפצפה העליונים. כל שיבוט מחסן 12 אתרים ב-3 עלים (10 אתרים לתפטיר ו-2 אתרים לחיסון מחשב כף יד.
- עטפו את העלים המחוסנים בסרט הדבקה שקוף (ברוחב 6.0 ס"מ) ולחצו עליהם בעדינות כדי להפוך אותם להדביקים לעלים, ובכך מנעו תזוזה ואיבוד מים של קוביות התפטיר (או מחשב כף היד) במהלך הניסוי.
- מנקבים את העלים ואת קוביות התפטיר (או מחשב כף יד) בחמישה אתרים עד שהמחטים חודרות את הקוביות מהמשטח העליון לתחתון של עלי הצפצפה. אתר אחד נמצא במרכז, וארבעת האחרים נמצאים 1-2 מ"מ ליד ארבעת קודקודי הקוביות.
הערה: שיתוף פעולה צוות של 3 אנשים מומלץ למניפולציה של חיסון פטרייתי. מניפולציית החיסון של אוכלוסיית כלאיים צפצפה (>100 גנוטיפים) יכולה להתבצע תוך 4 שעות באמצעות עבודת צוות. מניפולציות הפירסינג בוצעו לאחר שכל העלים שנבדקו חוסנו ונעטפו כדי להקל על ההשפעה של זמני פירסינג שונים על חומרת המחלה. - בדוק את שינוי המיקום ואת אובדן המים של חיסוני התפטיר, וצפה בהופעת נגעים נמקיים סביב אתרי פצע פירס מפני השטח התחתונים של העליםעד היום השלישי לחיסון.
- תוך 3 ימים מהחיסון, שימו לב לשינוי המיקום ולאובדן המים של קוביות התפטיר. הגדירו וסמנו את קוביות התפטיר המועברות והמיובשות כחיסונים לא יעילים והשליכו אותן מהזיהוי הסופי של הפתוטיפים תוך הגדרת הקוביות האחרות כחיסונים יעילים.
הערה: פרוטוקול זה מגדיר את שיבוטי הצפצפה שנבדקו עם יותר מחמש קוביות חיסון יעילות כשיבוטים מחוסנים לא חוקיים; לכן, כל שיבוט צפצפה סיפק לפחות 30 אתרי חיסון יעילים, שיתפתחו ל-30 נקודות נמק עצמאיות.
- תוך 3 ימים מהחיסון, שימו לב לשינוי המיקום ולאובדן המים של קוביות התפטיר. הגדירו וסמנו את קוביות התפטיר המועברות והמיובשות כחיסונים לא יעילים והשליכו אותן מהזיהוי הסופי של הפתוטיפים תוך הגדרת הקוביות האחרות כחיסונים יעילים.
- קטפו את כל העלים המחוסנים בסוף הניסוי (~5-7 ימים לאחר החיסון), החזירו אותם למעבדה בשקיות דגימת פלסטיק, ואחסנו אותם בטמפרטורה של 4 מעלות צלזיוס.
5. רכישת פתוטיפ עלים והערכת עמידות צפצפה למחלות אפטות גזע במעבדה
- הסירו בזהירות את סרטי ההדבקה השקופים ואת התפטיר (או מחשבי כף היד) מהעלים.
- התבוננו וזהו את פתוטיפ העלים של כל שיבוט צפצפה, כולל הצורה והצבע של כתמים נמקיים, ועשויים לכלול את המבנה דמוי קור הפטרייה, פיקנידיה וקונידיה שנוצרו על פני השטח של העלים סביב אתרי הפירס.
- צלם את העלים (עם סרגל נוסף) באמצעות מצלמה, או סרוק את העלים (עם סרגל נוסף) באמצעות סורק לקבלת תמונות ברזולוציה של מעל 300 dpi, ולאחר מכן שמור את התמונות בתבנית JPEG , TIFF או PNG.
6. זיהוי וניתוח סטטיסטי של התרחשות המחלה
- פתח את התמונות של עלים חולים בתוכנה ImageJ 1.54g (http://imagj.org).
- קבעו את קנה המידה בהתאם לסרגל בתמונות העלים.
- זהה ומדוד את הנגעים בעזרת כלי השרביט (עקיבה).
- רשום וייצא את ערכי האזור כגיליון אלקטרוני לאחר מדידת האזורים של כל הכתמים הנמקיים.
- קבעו את הקריטריונים לקביעת המחלה:
- אם שטח הנגע סביב קוביות התפטיר המכוסות באתרי פירס גדול משמעותית מזה המכוסה בקוביות PDA, אז הגדירו אתרים אלה כאתרי מחלה.
- אם המאפיינים המורפולוגיים של קוביות התפטיר שכסו אתרי פירס השתנו באופן משמעותי בהשוואה לאתרים המכוסים במחשבי כף יד, כולל צבעי הנגע, המייצרים מבנה דמוי קורים, פיקנידיה וקונידיה, הגדירו את האתר גם כאתר מחלה.
- חשב את האזורים הממוצעים של כתמי הנגע היעילים של כל שיבוט צפצפה היברידי. על פי האזורים הממוצעים, חלקו את כל כתמי התפטיר של שיבוט צפצפה אחד לשתי קטגוריות: התחלה ואי הופעה. לאחר מכן, חשב את שיעור היארעות המחלה של שיבוט הצפצפה הנבדק (פורמולה 1: שיעור היארעות המחלה (%) = מספר אתרי הדקירה החולה/המספר הכולל של אתרי דקירה יעילים × 100).
- חשב את השטח הממוצע של כתמים חולים בעלים (n = 50). על פי ערכי האזורים הממוצעים של כתמי עלים חולים בכל שיבוטי הצפצפה שנבדקו, קבעו סטנדרט לדירוג מחלה בן 5 רמות.
- חשב את מדד המחלה של כל שיבוט צפצפה (פורמולה 2) בהתבסס על תקן דירוג המחלה לעיל (פורמולה 2: מדד המחלה = ∑(מספר אתרי הדקירה לפי רמה × ערכי חומרה בכל הרמות)/(ערך רמת החומרה הגבוהה ביותר × המספר הכולל של אתרי דקירה יעילים) × 100).
- אמת את ההתפלגות הנורמלית של מספר שיבוטי הצפצפה על פני רמות התנגדות שונות באמצעות מבחן שפירא-וילק באמצעות כל תוכנת ניתוח נתונים מתאימה.
- על פי מדד המחלה, זהה את כל שיבוטי הצפצפה שנבדקו כחמש (או שבע) קבוצות: התנגדות גבוהה מאוד (VHR), התנגדות גבוהה (HR), התנגדות (R), ללא התנגדות וללא רגישות (NRNS), רגישות (S), רגישות גבוהה (HS) ורגישות גבוהה מאוד (VHS)קבוצה 5.
תוצאות
בפרוטוקול הזה, תהליך העבודה הסכמטי נערך ב-48 שיבוטים היברידיים של צפצפה שנדבקו על-ידי פתוגן האפטות C . chrysosperma (איור 1). שיבוטי הכלאיים של הצפצפה הם חלק מצאצאי הכלאה של P. deltoides, המעובדים במשתלה באקדמיה הסינית ליערנות (CAF), בייג'ינג.
פתוגן אפטות הגזע C. chrysosperma isolate CZC הוא זן פטרייתי טיפוסי (עם פתוגניות אמצעית) המשמש למחקר פיזיולוגי של מחלת אפטות צפצפה 6,7,8,9 ומופקד במעבדה שלנו. התוצאות הראו שחיסון של פתוגן C. chrysosperma גרם לנגעים נמקיים (איור 2B,C) ואפילו למבנים דמויי פיקנידיה על עלי צפצפה (איור 2D-F). יתר על כן, התוצאות גם הראו שמיקום העלים (או גילאי העלים ואונטוגניות העלים) (איור 2G-I) ותנאי האור של העלים (איור 2J-L) משפיעים על חומרת המחלה של העלים שחוסנו על-ידי פתוגן C. chrysosperma isolate CZC.
הפתוגנניות של חיסונים פטרייתיים היא גורם מכריע בבדיקת עמידות של אוכלוסיות היברידיות לא ידועות. עם זאת, היו שתי דעות מנוגדות לגבי בחירת זנים אלימים ברבייה: שימוש בזנים האלימים ביותר10 ובזנים האלימים המתונים11. בניסוי הראשוני של פרוטוקול זה, בחרנו ב- C. chrysosperma לבודד CZC מזיהוי פתוגניות של 10 מבודדים פטרייתיים בצפצפה היברידית "Bofeng 3". באופן מעודד, התוצאות מצביעות על כך שהתפלגות שיבוטי הצפצפה על פני רמות התנגדות שונות ב-48 שיבוטים היברידיים של צפצפה היא נורמלית, כפי שאושר על ידי ניתוח מבחן שפירא-וילק ב- SPSS, מה שמרמז על כך שמבודד זה מועדף לסינון התנגדות של אוכלוסיית הכלאת הצפצפה הנוכחית. תוצאות חלקיות של בדיקת התנגדות של 48 שיבוטים של צפצפה מוצגות באיור 3A-C. יתר על כן, התוצאות הראו שלשישה מבודדים של הפתוגן B. dothidea יש אלימות דיפרנציאלית לצפצפה היברידית "Bofeng 3", ומבודדים SD47 ו-SD60 הם המבודדים האלימים ביותר בזני הפטריות שנבדקו (איור 3D-F), מה שמרמז על כך ששיטת חיסון העלים משמשת גם בסינון אלים של פתוגן מחלת אפטות גזע הצפצפה.
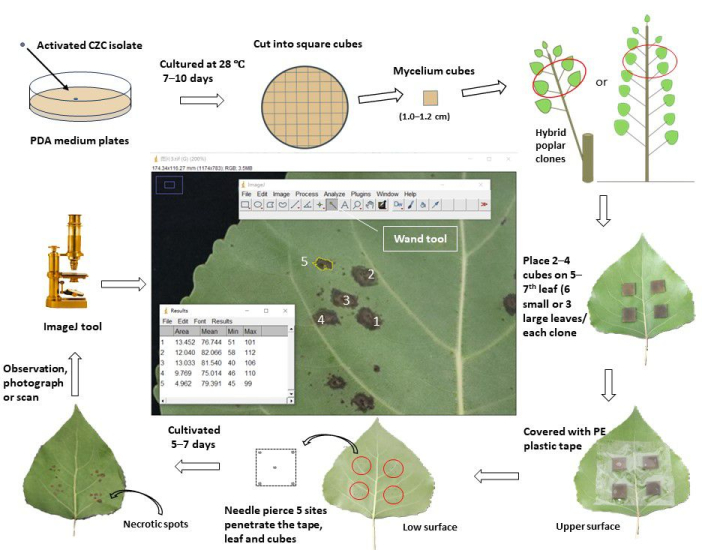
איור 1: תהליך עבודה סכמטי של הערכת עמידות לאפטות גזע באמצעות חיסון עלי in vivo בשיבוטים של צפצפה. פתוגן אפטות הגזע הפעיל Cytospora chrysosperma isolate CZC תורבת בצלחות PDA ב 28 מעלות צלזיוס, בחושך, במשך 10 ימים. לאחר מכן, התפטיר C. chrysosperma נחתך לקוביות מרובעות (1.0-1.2 ס"מ באורך צד) וחוסן על פני השטח העליוניםשל 5-7 העלים העליונים בשתילי צפצפה בני שנה או צפצפה בת שנה המסועפת על צפצפה רב שנתית. הצד הקורי של קוביות התפטיר פנה אל העלים. עבור העלים הקטנים (רוחב העלה < 8.0 ס"מ) חוסנו שתי קוביות תפטיר לעלה אחד, ואילו ארבע קוביות תפטיר חוסנו על העלים הגדולים (רוחב העלה ≥ 8.0 ס"מ). עם זאת, העלים הקטנים והגדולים, עשר קוביות תפטיר ו-2 קוביות בינוניות PDA חוסנו על השתילים/ענפים. לאחר מכן, העלים המחוסנים נעטפו בסרט מגן מפלסטיק ברוחב 6.0-8.0 ס"מ כדי לקבע את הקוביות ולשמור עליהן מפני איבוד מים. העלים והקוביות נוקבו במחטים כדי ליצור אתרי פציעה במרכז ובארבעת קודקודי הריבועים. העלים המחוסנים טופחו בשדה/חממה ונצפו, צולמו/נסרקו 5-7 ימים לאחר החיסון. לאחר מכן, התמונות הועמסו לתוך תוכנת ImageJ כדי למדוד את האזורים הממוצעים של הכתמים הנמקיים שהתפתחו מאתרי הפציעה המנוקבים של כל שיבוט צפצפה. לבסוף, שיעור היארעות המחלה ומדד המחלה חושבו על בסיס האזורים הממוצעים של הכתמים הנמקיים של כל שיבוט צפצפה. על פי מדד המחלה, כל שיבוטי הצפצפה שנבדקו חולקו לקבוצות התנגדות שונות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
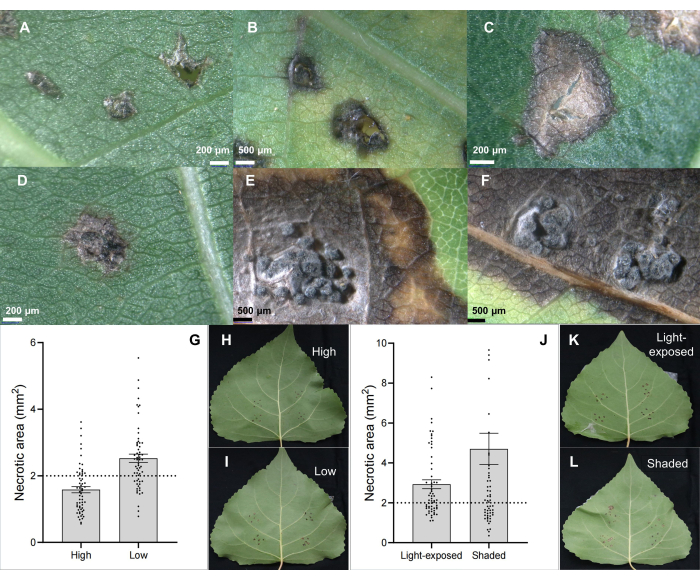
איור 2: מאפייני נגע עלים קלאסי בשיבוט צפצפה היברידי B246 הנגוע בפתוגן C. chrysosperma באמצעות חיסון עלים. (א) מחוסן בחיסוני PDA; (B,C) כתמים נמקיים; (D-F) כתמים נמקיים עם מבנה pycnidia; (G-I) מיקומי עלה מחוסן בשתיל/ענפים בני שנה משפיעים על חומרת המחלה של פתוגן אפטות גזע C. chrysosperma על זן צפצפה היברידי "Bofeng 3"; (J-L) תנאי האור משפיעים על חומרת המחלה על זן הצפצפה "Bofeng 3". אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: סינון התנגדות וזיהוי רגיש. בדיקת עמידות של שיבוטי צפצפה היברידיים (A-C) וזיהוי רגיש של פתוגן Botryosphaeria dothidea מבודד בשיבוט צפצפה היברידי (D-F) "Bofeng 3" באמצעות שיטת חיסון עלי in vivo. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| דרגת חומרה | קריטריונים למתן ציונים | רמה |
| אין מחלה | ללא תסמינים, אזור נמק 0-2.0 מ"מ² | 0 |
| מתון במיוחד | שטח נמק 2.0–4.0 מ"מ² | 1 |
| מחלה קלה | שטח נמק 4.0–6.0 מ"מ² | 2 |
| מחלה בינונית | שטח נמק 6.0–8.0 מ"מ² | 3 |
| מחלה בינונית קשה | שטח נמק 8.0–10.0 מ"מ² | 4 |
| מחלה קשה | שטח נמק גדול מ- 10.0 מ"מ² | 5 |
טבלה 1: דירוג חומרה של תסמינים נמקיים הנגרמים על ידי פתוגנים של אפטות על עלים.
Discussion
פרוטוקול זה מספק שיטת חיסון מהירה ויעילה לפתוגנים של עמידות לאפטות צפצפה, המתאימה לתחומי המחקר הדורשים בדיקות סקר עמידות למחלות בקנה מידה גדול, כגון רבייה היברידית של עמידות לאפטות צפצפה ובדיקת פתוגניות של פתוגנים של אפטות גזע.
נקודת המפתח הראשונה של השיטה היא להעריך עמידות למחלות על ידי חיסון עלים שזה עתה הבשילו במקום גבעולים / ענפים בשלים. כתוצאה מכך, בחירת שיבוטים של אפטות גזע עמידות למחלות יכולה להתבצע תוך 1-2 שנים של הכלאה צפצפה בעת שימוש בשיטת חיסון העלים, לעומת בדיקת עמידות גוזלת זמן במסלול חיסון גזע (5-7 שנים לאחר הרבייה), שיטת העלים המקצרת בחדות את מחזור הרבייה של מחלת אפטות גזע הצפצפה. השלב המכריע השני בשיטת העלים הוא בחירת העלים. עמידות העלים למחלה משתנה בהתאם לאונטוגניות שלהם (גילאים או מיקום על הענפים), הנקראת עמידות אונטוגנית של עלים הקשורה לשלב ההתנגדות12,13. לכן, המתאם של עמידות הצמח בין העלים שנבדקו לבין הגבעול/ענפים הוא קריטי ליעילות שיטת חיסון העלים. התנגדות כתמי העלה על "חמשת העלים האמצעיים" אינה קשורה לעמידות אפטות הגבעול באינטראקציה היברידית צפצפה-ספטוריה13; עם זאת, המחקר של Wei et al.14 והמחקר שלנו המחישו כי עמידות כתמי העלה על העלים הבשילו העליונים או 5-7העלים העליונים עולים בקנה אחד עם עמידות אפטות הגבעול ב Malus-V. ceratosperma ו צפצפה-C. אינטראקציות chrysosperma. לכן, ניתן להשתמש בשיטת חיסון עלי in vivo בגידול צפצפה של גזע, ו 5-7 העלים העליונים הם חומרי חיסון זמינים. נקודת המפתח השלישית של שיטה זו היא ייצור אתרי פציעה מספיקים (30 אתרים מומלצים ו-50 אתרים בפרוטוקול זה) באמצעות פירסינג חוזר ונשנה במחט לאחר חיסון פתוגן, באופן תיאורטי, אשר אתרי הפציעה יתפתחו ל-50 נקודות נמק עצמאיות על שלושה עלי צפצפה המספקים הערכה מדויקת יותר של עמידות מחלת האפטות בצאצאי צפצפה. בנוסף, שימור הלחות ובחירת תנאי האור15 בעלים מועילים ברכישת הערכת עמידות יציבה ומדויקת יותר למחלות אפטות גזע צפצפה.
בפרוטוקול זה, הן שתילי צפצפה בני שנה (מעובדים > 3 חודשים) והן ענפים בני שנה (מעובדים > חודשיים) של עצי צפצפה רב שנתיים שימשו כחומרי חיסון. שתילי הצפצפה אידיאליים לבדיקת עמידות למחלות מכיוון שהם עקביים יותר וקלים יותר לתפעול. להיפך, בחירת ענפי צפצפה או עלים (שאמורים להיות נקיים ממזיקים, מחלות ונזקים מכניים ובעלי אותם תנאים סביבתיים, כמו תאורה או הצללה) היא מאתגרת.
בהשוואה לשיטת החיסון המסורתית בגזע חוץ גופי , שיטת החיסון in vivo משפרת באופן חד את הרבייה העמידה לאפטות צפצפה בהיבטים רבים: 1) מספקת שיטת סינון אפשרית לעמידות למחלות לרבייה היברידית של אפטות גזע צפצפה. על פי הניסיון שלנו, צוות של 3 אנשים יכול לבצע את החיסון הפטרייתי של יותר מ -200 שיבוטים היברידיים צפצפה ביום אחד ולאחר מכן לקבל את התוצאות לאחר 5-7 ימים. לפיכך, המגדלים יכולים לסנן את עמידות המחלה של אוכלוסייה היברידית גדולה (למשל, 1,000 גנוטיפים) בתקופה קצרה (למשל, חודש) באמצעות שיתוף פעולה של 3-6 אנשים. 2) שיטת חיסון העלים מקדמת באופן משמעותי את זמן הברירה הראשונה לשיבוטים עמידים לאפטות (מ 5-7 שנים ל 1-2 שנים לאחר הרבייה), מה שמיטיב עם הבחירה המוקדמת והשתילים של שיבוטים עמידים למחלות אפטות גזע. 3) באמצעות שיטת חיסון העלים, חוקרים יכולים לחשוף לעומק את כל מבנה העמידות והמגוון של צאצאי הכלאיים ולקבל שיבוטים עמידים מועמדים לייצור או רבייה. 4) יתר על כן, בשילוב עם טכנולוגיית ריצוף בתפוקה גבוהה, שיטת חיסון העלים מועילה לכריית גנים ומודולים גנטיים הקשורים לעמידות4וניתן להשתמש בה ברבייה של עמידות למחלות צפצפה על בסיס טכנולוגיית ברירה גנומית (GS)4. לבסוף, לייצור רציףשל 5-7 העלים העליונים במהלך עונת הצמיחה של צפצפה, מגדלים יכולים לסנן את עמידות הצפצפה לזני פתוגן שונים או לפתוגנים שונים של מחלות; לאחר מכן, שיטת חיסון העלים מספקת גם מסלול אפשרי לרבייה רב-פרויקטיבית של צפצפה, למשל, להשיג שיבוט(ים) היברידיים העמידים למחלות C. chrysosperma ו- B. dothidea canker בו זמנית. עם זאת, יש לציין כי שיטת חיסון העלים התפתחה מבדיקת עמידות לאפטות בצאצא צפצפה היברידי קטן יחסית (48 גנוטיפים). לאחר מכן, כאסטרטגיה קריטית לגידול אפטות צפצפה, יעילותה של שיטה זו עדיין זקוקה לאימות חזק יותר מאוכלוסייה גדולה יותר של כלאיים צפצפה או מטעי צפצפה מתורבתים.
פרוטוקול זה יתרום לפיתוח מחלות אפטות צפצפה (לדוגמה, Cytospora, Botryosphaeria ומחלות Septoria ) הכלאה היברידית, מתן שיבוטים היברידיים צפצפה עמידים בייעור צפצפה בסין ובצפון אמריקה. יתר על כן, פרוטוקול זה יתרום להבנתנו את הפתוגני של מחלות אפטות גזע, יקל על בדיקות גנטיות וכריית גנים, וישפר את התפתחות הרבייה המולקולרית של צפצפה. בנוסף, שיטת חיסון העלים מרמזת גם על שיטת הערכה מדויקת ויציבה לבדיקת הרגישות של פתוגנים של אפטות וקביעת גנים הקשורים לפתוגנים של פטריות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן במשותף על ידי המוסד המדעי המרכזי לאינטרס ציבורי, קרן המחקר בזאלית של מעבדת המפתח הממלכתית לגנטיקה והשבחה של עצים (מענק מספר CAFYBB2020ZY001-2) והקרן הלאומית למדעי הטבע של סין (מענק מספר 32171776) לג'יאפינג ג'או.
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
References
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved