Method Article
Inoculação foliar in vivo: um método alternativo para avaliar a resistência a doenças de clones híbridos no melhoramento genético de choupo da doença do cancro do caule
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Fornecemos um protocolo passo a passo para avaliar a resistência do choupo aos patógenos do cancro do caule usando um método de inoculação de folhas in vivo . Este método é especialmente adequado para avaliação em larga escala da resistência à doença do cancro de Cytospora chrysosperma e Botryosphaeria dothidea na progênie reprodutora de choupo na China.
Resumo
Doenças do cancro do caule causadas pelo patógeno Cytospora chrysosperma (Pers.) Fr.) e Botryosphaeria dothidea (Moug. ex Fr.) Ces. são as duas principais doenças florestais nas plantações de choupo na China, às vezes que podem destruir todas as mudas de choupo ou danificar severamente as florestas de choupo maduras. A reprodução híbrida é o método mais direto e eficiente de controle e manejo de doenças de árvores. No entanto, avaliar a resistência a doenças ou selecionar clones de resistência a doenças com base na inoculação in vitro do caule é ineficiente, demorado e caro, limitando o desenvolvimento da reprodução híbrida da doença do cancro do caule do choupo. Neste estudo, propusemos um método alternativo para avaliar a resistência a doenças patogênicas do cancro do caule por meio da inoculação in vivo de folhas. Os materiais de teste usados neste método podem ser em mudas de choupo de 1 ano ou nos ramos anuais de choupos perenes na estufa ou no campo. A etapa crítica deste método alternativo é a seleção de folhas inoculantes: as 5-7ª folhas recém-amadurecidas podem ser as mais adequadas. A segunda etapa crítica do método de inoculação foliar é fazer feridas nas folhas das plantas por meio de perfurações de agulha, fornecendo lesões suficientes para medir a gravidade da doença. Para o número adequado de folhas produzidas no estágio inicial da reprodução do choupo, esta inoculação de folhas in vivo contribui para a triagem rápida, precisa e em larga escala dos clones de choupo resistentes a doenças para patógenos do cancro do caule. Além disso, este método de inoculação foliar também servirá como um método eficiente para a triagem de patótipos do patógeno da doença do cancro do caule C. chrysosperma, B.dothidea ou outros patógenos do cancro do caule do choupo.
Introdução
Doenças do cancro do caule do choupo, causadas principalmente por dois patógenos necrotróficos, Cytospora chrysosperma (Pers.) Fr. e Botryosphaeria dothidea (Moug. ex Fr.) Ces. Ameaçam severamente o desenvolvimento e a sobrevivência das plantações de choupo no Nordeste, Norte e Noroeste (Três Nortes) da China. A reprodução híbrida é o método mais direto e eficiente para controlar e manejar doenças de árvores; No entanto, em comparação com o progresso na reprodução de clones híbridos de álamo de alto rendimento, crescimento rápido ou outros clones híbridos de choupo, a pesquisa sobre a reprodução de resistência para a doença do cancro do choupo é escassa. Apenas estudos limitados de melhoramento híbrido resistente a doenças foram relatados 1,2,3, e nenhum clone híbrido resistente ao cancro foi cultivado no florestamento de choupo.
A etapa crucial do melhoramento híbrido regular é a seleção de clones com base na aquisição fenotípica da progênie híbrida. No entanto, adquirir a aquisição de fenótipos patológicos (patótipos) é um processo demorado, trabalhoso, cansativo, caro e dependente de especialistas. Para plantas lenhosas, é mais desafiador devido à natureza que consome tempo, mão de obra e economia causada por seu longo ciclo de vida, crescimento lento e corpo maciço. Por exemplo, no choupo, a triagem de resistência ao cancro da progênie híbrida foi realizada 5-7 anos após a hibridização por meio de métodos convencionais de inoculação do caule in vitro 1,2,3. Além disso, limitados por esse método de triagem resistente a doenças de baixa eficiência e alto consumo, os pesquisadores selecionaram novamente os clones resistentes ao cancro de um pequeno subgrupo (por exemplo, os clones de álamo selecionados de alto rendimento ou crescimento rápido), não de todas as progênies híbridas. Portanto, usando os métodos regulares de inoculação do caule, não é certo identificar os clones resistentes autênticos e não pode revelar a diversidade resistente a doenças da progênie reprodutora, limitando assim a exploração de genes ou módulos gênicos relacionados à resistência a doenças. Em comparação com o rápido desenvolvimento da reprodução de choupo de crescimento rápido / alto rendimento, esses programas de melhoramento podem obter híbridos por meio de seleção fenotípica ou mesmo seleção genômica nos primeiros dois anos de reprodução4, a reprodução de resistência ao cancro do choupo desenvolveu-se lentamente. A triagem (ou detecção) resistente a doenças de progênie híbrida, ou o método de inoculação de patógenos, tornou-se a etapa crucial de limitação de velocidade na reprodução de resistência à doença do cancro do choupo.
Neste protocolo, introduzimos um novo método de inoculação para patógenos do cancro do caule do choupo, método de inoculação de folhas in vivo . Usando este método, podemos testar de forma rápida e eficiente a resistência ao cancro de dezenas de espécies de choupo (cultivares ou clones) em 5-7 dias. O ensaio de validação ilustrou que a inoculação foliar in vivo é consistente com a inoculação tradicional in vitro do caule na detecção de resistência da doença do cancro do caule, sugerindo que o método de inoculação foliar é adequado para a triagem de resistência em larga escala das doenças do cancro do choupo, como a seleção de todo o genótipo da progênie de resistência na criação da doença do cancro do caule. Este método resolve o problema patológico de seleção de descendentes resistentes na criação híbrida de doenças do cancro do choupo.
Protocolo
1. Cultura fúngica para o patógeno do cancro
- Prepare o meio de cultura em ágar batata dextrose (BDA; extração de batata 6,0 g, dextrose 20,0 g, ágar 20,0 g) para cepas de fungos; dissolva os materiais acima em água até 1000 mL, dissolva completamente o meio a 100 °C por 10 min.
- Despeje o meio PDA em tubos de 25 mL (cada um contendo 15,0 mL); esterilize todos os tubos a 121,1 °C por 30 min. Despeje o meio em placas de cultura (9,0 cm de diâmetro) e resfrie as placas em temperatura ambiente (RT).
- Corte o micélio do patógeno fúngico, que é cultivado em meio BDA a 28 ° C por 7 dias, em cubos quadrados de ~ 0,5 cm; inocular os cubos fúngicos no centro das placas de PDA (os lados do micélio estão voltados para o meio).
- Cultive os patógenos fúngicos em uma incubadora termostática (28 ° C, no escuro) por 7 a 10 dias.
- Corte o meio PDA com micélio fúngico em cubos quadrados (comprimento lateral 1,0-1,2 cm).
2. Preparação de materiais de choupo
- Para clones de choupo de 1 ano (cultivados > 3 meses), selecione as folhas recém-amadurecidas e totalmente estendidas (sempre 5-7folhas , do topo da muda / galhos) dos ramos principais como materiais inoculados, certifique-se de que estejam livres de pragas, doenças e danos mecânicos.
- Para ramos de 1 ano de idade de clones híbridos perenes de choupo (cultivados > 2 meses), selecione as folhas superiores de 5 a 7dos ramos selecionados como materiais inoculados. Certifique-se de que as folhas estejam saudáveis e tenham a mesma condição de luz (sombra ou luz) entre todos os clones de choupo testados.
3. Pré-tratamento das folhas de inoculação
- Pulverize as folhas de choupo com água limpa e, após a secagem, limpe as folhas selecionadas com álcool 75% 1 h ou 1 dia antes das manipulações da inoculação.
4. Inoculação foliar in vivo
- Para folhas pequenas (largura da folha < 8,0 cm), inocule dois cubos quadrados de micélio fúngico e cubos de PDA (ou ágar água, WA) (1,0-1,2 cm de comprimento lateral) na superfície superior das 5-7 folhas superiores de clones de choupo; o micélio está voltado para as folhas. Certifique-se de que os locais de inoculação estejam localizados no centro das meias folhas, ~ 1-2 cm de distância das nervuras centrais, evitando obscurecer as nervuras secundárias. Cada clone inocula 12 locais em 6 folhas (10 locais para micélio e 2 locais para inoculação de PCA).
- Para folhas grandes (largura da folha ≥ 8,0 cm), inocule quatro cubos quadrados de micélio fúngico e cubos de PDA (ou WA) nas 5-7 folhas superiores do choupo. Cada clone inocula 12 locais em 3 folhas (10 locais para micélio e 2 locais para inoculação de PCA.
- Enrole as folhas inoculadas com fita adesiva transparente (6,0 cm de largura) e pressione-as suavemente para torná-las adesivas às folhas, evitando o movimento e a perda de água dos cubos de micélio (ou PDA) durante o experimento.
- Fure as folhas e os cubos de micélio (ou PDA) em cinco locais até que as agulhas penetrem nos cubos da superfície superior para a inferior das folhas de choupo. Um local fica no centro e os outros quatro ficam 1-2 mm perto dos quatro vértices dos cubos.
NOTA: Recomenda-se uma colaboração de equipe de 3 pessoas para manipulação de inoculação fúngica. A manipulação da inoculação de uma população híbrida de choupo (>100 genótipos) pode ser realizada em 4 h por meio de trabalho em equipe. As manipulações de perfuração foram realizadas após todas as folhas testadas terem sido inoculadas e embrulhadas para aliviar o impacto de diferentes tempos de perfuração na severidade da doença. - Inspecione a mudança de localização e a perda de água dos inoculantes de micélio e observe o aparecimento de lesões necróticas ao redor dos locais da ferida perfurada desde a superfície inferior das folhas até o3º dia de inoculação.
- Dentro de 3 dias após a inoculação, observe a mudança de localização e a perda de água dos cubos de micélio. Defina e marque os cubos de micélio movidos e secos como inoculações ineficazes e descarte-os da identificação final dos patótipos enquanto define os outros cubos como inoculações eficazes.
NOTA: Este protocolo define os clones de choupo testados com mais de cinco cubos de inoculação eficazes como clones inoculados inválidos; Portanto, cada clone de choupo forneceu pelo menos 30 locais de inoculação eficazes, que se desenvolverão em 30 manchas necróticas independentes.
- Dentro de 3 dias após a inoculação, observe a mudança de localização e a perda de água dos cubos de micélio. Defina e marque os cubos de micélio movidos e secos como inoculações ineficazes e descarte-os da identificação final dos patótipos enquanto define os outros cubos como inoculações eficazes.
- Retire todas as folhas inoculadas no final do experimento (~ 5-7 dias após a inoculação), traga-as de volta ao laboratório em sacos plásticos de amostra e armazene-as a 4 ° C.
5. Aquisição do patótipo foliar e avaliação da resistência do choupo às doenças do cancro do caule em laboratório
- Remova cuidadosamente as fitas adesivas transparentes e os inoculantes de micélio (ou PDA) das folhas.
- Observe e identifique os patótipos foliares de cada clone de choupo, incluindo a forma e a cor das manchas necróticas, e podem incluir a estrutura semelhante a hifas fúngicas, picnídios e conídios que se formaram na superfície das folhas ao redor dos locais de perfuração.
- Fotografe as folhas (com uma régua adicional) com uma câmera ou escaneie as folhas (com uma régua adicional) usando um scanner para obter imagens com resolução superior a 300 dpi e, em seguida, salve as imagens no formato JPEG, TIFF ou PNG.
6. Identificação e análise estatística da ocorrência da doença
- Abra as imagens de folhas doentes no software ImageJ 1.54g (http://imagj.org).
- Defina a escala de acordo com a régua nas imagens de folhas.
- Identifique e meça as lesões com a ferramenta de varinha (rastreamento).
- Registre e exporte os valores da área como uma planilha depois que as áreas de todas as manchas necróticas forem medidas.
- Defina os critérios para a determinação da doença:
- Se a área da lesão ao redor dos cubos de micélio cobertos pelos locais de perfuração for significativamente maior do que a coberta pelos cubos de PDA, defina esses locais como locais de doença.
- Se as características morfológicas dos sítios de perfuração cobertos por cubos de micélio mudaram significativamente quando comparadas com os locais cobertos por PCA, incluindo cores da lesão, produzindo estrutura semelhante a hifas, picnídios e conídios, defina o local também como um local de doença.
- Calcule as áreas médias dos pontos efetivos de lesão de PDA de cada clone híbrido de choupo. De acordo com as áreas médias, divida todas as manchas inoculadas com micélio de um clone de choupo em duas categorias: início e não início. Em seguida, calcule a taxa de incidência da doença do clone de choupo testado (Fórmula 1: Taxa de incidência da doença (%) = Número de locais de picada doentes/Número total de locais de picada eficientes × 100).
- Calcule a área média das manchas doentes nas folhas (n = 50). De acordo com os valores das áreas médias de manchas de folhas doentes em todos os clones de choupo testados, defina um padrão de classificação de doenças de 5 níveis.
- Calcule o índice de doença de cada clone de choupo (Fórmula 2) com base no padrão de classificação de doença acima (Fórmula 2: Índice de doença = ∑(Número de locais de picada por nível × Valores de gravidade em todos os níveis)/(Valor do nível de gravidade mais alto × Número total de locais de picada eficientes) × 100).
- Verificar a distribuição normal do número de clones de choupo em diferentes níveis de resistência utilizando o teste de Shapiro-Wilk, utilizando qualquer software de análise de dados adequado.
- De acordo com o índice da doença, identifique todos os clones de choupo testados em cinco (ou sete) grupos: resistência muito alta (VHR), alta resistência (HR), resistência (R), sem resistência e sem suscetibilidade (NRNS), suscetibilidade (S), alta suscetibilidade (HS) e suscetibilidade muito alta (VHS) grupo5.
Resultados
Neste protocolo, o fluxo de trabalho esquemático foi conduzido em 48 clones híbridos de choupo infectados pelo patógeno do cancro do caule C. chrysosperma (Figura 1). Os clones híbridos de choupo fazem parte da progênie de hibridização de P. deltoides, cultivada no viveiro da Academia Chinesa de Silvicultura (CAF), Pequim.
O patógeno do cancro do caule C. chrysosperma isolado CZC é uma cepa fúngica típica (com patogenicidade média) usada para a pesquisa fisiológica da doença do cancro do choupo 6,7,8,9 e depositada em nosso laboratório. Os resultados mostraram que a inoculação do patógeno do cancro do caule C. chrysosperma induziu lesões necróticas ( Figura 2B , C ) e até mesmo estruturas semelhantes a picnídios nas folhas de choupo ( Figura 2D-F ). Além disso, os resultados também ilustraram que as posições das folhas (ou idades e ontogenia das folhas) (Figura 2G-I) e as condições de luz das folhas (Figura 2J-L) afetam a severidade da doença das folhas inoculadas pelo patógeno do cancro do caule C. chrysosperma isolado CZC.
A patogenicidade dos inoculantes fúngicos é um fator crucial na triagem de resistência de populações híbridas desconhecidas. No entanto, houve duas visões opostas sobre a seleção de cepas virulentas na reprodução: usando a cepa mais virulenta10 e as cepas moderadamente virulentas11. No experimento preliminar deste protocolo, selecionamos C. chrysosperma para isolar CZC a partir da detecção de patogenicidade de 10 isolados fúngicos em choupo híbrido "Bofeng 3". De forma encorajadora, os resultados indicam que a distribuição dos clones de choupo em diferentes níveis de resistência nos 48 clones híbridos de choupo é normal, conforme confirmado pela análise do teste de Shapiro-Wilk no SPSS, sugerindo que este isolado é o favorito para a triagem de resistência desta população atual de hibridização de choupo. Os resultados parciais da triagem de resistência de 48 clones de choupo são mostrados na Figura 3A-C. Além disso, os resultados mostraram que seis isolados do patógeno B. dothidea têm virulência diferencial para o híbrido de choupo "Bofeng 3", e os isolados SD47 e SD60 são os isolados mais virulentos nas cepas de fungos testadas (Figura 3D-F), sugerindo que o método de inoculação foliar também deve ser usado na triagem de virulência do patógeno da doença do cancro do caule do choupo.
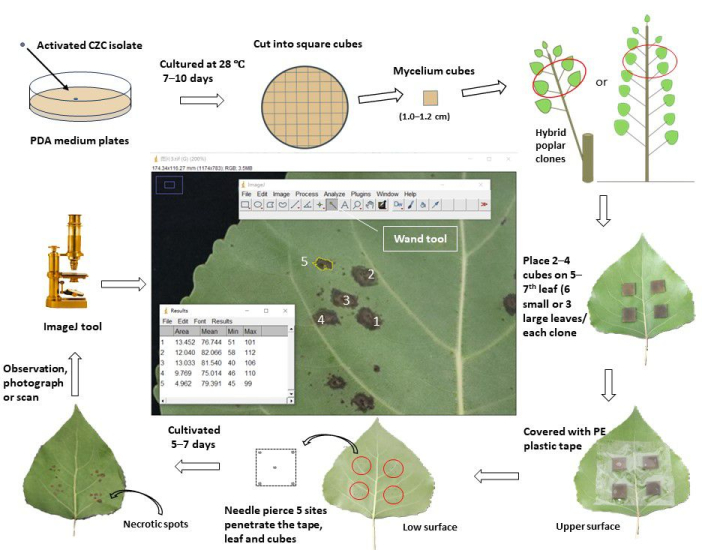
Figura 1: Um fluxo de trabalho esquemático de avaliação da resistência ao cancro do caule por meio da inoculação in vivo de folhas em clones de choupo. O patógeno do cancro do caule ativado Cytospora chrysosperma isolado CZC foi cultivado em placas de BDA a 28 °C, no escuro, por 10 dias. Em seguida, o micélio de C. chrysosperma foi cortado em cubos quadrados (1,0-1,2 cm de comprimento lateral) e inoculado na superfície superior das folhas superiores de 5-7em mudas de choupo de 1 ano ou choupo de 1 ano ramificado em choupos perenes. O lado das hifas dos cubos de micélio estava voltado para as folhas. Para as folhas pequenas (largura da folha < 8,0 cm), dois cubos de micélio foram inoculados em uma folha, enquanto quatro cubos de micélio foram inoculados nas folhas grandes (largura da folha ≥ 8,0 cm). No entanto, as folhas pequenas e grandes, dez cubos de micélio e 2 cubos médios de BDA foram inoculados nas mudas/galhos. Em seguida, as folhas inoculadas foram envolvidas com fita plástica protetora de 6,0-8,0 cm de largura para fixar os cubos e evitar a perda de água. As folhas e cubos foram perfurados com agulhas para produzir locais de ferimentos no centro e nos quatro vértices dos quadrados. As folhas inoculadas foram cultivadas em campo/casa de vegetação e observadas, fotografadas/digitalizadas 5-7 dias após a inoculação. Em seguida, as imagens foram carregadas no software ImageJ para medir as áreas médias das manchas necróticas que se desenvolveram a partir dos locais de ferimento perfurados de cada clone de choupo. Por fim, a taxa de incidência da doença e o índice da doença foram calculados com base nas áreas médias das manchas necróticas de cada clone de choupo. De acordo com o índice da doença, todos os clones de choupo testados foram divididos em diferentes grupos de resistência. Clique aqui para ver uma versão maior desta figura.
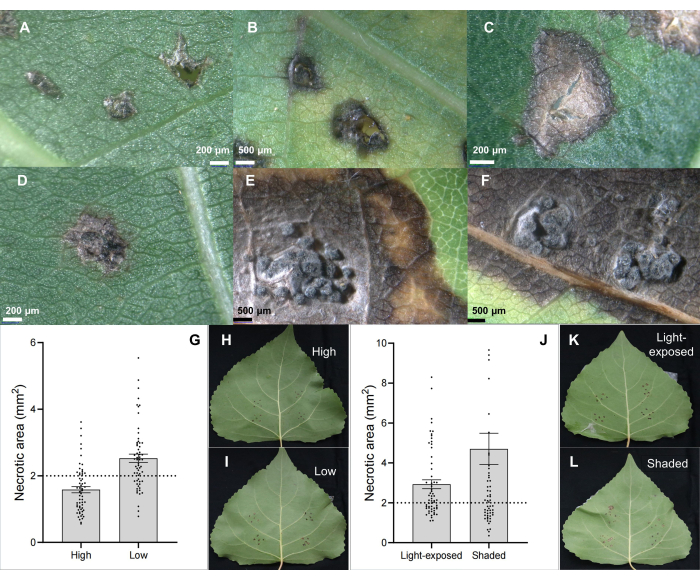
Figura 2: Características clássicas da lesão foliar no clone híbrido de choupo B246 infectado pelo patógeno do cancro C. chrysosperma por meio de inoculação foliar. (A) inoculado por inoculantes de PDA; (B,C) manchas necróticas; (D-F) manchas necróticas com estrutura picnídica; (G-I) as posições da folha inoculada na muda/ramos de 1 ano influenciam a severidade da doença do patógeno do cancro do caule C. chrysosperma na cultivar híbrida de choupo "Bofeng 3"; (J-L) influenciam a severidade da doença na cultivar de choupo "Bofeng 3". Clique aqui para ver uma versão maior desta figura.

Figura 3: Triagem de resistência e detecção de suscetíveis. Triagem de resistência de clones híbridos de choupo (A-C) e detecção suscetível de isolados do patógeno Botryosphaeria dothidea em clone híbrido de choupo (D-F) "Bofeng 3" usando o método de inoculação de folhas in vivo. Clique aqui para ver uma versão maior desta figura.
| Grau de gravidade | Critérios de classificação | Nível |
| Nenhuma doença | Sem sintomas, área necrótica 0–2,0 mm² | 0 |
| Extremamente leve | Área necrótica 2,0–4,0 mm² | 1 |
| Doença leve | Área necrótica 4,0–6,0 mm² | 2 |
| Doença moderada | Área necrótica 6,0–8,0 mm² | 3 |
| Doença moderadamente grave | Área necrótica 8,0–10,0 mm² | 4 |
| Doença grave | Área necrótica maior que 10,0 mm² | 5 |
Tabela 1: Classificação de gravidade dos sintomas necróticos induzidos por patógenos do cancro nas folhas.
Discussão
Este protocolo fornece um método de inoculação rápido e eficiente para patógenos resistentes ao cancro do choupo, adequado para os campos de pesquisa que requerem triagem de resistência a doenças em larga escala, como reprodução híbrida de resistência ao cancro do choupo e triagem de patogenicidade de patógenos do cancro do caule.
O primeiro ponto-chave do método é avaliar a resistência a doenças por inoculação de folhas recém-amadurecidas em vez de caules/galhos maduros. Como resultado, a seleção de clones de resistência à doença do cancro do caule pode ser conduzida em 1-2 anos do melhoramento híbrido do choupo ao usar o método de inoculação foliar, em comparação com a triagem de resistência demorada na via de inoculação do caule (5-7 anos após o cruzamento), o método da folha encurtando drasticamente o ciclo de reprodução da doença do cancro do caule do choupo. A segunda etapa crucial do método da folha é a seleção das folhas. A resistência a doenças das folhas varia com sua ontogenia (idades ou posição nos galhos), denominada resistência à ontogenia foliar de resistência associada ao estágio foliar12,13. Portanto, a correlação da resistência da planta entre as folhas e caules/galhos testados é crucial para a eficácia do método de inoculação foliar. A resistência à mancha foliar nas "cinco folhas do meio" não está relacionada à resistência ao cancro do caule na interação híbrida choupo-Septoria13; no entanto, o estudo de Wei et al.14 e nossa pesquisa ilustraram que a resistência à mancha foliar nas folhas superiores recém-amadurecidas ou nas folhas superiores 5-7são consistentes com a resistência ao cancro do caule nas interações Malus-V. ceratosperma e choupos-C. chrysosperma. Portanto, o método de inoculação de folhas in vivo pode ser usado na criação de choupos do caule, e as 5-7 folhas superiores são materiais de inoculação disponíveis. O terceiro ponto-chave deste método é a produção de locais de ferimento suficientes (30 locais são recomendados e 50 locais neste protocolo) por meio de perfuração repetida de agulha após a inoculação do patógeno, teoricamente, quais locais de ferimento se desenvolverão em 50 pontos necróticos independentes em três folhas de choupo, fornecendo uma avaliação mais precisa da resistência ao cancro na progênie de choupo. Além disso, a preservação da umidade e a seleção das condições de luz15 nas folhas são benéficas para adquirir uma avaliação de resistência mais estável e precisa às doenças do cancro do caule do choupo.
Neste protocolo, tanto mudas de choupo de 1 ano (cultivadas > 3 meses) quanto galhos de 1 ano (cultivados > 2 meses) de choupos perenes foram usados como materiais de inoculação. As mudas de choupo são ideais para triagem de resistência a doenças porque são mais consistentes e fáceis de operar. Pelo contrário, selecionar galhos ou folhas de choupo (que devem estar livres de pragas, doenças e danos mecânicos e ter as mesmas condições ambientais, como iluminação ou sombreamento) é um desafio.
Comparado com o método tradicional de inoculação do caule in vitro , o método de inoculação de folhas in vivo melhora drasticamente a reprodução de resistência ao cancro do choupo em muitos aspectos: 1) fornecendo um método de triagem de resistência a doenças viável para a reprodução híbrida de doenças do cancro do caule do choupo. De acordo com nossa experiência, uma equipe de 3 pessoas pode realizar a inoculação fúngica de mais de 200 clones híbridos de choupo em 1 dia e obter os resultados após 5-7 dias. Assim, os criadores podem rastrear a resistência a doenças de uma grande população híbrida (por exemplo, 1.000 genótipos) em um curto período (por exemplo, 1 mês) por meio da colaboração de 3-6 pessoas. 2) O método de inoculação foliar avança significativamente o tempo da primeira seleção para os clones resistentes ao cancro (de 5-7 anos para 1-2 anos após o melhoramento), o que beneficia a seleção precoce e a seleção de mudas de clones resistentes às doenças do cancro caulinar. 3) Usando o método de inoculação foliar, os pesquisadores podem revelar profundamente a estrutura e diversidade de resistência de toda a progênie híbrida e obter clones de resistência candidatos para produção ou reprodução. 4) Além disso, combinado com a tecnologia de sequenciamento de alto rendimento, o método de inoculação foliar beneficia a mineração de genes relacionados à resistência e módulos genéticos4e pode ser usado na reprodução de resistência a doenças de álamo com base na tecnologia de seleção genômica (GS)4. Finalmente, para a produção contínua das5-7ª folhas superiores durante a estação de crescimento do choupo, os criadores podem rastrear a resistência do choupo a diferentes cepas de patógenos ou diferentes patógenos de doenças; então, o método de inoculação foliar também fornece um caminho viável para o melhoramento multiprojetivo de choupo, por exemplo, obter clone(s) híbrido(s) que resistem às doenças de C. chrysosperma e B. dothidea cancro simultaneamente. No entanto, deve-se notar que o método de inoculação foliar se desenvolveu a partir da triagem de resistência ao cancro em uma progênie híbrida de choupo relativamente pequena (48 genótipos). Então, como uma estratégia crítica para a reprodução de resistência ao cancro do choupo, a eficácia desse método ainda precisa de uma validação mais robusta de uma população maior de híbridos de choupo ou plantações de choupo cultivadas.
Este protocolo contribuirá para o desenvolvimento de melhoramento híbrido de doenças do cancro do choupo (por exemplo, doenças de Cytospora, Botryosphaeria e Septoria ), fornecendo clones híbridos de choupo resistentes no florestamento de choupo na China e na América do Norte. Além disso, este protocolo contribuirá para nossa compreensão da patogenicidade das doenças do cancro do caule, facilitará os ensaios genéticos e a mineração de genes e melhorará o desenvolvimento do melhoramento molecular do choupo. Além disso, o método de inoculação foliar também implica um método de avaliação preciso e estável para rastrear a suscetibilidade de patógenos do cancro e determinar genes relacionados à patogenicidade dos fungos.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta pesquisa foi financiada conjuntamente pela Instituição Científica Central de Interesse Público, Fundo de Pesquisa Basal do Laboratório Estadual de Genética e Melhoramento de Árvores (número de concessão CAFYBB2020ZY001-2) e pela Fundação Nacional de Ciências Naturais da China (número de concessão 32171776) para Jiaping Zhao.
Materiais
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
Referências
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados