Method Article
Inoculation foliaire in vivo : une méthode alternative pour évaluer la résistance aux maladies des clones hybrides dans la sélection du peuplier de la maladie du chancre de la tige
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous fournissons un protocole étape par étape pour évaluer la résistance du peuplier aux agents pathogènes du chancre de la tige à l’aide d’une méthode d’inoculation in vivo des feuilles. Cette méthode est particulièrement adaptée à l’évaluation à grande échelle de la résistance à la maladie du chancre de Cytospora chrysosperma et de Botryosphaeria dothidea chez la descendance de la sélection de peupliers en Chine.
Résumé
Chancres de la tige causés par les agents pathogènes Cytospora chrysosperma (Pers.) Fr.) et Botryosphaeria dothidea (Moug. ex Fr.) Ces. sont les deux principales maladies forestières dans les plantations de peupliers en Chine, qui peuvent parfois détruire tous les plants de peupliers ou gravement endommager les forêts de peupliers matures. La sélection hybride est la méthode la plus directe et la plus efficace de contrôle et de gestion des maladies des arbres. Cependant, l’évaluation de la résistance aux maladies ou la sélection de clones résistants aux maladies sur la base de l’inoculation in vitro des tiges est inefficace, longue et coûteuse, ce qui limite le développement de la sélection d’hybrides de la maladie du chancre de la tige du peuplier. Dans cette étude, nous avons proposé une méthode alternative pour évaluer la résistance aux agents pathogènes du chancre de la tige par inoculation in vivo des feuilles. Le matériel d’essai utilisé dans cette méthode peut se trouver sur des jeunes peupliers âgés de 1 an ou sur les branches annuelles de peupliers vivaces en serre ou au champ. L’étape critique de cette méthode alternative est la sélection des feuilles inoculées : les 5 à 7e feuilles nouvellement matures pourraient être les plus appropriées. La deuxième étape critique de la méthode d’inoculation des feuilles consiste à faire des blessures sur les feuilles des plantes par des perforations d’aiguilles, fournissant des lésions suffisantes pour mesurer la gravité de la maladie. Pour le nombre adéquat de feuilles produites au stade précoce de la sélection du peuplier, cette inoculation in vivo des feuilles contribue au dépistage rapide, précis et à grande échelle des clones de peuplier résistants aux maladies contre les agents pathogènes du chancre de la tige. De plus, cette méthode d’inoculation des feuilles servira également de méthode efficace pour le dépistage des pathotypes de la maladie du chancre de la tige C. chrysosperma, B. dothidea ou d’autres agents pathogènes du chancre de la tige du peuplier.
Introduction
Les maladies du chancre de la tige du peuplier, principalement causées par deux agents pathogènes nécrotrophes, Cytospora chrysosperma (Pers.) Fr. et Botryosphaeria dothidea (Moug. ex Fr.) Ces. menacent gravement le développement et la survie des plantations de peupliers dans le nord-est, le nord et le nord-ouest (trois-nord) de la Chine. La sélection hybride est la méthode la plus directe et la plus efficace pour contrôler et gérer les maladies des arbres ; Cependant, par rapport aux progrès de la sélection pour les clones hybrides de peuplier à haut rendement, à croissance rapide ou autres, la recherche sur la sélection de résistance pour la maladie du chancre du peuplier est rare. Seules des études limitées sur la reproduction d’hybrides résistants aux maladies ont été signalées 1,2,3, et aucun clone hybride résistant au chancre n’a été cultivé dans le boisement de peupliers.
L’étape cruciale de la sélection régulière d’hybrides est la sélection des clones basée sur l’acquisition du phénotype de la descendance hybride. Cependant, l’acquisition de phénotypes pathologiques (pathotypes) est un processus long, laborieux, fatigant, coûteux et dépendant des experts. Pour les plantes ligneuses, c’est plus difficile en raison de la nature consommatrice de temps, de main-d’œuvre et d’économie causée par leur long cycle de vie, leur croissance lente et leur corps massif. Par exemple, chez le peuplier, le dépistage de la résistance au chancre de la descendance hybride a été effectué 5 à 7 ans après l’hybridation par des méthodes conventionnelles d’inoculation de tiges in vitro 1,2,3. De plus, limités par cette méthode de dépistage résistante aux maladies peu efficace et très consommatrile, les chercheurs ont sélectionné à nouveau les clones résistants au chancre dans un petit sous-groupe (par exemple, les clones de peuplier à haut rendement ou à croissance rapide sélectionnés), et non dans toute la descendance hybride. Par conséquent, en utilisant les méthodes habituelles d’inoculation des tiges, il n’est pas certain d’identifier les clones résistants authentiques et ne peut pas révéler la diversité résistante aux maladies de la descendance reproductrice, limitant ainsi l’exploration des gènes ou des modules de gènes liés à la résistance aux maladies. Par rapport au développement rapide de la sélection à croissance rapide et à haut rendement du peuplier, ces programmes de sélection peuvent obtenir des hybrides par sélection phénotypique ou même sélection génomique au cours des deux premières années de sélection4, la sélection résistante au chancre du peuplier s’est développée lentement. Le dépistage (ou la détection) de la descendance hybride résistant aux maladies, ou la méthode d’inoculation des agents pathogènes, est devenu l’étape cruciale de limitation de la vitesse dans la sélection de la résistance à la maladie du chancre du peuplier.
Dans ce protocole, nous introduisons une nouvelle méthode d’inoculation pour les agents pathogènes du chancre de la tige du peuplier, la méthode d’inoculation foliaire in vivo . En utilisant cette méthode, nous pouvons tester rapidement et efficacement la résistance aux chancres de dizaines d’espèces de peupliers (cultivars ou clones) en 5 à 7 jours. L’essai de validation a montré que l’inoculation foliaire in vivo est compatible avec l’inoculation traditionnelle in vitro de la tige sur la détection de la résistance du chancre de la tige, ce qui suggère que la méthode d’inoculation des feuilles convient au dépistage à grande échelle de la résistance des chancres du peuplier, comme la sélection du génotype complet de la descendance de la résistance dans la sélection de la maladie du chancre de la tige. Cette méthode résout le problème pathologique de la sélection d’une progéniture résistante dans la sélection hybride des maladies du chancre du peuplier.
Protocole
1. Culture fongique pour l’agent pathogène du chancre
- Préparez le milieu de culture de la gélose au dextrose de pomme de terre (PDA ; extraction de la pomme de terre 6,0 g, dextrose 20,0 g, gélose 20,0 g) pour les souches fongiques ; dissoudre les matériaux ci-dessus dans l’eau jusqu’à 1000 ml, dissoudre complètement le milieu à 100 °C pendant 10 min.
- Verser le milieu PDA dans des tubes de 25 mL (contenant chacun 15,0 mL) ; stériliser tous les tubes à 121,1 °C pendant 30 min. Verser le milieu dans des plaques de culture (9,0 cm de diamètre) et refroidir les plaques à température ambiante (RT).
- Coupez le mycélium de l’agent pathogène fongique, qui est cultivé dans un milieu PDA à 28 °C pendant 7 jours, en cubes carrés de ~0,5 cm ; inoculer les cubes fongiques au centre des plaques PDA (les côtés du mycélium font face au milieu).
- Cultivez les agents pathogènes fongiques dans un incubateur thermostatique (28 °C, dans l’obscurité) pendant 7 à 10 jours.
- Coupez le milieu PDA avec du mycélium fongique en cubes carrés (longueur latérale 1,0-1,2 cm).
2. Préparation des matériaux en peuplier
- Pour les clones de peuplier âgés de 1 an (cultivés > 3 mois), sélectionnez les feuilles nouvellement mûres et entièrement étendues (toujours 5-7èmes feuilles, à partir du haut du jeune arbre/des branches) des branches principales comme matériaux inoculés, assurez-vous qu’elles sont exemptes de parasites, de maladies et de dommages mécaniques.
- Pour les branches de 1 an de clones hybrides de peuplier vivace (cultivées > 2 mois), sélectionnez les 5 à 7e feuilles supérieures des branches sélectionnées comme matériaux inoculés. Assurez-vous que les feuilles sont saines et ont les mêmes conditions de lumière (ombre ou lumière) parmi tous les clones de peuplier testés.
3. Prétraitement des feuilles d’inoculation
- Vaporisez les feuilles de peuplier avec de l’eau propre et, après séchage, essuyez les feuilles sélectionnées avec de l’alcool à 75% 1 h ou 1 jour avant les manipulations d’inoculation.
4. Inoculation foliaire in vivo
- Pour les petites feuilles (largeur des feuilles < 8,0 cm), inoculer deux cubes carrés de mycélium fongique et des cubes de PDA (ou gélose à l’eau, WA) (1,0 à 1,2 cm de longueur) sur la surface supérieure des 5 à 7 feuilles supérieures des clones de peuplier ; Le mycélium fait face aux feuilles. Assurez-vous que les sites d’inoculation sont situés au centre des demi-feuilles, à ~1-2 cm des nervures centrales, en évitant d’obscurcir les nervures secondaires. Chaque clone inocule 12 sites sur 6 feuilles (10 sites pour le mycélium et 2 sites pour l’inoculation de la PDA).
- Pour les grandes feuilles (largeur des feuilles ≥ 8,0 cm), inoculez quatre cubes carrés de mycélium fongique et des cubes PDA (ou WA) sur les 5 à 7 feuilles supérieures de peuplier. Chaque clone inocule 12 sites à 3 feuilles (10 sites pour le mycélium et 2 sites pour l’inoculation de la PDA.
- Enveloppez les feuilles inoculées avec du ruban adhésif transparent (6,0 cm de largeur) et appuyez doucement pour les faire adhérer aux feuilles, empêchant ainsi le déplacement et la perte d’eau des cubes de mycélium (ou PDA) pendant l’expérience.
- Percez les feuilles et les cubes de mycélium (ou PDA) à cinq endroits jusqu’à ce que les aiguilles pénètrent dans les cubes de la face supérieure à la surface inférieure des feuilles de peuplier. Un site se trouve au centre, et les quatre autres se trouvent à 1-2 mm près des quatre sommets des cubes.
REMARQUE : Une collaboration d’équipe de 3 personnes est recommandée pour la manipulation de l’inoculation fongique. La manipulation de l’inoculation d’une population hybride de peuplier (>100 génotypes) peut être réalisée en 4 h grâce à un travail d’équipe. Les manipulations de perçage ont été effectuées après que toutes les feuilles testées aient été inoculées et enveloppées pour atténuer l’impact des différents moments de perçage sur la gravité de la maladie. - Inspectez le déplacement de l’emplacement et la perte d’eau des inoculants de mycélium, et observez l’apparition de lésions nécrotiques autour des sites de plaie de perçage à partir de la surface inférieure des feuilles jusqu’au 3e jour de l’inoculation.
- Dans les 3 jours suivant l’inoculation, observez le déplacement de l’emplacement et la perte d’eau des cubes de mycélium. Définir et marquer les cubes de mycélium déplacés et séchés comme des inoculations inefficaces et les éliminer de l’identification finale des pathotypes tout en définissant les autres cubes comme des inoculations efficaces.
REMARQUE : Ce protocole définit les clones de peuplier testés avec plus de cinq cubes d’inoculation efficaces comme des clones inoculés invalides ; Par conséquent, chaque clone de peuplier a fourni au moins 30 sites d’inoculation efficaces, qui se développeront en 30 taches nécrotiques indépendantes.
- Dans les 3 jours suivant l’inoculation, observez le déplacement de l’emplacement et la perte d’eau des cubes de mycélium. Définir et marquer les cubes de mycélium déplacés et séchés comme des inoculations inefficaces et les éliminer de l’identification finale des pathotypes tout en définissant les autres cubes comme des inoculations efficaces.
- Retirez toutes les feuilles inoculées à la fin de l’expérience (~5-7 jours après l’inoculation), rapportez-les au laboratoire dans des sacs d’échantillons en plastique et conservez-les à 4 °C.
5. Acquisition du pathotype foliaire et évaluation de la résistance du peuplier aux maladies du chancre de la tige en laboratoire
- Retirez délicatement les rubans adhésifs transparents et les inoculants de mycélium (ou PDA) des feuilles.
- Observez et identifiez les pathotypes foliaires de chaque clone de peuplier, y compris la forme et la couleur des taches nécrotiques, et peuvent inclure la structure fongique en forme d’hyphes, les pycnides et les conidies qui se sont formées à la surface des feuilles autour des sites de perforation.
- Photographiez les feuilles (avec une règle supplémentaire) avec un appareil photo, ou numérisez les feuilles (avec une règle supplémentaire) à l’aide d’un scanner pour obtenir des images avec une résolution de plus de 300 ppp, puis enregistrez les images au format JPEG, TIFF ou PNG.
6. Identification et analyse statistique de l’apparition de la maladie
- Ouvrez les images des feuilles malades dans le logiciel ImageJ 1.54g (http://imagj.org).
- Réglez l’échelle en fonction de la règle dans les images feuilles.
- Identifiez et mesurez les lésions à l’aide de la baguette (traçage).
- Enregistrez et exportez les valeurs de surface sous forme de tableur après avoir mesuré les surfaces de tous les points nécrotiques.
- Définissez les critères de détermination de la maladie :
- Si la zone de lésion autour des cubes de mycélium recouverts de sites de perçage est significativement plus grande que celle couverte par les cubes de PDA, alors définissez ces sites comme des sites de maladie.
- Si les caractéristiques morphologiques des sites de perçage recouverts de cubes de mycélium ont considérablement changé par rapport aux sites recouverts de PDA, y compris les couleurs de la lésion, produisant une structure semblable à celle des hyphes, les pycnides et les conidies, définissent également le site comme un site de maladie.
- Calculez les surfaces moyennes des taches de lésion PDA efficaces de chaque clone d’hybride de peuplier. En fonction des superficies moyennes, divisez toutes les taches inoculées au mycélium d’un clone de peuplier en deux catégories : débutantes et non débutantes. Ensuite, calculez le taux d’incidence de la maladie du clone de peuplier testé (Formule 1 : Taux d’incidence de la maladie (%) = Nombre de sites de piqûre malades/Nombre total de sites de piqûre efficaces × 100).
- Calculez la superficie moyenne des taches malades dans les feuilles (n = 50). Selon les valeurs des zones moyennes de taches malades des feuilles dans tous les clones de peuplier testés, établissez une norme de classement des maladies à 5 niveaux.
- Calculez l’indice de maladie de chaque clone de peuplier (Formule 2) sur la base de la norme de classification de la maladie ci-dessus (Formule 2 : Indice de maladie = ∑(Nombre de sites de piqûre par niveau × Valeurs de gravité à tous les niveaux)/(Valeur du niveau de gravité le plus élevé × Nombre total de sites de piqûre efficaces) × 100).
- Vérifiez la distribution normale du nombre de clones de peupliers à travers différents niveaux de résistance à l’aide du test Shapiro-Wilk à l’aide de tout logiciel d’analyse de données approprié.
- Selon l’indice de maladie, identifier tous les clones de peuplier testés en cinq (ou sept) groupes : très haute résistance (VHR), haute résistance (HR), résistance (R), aucune résistance et aucune sensibilité (NRNS), sensibilité (S), sensibilité élevée (HS) et très haute sensibilité (VHS) groupe5.
Résultats
Dans ce protocole, le flux de travail schématique a été réalisé sur 48 clones hybrides de peuplier infectés par l’agent pathogène du chancre de la tige C. chrysosperma (Figure 1). Les clones hybrides de peuplier font partie de la descendance d’hybridation de P. deltoides, cultivée en pépinière de l’Académie chinoise de foresterie (CAF), à Pékin.
L’agent pathogène du chancre de la tige C. chrysosperma isolat CZC est une souche fongique typique (avec une pathogénicité moyenne) utilisée pour la recherche physiologique de la maladie du chancre du peuplier 6,7,8,9 et déposée dans notre laboratoire. Les résultats ont montré que l’inoculation de l’agent pathogène du chancre de la tige C. chrysosperma induisait des lésions nécrotiques (Figure 2B,C) et même des structures de type pycnidie sur les feuilles de peuplier (Figure 2D-F). De plus, les résultats ont également montré que la position des feuilles (ou l’âge des feuilles et l’ontogenèse des feuilles) (Figure 2G-I) et les conditions de lumière des feuilles (Figure 2J-L) ont un impact sur la gravité de la maladie des feuilles inoculées par l’agent pathogène du chancre de la tige C. chrysosperma isolat CZC.
La pathogénicité des inoculants fongiques est un facteur crucial dans le dépistage de la résistance des populations hybrides inconnues. Cependant, deux points de vue opposés se sont opposés sur la sélection des souches virulentes en sélection : l’utilisation de la souche la plus virulente10 et de la souche modérément virulente11. Dans l’expérience préliminaire de ce protocole, nous avons sélectionné C. chrysosperma pour isoler CZC à partir de la détection de la pathogénicité de 10 isolats fongiques dans le peuplier hybride « Bofeng 3 ». Il est encourageant de constater que les résultats indiquent que la distribution des clones de peuplier à travers différents niveaux de résistance dans les 48 clones hybrides de peuplier est normale, comme le confirme l’analyse du test de Shapiro-Wilk dans SPSS, ce qui suggère que cet isolat est favori pour le dépistage de la résistance de cette population actuelle d’hybridation de peuplier. Les résultats partiels du criblage de résistance de 48 clones de peupliers sont présentés à la figure 3A-C. De plus, les résultats ont montré que six isolats de l’agent pathogène B. dothidea ont une virulence différentielle par rapport au peuplier hybride « Bofeng 3 », et que les isolats SD47 et SD60 sont les isolats les plus virulents dans les souches fongiques testées (figure 3D-F), ce qui suggère que la méthode d’inoculation des feuilles doit également être utilisée dans le dépistage de la virulence de l’agent pathogène de la maladie du chancre de la tige du peuplier.
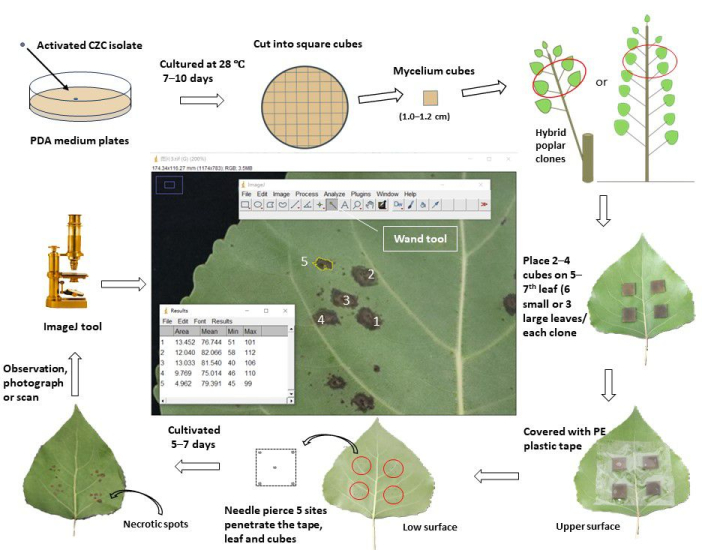
Figure 1 : Schéma de travail de l’évaluation de la résistance au chancre de la tige par inoculation in vivo des feuilles dans des clones de peuplier. L’agent pathogène activé du chancre de la tige, Cytospora chrysosperma, isolat CZC a été cultivé dans des plaques PDA à 28 °C, dans l’obscurité, pendant 10 jours. Ensuite, le mycélium de C. chrysosperma a été coupé en cubes carrés (1,0 à 1,2 cm de côté) et inoculé sur la face supérieure des 5 à 7e feuilles dans des jeunes peupliers de 1 an ou des peupliers de 1 an ramifiés sur des peupliers vivaces. Le côté hyphe des cubes de mycélium faisait face aux feuilles. Pour les petites feuilles (largeur des feuilles < 8,0 cm), deux cubes de mycélium ont été inoculés sur une feuille, tandis que quatre cubes de mycélium ont été inoculés sur les grandes feuilles (largeur des feuilles ≥ 8,0 cm). Cependant, les petites et grandes feuilles, dix cubes de mycélium et 2 cubes moyens de PDA ont été inoculés sur les jeunes arbres/branches. Ensuite, les feuilles inoculées ont été enveloppées avec du ruban de protection en plastique de 6,0 à 8,0 cm de large pour fixer les cubes et les empêcher de perdre de l’eau. Les feuilles et les cubes ont été percés avec des aiguilles pour produire des sites de blessure au centre et aux quatre sommets des carrés. Les feuilles inoculées ont été cultivées au champ ou en serre et observées, photographiées et scannées 5 à 7 jours après l’inoculation. Ensuite, les images ont été chargées dans le logiciel ImageJ pour mesurer les zones moyennes des taches nécrotiques qui se sont développées à partir des sites de blessure percés de chaque clone de peuplier. Enfin, le taux d’incidence de la maladie et l’indice de maladie ont été calculés sur la base des superficies moyennes des taches nécrotiques de chaque clone de peuplier. Selon l’indice de maladie, tous les clones de peuplier testés ont été divisés en différents groupes de résistance. Veuillez cliquer ici pour voir une version agrandie de cette figure.
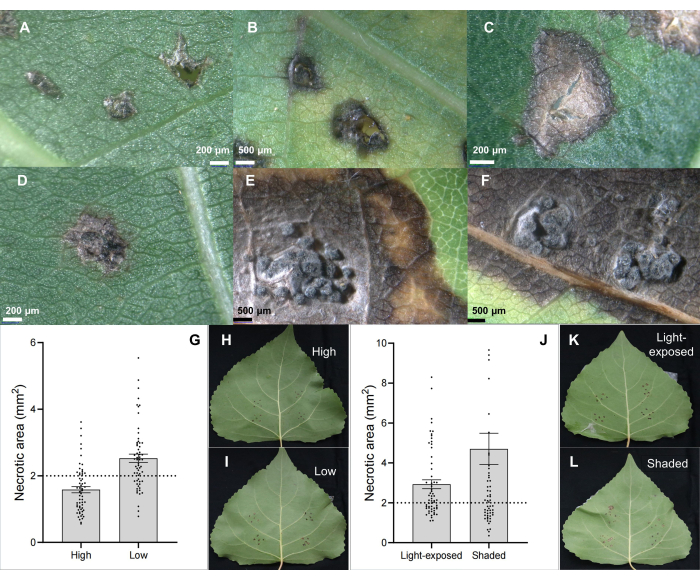
Figure 2 : Caractéristiques classiques des lésions foliaires sur le clone de peuplier hybride B246 infecté par l’agent pathogène du chancre C. chrysosperma par inoculation des feuilles. (A) inoculé par des inoculants PDA ; (B,C) taches nécrotiques ; (D-F) taches nécrotiques avec structure pycnides ; (G-I) les positions des feuilles inoculées dans le jeune arbre/les rameaux de 1 an influencent la gravité de la maladie de l’agent pathogène du chancre de la tige C. chrysosperma sur le cultivar de peuplier hybride « Bofeng 3 » ; Les conditions de lumière (J-L) influencent la gravité de la maladie sur le cultivar de peuplier « Bofeng 3 ». Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Criblage de résistance et détection des susceptibles. Dépistage de la résistance des clones de peuplier hybride (A-C) et détection sensible des isolats pathogènes de Botryosphaeria dothidea dans le clone de peuplier hybride (D-F) « Bofeng 3 » à l’aide de la méthode d’inoculation foliaire in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Degré de gravité | Critères de classement | Niveau |
| Pas de maladie | Aucun symptôme, zone nécrotique 0–2,0 mm² | 0 |
| Extrêmement doux | Zone nécrotique 2,0–4,0 mm² | 1 |
| Maladie bénigne | Zone nécrotique 4,0–6,0 mm² | 2 |
| Maladie modérée | Zone nécrotique 6,0–8,0 mm² | 3 |
| Maladie modérément grave | Zone nécrotique 8,0–10,0 mm² | 4 |
| Maladie grave | Surface nécrotique supérieure à 10,0 mm² | 5 |
Tableau 1 : Classement de la gravité des symptômes nécrotiques induits par les agents pathogènes du chancre sur les feuilles.
Discussion
Ce protocole fournit une méthode d’inoculation rapide et efficace des agents pathogènes résistants au chancre du peuplier, qui convient aux domaines de recherche nécessitant un dépistage à grande échelle de la résistance au chancre du peuplier, tels que la sélection hybride de la résistance au chancre du peuplier et le dépistage de la pathogénicité des agents pathogènes du chancre de la tige.
Le premier point clé de la méthode est d’évaluer la résistance aux maladies par inoculation de feuilles nouvellement matures au lieu de tiges/branches matures. Par conséquent, la sélection des clones de résistance au chancre de la tige peut être effectuée dans 1 à 2 ans de sélection de l’hybride de peuplier en utilisant la méthode d’inoculation des feuilles, par rapport au dépistage de la résistance qui prend beaucoup de temps dans la voie d’inoculation de la tige (5 à 7 ans après la sélection), la méthode des feuilles raccourcissant considérablement le cycle de reproduction de la maladie du chancre de la tige du peuplier. La deuxième étape cruciale de la méthode des feuilles est la sélection des feuilles. La résistance aux maladies des feuilles varie en fonction de leur ontogenèse (âge ou position sur les branches), appelée résistance à l’ontogenèse foliaire de la résistance associée au stade foliaire12,13. Ainsi, la corrélation de la résistance des plantes entre les feuilles testées et les tiges/branches est cruciale pour l’efficacité de la méthode d’inoculation des feuilles. La résistance aux taches foliaires sur les « cinq feuilles du milieu » n’est pas liée à la résistance au chancre de la tige dans l’interaction hybride peuplier-septoriose13 ; cependant, l’étude de Wei et al.14 et notre recherche ont montré que la résistance aux taches foliaires sur les feuilles supérieures nouvellement matures ou les 5 à 7e feuilles supérieures est compatible avec la résistance au chancre de la tige dans les interactions Malus-V. ceratosperma et peupliers-C. chrysosperma. Par conséquent, la méthode d’inoculation des feuilles in vivo peut être utilisée dans la sélection des tiges de peuplier, et les 5 à 7 feuilles supérieures sont des matériaux d’inoculation disponibles. Le troisième point clé de cette méthode est la production de sites de blessure suffisants (30 sites sont recommandés et 50 sites dans ce protocole) par perçage répété de l’aiguille après l’inoculation de l’agent pathogène, théoriquement, lesquels sites de blessure se développeront en 50 taches nécrotiques indépendantes sur trois feuilles de peuplier, ce qui permettra une évaluation plus précise de la résistance à la maladie du chancre chez la descendance du peuplier. De plus, la préservation de l’humidité et la sélection des conditions de lumière15 dans les feuilles sont bénéfiques pour l’acquisition d’une évaluation plus stable et plus précise de la résistance aux maladies du chancre de la tige du peuplier.
Dans ce protocole, des jeunes plants de peuplier âgés de 1 an (cultivés > 3 mois) et des branches de peuplier vivaces âgés de 1 an (cultivées > 2 mois) ont été utilisés comme matériel d’inoculation. Les jeunes plants de peuplier sont idéaux pour le dépistage de la résistance aux maladies, car ils sont plus consistants et plus faciles à utiliser. Au contraire, la sélection de branches ou de feuilles de peuplier (qui doivent être exemptes de parasites, de maladies et de dommages mécaniques et avoir les mêmes conditions environnementales, telles que l’éclairage ou l’ombrage) est un défi.
Par rapport à la méthode traditionnelle d’inoculation in vitro de la tige, la méthode d’inoculation in vivo des feuilles améliore considérablement la sélection de la résistance au chancre du peuplier à bien des égards : 1) fournir une méthode de dépistage de la résistance aux maladies réalisable pour la sélection hybride des maladies du chancre de la tige du peuplier. D’après notre expérience, une équipe de 3 personnes peut effectuer l’inoculation fongique de plus de 200 clones hybrides de peuplier en 1 jour, puis obtenir les résultats après 5 à 7 jours. Ainsi, les éleveurs peuvent dépister la résistance aux maladies d’une grande population hybride (par exemple, 1 000 génotypes) dans un court laps de temps (par exemple, 1 mois) grâce à la collaboration de 3 à 6 personnes. 2) La méthode d’inoculation des feuilles avance considérablement le moment de la première sélection pour les clones résistants au chancre (de 5-7 ans à 1-2 ans après la reproduction), ce qui profite à la sélection précoce et à la sélection des jeunes arbres des clones résistants aux maladies du chancre de la tige. 3) En utilisant la méthode d’inoculation des feuilles, les chercheurs peuvent révéler en profondeur la structure et la diversité de la résistance de toute la descendance hybride et obtenir des clones de résistance candidats pour la production ou la reproduction. 4) De plus, combinée à la technologie de séquençage à haut débit, la méthode d’inoculation des feuilles profite à l’exploitation des gènes liés à la résistance et des modules de gènes4et peut être utilisée dans la sélection de la résistance aux maladies du peuplier basée sur la technologie de sélection génomique (GS)4. Enfin, pour la production continue des 5 à 7e feuilles supérieures pendant la saison de croissance du peuplier, les sélectionneurs peuvent dépister la résistance du peuplier à différentes souches pathogènes ou à différents agents pathogènes ; Ensuite, la méthode d’inoculation foliaire fournit également une voie réalisable pour la sélection multi-projective du peuplier, par exemple, obtenir un ou plusieurs clones hybrides qui résistent simultanément aux chancres de C. chrysosperma et de B. dothidea . Cependant, il convient de noter que la méthode d’inoculation foliaire s’est développée à partir du dépistage de la résistance au chancre chez une descendance de peuplier hybride relativement petite (48 génotypes). Ensuite, en tant que stratégie essentielle pour la sélection de la résistance au chancre du peuplier, l’efficacité de cette méthode doit encore être validée de manière plus robuste par une plus grande population d’hybrides de peupliers ou de plantations de peupliers cultivés.
Ce protocole contribuera au développement de la sélection hybride des chancres du peuplier (par exemple, les maladies de Cytospora, de Botryosphaeria et de Septoria ), fournissant des clones hybrides de peuplier résistants dans le boisement de peupliers en Chine et en Amérique du Nord. De plus, ce protocole contribuera à notre compréhension de la pathogénicité des chancres de la tige, facilitera les tests génétiques et l’exploitation minière des gènes, et améliorera le développement de la sélection moléculaire du peuplier. De plus, la méthode d’inoculation des feuilles implique également une méthode d’évaluation précise et stable pour dépister la sensibilité des agents pathogènes du chancre et déterminer les gènes liés à la pathogénicité des champignons.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée conjointement par l’Institut scientifique central d’intérêt public, le Fonds de recherche fondamentale du Laboratoire clé d’État de génétique et de sélection des arbres (subvention numéro CAFYBB2020ZY001-2) et la Fondation nationale des sciences naturelles de Chine (subvention 32171776) à Jiaping Zhao.
matériels
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
Références
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon