Method Article
In Vivo Leaf Inoculation: 줄기 구내염의 포플러 육종에서 하이브리드 클론의 질병 저항성을 평가하는 대체 방법
* 이 저자들은 동등하게 기여했습니다
요약
당사는 in vivo leaf 접종 방법을 사용하여 줄기 구내염 병원균에 대한 포플러 내성을 평가하기 위한 단계별 프로토콜을 제공합니다. 이 방법은 중국의 포플러 육종 자손에서 Cytospora chrysosperma 및 Botryosphaeria dothidea 구내염 저항성의 대규모 평가에 특히 적합합니다.
초록
병원균 Cytospora chrysosperma (Pers.) Fr.) 및 Botryosphaeria dothidea (Moug. ex Fr.) Ces에 의해 발생하는 줄기 구내염 중국의 포플러 농장에서 발생하는 두 가지 주요 산림 질병은 때때로 모든 포플러 묘목을 파괴하거나 성숙한 포플러 숲을 심각하게 손상시킬 수 있습니다. 잡종 육종은 나무 질병을 통제하고 관리하는 가장 직접적이고 효율적인 방법입니다. 그러나 질병 저항성을 평가하거나 체외 줄기 접종에 기반한 질병 저항성 클론을 선택하는 것은 비효율적이고 시간이 많이 걸리며 비용이 많이 들기 때문에 포플러 줄기 구내염의 하이브리드 육종 개발을 제한합니다. 이 연구에서는 in vivo leaf 접종을 통해 줄기 구내염 병원체에 대한 질병 저항성을 평가하는 대체 방법을 제안했습니다. 이 방법에 사용 된 시험 재료는 1 년 된 포플러 묘목 또는 온실이나 들판의 다년생 포플러의 연간 가지에있을 수 있습니다. 이 대체 방법의 중요한 단계는 접종 잎의 선택입니다 : 5-7번째로 자란 잎이 가장 적합 할 수 있습니다. 잎 접종 방법의 두 번째 중요한 단계는 바늘 구멍을 통해 식물 잎에 상처를 만들어 질병의 중증도를 측정하기에 충분한 병변을 제공하는 것입니다. 포플러 육종의 초기 단계에서 생산되는 적절한 수의 잎을 위해, 이 생체 내 잎 접종은 구내염 병원균을 막기 위해 질병 저항성 포플러 클론을 빠르고 정확하며 대규모로 스크리닝하는 데 기여합니다. 또한, 이 잎 접종 방법은 줄기 줄기 구내염 병원체 C. chrysosperma, B.dothidea 또는 기타 포플러 줄기 구내염 병원체의 병원형을 스크리닝하는 효율적인 방법이기도 합니다.
서문
주로 두 개의 괴사성 병원체인 Cytospora chrysosperma (Pers.) Fr. 및 Botryosphaeria dothidea (Moug. ex Fr.) Ces에 의해 발생하는 포플러 줄기 구내염 질환. 중국의 북동부, 북부 및 북서부(Three-north)에 있는 포플러 농장의 개발과 생존을 심각하게 위협합니다. 잡종 육종은 나무 질병을 통제하고 관리하는 가장 직접적이고 효율적인 방법입니다. 그러나 다수확, 빠르게 성장하는 또는 기타 포플러 잡종 클론에 대한 육종의 발전에 비해 포플러 구내염에 대한 저항성 육종에 대한 연구는 부족합니다. 질병 저항성 잡종 육종에 대한 제한된 연구만이 보고되었으며1,2,3, 포플러 조림에서 구내염 저항성 잡종 클론이 재배되지 않았습니다.
정기적인 잡종 육종의 중요한 단계는 잡종 자손의 표현형 획득에 기초한 클론 선택입니다. 그러나 병리학적 표현형(병원형)을 획득하는 것은 시간이 많이 걸리고, 힘들고, 피곤하고, 비용이 많이 들고, 전문가에 의존하는 과정입니다. 목본 식물의 경우 긴 수명주기, 느린 성장 및 거대한 몸체로 인해 시간, 노동 및 경제가 많이 소모되는 특성으로 인해 더 까다롭습니다. 예를 들어, 포플러의 경우, 잡종 자손의 구내염 저항성 스크리닝은 종래의 체외 줄기 접종 방법 1,2,3을 통해 교잡 후 5-7년 후에 수행되었습니다. 더욱이, 이러한 낮은 효율성과 높은 소모력의 질병 저항성 스크리닝 방법으로 인해 연구자들은 모든 잡종 자손이 아닌 작은 하위 그룹(예: 선택된 고수율 또는 빠르게 성장하는 포플러 클론)에서 구내염 저항성 클론을 다시 선택했습니다. 따라서 일반적인 줄기 접종 방법을 사용해서는 진정한 내성 클론을 식별할 수 없고 번식 자손의 질병 저항성 다양성을 밝힐 수 없으므로 질병 저항성 관련 유전자 또는 유전자 모듈의 탐색이 제한됩니다. 포플러의 빠른 성장/다수확 육종의 급속한 발전에 비해, 이러한 육종 프로그램은 육종 첫 2년 동안 표현형 선택 또는 게놈 선택을 통해 잡종을 얻을 수 있다.4, 포플러 구내염 저항성 육종은 천천히 발달했다. 잡종 자손의 질병 저항성 스크리닝(또는 검출) 또는 병원체 접종 방법은 포플러 구내염 저항성 육종에서 중요한 속도 제한 단계가 되었습니다.
이 프로토콜에서는 포플러 줄기 구내염 병원균에 대한 새로운 접종 방법인 in vivo leaf 접종 방법을 소개합니다. 이 방법을 사용하면 5-7일 이내에 수십 종의 포플러 종(품종 또는 클론)의 구내염 저항성을 빠르고 효율적으로 테스트할 수 있습니다. 검증 분석은 in vivo 잎 접종이 줄기 구내염의 내성 검출에 대한 전통적인 in vitro 줄기 접종과 일치함을 보여주었으며, 이는 잎 접종 방법이 줄기 구내염의 육종에서 저항성 자손의 전체 유전자형 선택과 같은 포플러 구내염의 대규모 내성 스크리닝에 적합함을 시사합니다. 이 방법은 포플러 구내염의 잡종 번식에서 저항성 자손을 선택하는 병리학적 문제를 해결합니다.
프로토콜
1. 구내염 병원체에 대한 진균 배양
- 곰팡이 균주에 대한 감자 포도당 한천(PDA; 감자 추출 6.0g, 포도당 20.0g, 한천 20.0g) 배양 배지를 준비합니다. 위의 물질을 최대 1000mL의 물에 용해시키고 매체를 100 °C에서 10 분 동안 완전히 용해시킵니다.
- PDA 배지를 25mL 튜브(각각 15.0mL 포함)에 붓습니다. 모든 튜브를 121.1°C에서 30분 동안 멸균합니다. 배지를 배양 플레이트(직경 9.0cm)에 붓고 플레이트를 실온(RT)에서 냉각합니다.
- 28 ° C의 PDA 배지에서 7 일 동안 배양 한 곰팡이 병원체의 균사체를 ~ 0.5cm 정사각형 입방체로 자릅니다. PDA 플레이트의 중앙에 있는 곰팡이 큐브를 접종합니다(균사체 측면이 배지를 향함).
- 온도 조절 인큐베이터(28°C, 어두운 곳에서)에서 7-10일 동안 곰팡이 병원균을 배양합니다.
- 곰팡이 균사체가 있는 PDA 배지를 정사각형 입방체(한 변 길이 1.0-1.2cm)로 자릅니다.
2. 포플러 재료의 준비
- 1 년 된 포플러 클론 (3 개월 > 재배)의 경우 주요 가지의 새로 성숙하고 완전히 확장 된 잎 (항상 5-7번째 잎, 묘목 / 가지 상단에서)을 접종 된 재료로 선택하고 해충, 질병 및 기계적 손상이 없는지 확인하십시오.
- 다년생 포플러 잡종 클론 (2 개월 > 재배)의 1 년 된 가지의 경우, 선택한 가지의 상단 5-7번째 잎을 접종 물질로 선택하십시오. 잎이 건강하고 테스트된 모든 포플러 클론 간에 동일한 조명 조건(그늘 또는 빛)을 가지고 있는지 확인하십시오.
3. 접종 잎의 전처리
- 포플러 잎에 깨끗한 물을 뿌리고 건조 후 접종 조작 1 시간 또는 1 일 전에 선택한 잎을 75 % 알코올로 닦으십시오.
4. 생체 내 잎 접종
- 작은 잎 (잎 너비 < 8.0cm)의 경우 두 개의 정사각형 곰팡이 균사체 큐브와 PDA (또는 물 한천, WA) 큐브 (한 변 길이 1.0-1.2cm)를 포플러 클론의 상단 5-7 잎의 윗면에 접종합니다. 균사체는 잎을 향합니다. 접종 부위가 중앙 정맥에서 ~ 1-2cm 떨어진 반 잎의 중앙에 위치해야하며 2 차 정맥을 가리지 않도록하십시오. 각 클론은 6개의 잎에 12개 부위(균사체용 10개 부위, PDA 접종용 2개 부위)에 접종합니다.
- 큰 잎 (잎 너비 ≥ 8.0cm)의 경우 4 개의 정사각형 곰팡이 균사체 큐브와 PDA (또는 WA) 큐브를 상단 5-7 개의 포플러 잎에 접종합니다. 각 클론은 3개의 잎에서 12개 부위(균사체의 경우 10개 부위, PDA 접종의 경우 2개 부위)를 접종합니다.
- 접종한 잎을 투명 접착 테이프(폭 6.0cm)로 감싸고 부드럽게 눌러 잎에 접착되도록 하여 실험 중에 균사체(또는 PDA) 큐브의 이동 및 수분 손실을 방지합니다.
- 바늘이 포플러 잎의 위쪽 표면에서 아래쪽 표면으로 큐브를 관통할 때까지 잎과 균사체(또는 PDA) 큐브를 5개 부위에 뚫습니다. 한 사이트는 중앙에 있고 다른 네 개는 큐브의 네 꼭짓점 근처 1-2mm에 있습니다.
참고: 진균 접종 조작을 위해 3인 팀 협업이 권장됩니다. 포플러 잡종 개체군(>100개의 유전자형)에 대한 접종 조작은 팀워크를 통해 4시간 내에 수행할 수 있습니다. 피어싱 조작은 질병의 중증도에 대한 다양한 피어싱 시간의 영향을 완화하기 위해 테스트된 모든 잎을 접종하고 포장한 후에 수행되었습니다. - 균사체 접종제의 위치 이동과 수분 손실을 검사하고, 접종3일째 까지 잎 아래쪽 표면에서 관통 상처 부위 주변의 괴사성 병변의 시작을 관찰합니다.
- 접종 후 3일 이내에 균사체 큐브의 위치 이동과 수분 손실을 관찰합니다. 이동 및 건조된 균사체 큐브를 비효율적인 접종으로 정의 및 표시하고 병원형의 최종 식별에서 폐기하는 동시에 다른 큐브를 효과적인 접종으로 정의합니다.
참고: 이 프로토콜은 5개 이상의 효과적인 접종 큐브가 있는 테스트된 포플러 클론을 유효하지 않은 접종 클론으로 정의합니다. 그러므로, 각 포플러 클론은 적어도 30 개의 효과적인 접종 부위를 제공했으며, 이는 30 개의 독립적 인 괴사 지점으로 발전 할 것입니다.
- 접종 후 3일 이내에 균사체 큐브의 위치 이동과 수분 손실을 관찰합니다. 이동 및 건조된 균사체 큐브를 비효율적인 접종으로 정의 및 표시하고 병원형의 최종 식별에서 폐기하는 동시에 다른 큐브를 효과적인 접종으로 정의합니다.
- 실험이 끝날 때(접종 후 5~7일 후) 접종한 모든 잎을 떼어내고 비닐 샘플 백에 담아 실험실로 다시 가져와 4°C에서 보관합니다.
5. 실험실에서 줄기 구내염에 대한 포플러 저항성의 잎 병원형 획득 및 평가
- 잎에서 투명 접착 테이프와 균사체(또는 PDA) 접종제를 조심스럽게 제거합니다.
- 괴사성 반점의 모양과 색상을 포함하여 각 포플러 클론의 잎 병원형을 관찰하고 식별하며, 관통 부위 주변의 잎 표면에 형성된 곰팡이 균사와 같은 구조, pycnidia 및 분생포자를 포함할 수 있습니다.
- 카메라로 나뭇잎을 사진(추가 자 사용)하거나 스캐너를 사용하여 나뭇잎을 스캔(추가 자 사용)하여 해상도가 300dpi 이상인 이미지를 얻은 다음 이미지를 JPEG, TIFF 또는 PNG 형식으로 저장합니다.
6. 질병 발생의 파악 및 통계적 분석
- ImageJ 1.54g (http://imagj.org) 소프트웨어에서 병든 잎의 이미지를 엽니다.
- 나뭇잎 이미지의 자에 따라 눈금을 설정합니다.
- 지팡이(추적) 도구로 병변을 식별하고 측정합니다.
- 모든 괴사 지점의 면적을 측정한 후 면적 값을 기록하고 스프레드시트로 내보냅니다.
- 질병 판정을 위한 기준을 설정합니다.
- 관통 부위를 덮고 있는 균사체 큐브 주변의 병변 영역이 PDA 큐브로 덮인 것보다 훨씬 큰 경우 이러한 부위를 질병 부위로 정의합니다.
- PDA로 덮인 부위와 비교했을 때 균사체로 덮인 관통 부위의 형태학적 특성이 크게 변한 경우, 병변의 색상, 균사와 같은 구조를 생성하는 pycnidia, 분생포자 및 분생포자(conidia)는 해당 부위를 질병 부위로 정의합니다.
- 각 포플러 하이브리드 클론의 효과적인 PDA 병변 반점의 평균 면적을 계산합니다. 평균 면적에 따라, 한 포플러 클론의 모든 균사체 접종 지점을 발병 및 비발병의 두 가지 범주로 나눕니다. 그런 다음, 테스트된 포플러 클론의 질병 발병률을 계산합니다(공식 1: 질병 발병률(%) = 병든 찌르기 부위의 수/효율적인 찌르기 부위의 총 수 × 100).
- 잎에서 병든 반점의 평균 면적을 계산합니다 (n = 50). 테스트된 모든 포플러 클론에서 잎의 병든 반점의 평균 면적 값에 따라 5단계 질병 등급 기준을 설정합니다.
- 위의 질병 등급 기준(공식 2: 질병 지수 = ∑(수준별 찌르기 부위 수 × 모든 수준에서의 중증도 값)/(가장 높은 중증도 수준 × 효율적인 찌르기 부위의 총 수) × 100)에 따라 각 포플러 클론(화학식 2)의 질병 지수를 계산한다.
- 적절한 데이터 분석 소프트웨어를 사용하여 Shapiro-Wilk 테스트를 사용하여 다양한 저항 수준에서 포플러 클론 수의 정규 분포를 확인합니다.
- 질병 지수에 따라 테스트된 모든 포플러 클론을 매우 높은 저항성(VHR), 높은 내성(HR), 내성(R), 내성 없음 및 감수성 없음(NRNS), 감수성(S), 높은 감수성(HS) 및 매우 높은 감수성(VHS) 그룹5의 5개(또는 7개) 그룹으로 식별합니다.
결과
이 프로토콜에서 도식적 워크플로우는 줄기 구내염 병원균 C. chrysosperma 에 감염된 48개의 포플러 하이브리드 클론에서 수행되었습니다(그림 1). 포플러 잡종 클론은 베이징 중국 임업 아카데미 (CAF)의 종묘장에서 재배 된 P. deltoides의 교잡 자손의 일부입니다.
줄기 구내염 병원체 C. chrysosperma isolate CZC는 포플러 구내염 6,7,8,9의 생리학적 연구에 사용되며 우리 실험실에 기탁된 전형적인 곰팡이 균주(중간 병원성)입니다. 그 결과, 줄기 구내염 병원균 C. chrysosperma를 접종하면 괴사성 병변(그림 2B,C)과 포플러 잎에 피크니디아와 같은 구조가 유발되는 것으로 나타났습니다(그림 2D-F). 또한, 결과는 잎의 위치(또는 잎 나이 및 잎 온토겐)(그림 2G-I)와 잎의 빛 조건(그림 2J-L)이 줄기 구내염 병원균 C. chrysosperma isolate CZC에 의해 접종된 잎의 질병 중증도에 영향을 미친다는 것을 보여주었습니다.
진균 접종제의 병원성은 알려지지 않은 하이브리드 개체군의 내성 스크리닝에 중요한 요소입니다. 그러나, 육종에서 독성이 있는 균주를 선택하는 것에 대해서는 두 가지 상반된 견해가 존재해 왔다: 가장 독성이 강한 균주(10)와 적당히 독성이 강한 균주(11)를 사용하는 것이다. 이 프로토콜의 예비 실험에서 우리는 하이브리드 포플러 "Bofeng 3"에서 10개의 곰팡이 분리체의 병원성 검출로부터 CZC를 분리하기 위해 C. chrysosperma를 선택했습니다. 고무적이게도, 결과는 SPSS의 Shapiro-Wilk 테스트 분석에 의해 확인 된 바와 같이 48 개의 포플러 하이브리드 클론에서 서로 다른 저항 수준에 걸친 포플러 클론의 분포가 정상임을 나타내며,이 분리물이 현재 포플러 교잡 집단의 저항성 스크리닝에 선호된다는 것을 시사합니다. 48개의 포플러 클론에 대한 내성 스크리닝의 일부 결과가 그림 3A-C에 나와 있습니다. 또한, 그 결과 병원체 B. dothidea의 6개 분리체가 잡종 포플러 "Bofeng 3"에 대해 차별적 독성을 가지고 있으며, 분리 SD47 및 SD60이 테스트된 곰팡이 균주에서 가장 독성이 강한 분리물임을 보여주었으며(그림 3D-F), 잎 접종 방법이 포플러 줄기 구내염 병원체의 독성 스크리닝에도 사용됨을 시사합니다.
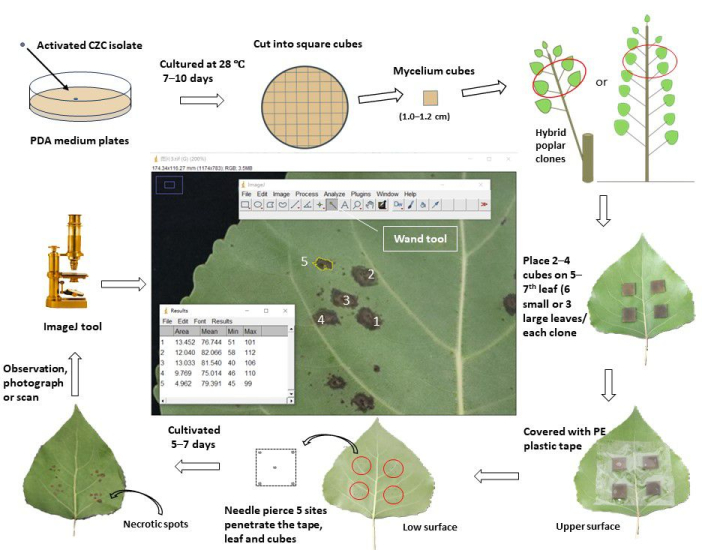
그림 1: 포플러 클론의 in vivo 잎 접종을 통해 줄기 구내염 저항성을 평가하는 개략적인 워크플로우. 활성화된 줄기 구내염 병원균 Cytospora chrysosperma isolate CZC를 28°C의 어두운 상태에서 PDA 플레이트에서 10일 동안 배양했습니다. 그런 다음 C. chrysosperma 균사체를 정사각형 입방체 (측면 길이 1.0-1.2cm)로 자르고 1 년생 포플러 묘목 또는 다년생 포플러에서 분지 된 1 년생 포플러에 상단 5-7번째 잎의 윗면에 접종했습니다. 균사체 큐브의 균사 쪽이 잎을 향하고 있었습니다. 작은 잎(잎 너비 < 8.0cm)의 경우 1개의 잎에 2개의 균사체 큐브를 접종하고, 큰 잎(잎 너비 ≥ 8.0cm)에 4개의 균사체 큐브를 접종했습니다. 그러나 크고 작은 잎, 10 개의 균사체 큐브 및 2 개의 PDA 중간 큐브를 묘목 / 가지에 접종했습니다. 그런 다음 접종 한 잎을 6.0-8.0cm 너비의 플라스틱 보호 테이프로 싸서 큐브를 고정하고 수분 손실을 방지했습니다. 나뭇잎과 큐브를 바늘로 뚫어 중앙과 사각형의 네 꼭짓점에 상처 부위를 만들었습니다. 접종된 잎은 밭/온실에서 재배하고 접종 후 5-7일 후에 관찰, 촬영/스캔했습니다. 그런 다음 이미지를 ImageJ 소프트웨어에 로드하여 각 포플러 클론의 피어싱된 상처 부위에서 발생한 괴사 부위의 평균 면적을 측정했습니다. 마지막으로, 질병 발병률과 질병 지수는 각 포플러 클론의 괴사 부위의 평균 면적을 기준으로 계산되었습니다. 질병 지수에 따르면, 테스트된 모든 포플러 클론은 서로 다른 저항 그룹으로 나뉘었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
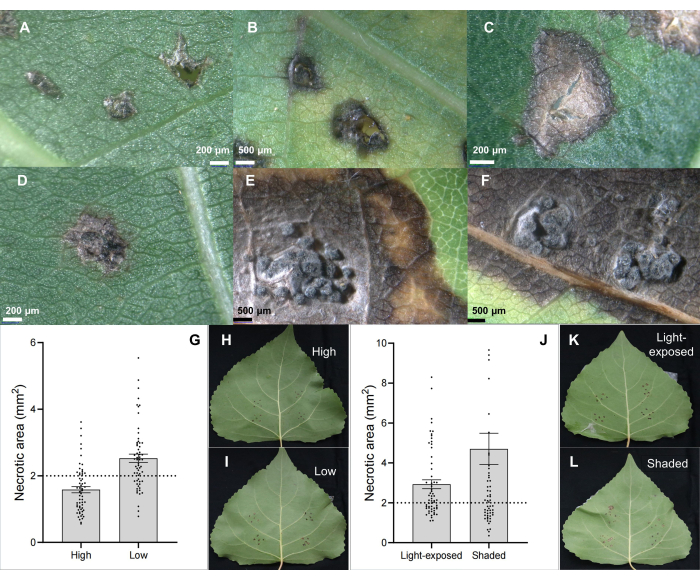
그림 2: 잎 접종을 통해 구내염 병원체 C. chrysosperma에 감염된 하이브리드 포플러 클론 B246의 고전적인 잎 병변 특성. (A) PDA 접종제에 의해 접종됨; (B,C) 괴사성 반점; (D-F) pycnidia 구조를 가진 괴사성 반점; (G-I) 1년생 묘목/가지에서 접종된 잎의 위치는 하이브리드 포플러 품종 "Bofeng 3"에서 줄기 구내염 병원균 C. chrysosperma의 질병 중증도에 영향을 미칩니다. (JL) 조명 조건은 포플러 품종 "Bofeng 3"의 질병 심각성에 영향을 미칩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 저항 스크리닝 및 민감성 검출. in vivo 잎 접종 방법을 사용하여 (D-F) 하이브리드 포플러 클론 "Bofeng 3"에서 분리한 (A-C) 하이브리드 포플러 클론의 내성 스크리닝 및 병원균 Botryosphaeria dothidea의 감수성 검출. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 심각도 등급 | 채점 기준 | 수준 |
| 질병 없음 | 증상 없음, 괴사 부위 0–2.0 mm² | 0 |
| 매우 순함 | 괴사 부위 2.0–4.0 mm² | 1 |
| 경증 질환 | 괴사 부위 4.0–6.0 mm² | 2 |
| 중등도 질환 | 괴사 부위 6.0–8.0 mm² | 3 |
| 중등도 중증 질환 | 괴사 부위 8.0–10.0 mm² | 4 |
| 중증 질환 | 괴사 면적이 10.0mm² 이상인 경우 | 5 |
표 1: 잎의 구내염 병원균에 의해 유발된 괴사 증상의 심각도 등급.
토론
이 프로토콜은 포플러 구내염 내성 병원체에 대한 빠르고 효율적인 접종 방법을 제공하며, 이는 포플러 구내염 내성의 하이브리드 육종 및 줄기 구내염 병원체의 병원성 스크리닝과 같은 대규모 질병 내성 스크리닝이 필요한 연구 분야에 적합합니다.
이 방법의 첫 번째 핵심은 성숙한 줄기/가지 대신 새로 성숙한 잎 접종으로 질병 저항성을 평가하는 것입니다. 결과적으로, 줄기 줄기 구내염 저항성 클론의 선택은 줄기 접종 경로(육종 후 5-7년)에서 시간이 많이 걸리는 저항성 스크리닝과 비교하여 잎 접종 방법을 사용할 때 포플러 잡종 육종의 1-2년 내에 수행될 수 있으며, 잎 방법은 포플러 줄기 구내염의 번식 주기를 급격히 단축합니다. 잎 방법의 두 번째 중요한 단계는 잎을 선택하는 것입니다. 잎의 질병 저항성은 잎 단계 관련 저항성12,13의 잎 존재 저항성이라고 불리는 잎 존재 발생 저항성 (나뭇가지에서의 나이 또는 위치)에 따라 다릅니다. 따라서 테스트된 잎과 줄기/가지 사이의 식물 저항성의 상관 관계는 잎 접종 방법의 효과에 매우 중요합니다. "5개의 중간 잎"에 대한 잎 반점 저항성은 하이브리드 포플러-Septoria 상호 작용에서 줄기 구강 저항성과 관련이 없습니다13; 그러나 Wei et al.의 연구14 및 우리의 연구는 새로 성숙한 상단 잎 또는 상단 5-7번째 잎의 잎 반점 저항성이 Malus-V의 줄기 구강 저항성과 일치한다는 것을 보여주었습니다. ceratosperma 및 poplars-C. Chrysosperma 상호 작용. 따라서, in vivo 잎 접종 방법은 줄기의 포플러 육종에 사용될 수 있으며, 상단 5-7 개의 잎은 사용 가능한 접종 재료입니다. 이 방법의 세 번째 핵심은 병원균 접종 후 반복적인 바늘 피어싱을 통해 충분한 상처 부위(이 프로토콜에서는 30개 부위가 권장되고 이 프로토콜에서는 50개 부위)를 생성하는 것이며, 이론적으로 상처 부위는 3개의 포플러 잎에 50개의 독립적인 괴사 지점으로 발전하여 포플러 자손의 구내염에 대한 저항력을 보다 정확하게 평가할 수 있습니다. 또한, 잎에서 수분 보존 및 빛 조건(15)의 선택은 포플러 줄기 구내염에 대한 보다 안정적이고 정확한 저항성 평가를 획득하는 데 유익하다.
이 프로토콜에서는 다년생 포플러 나무의 1년생 포플러 묘목(3개월 재배>)과 1년생 가지(2개월 > 재배)를 접종 재료로 사용했습니다. 포플러 묘목은 더 일관되고 작동하기 쉽기 때문에 질병 저항성 검사에 이상적입니다. 반대로, 포플러 가지나 잎(해충, 질병 및 기계적 손상이 없어야 하고 조명이나 차양과 같은 동일한 환경 조건을 가져야 함)을 선택하는 것은 어려운 일입니다.
전통적인 in vitro stem 접종 방법과 비교하여, in vivo leaf 접종 방법은 여러 측면에서 포플러 구내염 저항성 육종을 크게 향상시킵니다: 1) 포플러 줄기 구내염의 하이브리드 육종을 위한 실현 가능한 질병 저항성 스크리닝 방법을 제공합니다. 우리의 경험에 따르면, 3 인 팀은 1 일에 200 개 이상의 포플러 하이브리드 클론의 곰팡이 접종을 수행 한 다음 5-7 일 후에 결과를 얻을 수 있습니다. 따라서 육종가는 3-6명의 협력을 통해 단기간(예: 1개월)에 대규모 하이브리드 개체군(예: 1,000개의 유전자형)의 질병 저항성을 스크리닝할 수 있습니다. 2) 잎 접종 방법은 구내염 저항성 클론의 첫 번째 선택 시간을 크게 앞당겨(육종 후 5-7년에서 1-2년으로) 구내염을 막기 위한 저항성 클론의 조기 선택 및 묘목 선택에 도움이 됩니다. 3) 잎 접종 방법을 사용하여 연구자들은 모든 잡종 자손의 저항 구조와 다양성을 심층적으로 밝히고 생산 또는 육종을 위한 후보 저항성 클론을 얻을 수 있습니다. 4) 또한, 고처리량 염기서열분석 기술과 결합된 잎 접종 방법은 내성 관련 유전자 및 유전자 모듈4의 채굴에 도움이 되며, 유전체 선택(GS) 기술4에 기반한 포플러 질병 저항성 육종에 사용할 수 있다. 마지막으로, 포플러의 성장기 동안 상단 5-7번째 잎의 지속적인 생산을 위해 육종가는 다른 병원체 균주 또는 다른 질병 병원체에 대한 포플러 저항성을 선별 할 수 있습니다. 그런 다음, 잎 접종 방법은 또한 포플러의 다중 투사 육종을 위한 실현 가능한 경로를 제공하며, 예를 들어, C. chrysosperma 및 B. dothidea 구내염에 동시에 저항하는 하이브리드 클론을 얻습니다. 그러나 잎 접종 방법은 상대적으로 작은 잡종 포플러 자손(48개 유전자형)에서 구내염 저항성 스크리닝에서 개발되었다는 점에 유의해야 합니다. 그런 다음 포플러 구내염 저항성 육종을 위한 중요한 전략으로서 이 방법의 효과는 여전히 더 많은 포플러 잡종 또는 재배된 포플러 농장에서 보다 강력한 검증이 필요합니다.
이 프로토콜은 포플러 구내염(예: Cytospora, Botryosphaeria 및 Septoria 질병) 하이브리드 육종 개발에 기여하여 중국과 북미의 포플러 조림에서 저항성 포플러 하이브리드 클론을 제공할 것입니다. 또한, 이 프로토콜은 줄기 구내염의 병원성에 대한 이해에 기여하고, 유전자 분석 및 유전자 채굴을 촉진하며, 포플러 분자 육종의 개발을 개선할 것입니다. 또한, 잎 접종 방법은 구내염 병원체의 감수성을 스크리닝하고 진균 병원성 관련 유전자를 결정하기 위한 정확하고 안정적인 평가 방법을 의미합니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 중앙 공익 과학 기관, 국가 핵심 나무 유전학 및 육종 연구소의 기초 연구 기금(보조금 번호 CAFYBB2020ZY001-2) 및 중국 국립 자연 과학 재단(보조금 번호 32171776)이 공동으로 Jiaping Zhao에 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
참고문헌
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유