Method Article
Inoculación in vivo de hojas: un método alternativo para evaluar la resistencia a enfermedades de clones híbridos en la cría de álamos de la enfermedad del cancro del tallo
* Estos autores han contribuido por igual
En este artículo
Resumen
Proporcionamos un protocolo paso a paso para evaluar la resistencia del álamo a los patógenos del cancro del tallo utilizando un método de inoculación de hojas in vivo . Este método es especialmente adecuado para la evaluación a gran escala de la resistencia a la enfermedad del cancro de Cytospora chrysosperma y Botryosphaeria dothidea en la progenie de cría de álamos en China.
Resumen
Enfermedades del cancro del tallo causadas por el patógeno Cytospora chrysosperma (Pers.) Fr.) y Botryosphaeria dothidea (Moug. ex Fr.) Ces. Son las dos principales enfermedades forestales en las plantaciones de álamos en China, que a veces pueden destruir todas las plántulas de álamo o dañar gravemente los bosques maduros de álamos. El mejoramiento híbrido es el método más directo y eficiente para controlar y manejar las enfermedades de los árboles. Sin embargo, la evaluación de la resistencia a las enfermedades o la selección de clones resistentes a las enfermedades basados en la inoculación in vitro del tallo es ineficiente, requiere mucho tiempo y es costosa, lo que limita el desarrollo de la cría híbrida de la enfermedad del cancro del tallo del álamo. En este estudio, propusimos un método alternativo para evaluar la resistencia de las enfermedades a los patógenos del cancro del tallo a través de la inoculación de hojas in vivo . Los materiales de prueba utilizados en este método pueden estar en árboles jóvenes de álamo de 1 año o en las ramas anuales de álamos perennes en el invernadero o en el campo. El paso crítico de este método alternativo es la selección de las hojas inoculantes: las 5-7hojas recién maduras podrían ser las más adecuadas. El segundo paso crítico del método de inoculación de hojas es hacer heridas en las hojas de las plantas a través de perforaciones con agujas, proporcionando suficientes lesiones para medir la gravedad de la enfermedad. Para el número adecuado de hojas producidas en la etapa temprana de la cría del álamo, esta inoculación in vivo de la hoja contribuye a la detección rápida, precisa y a gran escala de los clones de álamo resistentes a enfermedades para los patógenos del cancro. Además, este método de inoculación de hojas también servirá como un método eficiente para detectar patotipos de patógenos de la enfermedad del cancro del tallo C. chrysosperma, B. dothidea u otros patógenos del cancro del tallo del álamo.
Introducción
Enfermedades del cancro del tallo del álamo, causadas principalmente por dos patógenos necrótrofos, Cytospora chrysosperma (Pers.) Fr. y Botryosphaeria dothidea (Moug. ex Fr.) Ces. De Not., amenazan severamente el desarrollo y la supervivencia de las plantaciones de álamos en el noreste, norte y noroeste (tres nortes) de China. El mejoramiento híbrido es el método más directo y eficiente para controlar y manejar las enfermedades de los árboles; Sin embargo, en comparación con los avances en la cría de clones híbridos de álamo de alto rendimiento, de crecimiento rápido u otros clones híbridos, la investigación sobre la mejora genética resistente a la enfermedad del cancro del álamo es escasa. Solo se han reportado estudios limitados de mejoramiento híbrido resistente a enfermedades 1,2,3, y no se ha cultivado ningún clon híbrido resistente al cancro en la forestación de álamos.
El paso crucial de la cría regular de híbridos es la selección de clones basada en la adquisición del fenotipo de la progenie híbrida. Sin embargo, la adquisición de fenotipos patológicos (patotipos) es un proceso lento, laborioso, agotador, costoso y dependiente de expertos. Para las plantas leñosas, es más desafiante debido a la naturaleza que consume tiempo, trabajo y economía causada por su largo ciclo de vida, crecimiento lento y cuerpo masivo. Por ejemplo, en álamo, el cribado de la resistencia al cancro de la progenie híbrida se realizó 5-7 años después de la hibridación mediante métodos convencionales de inoculación del tallo in vitro 1,2,3. Además, limitados por este método de cribado resistente a las enfermedades de baja eficiencia y alto consumo, los investigadores volvieron a seleccionar los clones resistentes al cancro de un pequeño subgrupo (por ejemplo, los clones de álamo seleccionados de alto rendimiento o de rápido crecimiento), no de toda la progenie híbrida. Por lo tanto, utilizando los métodos regulares de inoculación del tallo, no es seguro identificar los clones resistentes auténticos y no puede revelar la diversidad resistente a las enfermedades de la progenie reproductora, lo que limita la exploración de genes o módulos genéticos relacionados con la resistencia a las enfermedades. En comparación con el rápido desarrollo del mejoramiento genético de álamo de crecimiento rápido / alto rendimiento, esos programas de mejoramiento pueden obtener híbridos a través de la selección fenotípica o incluso la selección genómica en los primeros dos años de mejoramiento 4, el mejoramiento resistente al cancro del álamose desarrolló lentamente. El cribado (o detección) de la progenie híbrida resistente a las enfermedades, o el método de inoculación de patógenos, se ha convertido en el paso crucial que limita la velocidad en la cría de resistencia a la enfermedad del cancro del álamo.
En este protocolo, introducimos un nuevo método de inoculación para patógenos del cancro del tallo del álamo, el método de inoculación de hojas in vivo . Con este método, podemos probar de manera rápida y eficiente la resistencia a la enfermedad del chancro de docenas de especies de álamos (cultivares o clones) en 5-7 días. El ensayo de validación ilustró que la inoculación in vivo de la hoja es consistente con la inoculación tradicional del tallo in vitro en la detección de resistencia de la enfermedad del cancro del tallo, lo que sugiere que el método de inoculación de la hoja es adecuado para el cribado de la resistencia a gran escala de las enfermedades del cancro del álamo, como la selección completa del genotipo de la progenie de resistencia en la cría de la enfermedad del cancro del tallo. Este método resuelve el problema patológico de la selección de descendientes resistentes en la cría híbrida de enfermedades del cancro del álamo.
Protocolo
1. Cultivo de hongos para el patógeno del cancro
- Prepare el agar papa dextrosa (PDA; extracción de papa 6,0 g, dextrosa 20,0 g, agar 20,0 g) medio de cultivo para cepas fúngicas; disolver los materiales anteriores en agua hasta 1000 mL, disolver completamente el medio a 100 °C durante 10 min.
- Vierta el medio PDA en tubos de 25 mL (cada uno contiene 15.0 mL); esterilizar todos los tubos a 121,1 °C durante 30 min. Vierta el medio en placas de cultivo (9,0 cm de diámetro) y enfríe las placas a temperatura ambiente (RT).
- Cortar el micelio del patógeno fúngico, que se cultiva en medio PDA a 28 °C durante 7 días, en cubos cuadrados de ~0,5 cm; inocule los cubos de hongos en el centro de las placas de PDA (los lados del micelio miran hacia el medio).
- Cultivar los patógenos fúngicos en una incubadora termostática (28 °C, en oscuridad) durante 7-10 días.
- Corte el medio PDA con micelio fúngico en cubos cuadrados (longitud lateral 1,0-1,2 cm).
2. Preparación de materiales de álamo
- Para clones de álamo de 1 año (cultivados > 3 meses), seleccione las hojas recién maduras y completamente extendidas (siempre 5-7hojas , desde la parte superior del arbolito/ramas) de las ramas principales como materiales inoculados, asegúrese de que estén libres de plagas, enfermedades y daños mecánicos.
- Para ramas de 1 año de edad de clones híbridos de álamo perenne (cultivadas > 2 meses), seleccionelas hojas superiores de 5-7 de las ramas seleccionadas como materiales inoculados. Asegúrese de que las hojas estén sanas y tengan la misma condición de luz (sombra o luz) entre todos los clones de álamo probados.
3. Pretratamiento de las hojas de inoculación
- Rocíe las hojas de álamo con agua limpia y, después del secado, limpie las hojas seleccionadas con alcohol al 75% 1 h o 1 día antes de las manipulaciones de inoculación.
4. Inoculación foliar in vivo
- Para hojas pequeñas (ancho de hoja < 8,0 cm), inocule dos cubos cuadrados de micelio fúngico y cubos de PDA (o agar agua, WA) (1,0-1,2 cm de longitud lateral) en la superficie superior de las 5-7 hojas superiores de los clones de álamo; El micelio mira hacia las hojas. Asegúrese de que los sitios de inoculación estén ubicados en el centro de las medias hojas, a ~ 1-2 cm de distancia de las venas centrales, evitando oscurecer las venas secundarias. Cada clon inocula 12 sitios en 6 hojas (10 sitios para micelio y 2 sitios para inoculación de PDA).
- Para hojas grandes (ancho de hoja ≥ 8,0 cm), inocule cuatro cubos cuadrados de micelio fúngico y cubos de PDA (o WA) en las 5-7 hojas de álamo superiores. Cada clon inocula 12 sitios en 3 hojas (10 sitios para micelio y 2 sitios para la inoculación de PDA.
- Envuelva las hojas inoculadas con cinta adhesiva transparente (6,0 cm de ancho) y presiónelas suavemente para que se adhieran a las hojas, evitando el movimiento y la pérdida de agua de los cubos de micelio (o PDA) durante el experimento.
- Perfore las hojas y los cubos de micelio (o PDA) en cinco sitios hasta que las agujas penetren en los cubos desde la superficie superior hasta la inferior de las hojas de álamo. Un sitio se encuentra en el centro y los otros cuatro se encuentran a 1-2 mm cerca de los cuatro vértices de los cubos.
NOTA: Se recomienda una colaboración en equipo de 3 personas para la manipulación de la inoculación de hongos. La manipulación de la inoculación de una población híbrida de álamo (>100 genotipos) se puede realizar en 4 h mediante trabajo en equipo. Las manipulaciones de perforación se llevaron a cabo después de que todas las hojas analizadas fueron inoculadas y envueltas para aliviar el impacto de los diferentes tiempos de perforación en la gravedad de la enfermedad. - Inspeccione el cambio de ubicación y la pérdida de agua de los inoculantes de micelio, y observe la aparición de lesiones necróticas alrededor de los sitios de la herida perforante desde la superficie inferior de las hojas hasta el3er día de inoculación.
- Dentro de los 3 días posteriores a la inoculación, observe el cambio de ubicación y la pérdida de agua de los cubos de micelio. Defina y marque los cubos de micelio movidos y secos como inoculaciones ineficaces y descarte de la identificación final de los patotipos, definiendo los otros cubos como inoculaciones efectivas.
NOTA: Este protocolo define los clones de álamo probados con más de cinco cubos de inoculación efectivos como clones inoculados inválidos; Por lo tanto, cada clon de álamo proporcionó al menos 30 sitios de inoculación efectivos, que se convertirán en 30 manchas necróticas independientes.
- Dentro de los 3 días posteriores a la inoculación, observe el cambio de ubicación y la pérdida de agua de los cubos de micelio. Defina y marque los cubos de micelio movidos y secos como inoculaciones ineficaces y descarte de la identificación final de los patotipos, definiendo los otros cubos como inoculaciones efectivas.
- Retire todas las hojas inoculadas al final del experimento (~5-7 días después de la inoculación), llévelas de vuelta al laboratorio en bolsas de plástico para muestras y guárdelas a 4 °C.
5. Adquisición del patopatía foliar y evaluación de la resistencia del álamo a las enfermedades del cancro del tallo en el laboratorio
- Retire con cuidado las cintas adhesivas transparentes y los inoculantes de micelio (o PDA) de las hojas.
- Observe e identifique los patotipos de las hojas de cada clon de álamo, incluida la forma y el color de las manchas necróticas, y puede incluir la estructura fúngica similar a hifas, picnidios y conidios que se formaron en la superficie de las hojas alrededor de los sitios de perforación.
- Fotografíe las hojas (con una regla adicional) con una cámara, o escanee las hojas (con una regla adicional) con un escáner para obtener imágenes con una resolución de más de 300 ppp y, a continuación, guarde las imágenes en formato JPEG, TIFF o PNG.
6. Identificación y análisis estadístico de la incidencia de enfermedades
- Abra las imágenes de hojas enfermas en el software ImageJ 1.54g (http://imagj.org).
- Establezca la escala de acuerdo con la regla en las imágenes de hojas.
- Identifique y mida las lesiones con la herramienta de varita (trazado).
- Registre y exporte los valores de área como una hoja de cálculo después de medir las áreas de todos los puntos necróticos.
- Establecer los criterios para la determinación de la enfermedad:
- Si el área de la lesión alrededor de los cubos de micelio cubiertos por los sitios de perforación es significativamente mayor que la cubierta por los cubos de PDA, entonces defina estos sitios como sitios de enfermedad.
- Si las características morfológicas de los sitios de perforación cubiertos por cubos de micelio cambiaron significativamente en comparación con los sitios cubiertos por PDA, incluidos los colores de la lesión, la estructura productora de hifas, picnidios y conidios, defina el sitio también como un sitio de enfermedad.
- Calcule las áreas promedio de las manchas de lesiones PDA efectivas de cada clon híbrido de álamo. De acuerdo con las áreas promedio, divida todas las manchas inoculadas con micelio de un clon de álamo en dos categorías: de inicio y no de inicio. A continuación, calcule la tasa de incidencia de la enfermedad del clon de álamo analizado (Fórmula 1: Tasa de incidencia de la enfermedad (%) = Número de puntos de punción enfermos/Número total de puntos de pinchazos eficientes × 100).
- Calcule el área promedio de las manchas enfermas en las hojas (n = 50). De acuerdo con los valores de las áreas promedio de manchas enfermas de hojas en todos los clones de álamo analizados, se estableció un estándar de clasificación de enfermedades de 5 niveles.
- Calcule el índice de enfermedad de cada clon de álamo (Fórmula 2) en función del estándar de clasificación de enfermedades anterior (Fórmula 2: Índice de enfermedad = ∑(Número de sitios de punción por nivel × Valores de gravedad en todos los niveles)/(Valor del nivel de gravedad más alto × Número total de sitios de punción eficientes) × 100).
- Verifique la distribución normal del número de clones de álamo a través de diferentes niveles de resistencia utilizando la prueba de Shapiro-Wilk utilizando cualquier software de análisis de datos apropiado.
- De acuerdo con el índice de enfermedad, identifique todos los clones de álamo analizados en cinco (o siete) grupos: muy alta resistencia (VHR), alta resistencia (HR), resistencia (R), sin resistencia y sin susceptibilidad (NRNS), susceptibilidad (S), alta susceptibilidad (HS) y muy alta susceptibilidad (VHS) grupo5.
Resultados
En este protocolo, el flujo de trabajo esquemático se llevó a cabo en 48 clones híbridos de álamo infectados por el patógeno del cancro del tallo C. chrysosperma (Figura 1). Los clones híbridos de álamo forman parte de la progenie de hibridación de P. deltoides, cultivada en el vivero de la Academia China de Silvicultura (CAF), en Pekín.
El patógeno del cancro del tallo C. chrysosperma aislado CZC es una cepa fúngica típica (con patogenicidad media) utilizada para la investigación fisiológica de la enfermedad del cancro del álamo 6,7,8,9 y depositada en nuestro laboratorio. Los resultados mostraron que la inoculación del patógeno del cancro del tallo C. chrysosperma indujo lesiones necróticas (Figura 2B, C) e incluso estructuras similares a picnidios en hojas de álamo (Figura 2D-F). Además, los resultados también ilustraron que las posiciones de las hojas (o edades de las hojas y ontogenia de las hojas) (Figura 2G-I) y las condiciones de luz de las hojas (Figura 2J-L) influyen en la gravedad de la enfermedad de las hojas inoculadas por el patógeno del cancro del tallo C. chrysosperma aislado de CZC.
La patogenicidad de los inoculantes fúngicos es un factor crucial en el cribado de la resistencia de poblaciones híbridas desconocidas. Sin embargo, ha habido dos puntos de vista opuestos sobre la selección de cepas virulentas en la cría: el uso de la cepa más virulenta10 y las cepas moderadamente virulentas11. En el experimento preliminar de este protocolo, seleccionamos C. chrysosperma para aislar CZC a partir de la detección de patogenicidad de 10 aislados de hongos en álamo híbrido "Bofeng 3". De manera alentadora, los resultados indican que la distribución de los clones de álamo a través de diferentes niveles de resistencia en los 48 clones híbridos de álamo es normal, como lo confirma el análisis de la prueba de Shapiro-Wilk en SPSS, lo que sugiere que este aislado es el favorito para el cribado de resistencia de esta población actual de hibridación de álamo. En la Figura 3A-C se muestran los resultados parciales del cribado de resistencia de 48 clones de álamo. Además, los resultados mostraron que seis aislados del patógeno B. dothidea tienen virulencia diferencial con respecto al álamo híbrido "Bofeng 3", y los aislados SD47 y SD60 son los aislados más virulentos en las cepas fúngicas analizadas (Figura 3D-F), lo que sugiere que el método de inoculación de hojas también se utilizará en el cribado de virulencia del patógeno de la enfermedad del cancro del tallo del álamo.
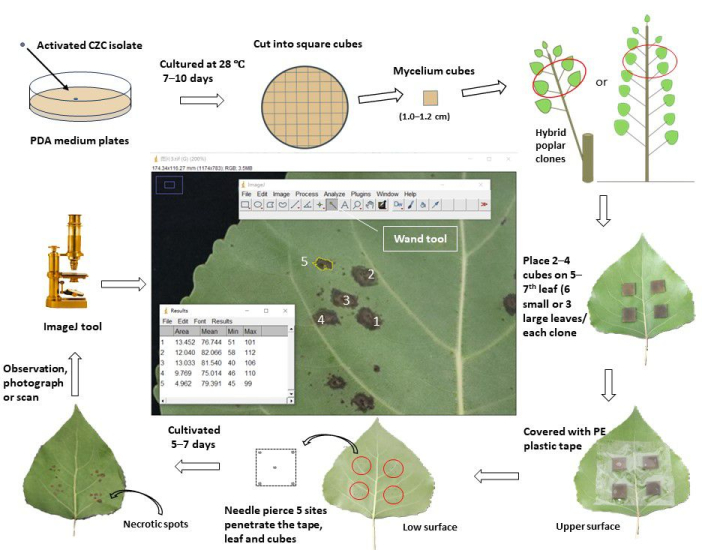
Figura 1: Un flujo de trabajo esquemático de evaluación de la resistencia al cancro del tallo a través de la inoculación de hojas in vivo en clones de álamo. El patógeno del cancro activado del tallo Cytospora chrysosperma aislado de CZC se cultivó en placas de PDA a 28 °C, en oscuridad, durante 10 días. Luego, el micelio de C. chrysosperma se cortó en cubos cuadrados (1,0-1,2 cm de longitud lateral) y se inoculó en la superficie superior delas hojas 5-7 superiores en árboles jóvenes de álamo de 1 año o álamo de 1 año ramificado en álamos perennes. El lado de las hifas de los cubos de micelio miraba hacia las hojas. Para las hojas pequeñas (ancho de hoja < 8.0 cm), se inocularon dos cubos de micelio en una hoja, mientras que cuatro cubos de micelio se inocularon en las hojas grandes (ancho de hoja ≥ 8.0 cm). Sin embargo, las hojas pequeñas y grandes, diez cubos de micelio y 2 cubos medianos de PDA se inocularon en los árboles jóvenes/ramas. Luego, las hojas inoculadas se envolvieron con cinta protectora de plástico de 6.0-8.0 cm de ancho para fijar los cubos y evitar la pérdida de agua. Las hojas y los cubos se perforaban con agujas para producir sitios hirientes en el centro y los cuatro vértices de los cuadrados. Las hojas inoculadas se cultivaron en el campo/invernadero y se observaron, fotografiaron/escanearon 5-7 días después de la inoculación. Luego, las imágenes se cargaron en el software ImageJ para medir las áreas promedio de las manchas necróticas que se desarrollaron a partir de los sitios de heridas perforadas de cada clon de álamo. Finalmente, se calculó la tasa de incidencia de enfermedad y el índice de enfermedad a partir de las áreas promedio de las manchas necróticas de cada clon de álamo. De acuerdo con el índice de la enfermedad, todos los clones de álamo analizados se dividieron en diferentes grupos de resistencia. Haga clic aquí para ver una versión más grande de esta figura.
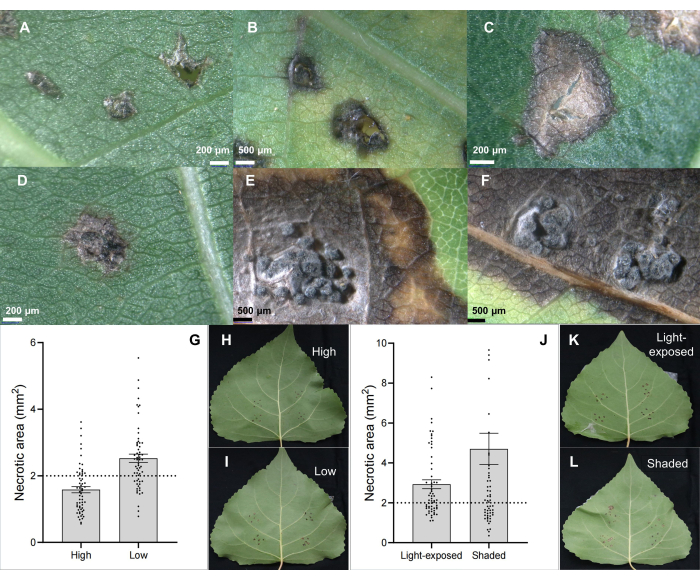
Figura 2: Características clásicas de la lesión foliar en el clon híbrido de álamo B246 infectado por el patógeno del cancro C. chrysosperma mediante inoculación foliar. (A) inoculado por inoculantes PDA; (B,C) manchas necróticas; (D-F) manchas necróticas con estructura de picnidios; Las posiciones (G-I) de la hoja inoculada en el árbol joven/ramas de 1 año influyen en la gravedad de la enfermedad del patógeno del cancro del tallo C. chrysosperma en el cultivar híbrido de álamo "Bofeng 3"; Las condiciones de luz (J-L) influyen en la gravedad de la enfermedad en el cultivar de álamo "Bofeng 3". Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cribado de resistencias y detección de susceptibles. Cribado de resistencia de clones híbridos de álamo (A-C) y detección susceptible de aislados del patógeno Botryosphaeria dothidea en el clon híbrido de álamo (D-F) "Bofeng 3" utilizando el método de inoculación foliar in vivo. Haga clic aquí para ver una versión más grande de esta figura.
| Grado de gravedad | Criterios de calificación | Nivel |
| Ninguna enfermedad | Sin síntomas, área necrótica de 0 a 2,0 mm² | 0 |
| Extremadamente leve | Área necrótica: 2,0–4,0 mm² | 1 |
| Enfermedad leve | Área necrótica: 4,0–6,0 mm² | 2 |
| Enfermedad moderada | Área necrótica 6,0–8,0 mm² | 3 |
| Enfermedad moderadamente grave | Área necrótica: 8,0–10,0 mm² | 4 |
| Enfermedad grave | Área necrótica superior a 10,0 mm² | 5 |
Tabla 1: Grado de gravedad de los síntomas necróticos inducidos por patógenos del cancro en las hojas.
Discusión
Este protocolo proporciona un método de inoculación rápido y eficiente para los patógenos de resistencia al cancro del álamo, que es adecuado para los campos de investigación que requieren el cribado de resistencia a enfermedades a gran escala, como el mejoramiento híbrido de la resistencia al cancro del álamo y el cribado de patogenicidad de los patógenos del cancro del tallo.
El primer punto clave del método es evaluar la resistencia a las enfermedades mediante la inoculación de hojas recién maduras en lugar de tallos/ramas maduras. Como resultado, la selección de clones de resistencia a la enfermedad del cancro del tallo se puede realizar en 1-2 años de la cría del híbrido de álamo cuando se utiliza el método de inoculación de hojas, en comparación con el cribado de resistencia que requiere mucho tiempo en la vía de inoculación del tallo (5-7 años después de la cría), el método de la hoja acorta drásticamente el ciclo de reproducción de la enfermedad del cancro del tallo del álamo. El segundo paso crucial del método de las hojas es la selección de las hojas. La resistencia a enfermedades de las hojas varía con su ontogenia (edades o posición en las ramas), denominada resistencia a la ontogenia foliar asociada a la etapa foliar12,13. Por lo tanto, la correlación de la resistencia de la planta entre las hojas probadas y el tallo/rama es crucial para la eficacia del método de inoculación de hojas. La resistencia a la mancha foliar en las "cinco hojas medias" no está relacionada con la resistencia al cancro del tallo en la interacción híbrida álamo-Septoria 13; sin embargo, el estudio de Wei et al.14 y nuestra investigación ilustraron que la resistencia a las manchas foliares en las hojas superiores recién maduras o en las hojas superiores 5-7son consistentes con la resistencia al cancro del tallo en las interacciones de Malus-V. ceratosperma y álamos-C. chrysosperma. Por lo tanto, el método de inoculación de hojas in vivo se puede utilizar en la cría de álamos del tallo, y las 5-7 hojas superiores son materiales de inoculación disponibles. El tercer punto clave de este método es la producción de suficientes sitios de herida (se recomiendan 30 sitios y 50 sitios en este protocolo) a través de la perforación repetida con aguja después de la inoculación del patógeno, teóricamente, qué sitios de herida se convertirán en 50 puntos necróticos independientes en tres hojas de álamo, lo que proporciona una evaluación más precisa de la resistencia a la enfermedad del cancro en la progenie del álamo. Además, la preservación de la humedad y la selección de las condiciones de luz15 en las hojas son beneficiosas para adquirir una evaluación de resistencia más estable y precisa a las enfermedades del cancro del tallo del álamo.
En este protocolo, se utilizaron como materiales de inoculación tanto plantones de álamo de 1 año (cultivados > 3 meses) como ramas de 1 año (cultivadas > 2 meses) de álamos perennes. Los árboles jóvenes de álamo son ideales para la detección de resistencia a enfermedades porque son más consistentes y fáciles de operar. Por el contrario, la selección de ramas u hojas de álamo (que deben estar libres de plagas, enfermedades y daños mecánicos y tener las mismas condiciones ambientales, como iluminación o sombra) es un desafío.
En comparación con el método tradicional de inoculación del tallo in vitro , el método de inoculación in vivo de la hoja mejora drásticamente la reproducción de la resistencia al cancro del álamo en muchos aspectos: 1) proporciona un método factible de detección de resistencia a enfermedades para el mejoramiento híbrido de las enfermedades del cancro del tallo del álamo. Según nuestra experiencia, un equipo de 3 personas puede realizar la inoculación fúngica de más de 200 clones híbridos de álamo en 1 día y luego obtener los resultados después de 5-7 días. Así, los criadores pueden cribar la resistencia a enfermedades de una gran población híbrida (por ejemplo, 1.000 genotipos) en un corto periodo de tiempo (por ejemplo, 1 mes) mediante la colaboración de 3-6 personas. 2) El método de inoculación de hojas adelanta significativamente el tiempo de la primera selección para los clones resistentes al cancro (de 5-7 años a 1-2 años después de la cría), lo que beneficia la selección temprana y la selección de clones resistentes al cancro del tallo. 3) Utilizando el método de inoculación de hojas, los investigadores pueden revelar en profundidad la estructura y diversidad de resistencia de toda la progenie híbrida y obtener clones de resistencia candidatos para la producción o la cría. 4) Además, combinado con la tecnología de secuenciación de alto rendimiento, el método de inoculación de hojas beneficia la extracción de genes relacionados con la resistencia y módulos genéticos4y puede utilizarse en la mejora genética de resistencia a enfermedades del álamo basada en la tecnología de selección genómica (GS)4. Finalmente, para la producción continua de las 5-7hojas superiores durante la temporada de crecimiento del álamo, los criadores pueden evaluar la resistencia del álamo a diferentes cepas de patógenos o patógenos de diferentes enfermedades; luego, el método de inoculación de hojas también proporciona una vía factible para el mejoramiento multiproyectivo de álamo, por ejemplo, obtener clones híbridos que resistan simultáneamente las enfermedades del cancro de C. chrysosperma y B. dothidea . Sin embargo, cabe señalar que el método de inoculación de hojas se desarrolló a partir del cribado de la resistencia al cancro en una progenie híbrida de álamo relativamente pequeña (48 genotipos). Luego, como estrategia crítica para el mejoramiento de la resistencia al cancro del álamo, la efectividad de este método aún necesita una validación más sólida de una población más grande de híbridos de álamo o plantaciones de álamo cultivadas.
Este protocolo contribuirá al desarrollo de la cría de híbridos de enfermedades del cancro del álamo (por ejemplo, enfermedades de Cytospora, Botryosphaeria y Septoria ), proporcionando clones híbridos de álamo resistentes en la forestación de álamos en China y América del Norte. Además, este protocolo contribuirá a nuestra comprensión de la patogenicidad de las enfermedades del cancro del tallo, facilitará los ensayos genéticos y la minería de genes, y mejorará el desarrollo de la mejora molecular del álamo. Además, el método de inoculación de hojas también implica un método de evaluación preciso y estable para detectar la susceptibilidad de los patógenos del cancro y determinar los genes relacionados con la patogenicidad de los hongos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue financiada conjuntamente por el Fondo de Investigación Basal de la Institución Científica Central de Interés Público del Laboratorio Estatal Clave de Genética y Mejoramiento de Árboles (subvención número CAFYBB2020ZY001-2) y la Fundación Nacional de Ciencias Naturales de China (subvención número 32171776) a Jiaping Zhao.
Materiales
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
Referencias
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados