Method Article
体内叶接种:评估杂交无性系在杨树育种茎溃疡病中的抗病性的替代方法
* 这些作者具有相同的贡献
摘要
我们提供了一个分步方案,用于使用 体内 叶接种方法评估杨树对茎溃疡病病原体的抗性。该方法特别适用于我国杨树育种后代中 Cytospora chrysosperma 和 Botryosphaeria dothidea 溃疡病抗性的大规模评估。
摘要
由病原体 Cytospora chrysosperma (Pers.) Fr.) 和 Botryosphaeria dothidea (Moug. ex Fr.) Ces. 引起的茎溃疡病。& De Not. 是中国杨树种植园的两种主要森林病害,有时可以破坏所有的杨树幼苗或严重损害成熟的杨树林。杂交育种是控制和管理树木病害的最直接、最有效的方法。然而,基于 体外 茎接种评估抗病性或选择抗病性系效率低、耗时且成本高,限制了杨树茎溃疡病杂交育种的发展。在这项研究中,我们提出了一种替代方法,通过 体内 接种来评估对茎溃疡病病原体的抗病性。该方法使用的测试材料可以在 1 年生的杨树树苗或温室或田间多年生杨树的一年生枝条上。这种替代方法的关键步骤是接种叶子的选择:第 5-7片 新成熟的叶子可能是最合适的。叶片接种法的第二个关键步骤是通过针刺在植物叶片上留下伤口,提供足够的病变来测量疾病的严重程度。对于杨树育种早期产生的足够数量的叶片,这种 体内 叶接种有助于快速、准确和大规模地筛选抗病杨树无性系以阻止溃疡病病原体。此外,这种叶接种方法也将作为筛选茎溃疡病病原体 C. chrysosperma、 B.dothidea 或其他杨树茎溃疡病病原体病型的有效方法。
引言
杨树茎溃疡病,主要由两种坏死营养病原体引起,即 Cytospora chrysosperma (Pers.) Fr. 和 Botryosphaeria dothidea (Moug. ex Fr.) Ces.严重威胁到中国东北、北方和西北(三北)杨树种植园的发展和生存。杂交育种是控制和管理树木病害的最直接、最有效的方法;然而,与高产、速生或其他杨树杂交无性系的育种进展相比,杨树溃疡病的抗性育种研究很少。仅报道了有限的抗病杂交育种研究 1,2,3,并且在杨树造林中没有培养出抗溃疡病杂交无性系。
常规杂交育种的关键步骤是基于杂交后代的表型获取进行克隆选择。然而,获取病理表型 (pathotypes) 是一个耗时、费力、累人、昂贵且依赖专家的过程。对于木本植物来说,由于其生命周期长、生长缓慢和体型庞大,导致耗时、耗力和耗经济的性质更具挑战性。例如,在杨树中,杂交后代的溃疡病抗性筛选是在杂交后 5-7 年通过常规体外茎接种方法进行的 1,2,3。此外,受这种低效率和高消耗的抗病筛选方法的限制,研究人员从一个小亚群(例如,选定的高产或快速生长的杨树克隆)中重新选择了抗溃疡病的克隆,而不是来自所有杂交后代。因此,使用常规的茎接种方法,无法确定鉴定出真正的抗性克隆,也无法揭示繁殖后代的抗病多样性,从而限制了对抗病相关基因或基因模块的探索。相较于杨树速生/高产育种的快速发展,那些育种程序在育种的前两年就可以通过表型选择甚至基因组选择获得杂交种4,杨树抗溃疡性育种发展缓慢。杂交后代的抗病筛选(或检测)或病原体接种方法已成为杨树溃疡病抗病育种的关键限速步骤。
在该方案中,我们介绍了一种用于杨树茎溃疡病病原体的新型接种方法, 即体内 叶接种法。使用这种方法,我们可以在 5-7 天内快速有效地测试数十种杨树物种(栽培品种或克隆)的抗溃疡病性。验证试验表明, 体内 叶片接种与传统 的体外 茎接种对茎溃疡病抗性检测的抗性检测一致,表明叶片接种法适用于杨树溃疡病的大规模抗性筛选,如茎溃疡病育种中抗性后代的全基因型选择。该方法解决了杨树溃疡病杂交育种中选择抗性后代的病理问题。
研究方案
1. 溃疡病菌菌培养
- 制备用于真菌菌株的马铃薯葡萄糖琼脂(PDA;马铃薯提取 6.0 g,葡萄糖 20.0 g,琼脂 20.0 g)培养基;将上述材料溶于高达 1000 mL 的水中,在 100 °C 下完全溶解培养基 10 分钟。
- 将 PDA 培养基倒入 25 mL 试管中(每管含 15.0 mL);将所有试管在 121.1 °C 下消毒 30 分钟。将培养基倒入培养板(直径 9.0 cm)中,并在室温 (RT) 下冷却板。
- 将真菌病原体的菌丝体切成~0.5 cm的方形立方体,该菌丝体在PDA培养基中于28°C培养7天;接种 PDA 板中心的真菌立方体(菌丝体侧面面向培养基)。
- 将真菌病原体在恒温培养箱(28°C,避光)中培养 7-10 天。
- 将含有真菌菌丝体的 PDA 培养基切成方形立方体(边长 1.0-1.2 厘米)。
2. 杨树材料的制备
- 对于 1 年生的杨树无性系(> 3 个月栽培),选择主枝新成熟、完全伸展的叶子(总是第 5-7片 叶子,从树苗/树枝的顶部开始)作为接种材料,确保它们没有病虫害和机械损伤。
- 对于多年生杨树杂交无性系的 1 年生枝条(培养 2 个月>),选择所选枝条的前 5-7片 叶作为接种材料。确保叶子健康,并在所有测试的杨树克隆中具有相同的光照条件(阴影或光线)。
3. 接种叶的预处理
- 用清水喷洒杨树叶,干燥后,在接种操作前 1 小时或 1 天用 75% 酒精擦拭选定的叶子。
4. 体内 叶接种
- 对于小叶子(叶宽< 8.0 厘米),将两个方形真菌菌丝体立方体和 PDA(或水琼脂,WA)立方体(边长 1.0-1.2 厘米)接种到杨树无性系顶部 5-7 片叶子的上表面;菌丝体面向叶子。确保接种部位位于半叶的中心,与中央静脉相距 ~1-2 厘米,避免遮挡次生静脉。每个克隆在 6 片叶子上接种 12 个位点(10 个位点用于菌丝体,2 个位点用于 PDA 接种)。
- 对于大叶子(叶宽≥ 8.0 厘米),将四个方形真菌菌丝体立方体和 PDA(或 WA)立方体接种到顶部 5-7 片杨树叶上。每个克隆在 3 片叶子上接种 12 个位点(10 个位点用于菌丝体,2 个位点用于 PDA 接种。
- 用透明胶带(6.0 厘米宽)包裹接种的叶子,轻轻按压以使其粘附在叶子上,防止菌丝体(或 PDA)立方体在实验过程中移动和失水。
- 在五个位置刺穿叶子和菌丝体(或 PDA)立方体,直到针从杨树叶的上表面到下表面穿透立方体。一个站点位于中心,其他四个位于立方体的四个顶点附近 1-2 毫米处。
注意:建议 3 人团队合作进行真菌接种操作。通过团队合作,可以在 4 小时内对杨树杂交种群 (>100 个基因型) 进行接种操作。穿刺操作是在所有测试的叶子接种和包裹后进行,以减轻不同穿刺时间对疾病严重程度的影响。 - 检查菌丝体接种剂的位置偏移和失水情况,并从叶子下表面观察穿孔伤口部位周围坏死病变的发生,直到接种第3 天。
- 在接种后 3 天内,观察菌丝体立方体的位置偏移和水分流失。定义并标记移动和干燥的菌丝体立方体为无效接种,并将其从病理型的最终鉴定中丢弃,同时将其他立方体定义为有效接种。
注意:该协议将具有五个以上有效接种立方体的受试杨树克隆定义为无效接种克隆;因此,每个杨树无性系至少提供 30 个有效接种位点,这些位点将发育成 30 个独立的坏死点。
- 在接种后 3 天内,观察菌丝体立方体的位置偏移和水分流失。定义并标记移动和干燥的菌丝体立方体为无效接种,并将其从病理型的最终鉴定中丢弃,同时将其他立方体定义为有效接种。
- 在实验结束时(接种后~5-7天)摘下所有接种的叶子,将它们装在塑料样品袋中带回实验室,并储存在4°C。
5. 实验室叶片病型采集和杨树对茎溃疡病抗性的评估
- 小心地从叶子上去除透明胶带和菌丝体(或 PDA)接种剂。
- 观察和鉴定每个杨树克隆的叶子病型,包括坏死斑点的形状和颜色,可能包括在穿孔部位周围叶子表面形成的真菌菌丝状结构、pycnidia 和 conidia。
- 使用相机拍摄叶子(使用额外的标尺),或使用扫描仪扫描叶子(使用额外的尺子)以获得分辨率超过 300 dpi 的图像,然后将图像存储为 JPEG、TIFF 或 PNG 格式。
6. 疾病发生的识别和统计分析
- 在ImageJ 1.54g(http://imagj.org)软件中打开病叶的图像。
- 根据叶图像中的标尺设置比例。
- 使用棒状(描摹)工具识别和测量病变。
- 测量完所有坏死点的面积后,将面积值记录并导出为电子表格。
- 设定疾病确定标准:
- 如果菌丝体立方体覆盖的穿刺部位周围的病变面积明显大于 PDA 立方体覆盖的病变面积,则将这些部位定义为疾病部位。
- 如果与 PDA 覆盖的部位相比,菌丝体立方体覆盖的穿刺部位的形态特征发生显着变化,包括病变的颜色,产生菌丝样结构、pycnidia 和 conidia,则该部位也定义为疾病部位。
- 计算每个杨树杂交克隆的有效 PDA 病变点的平均面积。根据平均面积,将一个杨树无性系的所有菌丝接种点分为两类:起始和非起始。然后,计算受试杨树无性系的病害发病率(公式 1:病害发病率 (%) = 病刺点数/有效点刺点总数× 100)。
- 计算叶子中病斑的平均面积 (n = 50)。根据供试杨树无性系叶片病斑平均面积值,设定 5 级病害分级标准。
- 根据上述病害分级标准(公式2:病害指数=∑(各级别点刺点数×各级严重程度值)/(最高严重程度值×有效点刺点总数)×100)计算每个杨树无性系的病害指数(公式2)。
- 使用任何适当的数据分析软件,使用 Shapiro-Wilk 测试验证杨树克隆数量在不同抗性水平上的正态分布。
- 根据疾病指数,将所有测试的杨树无性系确定为五组(或七组):极高抗性 (VHR)、高抗性 (HR)、抗性 (R)、无抗性和无敏感性 (NRNS)、易感性 (S)、高敏感性 (HS) 和极高敏感性 (VHS) 组5。
结果
在该协议中,示意图工作流程是在 48 个被茎溃疡病病原体 C. chrysosperma 感染的杨树杂交克隆中进行的(图 1)。杨树杂交无性系是 P. deltoides 杂交后代的一部分,在北京中国林业科学研究院 (CAF) 的苗圃中培养。
茎溃疡病病原体 C. chrysosperma 分离株 CZC 是一种典型的真菌菌株(具有中等致病性),用于杨树溃疡病的生理研究 6,7,8,9,并存放在我们的实验室。结果表明,接种茎溃疡病菌 C. chrysosperma 诱导了坏死病变(图 2B、C),甚至在杨树叶上诱导了类似刺虫的结构(图 2D-F)。此外,结果还表明,叶子的位置(或叶龄和叶子个体发育)(图 2G-I)和叶子的光照条件(图 2J-L)会影响接种茎溃疡病病原体 C. chrysosperma 分离株 CZC 的叶子的疾病严重程度。
真菌接种剂的致病性是未知杂交种群抗性筛选的关键因素。然而,关于育种中毒力菌株的选择,存在两种相反的观点:使用毒性最强的菌株10 和中等毒性菌株11。在该方案的初步实验中,我们从杂交杨树“博丰 3 号”的 10 种真菌分离株的致病性检测中选择 C. chrysosperma 分离 CZC。令人鼓舞的是,结果表明,在 48 个杨树杂交无性系中,杨树无性系在不同抗性水平上的分布是正常的,SPSS 中的 Shapiro-Wilk 检验分析证实了这一点,表明该分离株最有利于当前杨树杂交种群的抗性筛选。48 个杨树无性系的抗性筛选的部分结果如图 3A-C 所示。此外,结果表明,6 个病原菌 B. dothidea 分离株与杂交杨树“博丰 3 号”具有不同的毒力,分离株 SD47 和 SD60 是受试真菌菌株中毒性最强的分离株(图 3D-F),表明叶接种法也用于杨树茎溃疡病病原体的毒力筛选。
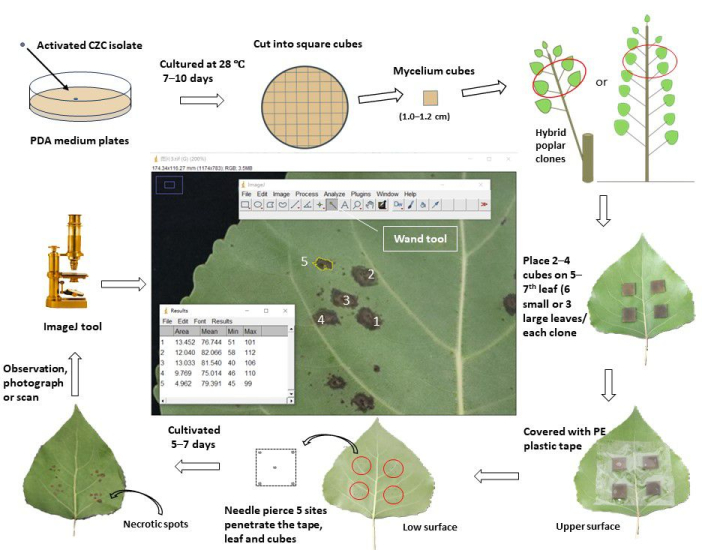
图 1:通过在杨树克隆中体内接种叶片来评估茎溃疡病抗性的示意图。将活化的茎溃疡病病原体 Cytospora chrysosperma 分离株 CZC 在 PDA 平板中于 28 °C 黑暗中培养 10 天。然后,将 C. chrysosperma 菌丝体切成方方立方体(边长 1.0-1.2 cm),接种于 1 年生杨树苗或 1 年生杨树上分枝的 1 年生杨树顶部第 5-7叶的上表面。菌丝体立方体的菌丝面面向叶子。对于小叶 (叶宽 < 8.0 cm),将 2 个菌丝体立方体接种到一片叶子上,而 4 个菌丝体立方体接种在大叶 (叶宽 ≥ 8.0 cm) 上。然而,小叶和大叶、10 个菌丝体立方体和 2 个 PDA 培养基立方体接种在树苗/树枝上。然后,用 6.0-8.0 cm 宽的塑料保护带包裹接种的叶子,以固定立方体并防止它们失水。用针刺穿叶子和立方体,在正方形的中心和四个顶点产生伤口部位。接种的叶子在田间/温室中培养,并在接种后 5-7 天观察、拍照/扫描。然后,将图像加载到 ImageJ 软件中,以测量从每个杨树克隆的刺穿伤口部位发展而来的坏死点的平均面积。最后,根据每个杨树无性系坏死斑点的平均面积计算病害发病率和病害指数。根据病害指数,将所有供试杨树无性系分为不同的抗性组。请单击此处查看此图的较大版本。
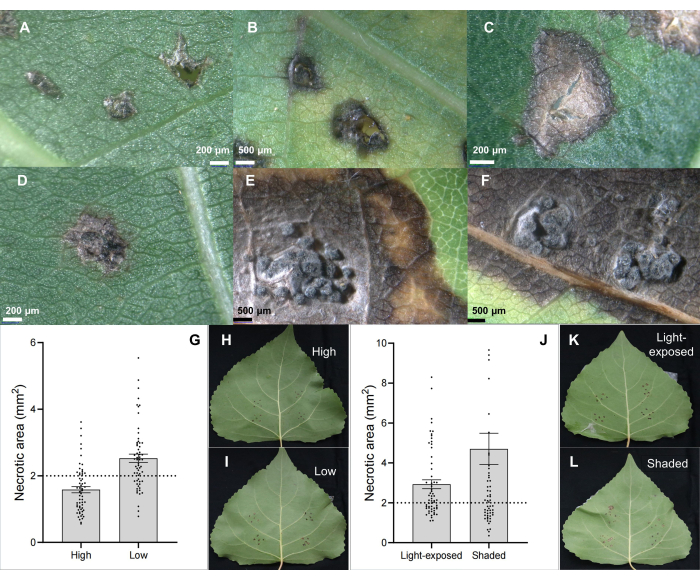
图 2:通过叶片接种感染溃疡病原菌 C. chrysosperma 的杂交杨树克隆 B246 的经典叶片病变特征。(A) 用 PDA 接种剂接种;(B,C) 坏死点;(D-F) 坏死斑点,具有 pycnidia 结构;(G-I) 接种叶片在 1 年生幼苗/树枝中的位置影响杂交杨树品种 “博风 3 号” 上茎溃疡病病原体 C. chrysosperma 的病害严重程度;(J-L) 光照条件影响杨树品种 “Bofeng 3” 的病害严重程度。请单击此处查看此图的较大版本。

图 3:耐药性筛选和易感检测。使用体内叶接种法对 (A-C) 杂交杨树克隆进行抗性筛选和 (D-F) 杂交杨树克隆“博丰 3 号”中病原体 Botryosphaeria dothidea 分离株的敏感检测。请单击此处查看此图的较大版本。
| 严重性等级 | 评分标准 | 水平 |
| 无病 | 无症状,坏死面积 0–2.0 mm² | 0 |
| 极度轻微 | 坏死面积 2.0–4.0 mm² | 1 |
| 轻度疾病 | 坏死面积 4.0–6.0 mm² | 2 |
| 中度疾病 | 坏死面积 6.0–8.0 mm² | 3 |
| 中重度疾病 | 坏死面积 8.0–10.0 mm² | 4 |
| 重症 | 坏死面积大于 10.0 mm² | 5 |
表 1:叶片上溃疡病菌诱导的坏死症状的严重程度分级。
讨论
该方案为杨树溃疡病抗性病原体提供了一种快速有效的接种方法,适用于需要大规模抗病性筛选的研究领域,如杨树溃疡病抗性杂交育种和茎溃疡病病原体的致病性筛选。
该方法的第一个关键点是通过新成熟的叶子接种而不是成熟的茎/枝来评估抗病性。因此,采用叶接种法在杨树杂交育种的 1-2 年内可以进行茎溃疡病抗病性系的选择,与茎接种途径中耗时的抗性筛选相比(育种后 5-7 年),叶法大大缩短了杨树茎溃疡病的繁殖周期。叶子法的第二个关键步骤是叶子的选择。叶子的抗病性随其个体发育(年龄或在枝条上的位置)而变化,称为叶阶段相关抗性的叶片个体发育抗性12,13。因此,受试叶子与茎/枝之间的植物抗性相关性对于叶子接种方法的有效性至关重要。“五片中间叶”上的叶斑病抗性与杂交杨树-Septoria 相互作用中的茎溃疡抗性无关13;然而,Wei 等人的研究14 和我们的研究表明,顶部新成熟叶或顶部 5-7层叶的叶斑病抗性与 Malus-V. ceratosperma 和 Poplars-C. chrysosperma 相互作用中的茎溃疡抗性一致。因此,体内叶接种法可用于茎的杨树育种,前 5-7 片叶为可用接种材料。该方法的第三个关键点是在病原体接种后通过反复穿刺产生足够的伤点(推荐 30 个位点,本方案中推荐 50 个位点),理论上,这些伤点将在三片杨树叶上发展成 50 个独立的坏死点,提供更准确的评估杨树后代对口腔溃疡病的抵抗力。此外,叶子中水分的保存和光照条件的选择15 有利于获得对杨树茎溃疡病更稳定和准确的抗性评估。
在该方案中,多年生杨树的 1 年生杨树苗 (> 3 个月栽培) 和 1 年生树枝 (> 2 个月栽培) 均用作接种材料。杨树苗是抗病性筛查的理想选择,因为它们更一致且更易于操作。相反,选择杨树的枝条或叶子(应该没有病虫害和机械损伤,并具有相同的环境条件,如光照或阴影)是具有挑战性的。
与传统的 体外 茎接种法相比, 体内 叶接种法在许多方面显著提高了杨树抗溃疡病育种:1)为杨树茎溃疡病杂交育种提供了一种可行的抗病筛选方法。根据我们的经验,一个 3 人团队可以在 1 天内对 200 多个杨树杂交克隆进行真菌接种,然后在 5-7 天后获得结果。因此,育种者可以通过 3-6 人的合作,在短时间内(例如 1,000 个基因型)筛选大型杂交种群(例如,1,6 个基因型)的抗病性。2) 叶片接种法显著提前了抗溃疡病性系的首次选择时间(从育种后 5-7 年到育种后 1-2 年),有利于抗性系的早期选择和树苗选择。3) 利用叶片接种法,研究人员可以深入揭示所有杂交后代的抗性结构和多样性,并获得用于生产或育种的候选抗性克隆。4) 此外,结合高通量测序技术,叶片接种法有利于抗性相关基因和基因模块的挖掘4,可用于基于基因组选择 (GS) 技术的杨树抗病育种4。最后,对于杨树生长季顶部 5-7叶 的持续生产,育种者可以筛选杨树对不同病原菌或不同病原菌的抗性;然后,叶片接种方法也为杨树的多投影育种提供了可行的途径,例如,获得同时抵抗 C. chrysosperma 和 B. dothidea 溃疡病的杂交无性系。然而,应该注意的是,叶片接种方法是从相对较小的杂交杨树后代(48 种基因型)的溃疡病抗性筛选中发展而来的。然后,作为杨树溃疡病抗性育种的关键策略,该方法的有效性仍然需要来自更多的杨树杂交种或栽培杨树人工林的更有力的验证。
该方案将有助于开发杨树溃疡病(例如, Cytospora、Botryosphaeria 和 Septoria 病)杂交育种,在中国和北美的杨树造林中提供抗性杨树杂交克隆。此外,该方案将有助于我们了解茎溃疡病的致病性,促进基因测定和基因挖掘,并促进杨树分子育种的发展。此外,叶片接种法还意味着一种准确、稳定的评价方法,用于筛选溃疡病原菌的易感性和确定真菌致病性相关基因。
披露声明
作者没有什么可披露的。
致谢
本研究由树木遗传育种国家重点实验室中央公益性科研机构基础研究基金(资助号 CAFYBB2020ZY001-2)和国家自然科学基金(资助号 32171776)联合资助给赵佳平。
材料
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Biosharp | BS-QT-027B | |
| C. chrysosperma isolate | China Forestry Culture Collection Center | CFCC86775 | Separation and preservation by our laboratory |
| Cytospora chrysosperma | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | NCBI accession number: MK994101 for rRNA-ITS and MN025273 for EF1α gene CGMCC number:40575 | Separation and preservation by our laboratory |
| Epson Perfection V370 Photo | Epson | V370 | Scanner; Scan the leaves into image |
| PDA (Potato Dextrose Agar) | Solarbio | P8931 | Provide nutrition for fungal growth |
| PE plastic film | To fix fungi on the leaves | ||
| Populus alba var. Pyramidalis | Plant Physiology Laboratory, Institute of Forestry New Technology, Chinese Academy of Forestry | Cultivated by our laboratory | |
| SPSS | IBM | Data analysis software | |
| Thermostatic incubator | Shanghai Kuntian Laboratory Instrument Co., Ltd | KTD-6000 | Provide an environment for fungal growth |
| Tough TG-6 camera | OLYMPUS | To take photos of diseased leaves |
参考文献
- Du, K., et al. Genetic analysis and seedling selection of the poplar progenies of Aigeiros section. Journal of Huazhong Agricultural University. 28 (5), 624-630 (2009).
- Shi, Y. . Identification of canker resistance to selection poplar clones [Master's thesis]. , (2014).
- Zhang, L., Zhang, H., Ou, D., Fan, J. Investigation on the resistance to canker of some new leuce hybrids inoculated with Botryosphaeria dothidea. Journal of Northwest Forestry University. 32 (6), 210-213 (2017).
- Du, C., et al. Genomic selection of seedling growth traits in a poplar hybrid population. For Res. 36 (6), 11-19 (2023).
- Li, Z., et al. A rapid and efficient in vivo inoculation method for introducing tree stem canker pathogens onto leaves: Suitable for large-scale assessment of resistance in poplar breeding progeny. BioRxiv. , (2024).
- Li, P., et al. Fungal canker pathogens trigger carbon starvation by inhibiting carbon metabolism in poplar stems. Sci Rep. 9 (1), 10111 (2019).
- Xing, J., et al. Fungal pathogens of canker disease trigger canopy dieback in poplar saplings by inducing functional failure of the phloem and cambium and carbon starvation in the xylem. Physiol Mol Plant Pathol. 112, 101523 (2020).
- Xing, J., et al. Comparisons of photosynthetic response and characteristics in leaves of Populus alba var. pyramidalis Infected by the stem canker pathogen Valsa sodida and Botryosphaeria dothidea at early stage. Scientia Silvae Sinicae. 57 (09), 121-129 (2021).
- Li, J., et al. Effects of Valsa sordida infection on photosynthetic characteristics and carbon-water metabolism in Populus alba var. pyramidalis. For Res. 34 (05), 58-68 (2021).
- Balendres, M. A., De Torres, R., Dela Cueva, F. Culture storage age and fungal re-isolation from host-tissue influence Colletotrichum spp. virulence to pepper fruits. J Phytopathol. 167 (9), 510-515 (2019).
- Ward, K. T., Ostry, M. E. Variation in Septoria musiva and implications for disease resistance screening of poplars. Plant Dis. 89 (10), 1077-1082 (2005).
- Asalf, B., et al. Ontogenic resistance of leaves and fruit, and how leaf folding influences the distribution of powdery mildew on strawberry plants colonized by Podosphaera aphanis. Phytopathology. 104 (9), 954-963 (2014).
- Dunnell, K. L., Le Boldus, J. M. The correlation between Septoria leaf spot and stem canker resistance in hybrid poplar. Plant Dis. 101 (3), 464-469 (2017).
- Wei, J., Huang, L., Gao, Z., Ke, X., Kang, Z. Laboratory evaluation methods of apple Valsa canker disease caused by Valsa ceratosperma sensu Kobayashi. Acta Phytopathol Sinica. 40 (1), 14-20 (2010).
- Shen, W., et al. Comparative study on the effectiveness of three inoculation methods for Valsa sordida in Populus alba var. pyramidalis. Biology. 13 (4), 251 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。