Method Article
Fetal ve Yetişkin Nöral Kök Hücre Türevi Oligodendrosit Öncül Hücre Kültürlerinin Yüksek İçerik tarama farklılaşması ve olgunlaşma analizi
Bu Makalede
Özet
Olgun oligodendrositlere dönüşen fetal veya yetişkin nöral kök hücrelerden elde edilen astrositlerin ve oligodendrosit öncül hücrelerin karma kültürlerinin üretimini ve zararlı uyaranların in vitro modellemesini anlatıyoruz. Hücre tabanlı yüksek içerikli tarama tekniği ile bağlantı, güvenilir ve sağlam bir ilaç tarama sistemi oluşturur.
Özet
Karmaşık hastalıklarda terapötik stratejilerin etkinliğini değerlendirmek için ilaç tarama tekniklerinin geliştirilmesindeki temel engel, in vitro basitleştirme ve karmaşık in vivo ortamını yeniden oluşturma ile tüm tarama stratejileri tarafından paylaşılan, sağlam ve güvenilir veriler elde etme, in vivo çeviri için son derece tahmine dayalı ana amaç arasında bir denge oluşturmaktır.
Demyelinize edici hastalıklar alanında, ilaç tarama stratejilerinin çoğu, yenidoğan hayvanlardan izole edilmiş primer oligodendrosit öncül hücrelerinin (OPC) ölümsüzleştirilmiş hücre hatlarına veya saf kültürlerine dayanmaktadır ve yaşa bağlı farklılıkların olmaması ve herhangi bir gerçek patolojik durum veya karmaşıklık nedeniyle güçlü önyargılara yol açmaktadır.
Burada, demiyelinasyon hastalıklarının tipik patolojik durumlarını taklit etmek için kolayca manipüle edilen nöral kök hücre (NSC) türevi OPC'lerin fizyolojik farklılaşmasını / olgunlaşmasını modellemeyi amaçlayan bir in vitro sistemin kurulumunu gösteriyoruz. Ayrıca, yöntem fetal ve yetişkin beyinlerinden izolasyonu içerir ve Astrositleri de içeren spontan bir ortak kültürde OPC'lerden olgun oligodendrositlere (OL' ler) dinamik olarak farklılaşan bir sistem verir. Bu model fizyolojik olarak tiroid hormon aracılı miyelinasyon ve miyelin onarım sürecine benzer ve hastalık mekanizmalarını model alan patolojik interferanların eklenmesini sağlar. Demiyelinasyon hastalıklarının iki ana bileşenini (yani hipoksi/ iskemi ve inflamasyon), gelişimsel miyelinasyon ve yetişkin miyelin onarımı üzerindeki etkilerini yeniden yaratmayı ve OPC'leri ayırt etmeye odaklanırken sistemin tüm hücre bileşenlerini dikkate almayı gösteriyoruz.
Bu spontan karma model, hücre tabanlı yüksek içerikli tarama teknolojileriyle birleştiğinde, demyelinasyonda yer alan patolojik süreçlerle mücadele etmeyi ve remyelinasyonu teşvik etmeyi amaçlayan terapötik stratejiler için sağlam ve güvenilir bir ilaç tarama sisteminin geliştirilmesini sağlar.
Giriş
Merkezi sinir sisteminde (CNS), miyelin oluşturan hücreler (oligodendrositler, OL'ler) ve öncülleri (oligodendrosit öncül hücreler, OPC'ler) gelişimsel miyelinasyondan, peri ve doğum sonrası dönemlerde meydana gelen bir süreçten ve yetişkinlikte miyelin ciro ve onarımından (remiyelinasyon) sorumludur1. Bu hücreler son derece uzmanlaşmıştır, anatomik ve fonksiyonel olarak diğer tüm glial ve nöronal bileşenlerle etkileşime girer ve bu da onları CNS yapısının ve işlevinin temel bir parçası haline getirir.
Demiyelinerasyon olayları farklı CNS yaralanmaları ve hastalıkları2'de yer almaktadır ve esas olarak hem gelişim hem de yetişkinlik döneminde çok yönlü mekanizmalar yoluyla OPC'ler ve OL'ler üzerinde hareket eder. Farklılaşmamış öncüller, başta tiroid hormonu (TH) olmak üzere farklılaşan faktörler tarafından yönlendirilir, senkronize bir işlem3'te, OPC'nin çoğalmaya, miyelinlenmemiş aksona göçe ve miyelin kılıtını geliştiren olgun OL'lere farklılaşmaya neden olan belirli uyaranları tanımasına ve yanıt vermesine neden olur4. Tüm bu işlemler ince bir şekilde kontrol edilir ve karmaşık bir ortamda gerçekleşir.
Miyelinasyon, remiyelinasyon ve demiyelinasyon olaylarının karmaşık doğası nedeniyle, temel mekanizmaları incelemek ve ana hücresel oynatıcıya odaklanarak yeni terapötik stratejiler geliştirmek için basitleştirilmiş ve güvenilir bir in vitro yönteme büyük ihtiyaç vardır: OPC5.
Bir in vitro sistemin güvenilir olması için bir dizi faktörün dikkate alınması gerekir: hücresel ortamın karmaşıklığı, yaşa bağlı hücre içsel farklılıklar, fizyolojik TH aracılı farklılaşma, patolojik mekanizmalar ve verilerin sağlamlığı6. Gerçekten de, alandaki karşılanmamış ihtiyaç, in vivo durumun karmaşıklığını taklit eden, izole saf OPC kültürlerinin kullanımıyla başarıyla elde edilmeyen bir modeldir. Ek olarak, demiyelinasyon olaylarının iki ana bileşeni olan inflamasyon ve hipoksi/iskemi (HI), aşırı basitleştirilmiş in vitro modellerde çalışılamayan bir yön olan OPC'lerin fizyolojik farklılaşmasını ve olgunlaşmasını dolaylı olarak etkileyebilecek diğer hücre bileşenlerini doğrudan içerir.
Son derece tahmine dayalı bir kültür sisteminden başlayarak, sonraki ve daha genel zorluk sağlam ve güvenilir verilerin üretilmesidir. Bu bağlamda, hücre tabanlı yüksek içerikli tarama (HCS) en uyguntekniktir 7, çünkü amacımız öncelikle tüm kültürü otomatik bir iş akışında analiz etmek, temsili alanlar seçme önyargısını önlemek ve ikincisi görüntüleme tabanlı yüksek içerikli verilerin otomatik ve eşzamanlı neslini eldeetmektir 8.
Temel ihtiyacın in vitro basitleştirme ve in vivo taklit karmaşıklık arasında en iyi dengeyi sağlamak olduğu göz önüne alındığında, burada fetal forebrandan ve yetişkin alt ventrikül bölgesinden (SVZ) izole edilmiş sinirsel kök hücrelerden (NSC' ler) elde edilen OPC'leri elde etmek için oldukça tekrarlanabilir bir yöntem sunuyoruz. Bu in vitro model, çok güçlü NSC'den olgun/miyelinasyon ol'a kadar tüm OPC farklılaşma sürecini fizyolojik TH'ye bağımlı bir şekilde kapsar. Ortaya çıkan kültür, dinamik olarak farklılaşan/olgunlaşan bir sistemdir ve bu da esas olarak nöronların düşük bir yüzdesiyle, farklılaşan OPC'ler ve astrositlerden oluşan spontan bir ortak kültürle sonuçlanır. Bu birincil kültür karmaşık in vivo ortamı daha iyi taklit ederken, kök hücre türetme, istenen hücre soy zenginleştirmesini elde etmek için basit manipülasyonların yapılmasına izin verir.
Hücre hatlarını veya birincil OPC'lerin saf kültürlerini kullanan diğer ilaç tarama stratejilerinin aksine, burada açıklanan yöntem, patolojik interferentlerin veya terapötik moleküllerin karmaşık bir ortamda, istenen hücre tipine odaklanmayı kaybetmeden etkisinin araştırılmasına izin verir. Açıklanan HCS iş akışı, hücre canlılığı ve soy spesifikasyonunun yanı sıra soyuna özgü hücre ölümü ve morfolojik parametrelerin analizine izin sağlar.
Protokol
Burada açıklanan tüm hayvan protokolleri Avrupa Toplum Konseyi Direktiflerine (86/609/EEC) göre gerçekleştirilmiştir ve NIH Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'ndayayınlanan yönergelere uygundur.
1. Çözümler ve reaktifler
- Standart ortamı hazırlayın: DMEM/F12 GlutaMAX 1x; 8 mmol/L HEPES; 100 U/100 μg Penisilin/Streptomisiin (%1 P/S); 1x B27; 1x N-2.
- Nörosfer ortamını hazırlayın: 10 ng/mL bFGF ekleyin; 10 ng/mL EGF'den standart ortama.
- Oligosfer/OPC ortamı hazırlayın: 10 ng/mL bFGF ekleyin; Standart ortama 10 ng/mL PDGF-AA.
- Oligodendroctye farklılaşma ortamını hazırlayın: 50 nM T3 ekleyin; 10 ng/mL CNTF; 1x N-asetil-L-sistein (NAC) standart ortama.
- Enzmatik olmayan ayrışma tamponu hazırlayın: Enzmatik olmayan ayrışma tamponu için %1 P/S ekleyin ve buzları soğuk tutun.
- Sakkaroz çözeltisi hazırlayın: HBSS, 0.3 g/mL sakkaroz.
- BSA yıkama solüsyonu hazırlayın: EBSS, 40 mg/mL BSA, 0.02 mL/l HEPES.
- Enzymatic dissosiyatif tampon hazırlayın: HBSS, 5.4 mg/mL D-glikoz, 15 mmol/L HEPES, 1.33 mg/mL Tripsin, 0.7 mg/mL Hyaluronidaz, 80 U/mL DNase.
- Sitokin karışımı hazırlayın: TGF-β1, TNF-α, IL-1β, IL-6, IL-17 ve IFN-γ (her biri 20 ng/mL).
- Sitokin karışımı aracı hazırlayın: stokun% 0.04'ü (10% gliserol / 100 nM glisin / 25 nM Tris, pH 7.3).
- Oksijen-glukoz yoksunluğu ortamını hazırlayın: DMEM w/o glikoz kullanarak standart ortam. İstenen glikoz yoksunluğu durumunun sıkılığına bağlı olarak, glikozla ilgili bileşiklerden kaçınmak için orta alandan B27 ve/veya N2'yi de çıkarmak mümkündür (örneğin, B27'de D-Galaktoz).
2. Diseksiyon ve NSC yalıtımı
NOT: Fetal ve erişkin NSC'ler, değişikliklerle Ahlenius ve Kokaia protokolü 9'u izleyerek E13.5 fetal forebrain veya2.5 aylık yetişkin alt-ventrikül bölgesinden (SVZ) izole edildi.
- Fetal NSC kültürleri
NOT: Diseksiyonlara başlamadan önce, her biri 150 μL enzmatik olmayan ayrışma tamponu içeren 1,5 mL tüpler hazırlayın; Petri tabaklarını temizleyin ve buz gibi HBSS ekleyin.- Embriyoları zamanlanmış hamile farelerden E13.5 - 14.5'te toplayın ve soğuk HBSS içeren bir Petri kabına yerleştirin.
- Yabanarı kullanarak embriyoların kafasını koparın.
- Embriyoların kafalarını buz gibi soğuk PBS içeren temiz bir Petri kabına yerleştirin ve büyüteç veya stereoskop kullanarak deriyi kafatasından çıkardı.
- Beyin görülüp deriden temizlendikten sonra, yanlaraps ile basınç uygulayarak sıkın.
- Beyincikleri çıkarın, sadece beyinleri tutun ve menenjitleri forsepsle çıkarın.
- İzole edilmiş dokuyu enzmatik olmayan ayrışma tamponuna yerleştirin ve diseksiyon adımlarını diğer embriyolarla tekrarlayın. 2-3 hayvandan gelen dokuyu tamponu içeren her tüpe yerleştirin.
- Sürekli sallanarak 15 dakika boyunca 37 °C'de kuluçkaya yatır.
- Kuluçkadan sonra, 850 μL standart ortam ekleyin ve süspansiyon kümelerden arınana kadar pipetleme yaparak karıştırın.
- Ayrışmayan doku hala görünür durumdaysa, tüpün dibinde birikine kadar RT'de 2 dakika bekleyin.
- Ayrışma tamamlandığında, hücreleri sayın ve hücre yapışıklığından kaçınmak için dikey konumda tutulan 10-30 mL nörosfer ortamı içeren bir T-25 veya T-45 şişesinde 10-50 hücre/μL yoğunluğunda süspansiyona yerleştirin.
-
Yetişkin NSC kültürleri
- Servikal çıkık ile hayvanları kurban edin.
- Buz gibi HBSS içeren 50 mL'lik bir tüpte 4-5 fareden beyin toplayın.
- Beyni soğuk steril bir yüzeye yerleştirin. Bu amaçla, suyla doldurulmuş ve gece boyunca -20 °C'ye yerleştirilmiş bir T-25 şişesi kullanın. Deney anında, şişeyi steril alüminyum folyo ile örtün.
- Beyin ventral tarafını aşağı doğru, rostro-kaudal yönde yerleştirin ve bir jilet kullanarak koku ampullerini çıkarın.
- Jilet kullanarak, korteksten optik chiasma'ya kadar 1 mm kalınlığında 2-3 koronal dilim kesin.
- Dilimleri soğuk yüzeye ventro-dorsal bir konuma yerleştirin ve korpus callosum ve iki lateral ventrikülleri tanımlayın.
- Büyüteç veya stereoskop kullanarak, korpus callosum parçalarını taşımamaya dikkat ederek lateral ventriküllerin duvarlarını izole edin.
- İzole dokuyu enzimamatik ayrışma tamponuna (5-10 mL) koyun ve 37 °C'de 15 dakika kuluçkaya yatırın.
- Çözeltiyi karıştırın, birkaç kez borulayın (en az 50) ve 10 dakika boyunca 37 °C'de tekrar kuluçkaya yatırın.
- 5 mL standart kültür ortamı ekleyerek tripsinleri nötralize edin ve çözeltiyi 70 μm filtre kullanarak filtreleyin.
- Filtrelenmiş çözeltiyi 400 x g'da5 dakika santrifüjleyin.
- Pelezi sakkaroz çözeltisinde ve santrifüjde 500 x g'da 10 dakika boyunca yeniden kullanın.
- Peletin BSA yıkama çözeltisinde ve santrifüjde 400 x g'da 7 dakika boyunca yeniden kullanın.
- Peletin standart kültür ortamında yeniden süzme, hücreleri sayma ve yukarıda açıklandığı gibi kaplama gerçekleştirme (adım 2.1.10).
3. Birincil nörosferler
- Her 2 günde bir büyüme faktörlerini (bFGF/EGF) ekleyin.
- Her 4-6 günde bir (hücre yoğunluğuna bağlı olarak), ortamın yarısını aşağıdaki gibi değiştirin:
- Tüm hücre süspansiyonu 15 veya 50 mL'lik bir tüpe aktarın.
- 400 x g'da5 dakika santrifüj.
- Birimin yarısını çıkarın.
- Aynı miktarda taze ortam ekleyin, pipetleme ile hafifçe karıştırın ve büyüme faktörleri ekleyin.
4. Oligosferler
NOT: Oligodendrosit farklılaşması Chen protokolü10'u takiben değişikliklerle gerçekleştirilir.
- Nörosferler 100-150 μm çapa ulaştığında geçirilmeye hazırdır. Bunu yapmak için, tüm hücre süspansiyonu 15 veya 50 mL tüpe aktarın ve 400 x g'da5 dakika santrifüj yapın.
- Ters iletilen ışık mikroskobu kullanarak kürelerin fotoğraflarını çekerek ve ImageJ yazılımı ile açarak çapı hızla değerlendirin.
- Çözümle menüsünü tıklatın ve Araçlar penceresinde Ölçek çubuğu 'nuseçin.
- Mikron cinsinden Genişlik olarak 150 μm ayarlayın ve ölçek çubuğunu kürelerle karşılaştırın.
- Ters çevrilerek tüm hacmi çıkarın ve peletin 180 μL taze standart kültür ortamında yeniden diriltmesi. Pipet 50 kez kürelerin parçalanmasına izin vermek için.
- 810 μL taze standart kültür ortamı ekleyin, hücreleri sayın ve nörosferler için açıklandığı gibi yeniden plakalayın.
- Her 2 günde bir bFGF/PDGF-AA 10 ng/mL ekleyin.
- Her 4-6 günde bir (hücre yoğunluğuna bağlı olarak), ortamın yarısını aşağıdaki gibi değiştirin:
- Tüm hücre süspansiyonu 15 veya 50 mL'lik bir tüpe aktarın.
- 400 x g'da5 dakika santrifüj.
- Birimin yarısını çıkarın.
- Aynı miktarda taze ortam ekleyin, pipetleme ile hafifçe karıştırın ve büyüme faktörleri ekleyin.
5. Plaka kaplaması
- Poli-D, L-ornit/laminin kaplama: OPC'leri kaplamadan en az 2 gün önce, PBS'de seyreltilmiş 50 μg/mL poli-D, L-ornit çözeltisini her kuyuya (96 kuyu plakası için 40 μL/ kuyu) ekleyin ve bir gecede RT'de kuluçkaya yatın.
- Ertesi gün, sıvıyı çıkarın ve damıtılmış steril su ile üç kez yıkayın.
- Tabakları rt'de bir gecede kurutun. Ertesi gün, PBS'de seyreltilmiş bir laminin çözeltisi ekleyin (5 μg / mL; 96 kuyu plakaları için 40 μL / kuyu) ve 37 ° C'de 2 saat kuluçkaya yatın.
6. Hücre tohumlama
- Oligosferler 100-150 μm çapa ulaştığında, poli-D, L-ornitin / lamine kaplı plakalarda ayrıştırılmaya ve tohum edilmeye hazırdır. Bunu yapmak için, tüm hücre süspansiyonu 15 veya 50 mL tüpe aktarın ve 400 x g'da 5 dakika santrifüj yapın (adım 4.1'de belirtildiği gibi)
- Ters çevrilerek tüm hacmi çıkarın ve peletin 180 μL taze standart kültür ortamında yeniden diriltmesi. Pipet 50 kez kürelerin parçalanmasına izin vermek için.
- 810 μL taze standart kültür ortamı ekleyin ve hücreleri sayın.
- Laminin çözeltisini kuyulardan çıkarın ve hücreleri 3.000 hücre/cm2 yoğunlukta (96 kuyu plakası için 100 μL/kuyu) plakalayın.
7. OPC farklılaşma indüksiyonu
- 3 gün sonra, tüm ortamı çıkarın ve aynı hacimde oligodendrosit farklılaşma ortamını ekleyin.
- Ortamın yarısını her 4 günde bir değiştirin ve her 2 günde bir taze farklılaşma karışımı (T3/CNTF/NAC) ekleyin.
8. İnflamasyon aracılı farklılaşma bloğunun indüksiyonu
- Nörosfer ayrışması ve oligosfer üretiminden sonra (bölüm 4), sitokin karışımını kültür ortamına ekleyin ve tüm küre oluşumu adımı için sitokinlere maruz kalan oligosferleri tutun.
NOT: Hacim hücre sayısına bağlıdır, çünkü hücre oluşturan küreler için 10-50 hücre / μL'de tohumlanır. - Ortamın değiştirilmesi gerekiyorsa, tüm hacmi değiştirin ve sitokin karışımını bir kez daha ekleyin.
9. Oksijen-glukoz yoksunluğu hücre ölümünün indüksiyonu
- -1 DIV'de (çok katlı plakalarda hücre tohumlanından 2 gün sonra), ortamı çıkarın ve yeni bir çok katlı plakada saklayın.
- OGD-medium (OGD grubu) veya taze orta (kontrol grubu) hacminin yarısını (96 kuyu plakası için 50 μL) ekleyin. Yarım hacim, sıvı ve hava arasındaki oksijen alışverişini azaltmak için kullanılır.
- OGD grup kültürlerini% 95 N 2 ve% 5 CO2 ile doymuş hava geçirmez bir hipoksi odasınayerleştirin. Haznenin doygunluğunu elde etmek için, oda borularını kapatmadan önce gaz karışımının 25 l / dak'ta 6 dakika akmasına izin verin.
- Hipoksik odayı inkübatörde 3 saat kuluçkaya yatırın. 9.1. adımda çıkarılan ve muhafaza edilen ortamı içeren kontrol grubu ve plakalar da inkübatörde bırakılmalıdır.
- Glikozsuz (OGD grubu) veya yeni ortamı (kontrol grubu) çıkarın ve 9.1.
10. İmmünosyatokinoloji
- İstenilen zaman noktasında, rt'de 20 dakika boyunca soğuk% 4 paraformaldehit ile hücreleri sabitleyin.
- PBS ile iki kez yıkayın (RT'deki her yıkama için 10 dakika kuluçka).
- Engelleme çözümü ile RT'de 1 saat kuluçkaya yatırın (PBS Triton% 0.3% 1 BSA ve% 1 eşek / keçi normal serum içerir).
- PBStriton%0.3oranında seyreltilmiş primer antikor karışımı ( Tablo 1) ile kuluçkaya yatırın, bir gecede 4 °C'de.
- PBS ile iki kez yıkayın (RT'deki her yıkama için 10 dakika kuluçka).
- PBS tritonunda seyreltilmiş ikincil antikor (Tablo 1) çözeltisi ile inkübte edin% 0.3 hoechst 33258 ekleyerek 37 °C'de 30 dakika.
- PBS ile iki kez yıkayın (RT'deki her yıkama için 10 dakika kuluçka).
11. Hücre canlılığının, soy bileşiminin ve soyuna özgü hücre ölümünün HCS analizi
NOT: HCS temsili görüntüleri ve iş akışı Şekil 2A,B'de gösterilmiştir.
- Yazılımın ana menüsünden Bölümlere Ayırıcı Analiz algoritmasını seçin (HCS Studio v 6.6.0) ve Ana menüden Test /Tarama Plakası Geliştir 'iseçin.
- iDev penceresinde, Yeni'yi seçin ve ardından Test Geliştir şablonundan Genel yoğunluk Ölçüm Aracı'nı seçin.
- 10x hedefini seçerek menünün sağ tarafındaki Oluştur'a tıklayın.
- Bu, Devralmayı Yapılandır menüsünü açar. Bu pencerede aşağıdaki parametreleri seçin: (a) kanal sayısı: Hoechst nükleer boyama (BGRFR_386) için ilk ve reaksiyonda kullanılan her soylara özgü işaretleyici için bir tane (b) kanal 1'deki yazılım odağını ve otomatik odaklama aralığını 1 (c) olarak seçin.
- Edinme menüsünden, farklı kuyulardaki ve farklı alanlardaki boyamanın kalitesine bakın ve menüde Sabit Pozlama Süresi'ni seçerek pozlama süresini manuel olarak seçin.
- Alma parametreleri ayarlandıktan sonra, menünün üst kısmında Mini Tarama'yı seçin ve deneysel durum başına iki kuyuda kuyu başına on alan seçin. Bu, tüm plaka için bir alan alt kümesindeki tüm analiz parametresinin kurulmasına izin verir.
- Mini tarama tamamlandığında, çözümleme algoritmasını yapılandırmak için Tahlil Parametresini Yapılandır'ı tıklatın.
- Pencerenin sağ tarafındaki Grupları Yapılandır'a tıklayın ve mini taramanın kuyularını sürükleyip bırakın. Farklı grupları yapılandırmak için Gruplar alt bölümündeki Ekle düğmesini tıklatın.
- Tüm algoritmayı geliştirmek için pencerenin sol tarafındaki iş akışını adım adım izleyin. Önce her kanal için Görüntüyü İşle'yi seçin ve Arka Plan Kaldırma'ya ve istediğiniz seviyeye tıklayın.
- Önce çekirdekleri nükleer lekeleme ile tanımlayın ve seçin. Gerçek çekirdeği seçmek ve yapıt ve döküntüleri analiz etmekten kaçınmak için Birincil Nesneyi Tanımla – Kanal 1'e tıklayın. Bu amaçla, nükleer lekelemenin temsili bir resmini yakınlaştırın ve çekirdeğin yazılım tarafından inşa edilen çevre tarafından iyi çevrili olup olmadığını kontrol edin. Eşik değerini değiştirmek ve tek çekirdeği daha iyi tanımlamak için segmentasyon algoritmaları uygulamak mümkündür.
- Çekirdek doğru tanımlandıktan sonra, aşağıdaki adımı tıklatın: Birincil Nesneyi Doğrula. Her alan görüntüsünün kenarlığındaki çekirdeklerin analizini önlemek için Object.BorderObject.Ch1 öğesini seçin. Object.Area.Ch1 öğesini seçin ve histogramlardaki "düşük" ve "yüksek" çubukları taşıyarak, tanımlanan tüm kalıntıları veya toplamalara veya eserlere karşılık gelen büyük nesneleri kaldırın.
- Seçilen parametrelerin hepsine uyduğundan emin olmak için tüm deneysel koşulların tüm mini tarama temsilcisi görüntülerini kontrol edin.
- Belirli soy işaretçilerine karşılık gelen her kanal için Noktaları Tanımla'ya tıklayın ve Halka değerlerini seçin: Genişlik = 3 ve Mesafe = 0. Bu, sitoplazmatik floresanların tanımlanmasını sağlayacaktır. Hücre yoğunluğuna göre bu değerler uyarlanabilir. Yazılım, bitişik halkalar arasında çakışmayı otomatik olarak önler.
- Analizi oluşturmak için iş akışında Başvuru Düzeyleri'ni seçin. Referans seviyelerinin ayarlanması, nükleer boyuta ve nükleer boyama yoğunluğuna ve Halka tarafından tanımlanan sitoplazmatik floresanlara dayanan belirli işaret pozitif hücrelerin yoğunlaştırılmış çekirdeklerin otomatik olarak sayılmasına izin verecektir.
- Önce Object.Area.Ch1'i tıklatın. Mini tarama görüntülerinde, yoğunlaştırılmış bir çekirdek seçin ve bu boyutun altındaki tüm çekirdekleri "yoğunlaştırılmış" olarak seçmek için histogramlardaki "DÜŞÜK" çubuğunu hareket ettinin.
- Object.AvgIntensity.Ch1üzerine tıklayın. Mini tarama görüntülerinde, yoğunlaştırılmış bir çekirdek seçin ve bu floresan yoğunluğunun üzerindeki tüm çekirdekleri "yoğunlaştırılmış" olarak seçmek için histogramlardaki "YÜKSEK" çubuğu hareket ettinin.
- Her bir soy kanalı için Object.RingAvgIntensity'ye tıklayın. Mini tarama görüntülerinizde pozitif bir hücre seçin ve bu floresan yoğunluğunun üzerindeki tüm hücreleri "pozitif" olarak seçmek için histogramlardaki "YÜKSEK" çubuğu hareket ettinin.
- Seçilen parametrelerin hepsine uyduğundan emin olmak için tüm deneysel koşulların tüm mini tarama temsilcisi görüntülerini kontrol edin.
- Üst menüde Nüfus Karakterizasyonu 'na ve Olay Alt Popülasyonu 'naseçin.
- Tür 1 Olayı olarak, sol listede ObjectAreaCh1'i seçin, ardından AND > düğmesine tıklayın ve son olarak ObjectAvgIntensityCh1'i seçin. Bu, düşük alan ve yüksek yoğunluğun bir kombinasyonu olarak yoğunlaştırılmış çekirdeklerin tanımlanmasına izin verecektir.
- Aynı pencerede, tüm Tarama Sınırları'nın seçimini kaldırın.
- Analizde saklanacağı parametreleri seçmek için üst menüde Saklanacağı Özellikleri Seç'e tıklayın.
- İyi Özellikler'i seçin ve sol listeden yalnızca istenen parametreleri sağa taşıyın: (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (Belirli soy işaretleyicilerinin her kanalı için).
NOT: Bu analiz, toplam hücre sayısını, yoğunlaştırılmış çekirdeklerin yüzdesini ve toplam hücre numarasında analiz edilen her işaretleyici için soyuna özgü pozitif hücrelerin yüzdesini okuma olarak verecektir. Farklı soyların yüzdesi yalnızca canlı hücrelerde gerekliyse, kanal için "High_RingAvgIntensity" değerini (mutlak pozitif hücre sayısı) tutmak ve ölü hücrelerin yüzdesinin çıkarılmasından sonra toplam hücre sayılarındaki yüzdeyi yeniden hesaplamak mümkündür.- Alternatif olarak, çekirdek doğrulamasında (adım 11.11) yoğunlaştırılmış çekirdekleri (adım 11.14–11.15) tanımlamak için kullanılan parametrelerin aynısını analiz ayarından ölü hücreleri çıkarmak mümkündür.
- Ana üst menüden Plakayı Tara'yı seçin ve analiz etmek için kuyuyu tanımlamak için üst bölümdeki Tarama Ayarı alt menüsündeki plaka sembolüne tıklayın.
- Deneyin adını ve açıklamayı yazın ve tüm ayarlar tamamlandıktan sonra oynatma sembolüne basın.
Sonuçlar
Kültürün ilk aşaması, tohumlama yoğunluğuna ve kürelerin fetal veya yetişkin kökenli olup olmadığına bağlı olarak süre olarak değişebilir. Ayrıca, oligosferler nörosferlere kıyasla iki katına daha az popülasyon gösterir (Şekil 1B). Ayrıca, yetişkin dokusundan küre üretimi daha yavaştır ve tohumlama yoğunluğuna bağlı olarak 1-2 hafta sürebilecek fetal ile karşılaştırıldığında oligosferlerin üretilmesi 2-3 hafta sürebilir.
Tohumlandıktan sonra, kültürlerin tüm farklılaşma aşaması, soyuna özgü antikorlar kullanılarak izlenebilir. Bu protokolün amacı farklılaşmanın son aşamasını incelemek olduğundan, 0 DEV'deki kültür kompozisyonu sunulmaz. Bununla birlikte, ilk kültür aşamasında, hücreler sinir öncül öncüllerini temsil eden nestin-pozitif olacaktır ve hücrelerin çoğunluğu da NG2-pozitiftir (OPC'ler)11. PreOL aşamasına karşılık gelen CNPase pozitif hücreler, T3 aracılı farklılaşma indüksiyonundan 3-6 gün sonra tespit edilebilirken, MBP pozitif hücreler 6 ila 12 DV arasında görünecektir (olgun DLL'ler; farklılaşma aşamasının sonunda kültürlerin bileşimi için Şekil 2C'ye bakın).
HCS analizi, nükleer boyama yoluyla kültürdeki her bir hücrenin tespitini ve kalan kanallardaki floresan yoğunluğunun analizini sağlar (Şekil 2A,B). Farklılaşma aşamasının sonunda kültürün bileşimi (12 DV), kültürlerin fetal veya yetişkin kökenli olup olmadığına bağlı olarak farklılık gösterir, fetal kültürler T3 aracılı farklılaşmaya daha duyarlıdır ve olgun DLL'lerin daha yüksek bir yüzdesine ulaşır12.
Tüm kültür süreci boyunca, hücrelerin yaklaşık% 40-50'si astrositlerdir (GFAP pozitif hücreler), küçük bir yüzde (% 0-10'dan az) nöronlardır (beta-III-tubulin-pozitif hücreler; Şekil 2C). Kültür kompozisyonu farklı kültür preparatları arasında% 10 değişebilir. Yetişkin ve fetal kültürler, farklılaşma evresinin sonunda olgun DLL üretiminin verimi için farklılık gösterir, fetal hücreler yüksek oranda olgun DLL gösterir, öncüllerin düşük yüzdesi ve astrositlerin yaklaşık% 30-40'ı. Öte yandan, yetişkin kültürleri 12 DIV farklılaşma indüksiyonu sonrasında daha fazla astrosit (%45-%55 civarında) ve daha az farklılaştırılmış hücreler sunar.
Yazılımın hücreleri tanımasına izin vermek ve kültür kompozisyonunun uygun bir tarafsız analizini sağlamak için, tohumlama yoğunluğunun doğru olması ve bitişik hücreler arasında çakışmayı önlemesi önemlidir. NSC türevi OPC'ler yüksek yoğunlukta tohumlandığında, çok hızlı bir şekilde toplanma eğilimindedirler ve birkaç gün sonra kuyunun tüm yüzeyinin astrositler tarafından işgal edilmesine yol haline sahiptirler. Ayrıca, karakteristik örümcek ağı şekline sahip olgunDLL'lersınırlı alan nedeniyle görünmez ( Şekil 3A,B).
İnflamasyon aracılı farklılaşma bloğu bu in vitro tahlil ile tekrarlanabilir ve hem fetal hem de yetişkin kültürlerinde CNPase ve MBP boyama ile tespit edilen preOL'lerde ve olgun OL'lerde güçlü bir azalma yaratır. OC sayısında bir artış yetişkin kültürlerinde de meydana gelir (Şekil 4A,B). Sitokin karışımı bileşimi multipl skleroz13'ünbir sıçan modelinde in vivo deneylerden seçildi ve bu hastalıkta meydana gelen iltihap aracılı farklılaşma bloğu için bir in vitro model olarak test edildi.
Fetal ve yetişkin OPC'ler enflamatuar sitokin maruziyetine karşı aynı güvenlik açığını gösterirken, sadece fetal türevli kültürler OGD toksisitesine duyarlıdır (Şekil 5A,B), farklı metabolik profilleri nedeniyle hücre ölümünde ve farklılaşma bozukluğunda bir artış gösterir14.

Şekil 1: Nöral kök hücre türevi oligodendrosit öncül hücre kültürü kurulumu ve farklılaşma protokolü. (A) Deneysel prosedürün şeması. (B) 2, 5 ve 7 DEV'deki nörosferlerin temsili görüntüleri ve nörosferlerin ve oligosferlerin popülasyonunun iki katına çıkarını gösteren grafik. Ölçek çubuğu: 100 μm. (C) Tohumlu oligosfer türevi OPC'lerin, 0 DIV'deki nestin ve NG2 pozitif hücrelerden (nöral öncül/OPC'ler), 6 DV'deki (preOL) CNPase pozitif hücrelere ve farklılaşma aşamasının sonundaki CNPase/MBP çift pozitif hücrelere (12 DIV; olgun OL) kadar farklılaşmanın farklı aşamalarını gösteren temsili görüntüleri. GFAP pozitif hücreler (astrositler) ve beta-III-tubulin pozitif hücrelerin (nöronlar) küçük bir yüzdesi tüm kültür boyunca mevcuttur. Ölçek çubukları: 20 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
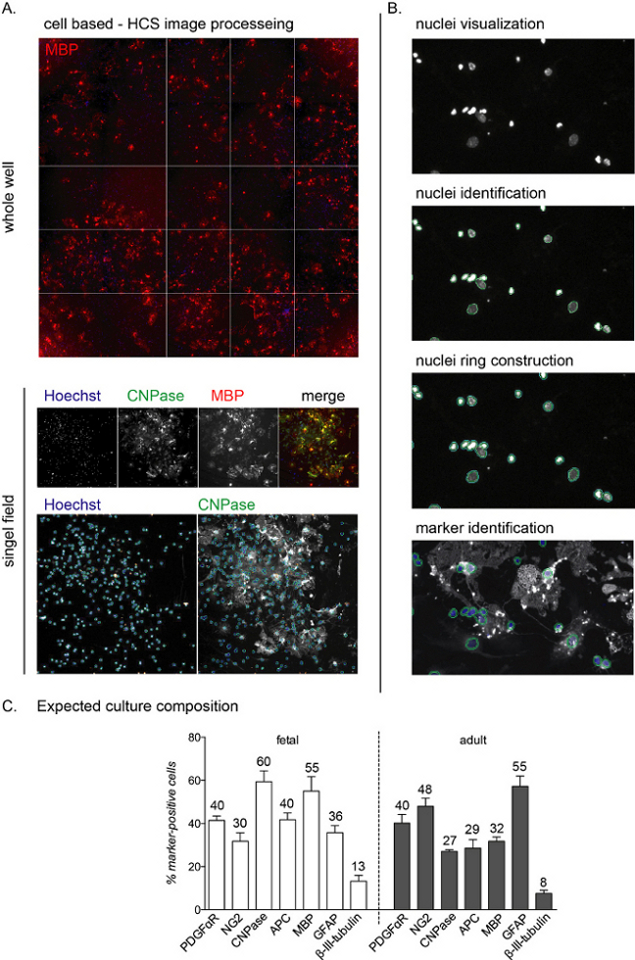
Şekil 2: Hücre tabanlı yüksek içerik tarama analizi iş akışları ve beklenen farklılaşma okumaları. (A) HCS'nin tüm bir kuyunun (96 kuyu plakası) ve NSC türevi OPC'lerin 12 DEV kültürünün 10x hedefiyle elde edilen izole edilmiş tek bir alanın elde edildiği temsili görüntüler. (B) Sitoplazmik boyama ve işaretleyici tanımlamasını tanımlamak için çekirdek (nesneler) görselleştirme, tanımlama ve çekirdek halkasının yapımını içeren HCS analizi iş akışı adımları. (C) Farklılaşma aşamasının sonunda beklenen kültür kompozisyonunu gösteren grafik (12 DV). OPC'ler (PDGFαR, NG2), preOL'ler (CNPase, APC), olgun OL'ler (MBP), astrositler (GFAP) ve nöronlar (β-III-tubulin) için belirteçler hem fetal hem de yetişkin kökenli kültürler için gösterilmiştir. Her hücre işaretçisi için yuvarlatılmış yüzdeler grafiğe dahil edilir, bunun temsili bir deney olduğunu ve yüzdelerin yaklaşık% 5-10 arasında farklı olabileceğini unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
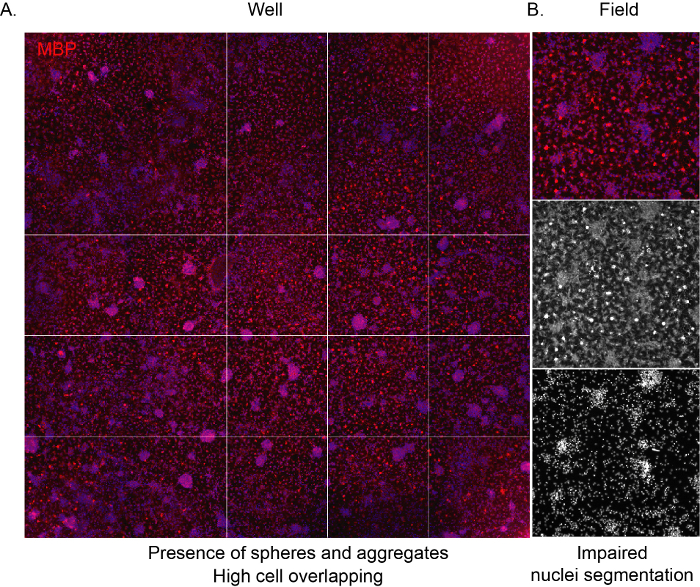
Şekil 3: Yüksek yoğunluklu bir kültürün temsili yüksek içerikli tarama görüntüleri. (A) 10x amaç tarafından elde edilen ve farklılaşma aşamasının sonunda MBP ifadesi için işaretlenmiş bir kuyu (96 kuyu plakası) görüntüsünün temsili görüntüsü (12 DIV). (B) Temsili, toplanan hücrelerin ve çakışan çekirdeklerin varlığını vurgulayan alan görüntüsünü ayıkladı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
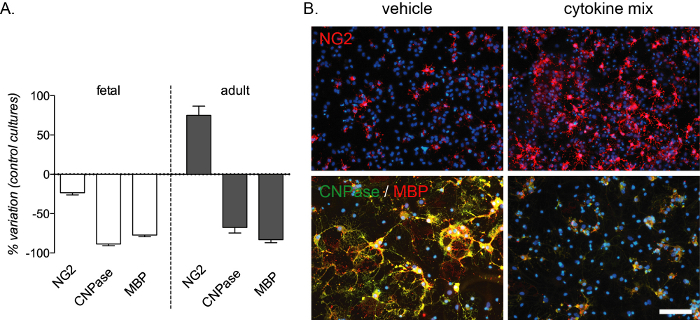
Şekil 4: Sitokin tedavisinin fetal ve yetişkin kökenli OPC kültürleri üzerinde beklenen etkisi. (A) Fetal ve yetişkin türevi OPC kültürlerinin standart kültürlere göre değişim yüzdesini gösteren grafik, farklılaşma aşamasının sonunda OPC'lerin (NG2), preOL'lerin (CNPase) ve olgun DLL'lerin (MBP) nicelleştirilmesi de dahil olmak üzere (12 DV). (B) Farklılaşma aşamasının sonunda yetişkin kültürlerinin temsili görüntüleri (12 DEV) araç veya sitokin karışımı ile muamele edilir ve NG2 veya CNPase / MBP için işaretlenir. Ölçek çubuğu: 20 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
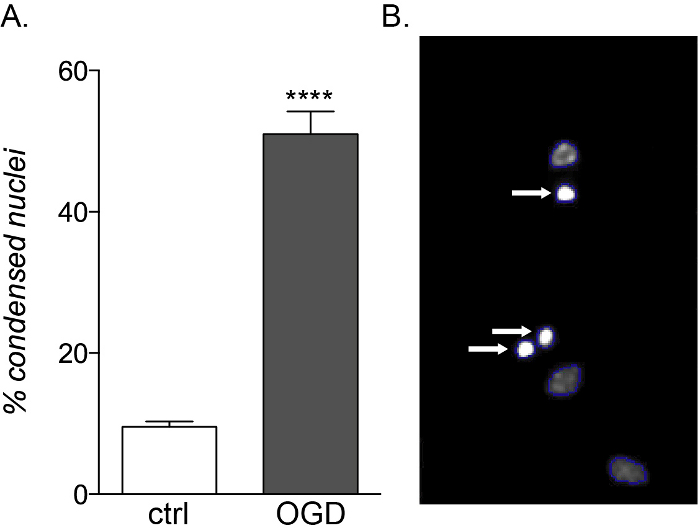
Şekil 5: OGD maruziyetinin fetal türevli OPC kültürleri üzerinde beklenen etkisi. (A) Denetimdeki hücre tabanlı HCS (ctrl) ve OGD'ye maruz kalan kültürler tarafından ölçülen yoğunlaştırılmış çekirdek yüzdesini gösteren grafik. (B) Tanımlanan yoğunlaştırılmış çekirdekleri (beyaz oklar) vurgulayan HCS işlenmiş nesnelerin temsili görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Antikor | Tür | Seyreltme | |
| anti-β-III-tubulin (Ar-Ge sistemi) | fare | 1:3000 | |
| anti-GFAP (Dako) | tavşan | 1:1000 | |
| anti-NG2 (Millipore) | tavşan | 1:350 | |
| anti-PDGFαR (Santa Cruz Biyoteknolojisi) | tavşan | 1:300 | |
| anti-CNPase (Millipore) | fare | 1:500 | |
| IgG2b anti-APC, klon CC1 (Calbiochem) | fare | 1:100 | |
| Anti-MBP (Dako) | tavşan | 1:250 | |
| Anti-nestin (Millipore) | fare | 1:500 | |
| Alexa Fluor 488 konjuge anti mouse (ThermoFisher Scientific) | eşek | 1:500 | |
| Alexa Fluor 647 konjuge anti-fare IgG2b (ThermoFisher Bilimsel) | keçi | 1:500 | |
| Alexa 568 konjuge anti-tavşan (ThermoFisher Scientific) | eşek | 1:500 | |
Tablo 1: Primer ve sekonder antikorların listesi.
Tartışmalar
Miyelinasyon/remiyelinasyon süreçlerinin ve demiyelinasyon olaylarının karmaşık doğası, tahmine dayalı in vitro sistemlerin geliştirilmesini son derece zorlaştırmamaktadır. En yaygın olarak kullanılan in vitro ilaç tarama sistemleri çoğunlukla insan hücre hatları veya birincil saf OL kültürleridir, daha karmaşık ortak kültürlerin veya organotipik sistemlerin artan kullanımıile 15. Bu tür sistemler yüksek içerikli teknolojilerle birleşse bile, saf OL kültürleri tarama platformları geliştirirken tercih edilen yöntem olmaya devam eder16.
Burada açıklanan spontan karma kültür, tüm ana değişkenleri dikkate alan yararlı bir in vitro sistemi temsil eder: fizyolojik T3 aracılı OPC farklılaşması, süreçle patolojik müdahaleler, diğer hücresel bileşenler ve yaşa bağlı farklılıklar. Prosedür, hücrelerin kökeninden (hayvanın yaşı) ve küresellerin oluşumundan ve manipülasyonundan kaynaklanan bir dizi değişken içerir. Aslında, kritik bir adım, dokudan izolasyondan sonra NSC tohumlamanın hücre yoğunluğudur, çünkü en uygun durumda tek bir küre çoğalan tek bir hücreden türemelidir. İzole NSC'lerin toplanma eğiliminde olduğunu ve kendi salgılanan parakrin faktörlerine ihtiyaç duyduklarını gördüğümüzden, bunları bir t25 veya t75 şişesinde 10-50 hücre / μL aralığında tohumlamak, hücre toplamayı önlemek için en iyi uzlaşmadır, ancak yine de hücrelerin salgılama faktörleriyle iletişim kurmasına izin verir.
Tekniğin ana sınırlamaları fonksiyonel bir aksonal miyelinasyon ve nöronlarla doğrudan etkileşim eksikliğidir, çünkü yöntem olgun OL'lerin aşamasına kadar sadece OPC farklılığını dikkate alır: CNPase / MBP-çift pozitif hücreler bir örümcek ağı morfolojisi ile. Bu amaçla, izole dorsal kök gangliyonunda kültürlenmiş birincil OPC'ler hala ana metodoloji17. Bununla birlikte, bu hücreleri herhangi bir yaşta hayvanlardan ayırt etme olasılığı, çeviri sürecinde temel bir noktadır, çünkü ilgi çağından izole edilmiş hücreler üzerinde bileşiklerin ve zararlı uyaranların testine izin verir. Burada açıklandığı gibi, aslında, NSC'ler hem fetal hem de yetişkin beyninden izole edilebilir. Yetişkinlikte gelişimsel miyelinasyon ve remiyelinasyon aynı amacı paylaştığından, yani çıplak aksona ulaşmak ve miyelin kılıfını oluşturmak için, başlangıçta iki işlemin her açıdan aynı olduğu ve rekapitülasyon hipotezini oluşturduğu varsayıldı18. Bununla birlikte, iki işlemin eşit kabul edilemeyeceği ve hücre içi yaşa bağlı farklılıkların mevcut olduğu ve deneysel soru19için en uygun in vitro modeli seçerken dikkate alınması gerektiği açıktır. Yetişkin NSC'lerden türetilmiş OPC'ler, aslında, fizyolojik TH odaklı farklılaşmada güçlü farklılıklar gösterir ve zararlı uyaranlara karşı güvenlik açığı14,20 ve birincil OPC'ler21,22. Ayrıca yetişkin dokularda OPC'lerin ve OLS popülasyonunun heterojenliği vardır, patolojik durumlar için özel bir ilgisivardır 23. Yetişkin dokularından birincil OPC izolasyonu için protokollermevcuttur 24 ve deneysel soru yetişkinlikte remyelinasyona neden olan moleküllere yönelik olduğunda dikkate alınmalıdır.
OPC'lerin NSC'lerden farklılaşması, farklılaşmamış öncülden olgun OL'ye kadar tüm farklılaşma sürecinin in vitro temsiline izin sağlar. Bu süreç, TH'nin belirli nükleer reseptörler aracılığıyla hareket ederek sürecin ana sürücüsü olduğu in vivo durumuna benzer ve patolojik durumları çevirisel bir görünümde taklit etmek için bu mekanizmaya deneysel müdahaleye izin vermektedir13.
Modelin son temel özelliği, tüm kültür boyunca astrositlerin sürekli varlığıdır. Bu, kültürün analizini daha zor hale getirirken, karmaşık hücre bileşimi belirgin bir avantaj oluşturur. Astrositlerin karışık nöronal kültürlerde zararlı olaylara yanıt vermeye nasıl katkıda bulunduğu yaygın olarak bilinmektedir25 ve CNS'nin bu ana bileşeninin yokluğu in vitro sistemi zayıf öngörülebilir ve çevrilebilir hale getirir. Öte yandan, bu özellik için, NSC türevi kültürler tek hücreli tip sistemlerden daha az düzgün olma dezavantajlarına sahiptir ve bu önyargılı bir analize yol açabilir. Bununla birlikte, hücre tabanlı HCS tekniği, tüm kültürün ve tüm hücre popülasyonlarının analizine izin verir ve analiz için temsili alanların randomizasyonunu da ortadan kaldırır. Deney için kullanılan hücre kültürünün güvenilir bir tohumlama kalitesinde olduğunu varsayarsak, HCS deneysel koşulların tam bir resmini verecek, istatistiksel olarak sağlam veriler ve bir dizi otomatik floresan tabanlı analiz üretecektir.
Sonuç olarak, mevcut protokol, NSC türevi OPC'lerin fetal ve yetişkin beyinden izolasyonu ve farklılaşması prosedürünü açıklar. Tüm protokol, hayvanların yaşına ve deneysel hedeflere bağlı olarak yaklaşık 30 gün sürer. Özellikle, yetişkin kökenli küre oluşumu, aynı tohumlama yoğunluğunda, fetal olanlara kıyasla iki kat zaman alabilir. Farklılaşma indüksiyonu için 2D yüzeyde tohumlamadan sonraki 15 günlük (-3 ila 12 DEV) süre, ancak tüm koşullarda sabit bir süredir. Tam protokol, TH aracılı tüm farklılaşma sürecinin karmaşık bir hücresel ortamda incelenmesine, belirli patolojik mekanizmalar (yani enflamatuar sitokinler ve HI) yoluyla müdahaleye ve bunun sonucunda bu sorunların üstesinden gelmeyi amaçlayan yeni stratejilerin test edilmesine izin verir. Kültür modelinin HCS tekniği ile birelenmesi sağlam ve çevrilebilir bir tarama platformu oluşturur.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
MIUR National Technology Clustersproject IRMI (CTN01_00177_888744) ve Regione Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020 tarafından desteklenmektedir.
Deneysel çalışmalara ev sahipliği yaptığı için IRET Vakfı'na özel teşekkürler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Referanslar
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır