Method Article
Analyse de la différenciation et de la maturation de criblage à haute teneur de cultures de cellules souches neurales fœtales et adultes dérivées de cellules souches oligodendrocytes
Dans cet article
Résumé
Nous décrivons la production de cultures mixtes d’astrocytes et de cellules précurseurs d’oligodendrocytes dérivées de cellules souches neurales fœtales ou adultes se différenciant en oligodendrocytes matures, et la modélisation in vitro de stimuli nocifs. Le couplage avec une technique de dépistage à haute teneur à base de cellules permet de construire un système de dépistage de médicaments fiable et robuste.
Résumé
Le principal obstacle au développement de techniques de dépistage des médicaments pour évaluer l’efficacité des stratégies thérapeutiques dans les maladies complexes est de trouver un équilibre entre la simplification in vitro et la recréation de l’environnement in vivo complexe, ainsi que l’objectif principal, partagé par toutes les stratégies de dépistage, d’obtenir des données robustes et fiables, hautement prédictives pour la traduction in vivo.
Dans le domaine des maladies démyélinisantes, la majorité des stratégies de dépistage des médicaments sont basées sur des lignées cellulaires immortalisées ou des cultures pures de cellules précurseurs d’oligodendrocytes primaires (OPC) isolées provenant d’animaux nouveau-nés, ce qui entraîne de forts biais en raison de l’absence de différences liées à l’âge et de toute condition ou complexité pathologique réelle.
Nous montrons ici la mise en place d’un système in vitro visant à modéliser la différenciation physiologique / maturation des OPC dérivés de cellules souches neurales (NSC), facilement manipulables pour imiter les conditions pathologiques typiques des maladies démyélinisantes. De plus, la méthode comprend l’isolement des cerveaux fœtaux et adultes, donnant un système qui se différencie dynamiquement des OPC aux oligodendrocytes matures (OL) dans une co-culture spontanée qui comprend également des astrocytes. Ce modèle ressemble physiologiquement à la myélinisation médiée par les hormones thyroïdiennes et au processus de réparation de la myéline, permettant l’ajout d’interférents pathologiques qui modélisent les mécanismes de la maladie. Nous montrons comment imiter les deux principaux composants des maladies démyélinisantes (c’est-à-dire l’hypoxie / ischémie et l’inflammation), en recréant leur effet sur la myélinisation développementale et la réparation de la myéline adulte et en tenant compte de tous les composants cellulaires du système tout au long, tout en nous concentrant sur la différenciation des OPC.
Ce modèle mixte spontané, couplé à des technologies de criblage cellulaire à haute teneur, permet le développement d’un système de dépistage médicamenteux robuste et fiable pour les stratégies thérapeutiques visant à lutter contre les processus pathologiques impliqués dans la démyélinisation et à induire la remyélinisation.
Introduction
Dans le système nerveux central (SNC), les cellules formant la myéline (oligodendrocytes, LAL) et leurs précurseurs (cellules précurseurs des oligodendrocytes, OPC) sont responsables de la myélinisation développementale, un processus qui se produit pendant les périodes péri- et postnatale, et du renouvellement et de la réparation de la myéline (remyélinisation) à l’âge adulte1. Ces cellules sont hautement spécialisées, interagissant anatomiquement et fonctionnellement avec tous les autres composants gliaux et neuronaux, ce qui en fait une partie fondamentale de la structure et de la fonction du SNC.
Les événements démyélinisants sont impliqués dans différentes lésions et maladies duSNC 2, et agissent principalement sur les OPC et les OL par le biais de mécanismes multifactoriels, à la fois pendant le développement et à l’âge adulte. Les précurseurs indifférenciés sont entraînés par des facteurs de différenciation, principalement l’hormone thyroïdienne (TH), dans un processus synchronisé3 qui conduit l’OPC à reconnaître et à répondre à des stimuli spécifiques qui induisent la prolifération, la migration vers l’axone non myélinisé et la différenciation en OL matures qui à leur tour développent la gaine de myéline4. Tous ces processus sont finement contrôlés et se produisent dans un environnement complexe.
En raison de la nature complexe des événements de myélinisation, de remyélinisation et de démyélinisation, il existe un grand besoin d’une méthode in vitro simplifiée et fiable pour étudier les mécanismes sous-jacents et développer de nouvelles stratégies thérapeutiques, en se concentrant sur le principal acteur cellulaire: l’OPC5.
Pour qu’un système in vitro soit fiable, un certain nombre de facteurs doivent être pris en compte : la complexité de l’environnement cellulaire, les différences intrinsèques cellulaires liées à l’âge, la différenciation physiologique médiée par la TH, les mécanismes pathologiques et la robustesse des données6. En effet, le besoin non satisfait sur le terrain est un modèle qui imite la complexité de la condition in vivo, qui n’est pas atteinte avec succès grâce à l’utilisation de cultures OPC pures isolées. En outre, les deux principaux composants des événements démyélinisants, l’inflammation et l’hypoxie/ischémie (IH), impliquent directement d’autres composants cellulaires qui peuvent affecter indirectement la différenciation physiologique et la maturation des OPC, un aspect qui ne peut pas être étudié dans des modèles in vitro trop simplifiés.
Partant d’un système de culture hautement prédictif, le défi ultérieur et plus général est la production de données robustes et fiables. Dans ce contexte, le criblage cellulaire à haute teneur (HCS) est la technique la plus appropriée7, car notre objectif est d’une part d’analyser l’ensemble de la culture dans un flux de travail automatique, en évitant le biais de choisir des champs représentatifs, et d’autre part d’obtenir la génération automatique et simultanée de données à haut contenu basées sur l’imagerie8.
Étant donné que le besoin principal est d’atteindre le meilleur équilibre entre la simplification in vitro et la complexité imitant in vivo, nous présentons ici une méthode hautement reproductible pour obtenir des OPC dérivés de cellules souches neurales (NSC) isolées du cerveau antérieur fœtal et de la zone sous-ventriculaire adulte (SVZ). Ce modèle in vitro englobe l’ensemble du processus de différenciation OPC, du NSC multipotent à l’OL mature/myélinisant, d’une manière physiologique dépendante de la TH. La culture résultante est un système de différenciation / maturation dynamique qui se traduit par une co-culture spontanée composée principalement d’OPC et d’astrocytes différenciants, avec un faible pourcentage de neurones. Cette culture primaire imite mieux l’environnement complexe in vivo, tandis que sa dérivation de cellules souches permet d’effectuer des manipulations simples pour obtenir l’enrichissement de la lignée cellulaire souhaité.
Contrairement à d’autres stratégies de dépistage de médicaments utilisant des lignées cellulaires ou des cultures pures d’OPC primaires, la méthode décrite ici permet d’étudier l’effet d’interférents pathologiques ou de molécules thérapeutiques dans un environnement complexe, sans perdre de vue le type de cellule souhaité. Le flux de travail HCS décrit permet une analyse de la viabilité cellulaire et des spécifications de la lignée, ainsi que de la mort cellulaire et des paramètres morphologiques spécifiques à la lignée.
Protocole
Tous les protocoles animaux décrits dans le présent document ont été mis en œuvre conformément aux directives du Conseil de la Communauté européenne (86/609/CEE) et sont conformes aux lignes directrices publiées dans le Guide des NIH pour les soins et l’utilisation des animaux de laboratoire.
1. Solutions et réactifs
- Préparer le support standard: DMEM / F12 GlutaMAX 1x; 8 mmol/L HEPES; 100 U/100 μg de pénicilline/streptomycine (1 % P/S); 1x B27; 1x N-2.
- Préparer le milieu de la neurosphère: ajouter 10 ng / mL bFGF; 10 ng/mL EGF au milieu standard.
- Préparer le milieu oligosphère/OPC : ajouter 10 ng/mL de bFGF; 10 ng/mL PDGF-AA au support standard.
- Préparer le milieu de différenciation oligodendroctye : ajouter 50 nM T3 ; 10 ng/mL CNTF; 1x N-acétyl-L-cystéine (NAC) au milieu standard.
- Préparez un tampon de dissociation non enzymatique : ajoutez 1 % de P/S au tampon de dissociation non enzymatique et gardez la glace au froid.
- Préparer la solution de saccharose : HBSS, 0,3 g/mL de saccharose.
- Préparer la solution de lavage BSA : EBSS, 40 mg/mL BSA, 0,02 mL/l HEPES.
- Préparer un tampon de dissociation enzymatique : HBSS, 5,4 mg/mL de D-glucose, 15 mmol/L HEPES, 1,33 mg/mL de trypsine, 0,7 mg/mL de hyaluronidase, 80 U/mL de DNase.
- Préparer un mélange de cytokines : TGF-β1, TNF-α, IL-1β, IL-6, IL-17 et IFN-γ (20 ng/mL chacun).
- Préparer le véhicule de mélange de cytokines: 0,04% du stock (10% glycérol / 100 nM glycine / 25 nM Tris, pH 7,3).
- Préparer le milieu de privation oxygène-glucose : milieu standard en utilisant le DMEM sans glucose. Selon la rigueur de l’état de privation de glucose souhaité, il est possible d’éliminer également B27 et/ou N2 du milieu pour éviter les composés liés au glucose (par exemple, D-Galactose dans B27).
2. Dissection et isolement NSC
REMARQUE: Les CSN fœtaux et adultes ont été isolés à partir du cerveau antérieur fœtal E13.5 ou de la zone sous-ventriculaire adulte (SVZ) de 2,5 mois, conformément au protocole9 d’Ahlenius et Kokaia avec des modifications.
- Cultures Fœtales NSC
REMARQUE: Avant de commencer les dissections, préparer des tubes de 1,5 mL contenant chacun 150 μL de tampon de dissociation non enzymatique; nettoyer les boîtes de Petri et ajouter du HBSS glacé.- Recueillir les embryons à E13,5 - 14,5 de souris gravides chronométrées et placer dans une boîte de Pétri contenant du HBSS froid.
- Décapiter les embryons à l’aide de pinces.
- Placez les têtes des embryons dans une boîte de Petri propre contenant du PBS glacé et retirez la peau du crâne avec une pince, à l’aide de loupes ou d’un stéréoscope.
- Une fois que le cerveau est visible et débarrassé de la peau, pressez-le en appliquant une pression sur les côtés avec une pince.
- Retirez le cervelet, ne gardez que le cerveau antérieur et retirez les méninges avec une pince.
- Placez le tissu isolé dans le tampon de dissociation non enzymatique et répétez les étapes de dissection avec les autres embryons. Insérez le tissu de 2 à 3 animaux dans chaque tube contenant le tampon.
- Incuber à 37 °C pendant 15 min sous agitation continue.
- Après incubation, ajouter 850 μL de milieu standard et mélanger par pipetage jusqu’à ce que la suspension soit exempte d’amas.
- Si un tissu non dissocié est encore visible, attendez 2 min à TA jusqu’à ce qu’il se dépose au fond du tube.
- Lorsque la dissociation est terminée, comptez les cellules et plaquez-les en suspension à une densité de 10 à 50 cellules/μL dans une fiole T-25 ou T-45 contenant 10 à 30 mL de milieu neurosphère, maintenue en position verticale pour éviter l’adhésion cellulaire.
-
Cultures adultes NSC
- Sacrifier des animaux par luxation cervicale.
- Recueillir les cerveaux de 4 à 5 souris dans un tube de 50 mL contenant du HBSS glacé.
- Placez le cerveau sur une surface stérile froide. À cette fin, utilisez une fiole T-25 remplie d’eau et placée à -20 °C pendant la nuit. Au moment de l’expérience, recouvrir la fiole avec du papier d’aluminium stérile.
- Placez la face ventrale du cerveau vers le bas, dans le sens rostro-caudal, et retirez les bulbes olfactifs à l’aide d’une lame de rasoir.
- À l’aide d’une lame de rasoir, coupez 2 à 3 tranches coronales de 1 mm d’épaisseur, du cortex au chiasma optique.
- Placez les tranches sur la surface froide en position ventro-dorsale et identifiez le corps calleux et les deux ventricules latéraux.
- À l’aide de loupes ou d’un stéréoscope, isolez les parois des ventricules latéraux, en prenant soin de ne pas porter de morceaux du corps calleux.
- Placer le tissu isolé dans le tampon de dissociation enzymatique (5–10 mL) et incuber à 37 °C pendant 15 min.
- Mélanger la solution en pipetant plusieurs fois (au moins 50) et incuber à nouveau à 37 °C pendant 10 min.
- Neutraliser la trypsine en ajoutant 5 mL de milieu de culture standard et filtrer la solution à l’aide d’un filtre de 70 μm.
- Centrifuger la solution filtrée pendant 5 min à 400 x g.
- Remettre la pastille dans la solution de saccharose et centrifuger pendant 10 min à 500 x g.
- Remettre en suspension la pastille dans une solution de lavage BSA et centrifuger pendant 7 min à 400 x g.
- Remettez la pastille dans le milieu de culture standard, comptez les cellules et effectuez le placage comme décrit ci-dessus (à l’étape 2.1.10).
3. Neurosphères primaires
- Ajouter les facteurs de croissance (bFGF/EGF) tous les 2 jours.
- Tous les 4 à 6 jours (selon la densité cellulaire), changez la moitié du milieu comme suit :
- Transférer toute la suspension cellulaire dans un tube de 15 ou 50 mL.
- Centrifugeuse pendant 5 min à 400 x g.
- Retirez la moitié du volume.
- Ajouter la même quantité de milieu frais, mélanger doucement par pipetage et ajouter des facteurs de croissance.
4. Oligosphères
REMARQUE: La différenciation des oligodendrocytes est effectuée en suivant le protocole Chen10 avec des modifications.
- Lorsque les neurosphères atteignent un diamètre de 100 à 150 μm, elles sont prêtes à être passées. Pour ce faire, transférer toute la suspension cellulaire dans un tube de 15 ou 50 mL, et centrifuger pendant 5 min à 400 x g.
- Évaluez rapidement le diamètre en prenant des photos des sphères à l’aide d’un microscope à lumière transmise inversée et en les ouvrant par le logiciel ImageJ.
- Cliquez sur le menu Analyser et dans la fenêtre Outils, sélectionnez Barre d’échelle.
- Définissez 150 μm comme Largeur en microns et comparez la barre d’échelle avec les sphères.
- Retirer tout le volume par inversion et remettre la pastille en suspension dans 180 μL de milieu de culture standard frais. Pipette 50 fois pour permettre la désagrégation des sphères.
- Ajouter 810 μL de milieu de culture standard frais, compter les cellules et les plaquer à nouveau comme décrit pour les neurosphères.
- Ajouter bFGF/PDGF-AA 10 ng/mL tous les 2 jours.
- Tous les 4 à 6 jours (selon la densité cellulaire), changez la moitié du milieu comme suit :
- Transférer toute la suspension cellulaire dans un tube de 15 ou 50 mL.
- Centrifugeuse pendant 5 min à 400 x g.
- Retirez la moitié du volume.
- Ajouter la même quantité de milieu frais, mélanger doucement par pipetage et ajouter des facteurs de croissance.
5. Revêtement de plaque
- Revêtement poly-D,L-ornithine/laminine : au moins 2 jours avant le placage des OPC, ajouter 50 μg/mL de solution de poly-D,L-ornithine, diluée dans du PBS, à chaque puits (40 μL/puits pour les plaques de 96 puits) et incuber à RT pendant la nuit.
- Le lendemain, retirez le liquide et lavez trois fois avec de l’eau stérile distillée.
- Laissez les assiettes sécher à RT pendant la nuit. Le lendemain, ajouter une solution de laminine diluée dans du PBS (5 μg/mL; 40 μL/puits pour les plaques à 96 puits) et incuber pendant 2 h à 37 °C.
6. Ensemencement cellulaire
- Lorsque les oligosphères atteignent un diamètre de 100 à 150 μm, elles sont prêtes à être dissociées et ensemencées sur les plaques revêtues de poly-D,L-ornithine/laminine. Pour ce faire, transférer toute la suspension de la cellule dans un tube de 15 ou 50 mL et centrifuger pendant 5 min à 400 x g (comme indiqué à l’étape 4.1)
- Retirer tout le volume par inversion et remettre la pastille en suspension dans 180 μL de milieu de culture standard frais. Pipette 50 fois pour permettre la désagrégation des sphères.
- Ajouter 810 μL de milieu de culture standard frais et compter les cellules.
- Retirer la solution de laminine des puits et plaquer les cellules à une densité de 3 000 cellules/cm2 (100 μL/puits pour les plaques de 96 puits).
7. Induction de différenciation OPC
- Après 3 jours, retirez tout le milieu et ajoutez le même volume de milieu de différenciation des oligodendrocytes.
- Changer la moitié du milieu tous les 4 jours et ajouter un nouveau mélange de différenciation (T3 / CNTF / NAC) tous les 2 jours.
8. Induction du bloc de différenciation médié par l’inflammation
- Après la dissociation de la neurosphère et la production d’oligosphères (section 4), ajouter le mélange de cytokines au milieu de culture et maintenir les oligosphères exposées aux cytokines pendant toute l’étape de formation des sphères.
REMARQUE: Le volume dépend du nombre de cellules, car pour les sphères formant des cellules sont ensemencées à 10–50 cellules / μL. - Si le milieu doit être changé, changez tout le volume et ajoutez à nouveau le mélange de cytokines.
9. Induction de la mort cellulaire de privation d’oxygène-glucose
- À -1 DIV (2 jours après l’ensemencement cellulaire dans des plaques multipuits), retirez le milieu et conservez-le dans une nouvelle plaque multipuits.
- Ajouter la moitié du volume (50 μL pour les plaques de 96 puits) du milieu OGD (groupe OGD) ou du milieu frais (groupe témoin). La demi-quantité de volume est utilisée pour réduire l’échange d’oxygène entre le liquide et l’air.
- Placer les cultures du groupe OGD dans une chambre d’hypoxie hermétique saturée de 95% de N2 et 5% de CO2. Pour obtenir la saturation de la chambre, laissez le mélange de gaz s’écouler pendant 6 min à 25 l/min avant de fermer les tuyaux de la chambre.
- Incuber la chambre hypoxique dans l’incubateur pendant 3 h. Le groupe témoin et les plaques contenant le milieu retiré et conservé à l’étape 9.1 doivent également être laissés dans l’incubateur.
- Retirer le milieu sans glucose (groupe OGD) ou le nouveau milieu (groupe témoin) et ajouter le milieu retiré et conservé à l’étape 9.1.
10. Immunocytochimie
- Au moment souhaité, fixez les cellules avec du paraformaldéhyde froid à 4% pendant 20 min à TA.
- Laver deux fois avec du PBS (10 min d’incubation pour chaque lavage à RT).
- Incuber 1 h à TA avec la solution bloquante (PBS Triton 0,3% contenant 1% de BSA et 1% de sérum normal âne/chèvre).
- Incuber avec un mélange d’anticorps primaires (Tableau 1), dilué dans du triton PBS 0,3%, pendant la nuit à 4 °C.
- Laver deux fois avec du PBS (10 min d’incubation pour chaque lavage à RT).
- Incuber avec une solution d’anticorps secondaire(tableau 1)diluée dans du triton PBS à 0,3 % en ajoutant Hoechst 33258 pendant 30 min à 37 °C.
- Laver deux fois avec du PBS (10 min d’incubation pour chaque lavage à RT).
11. Analyse HCS de la viabilité cellulaire, de la composition de la lignée et de la mort cellulaire spécifique à la lignée
REMARQUE : Les images représentatives HCS et le flux de travail sont illustrés à la Figure 2A, B.
- Sélectionnez l’algorithme d’analyse compartimentale dans le menu principal du logiciel (HCS Studio v 6.6.0) et sélectionnez Scan dans le menu principal Développer un test/plaque de numérisation.
- Dans la fenêtre iDev, sélectionnez Nouveau, puis Outil de mesure générale de l’intensité dans le modèle Développer un essai.
- Cliquez sur Créer sur le côté droit du menu, en sélectionnant l’objectif 10x.
- Cela ouvrira le menu Configurer l’acquisition. Dans cette fenêtre, sélectionnez les paramètres suivants : (a) nombre de canaux : le premier pour la coloration nucléaire Hoechst (BGRFR_386) et un pour chaque marqueur spécifique à la lignée utilisé dans la réaction (b) sélectionnez la mise au point logicielle sur le canal 1 et l’intervalle de mise au point automatique comme 1 (c) sélectionnez le modèle de plaque dans la liste.
- Dans le menu d’acquisition, examinez la qualité de la coloration dans différents puits et différents champs et sélectionnez manuellement le temps d’exposition en sélectionnant Temps d’exposition fixe dans le menu.
- Une fois les paramètres d’acquisition définis, sélectionnez Mini Scan en haut du menu et sélectionnez dix champs par puits dans deux puits par condition expérimentale. Cela permettra la configuration de tous les paramètres d’analyse dans un sous-ensemble de champs pour l’ensemble de la plaque.
- Lorsque la mini-analyse est terminée, cliquez sur le paramètre Configurer le test pour configurer l’algorithme de l’analyse.
- Cliquez sur Configurer les groupes dans le côté droit de la fenêtre et faites glisser et déposez les puits du miniscan. Cliquez sur le bouton Ajouter dans la sous-section Groupes pour configurer les différents groupes.
- Suivez le flux de travail sur le côté gauche de la fenêtre étape par étape pour développer l’ensemble de l’algorithme. Sélectionnez d’abord Traiter l’image pour chaque canal et cliquez sur Suppression de l’arrière-plan et au niveau souhaité.
- Identifiez et sélectionnez d’abord les noyaux par coloration nucléaire. Cliquez sur Identifier l’objet principal – Canal 1 pour sélectionner les noyaux réels et éviter d’analyser les artefacts et les débris. À cette fin, zoomez sur une image représentative de la coloration nucléaire et vérifiez si les noyaux sont bien entourés par le périmètre construit par le logiciel. Il est possible de modifier la valeur seuiluse et d’appliquer des algorithmes de segmentation pour mieux identifier les noyaux uniques.
- Une fois les noyaux définis correctement, cliquez sur l’étape suivante : Valider l’objet principal. Sélectionnez Object.BorderObject.Ch1 pour éviter l’analyse des noyaux à la bordure de chaque image de champ. Sélectionnez Object.Area.Ch1 et, en déplaçant les barres « bas » et « haut » sur les histogrammes, retirez tous les débris ou objets volumineux identifiés correspondant à des agrégats ou des artefacts.
- Vérifiez toutes les images représentatives du mini scan de toutes les conditions expérimentales pour vous assurer que les paramètres sélectionnés correspondent à toutes.
- Cliquez sur Identifier les taches pour chaque canal correspondant aux marqueurs de lignée spécifiques, puis sélectionnez les valeurs de l’anneau: Largeur = 3 et Distance = 0. Cela permettra l’identification de la fluorescence cytoplasmique. Selon la densité cellulaire, ces valeurs peuvent être adaptées. Le logiciel évitera automatiquement le chevauchement entre les anneaux adjacents.
- Sélectionnez Niveaux de référence dans le flux de travail pour générer l’analyse. Le réglage des niveaux de référence permettra le comptage automatique des noyaux condensés, en fonction de la taille nucléaire et de l’intensité de coloration nucléaire, et des cellules marqueurs positifs spécifiques, en fonction de la fluorescence cytoplasmique identifiée par l’anneau.
- Cliquez d’abord sur Object.Area.Ch1. Dans les images mini-scan, sélectionnez un noyau condensé et déplacez la barre « LOW » sur les histogrammes afin de sélectionner comme « condensés » tous les noyaux de cette taille.
- Cliquez sur Object.AvgIntensity.Ch1. Dans les images mini-scan, sélectionnez un noyau condensé et déplacez la barre « HIGH » sur les histogrammes afin de sélectionner comme « condensés » tous les noyaux au-dessus de cette intensité de fluorescence.
- Cliquez sur Object.RingAvgIntensity pour chaque canal de marqueurs spécifiques à la lignée. Sélectionnez dans vos mini images de numérisation une cellule positive et déplacez la barre « HIGH » sur les histogrammes afin de sélectionner comme « positives » toutes les cellules au-dessus de cette intensité de fluorescence.
- Vérifiez toutes les images représentatives du mini scan de toutes les conditions expérimentales pour vous assurer que les paramètres sélectionnés correspondent à toutes.
- Dans le menu supérieur, sélectionnez Caractérisation de la population et sélectionnez Sous-population de l’événement.
- En tant qu’événement de type 1, sélectionnez ObjectAreaCh1 dans la liste de gauche, puis cliquez sur le bouton ET > et enfin sélectionnez ObjectAvgIntensityCh1. Cela permettra d’identifier les noyaux condensés, comme une combinaison de faible surface et de haute intensité.
- Dans la même fenêtre, désélectionnez toutes les limites d’analyse.
- Cliquez sur Sélectionner les fonctionnalités à stocker dans le menu supérieur, pour choisir les paramètres à conserver dans l’analyse.
- Sélectionnez Fonctions de puits et déplacez de la liste de gauche vers la droite uniquement les paramètres souhaités : (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (pour chaque canal des marqueurs de lignure spécifiques).
REMARQUE: Cette analyse donnera en lecture le nombre total de cellules, le pourcentage de noyaux condensés et le pourcentage de cellules positives spécifiques à la lignée pour chaque marqueur analysé sur le nombre total de cellules. Si le pourcentage des différentes lignées n’est nécessaire que sur les cellules vivantes, est-il possible soit de conserver la valeur « High_RingAvgIntensity » pour le canal (nombre absolu de cellules positives) et de recalculer le pourcentage sur le nombre total de cellules après la soustraction du pourcentage de cellules mortes.- Alternativement, il est possible de retirer les cellules mortes de l’analyse en définissant les mêmes paramètres que ceux utilisés pour identifier les noyaux condensés (étapes 11.14 à 11.15) lors de la validation des noyaux (étape 11.11).
- Sélectionnez Plaque de numérisation dans le menu principal du haut et cliquez sur le symbole de la plaque dans le sous-menu Paramètre de numérisation dans la section supérieure pour identifier le puits à analyser.
- Écrivez le nom de l’expérience et la description et une fois tous les paramètres terminés, appuyez sur le symbole de lecture.
Résultats
La durée de la première phase de la culture peut varier en fonction de la densité d’ensemencement et du fait que les sphères soient d’origine fœtale ou adulte. De plus, les oligosphères affichent une population réduite doublant par rapport aux neurosphères(Figure 1B). De plus, la production de sphères à partir de tissus adultes est plus lente et il peut prendre 2 à 3 semaines pour générer des oligosphères par rapport au fœtus, ce qui peut prendre 1 à 2 semaines, selon la densité d’ensemencement.
Une fois ensemencées, toute la phase de différenciation des cultures peut être surveillée à l’aide d’anticorps spécifiques à la lignée. Étant donné que l’objectif de ce protocole est d’étudier la phase finale de la différenciation, la composition de la culture à 0 DIV n’est pas présentée. Cependant, au cours de la première phase de culture, les cellules seront toujours nestin-positives, représentant des précurseurs neuronaux, et la majorité des cellules sont également NG2-positives (OPC)11. Les cellules CNPase positives, correspondant au stade préOL, seront détectables 3 à 6 jours après l’induction de la différenciation médiée par la T3, tandis que les cellules MBP positives apparaîtront entre 6 et 12 DIV (OL matures; voir la figure 2C pour la composition des cultures à la fin de la phase de différenciation).
L’analyse HCS permet la détection de chaque cellule de la culture par la coloration nucléaire et l’analyse de l’intensité de fluorescence dans les canaux restants(Figure 2A,B). La composition de la culture à la fin de la phase de différenciation (12 DIV) diffère selon que les cultures sont d’origine fœtale ou adulte, les cultures fœtales étant plus sensibles à la différenciation médiée par la T3 et atteignant un pourcentage plus élevé de LL matures12.
Tout au long du processus de culture, environ 40% à 50% des cellules sont des astrocytes (cellules GFAP positives), tandis qu’un faible pourcentage (moins de 0% à 10%) sont des neurones (cellules bêta-III-tubuline positives; Figure 2C). La composition de la culture peut varier de 10% entre les différentes préparations de culture. Les cultures adultes et fœtales diffèrent pour le rendement de la production de LA matures à la fin de la phase de différenciation, les cellules fœtales montrant un pourcentage élevé de LA matures, un faible pourcentage de précurseurs et environ 30% à 40% des astrocytes. D’autre part, les cultures adultes présentent plus d’astrocytes (environ 45% à 55%) et moins de cellules différenciées après 12 DIV d’induction de différenciation.
Pour permettre au logiciel de reconnaître les cellules et de fournir une analyse impartiale appropriée de la composition de la culture, il est important que la densité d’ensemencement soit correcte, en évitant le chevauchement entre les cellules adjacentes. Lorsque les OPC dérivés du NSC sont ensemencés à haute densité, ils ont tendance à s’agréger très rapidement, ce qui conduit à toute la surface du bien-être occupé par les astrocytes après quelques jours. De plus, les OL matures avec leur forme caractéristique de filet d’araignée ne seront pas visibles en raison de l’espace limité(Figure 3A, B).
Le bloc de différenciation médié par l’inflammation est reproductible par ce test in vitro et génère une forte diminution des préOL et des OL matures détectés par la coloration à la CNPase et au MBP dans les cultures fœtales et adultes. Une augmentation du nombre d’OPC se produit également dans les cultures adultes(Figure 4A,B). La composition du mélange de cytokines a été choisie à partir d’expériences in vivo dans un modèle de sclérose en plaques chez le rat13, et a été testée comme modèle in vitro pour le bloc de différenciation médié par l’inflammation survenant dans cette maladie.
Alors que les OPC fœtaux et adultes présentent la même vulnérabilité à l’exposition inflammatoire aux cytokines, seules les cultures dérivées du fœtus sont sensibles à la toxicité des DCO(Figure 5A, B),montrant une augmentation de la mort cellulaire et une altération de la différenciation en raison de leur profil métabolique différent14.

Figure 1 : Configuration et protocole de différenciation de la culture de cellules précurseurs d’oligodendrocytes dérivés de cellules souches neurales. (A) Schéma de la procédure expérimentale. (B) Images représentatives des neurosphères à 2, 5 et 7 DIV, et graphique montrant le doublement de la population des neurosphères et des oligosphères. Barre d’échelle: 100 μm. (C) Images représentatives des OPC dérivés de l’oligosphère ensemencée montrant les différents stades de différenciation, des cellules nestines et NG2 positives à 0 DIV (précurseurs neuronaux / OPC), en passant par les cellules CNPase positives à 6 DIV (préOL) et les cellules double positives CNPase / MBP à la fin de la phase de différenciation (12 VDI; FL matures). Des cellules GFAP positives (astrocytes) et un faible pourcentage de cellules bêta-III-tubuline positives (neurones) sont présentes dans toute la culture. Barres d’échelle : 20 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
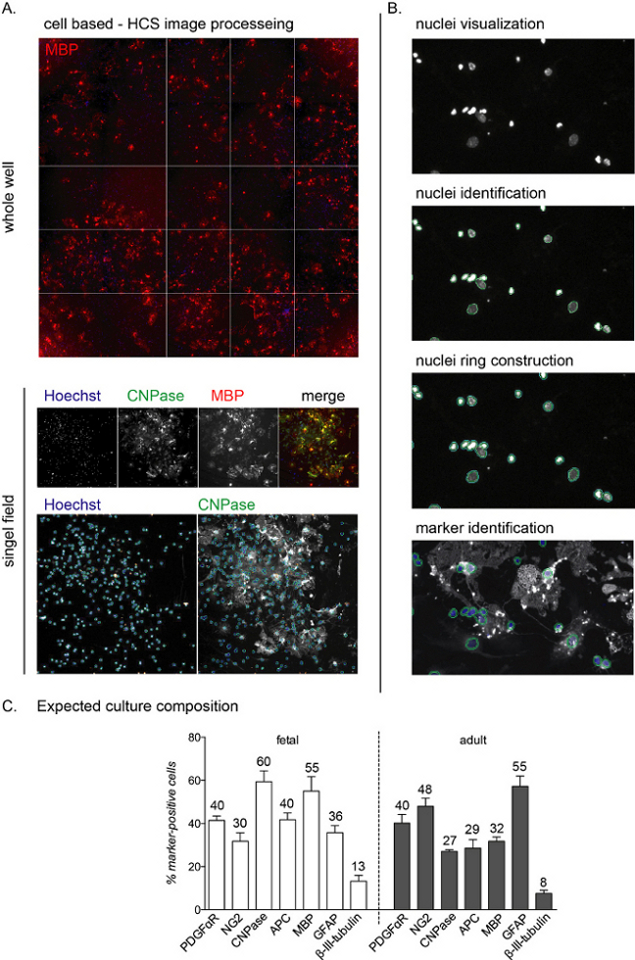
Figure 2 : Workflows d’analyse de filtrage à contenu élevé basés sur des cellules et lecture de différenciation attendue. (A) Images représentatives de l’acquisition par HCS d’un puits entier (plaque de 96 puits) et d’un champ unique isolé acquis avec un objectif 10x d’une culture de 12 DIV d’OPC dérivés de NSC. (B) Étapes du flux de travail d’analyse HCS, y compris la visualisation des noyaux (objets), l’identification et la construction de l’anneau des noyaux pour identifier la coloration cytoplasmique et l’identification des marqueurs. (C) Graphique montrant la composition de culture attendue à la fin de la phase de différenciation (12 DIV). Les marqueurs des OPC (PDGFαR, NG2), des préOL (CNPase, APC), des OL matures (MBP), des astrocytes (GFAP) et des neurones (β-III-tubuline) sont montrés pour les cultures dérivées du fœtus et de l’adulte. Des pourcentages arrondis pour chaque marqueur de cellule sont inclus dans le graphique, notez qu’il s’agit d’une expérience représentative et que les pourcentages peuvent être différents d’environ 5% à 10%. Veuillez cliquer ici pour voir une version agrandie de cette figure.
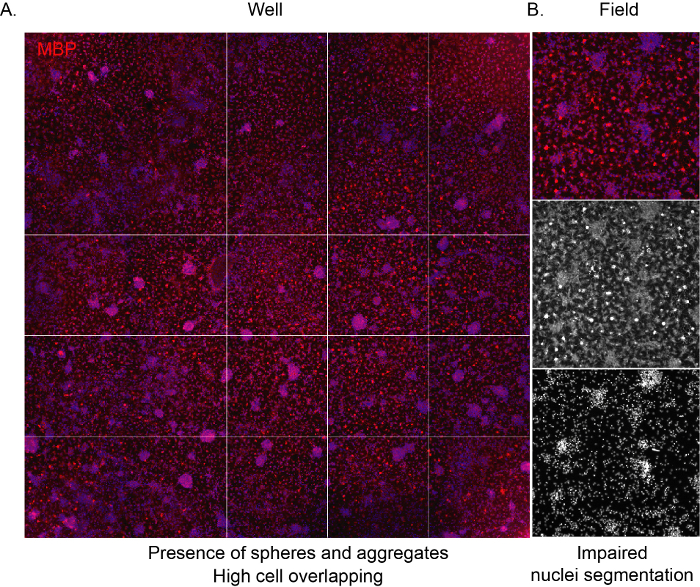
Figure 3 : Images représentatives à haute teneur d’une culture à haute densité. (A) Image représentative d’une image de puits (plaque de 96 puits) acquise par objectif 10x et marquée pour l’expression MBP à la fin de la phase de différenciation (12 DIV). ( B )Imagede champ extraite représentative mettant en évidence la présence de cellules agrégées et de noyaux qui se chevauchent. Veuillez cliquer ici pour voir une version agrandie de cette figure.
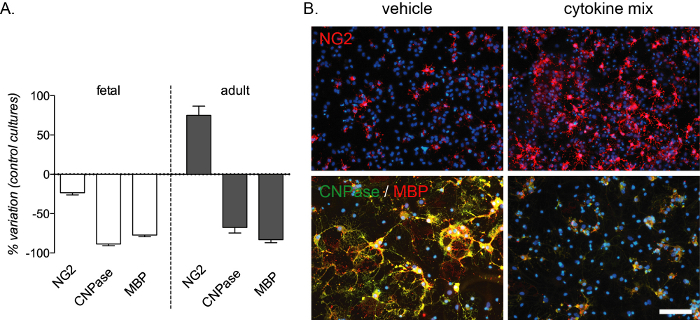
Figure 4 : Effet attendu du traitement par cytokines sur les cultures OPC d’origine fœtale et adulte. (A) Graphique montrant le pourcentage de variation des cultures OPC d’origine fœtale et adulte par rapport aux cultures standard, y compris la quantification des OPC (NG2), des préOL (CNPase) et des OL matures (MBP) à la fin de la phase de différenciation (12 DIV). (B) Images représentatives de cultures adultes à la fin de la phase de différenciation (12 VDI) traitées avec un mélange de véhicules ou de cytokines et marquées pour NG2 ou CNPase/MBP. Barre d’échelle : 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
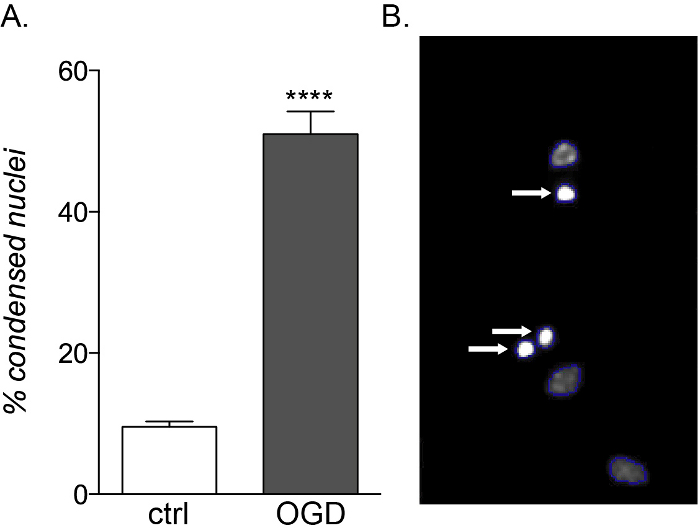
Figure 5 : Effet attendu de l’exposition aux DCI sur les cultures d’OPC d’origine fœtale. (A) Graphique montrant le pourcentage de noyaux condensés quantifiés par HCS à base de cellules dans des cultures témoins (ctrl) et exposées aux AUTRES. (B) Images représentatives d’objets traités par HCS mettant en évidence les noyaux condensés identifiés (flèches blanches). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Anticorps | Espèce | Dilution | |
| tubuline anti-β-III (système de R&D) | souris | 1:3000 | |
| anti-GFAP (Dako) | lapin | 1:1000 | |
| anti-NG2 (Millipore) | lapin | 1:350 | |
| anti-PDGFαR (Santa Cruz Biotechnology) | lapin | 1:300 | |
| anti-CNPase (Millipore) | souris | 1:500 | |
| IgG2b anti-APC, clone CC1 (Calbiochem) | souris | 1:100 | |
| Anti-MBP (Dako) | lapin | 1:250 | |
| Anti-nestin (Millipore) | souris | 1:500 | |
| Alexa Fluor 488-conjugué anti souris (ThermoFisher Scientific) | âne | 1:500 | |
| Alexa Fluor 647-conjugué anti-souris IgG2b (ThermoFisher Scientific) | chèvre | 1:500 | |
| Alexa 568-conjugué anti-lapin (ThermoFisher Scientific) | âne | 1:500 | |
Tableau 1 : Liste des anticorps primaires et secondaires.
Discussion
La nature complexe des processus de myélinisation/remyélinisation et des événements démyélinisants rend le développement de systèmes prédictifs in vitro extrêmement difficile. Les systèmes de dépistage de médicaments in vitro les plus largement utilisés sont principalement des lignées cellulaires humaines ou des cultures PRIMAIRES d’OL pur, avec une utilisation croissante de co-cultures plus complexes ou de systèmes organotypiques15. Même si de tels systèmes sont couplés à des technologies à haut contenu, les cultures OL pures restent la méthode de choix lors du développement de plateformes decriblage 16.
La culture mixte spontanée décrite ici représente un système in vitro utile, qui prend en compte toutes les principales variables: différenciation physiologique de l’OPC médiée par T3, interférences pathologiques avec le processus, autres composants cellulaires et différences liées à l’âge. La procédure contient un certain nombre de variables dérivant de l’origine des cellules (âge de l’animal) et de la formation et de la manipulation des sphéroïdes. En fait, une étape critique est la densité cellulaire des NSC ensemenc après l’isolement du tissu, car dans les conditions optimales, une seule sphère devrait dériver d’une seule cellule proliférante. Puisque nous avons vu que les NSC isolés ont tendance à s’agréger et qu’ils ont besoin de leurs propres facteurs paracrines sécrétés, les ensemencer dans une plage de 10 à 50 cellules / μL, dans une fiole t25 ou t75, est le meilleur compromis pour éviter l’agrégation cellulaire tout en permettant aux cellules de communiquer par des facteurs sécréteurs.
Les principales limites de la technique sont l’absence d’une myélinisation axonale fonctionnelle et d’une interaction directe avec les neurones, puisque la méthode ne prend en compte que la différenciation OPC jusqu’au stade des OL matures : cellules CNPase/MBP-double positives avec une morphologie en filet d’araignée. À cette fin, les OPC primaires cultivés sur des ganglions de la racine dorsale isolés restent la méthodologie principale17. Cependant, la possibilité de différencier ces cellules des animaux à tout âge est un point fondamental du processus de translation, car elle permet de tester des composés et des stimuli nocifs sur des cellules isolées à partir de l’âge d’intérêt. Comme décrit ici, en fait, les NSC peuvent être isolés à la fois du cerveau du fœtus et du cerveau adulte. Étant donné que la myélinisation développementale et la remyélinisation à l’âge adulte partagent le même objectif, c’est-à-dire atteindre l’axone nu et créer la gaine de myéline, on a émis à l’origine l’hypothèse que les deux processus étaient identiques dans tous les aspects, générant l’hypothèse dite de récapitulation18. Cependant, il est maintenant clair que les deux processus ne peuvent pas être considérés comme égaux et que des différences intrinsèques à l’âge cellulaire sont présentes et doivent être prises en compte lors du choix du modèle in vitro le plus approprié pour la question expérimentale19. Les OPC adultes dérivés des NSC, en fait, montrent de fortes différences dans la différenciation physiologique induite par la TH et la vulnérabilité aux stimuli nocifs14,20 ainsi que les OPC primaires21,22. Il existe également une hétérogénéité de la population des OPC et des LL dans les tissus adultes, particulièrement pertinente pour les conditions pathologiques23. Des protocoles pour l’isolement des OPC primaires à partir de tissus adultes sont disponibles24 et doivent être pris en compte lorsque la question expérimentale est adressée aux molécules agissant sur la remyélinisation à l’âge adulte.
La différenciation des OPC des CSN permet la représentation in vitro de l’ensemble du processus de différenciation, du précurseur indifférencié à l’OL mature. Ce processus ressemble à la condition in vivo, où TH est le principal moteur du processus, agissant à travers des récepteurs nucléaires spécifiques, et il permet une interférence expérimentale avec ce mécanisme pour imiter les conditions pathologiques dans une vue translationnelle13.
La dernière caractéristique fondamentale du modèle est la présence constante d’astrocytes tout au long de la culture. Bien que cela rende la culture plus difficile à analyser, sa composition cellulaire complexe constitue un avantage distinct. La manière dont les astrocytes contribuent à la réponse aux événements nocifs dans les cultures neuronales mixtes25 est largement connue, et l’absence de ce composant principal du SNC rend le système in vitro peu prévisible et traduisible. D’autre part, pour cette caractéristique, les cultures dérivées du NSC ont l’inconvénient d’être moins uniformes que les systèmes de type unicellulaire, ce qui peut conduire à une analyse biaisée. Cependant, la technique HCS à base de cellules permet une analyse de l’ensemble de la culture et de toutes les populations cellulaires, en supprimant également la randomisation de champs représentatifs pour l’analyse. En supposant que la culture cellulaire utilisée pour l’expérience est d’une qualité d’ensemencement fiable, le HCS donnera une image complète des conditions expérimentales, générant des données statistiquement robustes et un certain nombre d’analyses automatiques basées sur la fluorescence.
En conclusion, le protocole actuel décrit la procédure d’isolement et de différenciation des OPC dérivés du NSC du cerveau fœtal et adulte. L’ensemble du protocole prend environ 30 jours, en fonction de l’âge des animaux et des objectifs expérimentaux. En particulier, la formation de sphères d’origine adulte peut prendre deux fois plus de temps que les sphères fœtales, à la même densité d’ensemencement. Le temps de 15 jours (de -3 à 12 DIV) après l’ensemencement sur la surface 2D pour l’induction de différenciation est cependant un temps fixe dans toutes les conditions. Le protocole complet permet l’étude de l’ensemble du processus de différenciation médié par la TH dans un environnement cellulaire complexe, l’interférence par des mécanismes pathologiques spécifiques (cytokines inflammatoires et HI) et le test conséquent de nouvelles stratégies visant à surmonter ces problèmes. Le couplage du modèle de culture avec la technique HCS génère une plateforme de criblage robuste et traduisible.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Soutenu par MIUR National Technology Clustersproject IRMI (CTN01_00177_888744), et Regione Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020.
Un merci spécial à la Fondation IRET pour l’accueil du travail expérimental.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Références
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon