Method Article
Análise de diferenciação e maturação de rastreamento de alto conteúdo das culturas celulares precursoras do Oligodendrocyte, derivadas de células-tronco-tronco-tronco-de-alto teor
Neste Artigo
Resumo
Descrevemos a produção de culturas mistas de astrócitos e células precursoras oligodendrocytes derivadas de células-tronco neurais fetais ou adultas se diferenciando em oligodenrócitos maduros, e modelagem in vitro de estímulos nocivos. O acoplamento com uma técnica de triagem de alto conteúdo baseada em células constrói um sistema de triagem de drogas confiável e robusto.
Resumo
O principal obstáculo no desenvolvimento de técnicas de triagem de medicamentos para avaliar a eficácia de estratégias terapêuticas em doenças complexas é encontrar um equilíbrio entre a simplificação in vitro e a recriação do complexo ambiente in vivo, juntamente com o objetivo principal, compartilhado por todas as estratégias de triagem, de obtenção de dados robustos e confiáveis, altamente preditivos para a tradução in vivo.
No campo das doenças desmielinizantes, a maioria das estratégias de rastreamento de medicamentos baseia-se em linhas celulares imortalizadas ou culturas puras de células precursoras de oligodendrocytos primários isolados (OPCs) de animais recém-nascidos, levando a fortes vieses devido à falta de diferenças relacionadas à idade e a qualquer condição ou complexidade patológica real.
Aqui mostramos a configuração de um sistema in vitro destinado a modelar a diferenciação fisiológica/maturação de OPCs derivados de células-tronco neurais (NSC), facilmente manipulados para imitar condições patológicas típicas de doenças desmielinizantes. Além disso, o método inclui o isolamento de cérebros fetais e adultos, dando um sistema que se diferencia dinamicamente de OPCs para oligodenrócitos maduros (OLs) em uma cocultura espontânea que também inclui astrócitos. Este modelo se assemelha fisiologicamente ao processo de mielinação mediada por hormônios da tireoide e processo de reparação da mielina, permitindo a adição de interferentes patológicos que modelam mecanismos da doença. Mostramos como imitar os dois principais componentes das doenças desmielinizantes (ou seja, hipoxia/isquemia e inflamação), recriando seu efeito na mielina do desenvolvimento e na reparação da mielina adulta e levando em conta todos os componentes celulares do sistema, ao mesmo tempo em que focamos na diferenciação de OPCs.
Este modelo misto espontâneo, juntamente com tecnologias de triagem de alto conteúdo baseadas em células, permite o desenvolvimento de um sistema robusto e confiável de triagem de medicamentos para estratégias terapêuticas destinadas a combater os processos patológicos envolvidos na desmielinização e induzir a remielinização.
Introdução
No sistema nervoso central (SNC), as células formadoras de mielina (oligodendrocytes, OLs) e seus precursores (células precursoras oligodendrocytes, OPCs) são responsáveis pela mielinação do desenvolvimento, processo que ocorre durante os períodos peri e pós-natal, e para a rotatividade e reparação da mielina (remielinização) na idade adulta1. Essas células são altamente especializadas, interagindo anatomicamente e funcionalmente com todos os outros componentes gliais e neuronais, tornando-as uma parte fundamental da estrutura e função do CNS.
Eventos desmelique estão envolvidos em diferentes lesões e doenças do CNS2, e atuam principalmente em OPCs e OLs por meio de mecanismos multifatoriais, tanto durante o desenvolvimento quanto na idade adulta. Os precursores indiferenciados são impulsionados por fatores diferenciadores, principalmente o hormônio da tireoide (TH), em um processo sincronizado3 que leva o OPC a reconhecer e responder a estímulos específicos que induzem a proliferação, migração para o axônio não mielinado e diferenciação em OLs maduros que, por sua vez, desenvolvem a baiamielina 4. Todos esses processos são finamente controlados e ocorrem em um ambiente complexo.
Devido à natureza complexa dos eventos de mielinação, remielinação e dessalinização, há uma grande necessidade de um método in vitro simplificado e confiável para estudar os mecanismos subjacentes e desenvolver novas estratégias terapêuticas, com foco no principal player celular: o OPC5.
Para que um sistema in vitro seja confiável, uma série de fatores precisam ser levados em conta: a complexidade do ambiente celular, diferenças intrínsecas relacionadas à idade celular, diferenciação fisiológica mediada pelo TH, mecanismos patológicos e a robustez dos dados6. De fato, a necessidade não atendida no campo é um modelo que imita a complexidade da condição in vivo, não alcançada com sucesso através do uso de culturas OPC puras isoladas. Além disso, os dois principais componentes dos eventos desmielinizadores, inflamação e hipóxia/isquemia (OI), envolvem diretamente outros componentes celulares que podem afetar indiretamente a diferenciação fisiológica e a maturação das OPCs, aspecto que não pode ser estudado em modelos in vitro super simplificados.
A partir de um sistema de cultura altamente preditivo, o desafio subsequente e mais geral é a produção de dados robustos e confiáveis. Nesse contexto, a triagem de alto teor baseado em células (HCS) é a técnica mais adequada7, uma vez que nosso objetivo é, em primeiro lugar, analisar toda a cultura em um fluxo de trabalho automático, evitando o viés de escolha de campos representativos e, em segundo lugar, obter a geração automática e simultânea de dados de alto conteúdo baseados em imagem8.
Dado que a principal necessidade é alcançar o melhor equilíbrio entre a simplificação in vitro e a complexidade in vivo-imitação, aqui apresentamos um método altamente reprodutível para a obtenção de OPCs derivados de células-tronco neurais (NSCs) isoladas do cérebro fetal e da zona sub-ventricular adulta (SVZ). Este modelo in vitro abrange todo o processo de diferenciação OPC, desde NSC multipotente até OL maduro/mieliing, de forma fisiológica dependente de TH. A cultura resultante é um sistema de diferenciação/amadurecimento dinamicamente que resulta em uma cocultura espontânea que consiste principalmente em diferenciar OPCs e astrócitos, com baixa porcentagem de neurônios. Essa cultura primária imita melhor o complexo ambiente in vivo, enquanto sua derivação de células-tronco permite que manipulações simples sejam realizadas para obter o enriquecimento de linhagem celular desejado.
Ao contrário de outras estratégias de triagem de medicamentos utilizando linhas celulares ou culturas puras de OPCs primárias, o método descrito aqui permite o estudo do efeito de interferentes patológicos ou moléculas terapêuticas em um ambiente complexo, sem perder o foco no tipo celular desejado. O fluxo de trabalho do HCS descrito permite uma análise da viabilidade celular e especificação de linhagem, bem como de morte celular específica da linhagem e parâmetros morfológicos.
Protocolo
Todos os protocolos de animais aqui descritos foram realizados de acordo com as Diretivas do Conselho Comunitário Europeu (86/609/CEE) e cumprem as diretrizes publicadas no Guia do NIH para o Cuidado e Uso de Animais de Laboratório.
1. Soluções e reagentes
- Preparar o meio padrão: DMEM/F12 GlutaMAX 1x; HEPES de 8 mmol/L; 100 U/100 μg Penicillin/Streptomycin (1% P/S); 1x B27; 1x N-2.
- Prepare o meio da neurosfera: adicione 10 ng/mL bFGF; 10 ng/mL EGF para médio padrão.
- Preparar oligosfera/meio OPC: adicionar 10 ng/mL bFGF; 10 ng/mL PDGF-AA para médio padrão.
- Prepare o meio de diferenciação oligodendroctye: adicione 50 nM T3; 10 ng/mL CNTF; 1x N-acetil-L-cisteína (NAC) para médio padrão.
- Prepare o tampão de dissociação não enzimático: adicione 1% P/S ao tampão de dissociação não enzimático e mantenha o gelo frio.
- Prepare a solução de sacarose: HBSS, 0,3 g/mL de sacarose.
- Prepare a solução de lavagem BSA: EBSS, 40 mg/mL BSA, 0,02 mL/l HEPES.
- Prepare tampão de dissociação enzimática: HBSS, 5,4 mg/mL D-glicose, 15 mmol/L HEPES, 1,33 mg/mL Trypsin, 0,7 mg/mL Hyaluronidase, 80 U/mL DNase.
- Prepare a mistura de citocinas: TGF-β1, TNF-α, IL-1β, IL-6, IL-17 e IFN-γ (20 ng/mL cada).
- Prepare o veículo mix de citocinas: 0,04% do estoque (10% glicerol/100 nM de glycina/25 nM Tris, pH 7.3).
- Prepare o meio de privação oxigênio-glicose: meio padrão usando glicose DMEM w/o. Dependendo da stringency da condição de privação de glicose desejada, é possível remover também B27 e/ou N2 do meio para evitar compostos relacionados à glicose (por exemplo, D-Galactose em B27).
2. Dissecção e isolamento do NSC
NOTA: Os NSCs fetais e adultos foram isolados do cérebro fetal E13,5 ou da zona sub-ventricular adulta (SVZ), seguindo o protocolo Ahlenius e Kokaia9 com modificações.
- Culturas fetais do NSC
NOTA: Antes de iniciar as dissecções, prepare tubos de 1,5 mL contendo 150 μL de tampão de dissociação não enzimática cada um; limpar pratos de Petri e adicionar HBSS gelado.- Colete os embriões em E13.5 - 14.5 de camundongos grávidas cronometradas e coloque em uma placa de Petri contendo HBSS frio.
- Decapitar os embriões usando fórceps.
- Coloque as cabeças dos embriões em uma placa de Petri limpa contendo PBS gelada e remova a pele do crânio com fórceps, usando lupas ou um estereoscópio.
- Uma vez que o cérebro é visível e limpo da pele, esprema-o aplicando pressão nos lados com fórceps.
- Retire o cerebelo, mantenha apenas o cérebro e remova as meninges com fórceps.
- Coloque o tecido isolado no tampão de dissociação não enzimática e repita as etapas de dissecção com os outros embriões. Insira o tecido de 2 a 3 animais em cada tubo contendo o tampão.
- Incubar a 37 °C por 15 min sob agitação contínua.
- Após a incubação, adicione 850 μL de médio padrão e misture por pipetação até que a suspensão esteja livre de aglomerados.
- Se o tecido não dissociado ainda estiver visível, espere por 2 min no RT até que ele se deposite na parte inferior do tubo.
- Quando a dissociação estiver completa, conte as células e as emplaque em suspensão a uma densidade de 10-50 células/μL em um frasco T-25 ou T-45 contendo 10-30 mL de neurosfera, mantido em posição vertical para evitar a adesão celular.
-
Culturas de NSC adultos
- Sacrificar animais por luxação cervical.
- Colete cérebros de 4 a 5 ratos em um tubo de 50 mL contendo HBSS gelado.
- Coloque o cérebro em uma superfície fria e estéril. Para isso, use um frasco T-25 cheio de água e colocado a -20 °C durante a noite. No momento do experimento, cubra o frasco com papel alumínio estéril.
- Coloque o lado ventral do cérebro para baixo, na direção rostro-caudal, e remova as lâmpadas olfativas usando uma lâmina de barbear.
- Usando uma lâmina de barbear, corte 2-3 fatias coronais de 1 mm de espessura, do córtex ao quiasma óptico.
- Coloque as fatias na superfície fria em uma posição ventro-dorsal e identifique o corpus caloso e os dois ventrículos laterais.
- Usando lupas ou um estereoscópio, isole as paredes dos ventrículos laterais, tomando cuidado para não carregar pedaços do caloso corpus.
- Coloque o tecido isolado no tampão de dissociação enzimática (5-10 mL) e incubar a 37 °C por 15 min.
- Misture a solução, pipetando várias vezes (pelo menos 50), e incubar novamente a 37 °C por 10 min.
- Neutralizar a trippsina adicionando 5 mL de meio de cultura padrão e filtrar a solução usando um filtro de 70 μm.
- Centrifugar a solução filtrada por 5 min a 400 x g.
- Resuspengem a pelota na solução de sacarose e centrífuga por 10 min a 500 x g.
- Resuspenha a pelota na solução de lavagem BSA e centrífuga por 7 min a 400 x g.
- Resuspend a pelota no meio de cultura padrão, conte as células e realize o revestimento conforme descrito acima (na etapa 2.1.10).
3. Neuroesferas primárias
- Adicione os fatores de crescimento (bFGF/EGF) a cada 2 dias.
- A cada 4 a 6 dias (dependendo da densidade celular), troque metade do meio da seguinte forma:
- Transfira toda a suspensão celular para um tubo de 15 ou 50 mL.
- Centrifugar por 5 min a 400 x g.
- Remova metade do volume.
- Adicione a mesma quantidade de meio fresco, misture suavemente por pipetação e adicione fatores de crescimento.
4. Oligosferas
NOTA: A diferenciação de oligodendrocito é realizada seguindo o protocolo Chen10 com modificações.
- Quando as neurosferas atingem um diâmetro de 100-150 μm, elas estão prontas para serem aprovadas. Para isso, transfira toda a suspensão celular para um tubo de 15 ou 50 mL, e centrífuga por 5 min a 400 x g.
- Avalie rapidamente o diâmetro tirando fotos das esferas usando um microscópio de luz transmitida invertida e abrindo-as pelo software ImageJ.
- Clique no menu Analisar e na janela Ferramentas, selecione Barra de escala.
- Defina 150 μm como Largura em mícrons e compare a barra de escala com as esferas.
- Remova todo o volume por inversão e resuspense a pelota em 180 μL de meio de cultura padrão fresco. Pipeta 50 vezes para permitir a desagregação das esferas.
- Adicione 810 μL de meio de cultura padrão fresco, conte as células e reemplaque-as como descrito para as neurosferas.
- Adicionar bFGF/PDGF-AA 10 ng/mL a cada 2 dias.
- A cada 4 a 6 dias (dependendo da densidade celular), troque metade do meio da seguinte forma:
- Transfira toda a suspensão celular para um tubo de 15 ou 50 mL.
- Centrifugar por 5 min a 400 x g.
- Remova metade do volume.
- Adicione a mesma quantidade de meio fresco, misture suavemente por pipetação e adicione fatores de crescimento.
5. Revestimento de placas
- Revestimento poly-D, L-ornithine/laminin: pelo menos 2 dias antes de emplacamento dos OPCs, adicione 50 μg/mL de poli-D, solução L-ornithine, diluída em PBS, para cada poço (40 μL/well para placas de 96 poços) e incubar na RT durante a noite.
- No dia seguinte, retire o líquido e lave três vezes com água estéril destilada.
- Deixe as placas secarem no RT durante a noite. No dia seguinte, adicione uma solução de laminina diluída em PBS (5 μg/mL; 40 μL/well para placas de 96 poços) e incubar por 2h a 37 °C.
6. Semeadura celular
- Quando as oligosferas atingem um diâmetro de 100-150 μm, elas estão prontas para serem dissociadas e semeadas nas placas revestidas de poli-D, L-ornithine/laminina. Para isso, transfira toda a suspensão celular para um tubo de 15 ou 50 mL, e centrífuga por 5 min a 400 x g (conforme indicado na etapa 4.1)
- Remova todo o volume por inversão e resuspense a pelota em 180 μL de meio de cultura padrão fresco. Pipeta 50 vezes para permitir a desagregação das esferas.
- Adicione 810 μL de meio de cultura padrão fresco e conte as células.
- Remova a solução de laminina dos poços e emplaque as células a 3.000 células/cm2 densidade (100 μL/bem para placas de 96 poços).
7. Indução de diferenciação OPC
- Após 3 dias, retire todo o meio e adicione o mesmo volume do meio de diferenciação de oligodendrocito.
- Troque metade do meio a cada 4 dias e adicione um novo mix de diferenciação (T3/CNTF/NAC) a cada 2 dias.
8. Indução do bloco de diferenciação mediado por inflamação
- Após a dissociação da neurosfera e a produção de oligosfera (seção 4), adicione a mistura de citocinas ao meio da cultura e mantenha as oligosferas expostas a citocinas para toda a etapa de formação das esferas.
NOTA: O volume depende do número de células, uma vez que para as esferas que formam células são semeadas a 10-50 células/μL. - Se o meio precisar ser alterado, altere todo o volume e adicione a mistura de citocina mais uma vez.
9. Indução da morte celular de privação de oxigênio-glicose
- Em -1 DIV (2 dias após a semeadura de células em placas multiwell), remova o meio e conserva-o em uma nova placa multiwell.
- Adicione metade do volume (50 μL para placas de 96 poços) de OGD-médio (grupo OGD) ou meio fresco (grupo de controle). A metade do volume é usada para reduzir a troca de oxigênio entre o líquido e o ar.
- Coloque as culturas do grupo OGD em uma câmara hermética de hipóxia saturada com 95% N2 e 5% de CO2. Para alcançar a saturação da câmara, deixe a mistura de gás fluir por 6 min a 25 l/min antes de fechar os tubos da câmara.
- Incubar a câmara hipóxica na incubadora por 3h. O grupo controle e as placas contendo o meio removido e conservado na etapa 9.1 também devem ser deixados na incubadora.
- Remova o grupo OGD livre de glicose ou o novo meio (grupo controle) e adicione o meio removido e conservado na etapa 9.1.
10. Imunocytoquímica
- No ponto de tempo desejado, fixar as células com paraformaldeído frio de 4% por 20 minutos na RT.
- Lave duas vezes com PBS (10 minutos de incubação para cada lavagem em RT).
- Incubar 1 h na RT com a solução de bloqueio (PBS Triton 0,3% contendo 1% BSA e 1% de burro/cabra normal.
- Incubar com mistura de anticorpos primários(Tabela 1),diluído em tritão PBS 0,3%, durante a noite a 4 °C.
- Lave duas vezes com PBS (10 minutos de incubação para cada lavagem em RT).
- Incubar com anticorpo secundário (Tabela 1) solução diluída em tritão PBS 0,3% adicionando Hoechst 33258 por 30 min a 37 °C.
- Lave duas vezes com PBS (10 minutos de incubação para cada lavagem em RT).
11. Análise do HCS sobre viabilidade celular, composição de linhagem e morte celular específica da linhagem
NOTA: As imagens representativas do HCS e o fluxo de trabalho são mostrados na Figura 2A,B.
- Selecione o algoritmo de Análise Compartimental no menu principal do software (HCS Studio v 6.6.0) e selecione Digitalizar no menu principal Desenvolver ensaio/placa de varredura.
- Na janela iDev, selecione Nova e selecione Ferramenta de medição de intensidade geral do modelo Develop Assay.
- Clique em Criar no lado direito do menu, selecionando o objetivo de 10x.
- Isso abrirá o menu Configurar aquisição. Nesta janela, selecione os seguintes parâmetros: (a) número de canais: o primeiro para a coloração nuclear hoechst (BGRFR_386) e um para cada marcador específico de linhagem usado na reação (b) selecione o foco do software no canal 1 e o intervalo de foco automático como 1 (c) selecione o modelo de placa da lista.
- A partir do menu de aquisição, veja a qualidade da coloração em diferentes poços e diferentes campos e selecione manualmente o tempo de exposição selecionando o Tempo de Exposição Fixa no menu.
- Uma vez definidos os parâmetros de aquisição, selecione Mini Scan na parte superior do menu e selecione dez campos por poço em dois poços por condição experimental. Isso permitirá a configuração de todo o parâmetro de análise em um subconjunto de campos para toda a placa.
- Quando a mini varredura estiver concluída, clique no Parâmetro de ensaio configurar para configurar o algoritmo da análise.
- Clique em Configurar grupos no lado direito da janela e arrastar e soltar os poços do miniscan. Clique no botão Adicionar na subseção Grupos para configurar os diferentes grupos.
- Siga o fluxo de trabalho no lado esquerdo da janela passo a passo para desenvolver todo o algoritmo. Selecione primeiro Imagem de processo para cada canal e clique em Remoção de fundo e no nível desejado.
- Primeiro identificar e selecionar os núcleos por coloração nuclear. Clique em Identificar objeto primário – Canal 1 para selecionar os núcleos reais e evitar analisar artefatos e detritos. Para isso, amplie uma imagem representativa da coloração nuclear e verifique se os núcleos estão bem cercados pelo perímetro construído pelo software. É possível alterar o valor de limiar e aplicar algoritmos de segmentação para identificar melhor núcleos únicos.
- Uma vez que os núcleos sejam definidos corretamente, clique na seguinte etapa: Validar objeto primário. Selecione Object.BorderObject.Ch1 para evitar a análise de núcleos na borda de cada imagem de campo. Selecione Object.Area.Ch1 e, movendo as barras "baixas" e "altas" nos histogramas, remova todos os detritos identificados ou objetos grandes correspondentes a agregados ou artefatos.
- Verifique todas as imagens representativas da mini varredura de todas as condições experimentais para ter certeza de que os parâmetros selecionados se encaixam com todos eles.
- Clique em Identificar pontos para cada canal correspondente aos marcadores de linhagem específicos e selecione os valores do anel: Largura = 3 e Distância = 0. Isso permitirá a identificação da fluorescência citoplasmática. De acordo com a densidade celular, esses valores podem ser adaptados. O software evitará automaticamente a sobreposição entre anéis adjacentes.
- Selecione Níveis de referência no fluxo de trabalho para construir a análise. A definição dos níveis de referência permitirá a contagem automática de núcleos condensados, baseados no tamanho nuclear e intensidade de coloração nuclear, e de células específicas marcador-positivas, baseadas na fluorescência citoplasmática identificada pelo Anel.
- Primeiro clique em Object.Area.Ch1. Nas imagens mini scan, selecione um núcleo condensado e mova a barra "LOW" nos histogramas, a fim de selecionar como "condensado" todos os núcleos sob este tamanho.
- Clique em Object.AvgIntensity.Ch1. Nas imagens mini scan, selecione um núcleo condensado e mova a barra "ALTA" nos histogramas, a fim de selecionar como "condensado" todos os núcleos acima desta intensidade de fluorescência.
- Clique em Object.RingAvgIntensity para cada canal de marcadores específicos de linhagem. Selecione em suas mini imagens uma célula positiva e mova a barra "HIGH" nos histogramas, a fim de selecionar como "positivo" todas as células acima desta intensidade de fluorescência.
- Verifique todas as imagens representativas da mini varredura de todas as condições experimentais para ter certeza de que os parâmetros selecionados se encaixam com todos eles.
- No menu superior, selecione Caracterização populacional e selecione Subpopulação de Eventos.
- Como Evento tipo 1, selecione ObjectAreaCh1 na lista esquerda e clique no botão E > e, finalmente, selecione ObjectAvgIntensityCh1. Isso permitirá a identificação de núcleos condensados, como uma combinação de baixa área e alta intensidade.
- Na mesma janela, desmarque todos os limites de varredura.
- Clique em Selecionar recursos para armazenar no menu superior, para escolher os parâmetros para manter na análise.
- Selecione Recursos de poço e mova-se da lista à esquerda para a direita apenas os parâmetros desejados: (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (Para cada canal dos marcadores de linha de linha específicos).
NOTA: Esta análise dará como leitura o número total de células, a porcentagem de núcleos condensados e a porcentagem de células positivas específicas de linhagem para cada marcador analisado no número total da célula. Se a porcentagem das diferentes linhagens é necessária apenas em células vivas, é possível manter o valor "High_RingAvgIntensity" para o canal (número absoluto de células positivas) e recalcular a porcentagem no número total de células após a subtração da porcentagem de células mortas.- Alternativamente, é possível remover as células mortas da análise estabelecendo os mesmos parâmetros utilizados para identificar núcleos condensados (etapas 11.14-11.15) sobre a validação dos núcleos (etapa 11.11).
- Selecione Digitalizar placa no menu principal e clique no símbolo da placa no subempreste de configuração de varredura na seção superior para identificar o poço a analisar.
- Escreva o nome do experimento e a descrição e, uma vez concluídas todas as configurações, pressione o símbolo de reprodução.
Resultados
A primeira fase da cultura pode variar de duração, dependendo da densidade de semeadura e se as esferas são de origem fetal ou adulta. Além disso, as oligosferas apresentam uma redução da população em relação às neuroesferas (Figura 1B). Além disso, a produção de esferas a partir de tecido adulto é mais lenta e pode levar de 2 a 3 semanas para gerar oligosferas em comparação com o fetal que pode levar de 1 a 2 semanas, dependendo da densidade de semeadura.
Uma vez semeada, toda a fase de diferenciação das culturas pode ser monitorada usando anticorpos específicos da linhagem. Como o objetivo deste protocolo é estudar a fase final da diferenciação, a composição cultural em 0 DIVs não é apresentada. No entanto, durante a primeira fase da cultura, as células ainda serão nestin-positivas, representando precursores neurais, e a maioria das células também são NG2-positivos (OPCs)11. As células positivas do CNPase, correspondentes ao estágio pré-OL, serão detectáveis de 3 a 6 dias após a indução de diferenciação mediada por T3, enquanto as células MBP-positivas aparecerão entre 6 e 12 DIVs (OLs maduros; ver Figura 2C para a composição das culturas no final da fase de diferenciação).
A análise do HCS permite a detecção de cada célula na cultura através da coloração nuclear e da análise da intensidade da fluorescência nos canais remanescentes(Figura 2A,B). A composição da cultura ao final da fase de diferenciação (12 DIVs) difere dependendo se as culturas são de origem fetal ou adulta, com culturas fetais mais responsivas à diferenciação mediada por T3 e atingindo um percentual maior de OLsmaduros 12.
Durante todo o processo de cultura, cerca de 40% a 50% das células são astrócitos (células positivas gfap), enquanto uma pequena porcentagem (menos de 0%-10%) são neurônios (células beta-III-tubulina-positivas; Figura 2C). A composição cultural pode variar de 10% entre diferentes preparações culturais. Culturas adultas e fetais diferem para o rendimento da produção madura de OLs no final da fase de diferenciação, com células fetais apresentando alto percentual de OLs maduros, baixo percentual de precursores e cerca de 30%-40% de astrócitos. Por outro lado, as culturas adultas apresentam mais astrócitos (cerca de 45%-55%) e células menos diferenciadas após 12 DIVs de indução de diferenciação.
Para permitir que o software reconheça as células e forneça uma análise imparcial adequada da composição da cultura, é importante que a densidade de semeadura esteja correta, evitando a sobreposição entre as células adjacentes. Quando os OPCs derivados do NSC são semeados em alta densidade, eles tendem a agregar muito rapidamente, levando a toda a superfície do poço sendo ocupada por astrócitos após alguns dias. Além disso, os OLs maduros com sua forma característica de rede de aranha não serão visíveis devido ao espaço limitado (Figura 3A,B).
O bloco de diferenciação mediado por inflamação é reproduzível por este ensaio in vitro e gera uma forte diminuição de pré-TOS e OLs maduros detectados por cnpase e mbp manchas em culturas fetais e adultas. Um aumento no número de OPCs também ocorre nas culturas adultas (Figura 4A,B). A composição da mistura de citocinas foi escolhida a partir de experimentos in vivo em um modelo de rato de esclerose múltipla13, e foi testada como um modelo in vitro para o bloco de diferenciação mediado pela inflamação que ocorre nesta doença.
Enquanto os OPCs fetais e adultos apresentam a mesma vulnerabilidade à exposição inflamatória à citocina, apenas culturas derivadas do fetal são sensíveis à toxicidade OGD(Figura 5A,B),mostrando um aumento na morte celular e comprometimento da diferenciação devido ao seu perfil metabólico diferente14.

Figura 1: Configuração e protocolo de diferenciação da cultura celular precursora do oligodendrocyte derivado de células-tronco neurais. (A) Esquema do procedimento experimental. (B) Imagens representativas de neurosferas em 2, 5 e 7 DIVs, e gráfico mostrando a população duplicando neuroferas e oligosferas. Barra de escala: 100 μm. (C) Imagens representativas de OPCs derivados da oligosfera semeadas mostrando os diferentes estágios de diferenciação, de células nestin e NG2 positivas em 0 DIV (precursor neural/OPCs), através de células CNPase-positivas em 6 DIVs (pré-OLs) e células duplas positivas CNPase/MBP no final da fase de diferenciação (12 DIVs maduros; OLs maduros). Células gfap-positivas (astrócitos) e uma pequena porcentagem de células beta-III-tubulina positivas (neurônios) estão presentes em toda a cultura. Barras de escala: 20 μm. Clique aqui para ver uma versão maior desta figura.
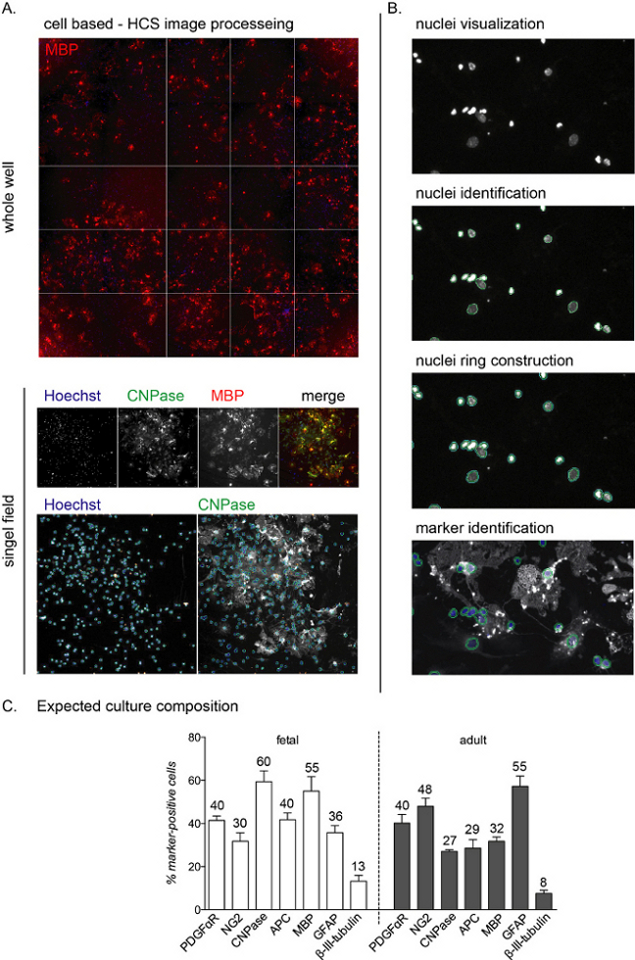
Figura 2: Fluxos de trabalho de análise de alto conteúdo baseados em células e leitura de diferenciação esperada. (A) Imagens representativas da aquisição do HCS de um poço inteiro (placa de 96 poços) e de um campo único isolado adquirido com um objetivo de 10x de uma cultura de 12 DIVs de OPCs derivados de NSC. (B) Análise do HCS etapas de fluxo de trabalho, incluindo visualização, identificação e construção de núcleos para identificar a coloração citoplasmática e identificação do marcador. (C) Gráfico mostrando a composição de cultura esperada no final da fase de diferenciação (12 DIVs). Marcadores para OPCs (PDGFαR, NG2), preOLs (CNPase, APC), OLs maduros (MBP), astrócitos (GFAP) e neurônios (β-III-tubulina) são mostrados para culturas fetais e adultas. As porcentagens arredondadas para cada marcador de célula estão incluídas no gráfico, observe que este é um experimento representativo e os percentuais podem ser diferentes em torno de 5%-10%. Clique aqui para ver uma versão maior desta figura.
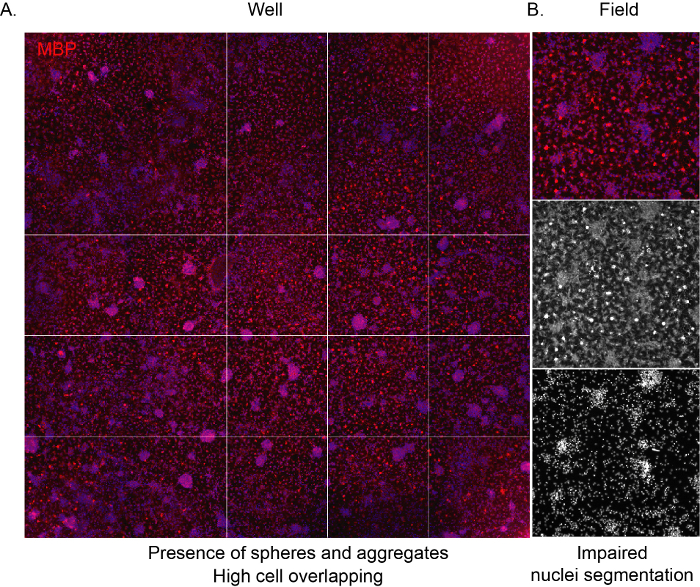
Figura 3: Imagens representativas de triagem de alto conteúdo de uma cultura de alta densidade. (A) Imagem representativa de uma imagem de poço (placa de 96 poços) adquirida por 10x objetivo e marcada para expressão MBP no final da fase de diferenciação (12 DIVs). (B) Imagem de campo extraída representativa destacando a presença de células agregadas e núcleos sobrepostos. Clique aqui para ver uma versão maior desta figura.
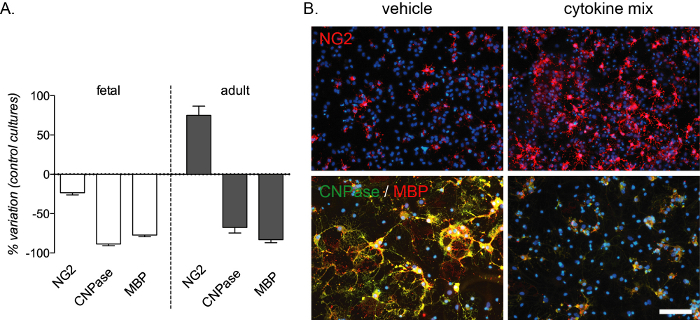
Figura 4: Efeito esperado do tratamento de citocinas nas culturas OPC derivadas de fetais e adultos. (A) Gráfico mostrando a porcentagem de variação das culturas OPC derivadas de fetais e adultos em relação às culturas padrão, incluindo a quantificação de OPCs (NG2), preOLs (CNPase) e OLs maduros (MBP) no final da fase de diferenciação (12 DIVs). (B) Imagens representativas de culturas adultas ao final da fase de diferenciação (12 DIVs) tratadas com mistura de veículo ou citocina e marcadas para NG2 ou CNPase/MBP. Barra de escala: 20 μm. Clique aqui para ver uma versão maior desta figura.
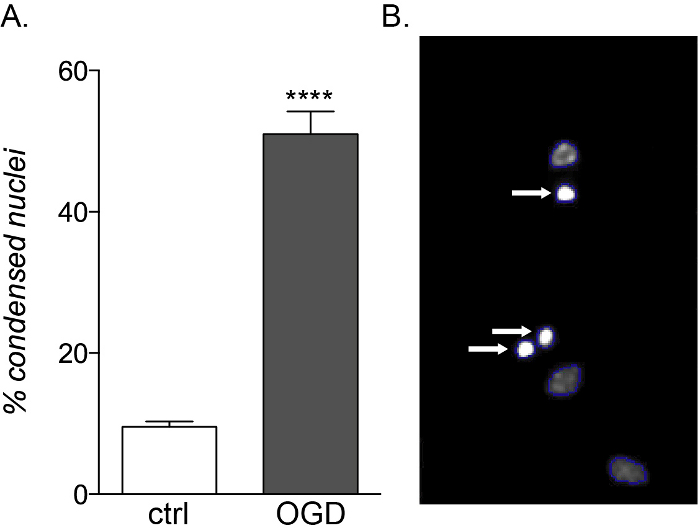
Figura 5: Efeito esperado da exposição ao OGD nas culturas OPC derivadas do fetal. (A) Gráfico mostrando a porcentagem de núcleos condensados quantificados por culturas de controle baseadas em células (ctrl) e expostas ao OGD. (B) Imagens representativas de objetos processados pelo HCS destacando os núcleos condensados identificados (setas brancas). Clique aqui para ver uma versão maior desta figura.
| Anticorpo | Espécie | Diluição | |
| anti-β-III-tubulin (sistema de P&D) | rato | 1:3000 | |
| anti-GFAP (Dako) | coelho | 1:1000 | |
| anti-NG2 (Millipore) | coelho | 1:350 | |
| anti-PDGFαR (Biotecnologia de Santa Cruz) | coelho | 1:300 | |
| anti-CNPase (Millipore) | rato | 1:500 | |
| IgG2b anti-APC, clone CC1 (Calbiochem) | rato | 1:100 | |
| Anti-MBP (Dako) | coelho | 1:250 | |
| Anti-nestin (Millipore) | rato | 1:500 | |
| Alexa Fluor 488-conjugado anti mouse (ThermoFisher Scientific) | burro | 1:500 | |
| Alexa Fluor 647-conjugado anti-mouse IgG2b (ThermoFisher Scientific) | cabra | 1:500 | |
| Alexa 568-conjugado anti-coelho (ThermoFisher Scientific) | burro | 1:500 | |
Tabela 1: Lista de anticorpos primários e secundários.
Discussão
A natureza complexa dos processos de mielinação/remielinização e eventos desmielinização torna o desenvolvimento de sistemas in vitro preditivos extremamente desafiadores. Os sistemas de triagem de drogas in vitro mais utilizados são principalmente linhas de células humanas ou culturas primárias de OL puras, com uso crescente de co-culturas mais complexas ou sistemas organotipicos15. Mesmo que tais sistemas estejam associados a tecnologias de alto conteúdo, culturas puras de OL continuam sendo o método de escolha ao desenvolver plataformas de triagem16.
A cultura mista espontânea descrita aqui representa um sistema in vitro útil, que leva em conta todas as principais variáveis: diferenciação oPC mediada fisiológica de T3, interferentes patológicos com o processo, outros componentes celulares e diferenças relacionadas à idade. O procedimento contém uma série de variáveis derivando da origem das células (idade do animal) e da formação e manipulação dos esferoides. Na verdade, um passo crítico é a densidade celular de NSCs semeando após o isolamento do tecido, porque na condição ideal uma única esfera deve derivar de uma única célula proliferante. Uma vez que vimos que os NSCs isolados tendem a agregar e que eles precisam de seus próprios fatores paracrinos secretos, semeando-os em uma gama de 10-50 células/μL, em um frasco t25 ou t75, é o melhor compromisso para evitar a agregação celular, mas ainda permitindo que as células se comuniquem por fatores secretos.
As principais limitações da técnica são a falta de uma mielina funcional axonal e uma interação direta com os neurônios, uma vez que o método leva em conta apenas a diferenciação oPC até o estágio de OLs maduros: CÉLULAS POSITIVAS CNPase/MBP-dupla positiva com uma morfologia da rede de aranha. Para isso, as OPCs primárias cultivadas em gânglios de raiz dorsal isolada ainda é a metodologia principal17. No entanto, a possibilidade de diferenciar essas células de animais em qualquer idade é um ponto fundamental no processo translacional, uma vez que permite o teste de compostos e estímulos nocivos em células isoladas da idade de interesse. Como descrito aqui, na verdade, os NSCs podem ser isolados tanto do cérebro fetal quanto do adulto. Uma vez que a mielina e a remielinação do desenvolvimento na idade adulta compartilham o mesmo objetivo, ou seja, alcançar o axônio nu e criar a baia de mielina, foi originalmente hipótese de que os dois processos eram idênticos em todos os aspectos, gerando a chamada hipótese de recapitulação18. No entanto, agora está claro que os dois processos não podem ser considerados iguais e que as diferenças relacionadas à idade intrínsecos estão presentes e devem ser levadas em conta na escolha do modelo in vitro mais adequado para a questão experimental19. Os OPCs derivados de NSCs adultos, de fato, apresentam fortes diferenças na diferenciação fisiológica orientada ao TH e à vulnerabilidade a estímulos nocivos14,20, bem como opcs primários21,22. Há também heterogeneidade da população de OPCs e OLs em tecidos adultos, de particular relevância para as condições patológicas23. Protocolos para isolamento primário de OPCs de tecidos adultos estão disponíveis24 e devem ser considerados quando a questão experimental é dirigida a moléculas que atuam na remielinização na idade adulta.
A diferenciação de OPCs dos NSCs permite a representação in vitro de todo o processo de diferenciação, de precursor indiferenciado a OL maduro. Este processo se assemelha à condição in vivo, onde o TH é o principal condutor do processo, atuando através de receptores nucleares específicos, e permite interferência experimental com esse mecanismo para imitar condições patológicas em uma visão translacional13.
A característica fundamental final do modelo é a presença constante de astrócitos em toda a cultura. Embora isso torne a cultura mais difícil de analisar, sua complexa composição celular constitui uma vantagem distinta. A forma como os astrócitos contribuem para a resposta a eventos nocivos nas culturas neuronais mistas25 é amplamente conhecida, e a ausência deste componente principal do CNS torna o sistema in vitro pouco previsível e traduzível. Por outro lado, para essa característica, as culturas derivadas do NSC têm a desvantagem de serem menos uniformes do que sistemas de tipo de célula única, o que pode levar a uma análise tendenciosa. No entanto, a técnica de HCS baseada em células permite uma análise de toda a cultura e de todas as populações celulares, removendo também a randomização de campos representativos para análise. Supondo que a cultura celular utilizada para o experimento seja de uma qualidade confiável de semeadura, o HCS dará uma visão completa das condições experimentais, gerando dados estatisticamente robustos e uma série de análises automáticas baseadas em fluorescência.
Em conclusão, o protocolo atual descreve o procedimento para o isolamento e diferenciação de OPCs derivados do NSC do cérebro fetal e adulto. Todo o protocolo leva cerca de 30 dias, dependendo da idade dos animais e das metas experimentais. Em particular, a formação de esferas de origem adulta pode levar o dobro de tempo em comparação com as fetais, na mesma densidade de semeadura. O tempo de 15 dias (de -3 a 12 DIVs) após a semeadura na superfície 2D para a indução de diferenciação é, no entanto, um tempo fixo em todas as condições. O protocolo completo permite o estudo de todo o processo de diferenciação mediada pelo TH em um ambiente celular complexo, interferência por meio de mecanismos patológicos específicos (ou seja, citocinas inflamatórias e OI) e o consequente teste de novas estratégias voltadas à superação dessas questões. O acoplamento do modelo de cultura com a técnica HCS gera uma plataforma de triagem robusta e traduzível.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Apoiado pelo PROJETO DE CLUSTERS Nacionais de Tecnologia MIUR IRMI (CTN01_00177_888744) e Região Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020.
Agradecimentos especiais à Fundação IRET por sediar o trabalho experimental.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Referências
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados