Method Article
Diferenciación de cribado de alto contenido y análisis de maduración de cultivos de células precursoras de oligodendrocitos derivados de células madre neurales fetales y adultas
En este artículo
Resumen
Describimos la producción de cultivos mixtos de astrocitos y células precursoras de oligodendrocitos derivadas de células madre neurales fetales o adultas que se diferencian en oligodendrocitos maduros, y el modelado in vitro de estímulos nocivos. El acoplamiento con una técnica de detección de alto contenido basada en células construye un sistema de detección de drogas confiable y robusto.
Resumen
El principal obstáculo en el desarrollo de técnicas de cribado farmacológico para evaluar la eficacia de las estrategias terapéuticas en enfermedades complejas es lograr un equilibrio entre la simplificación in vitro y la recreación del complejo entorno in vivo, junto con el objetivo principal, compartido por todas las estrategias de cribado, de obtener datos robustos y fiables, altamente predictivos para la traducción in vivo.
En el campo de las enfermedades desmielinizantes, la mayoría de las estrategias de detección de fármacos se basan en líneas celulares inmortalizadas o cultivos puros de células precursoras de oligodendrocitos primarios (OPC) aisladas de animales recién nacidos, lo que lleva a fuertes sesgos debido a la falta de diferencias relacionadas con la edad y de cualquier condición o complejidad patológica real.
Aquí mostramos la configuración de un sistema in vitro destinado a modelar la diferenciación fisiológica / maduración de las OPC derivadas de células madre neurales (NSC), fácilmente manipulables para imitar las condiciones patológicas típicas de las enfermedades desmielinizantes. Además, el método incluye el aislamiento de cerebros fetales y adultos, dando un sistema que se diferencia dinámicamente de los OPC a los oligodendrocitos maduros (OL) en un cocultivo espontáneo que también incluye astrocitos. Este modelo se asemeja fisiológicamente al proceso de mielinización y reparación de mielina mediado por hormona tiroidea, lo que permite la adición de interferentes patológicos que modelan los mecanismos de la enfermedad. Mostramos cómo imitar los dos componentes principales de las enfermedades desmielinizantes (es decir, hipoxia / isquemia e inflamación), recreando su efecto sobre la mielinización del desarrollo y la reparación de la mielina adulta y teniendo en cuenta todos los componentes celulares del sistema en todo momento, mientras nos centramos en diferenciar los OPC.
Este modelo mixto espontáneo, junto con las tecnologías de cribado de alto contenido basadas en células, permite el desarrollo de un sistema de cribado farmacológico robusto y fiable para estrategias terapéuticas dirigidas a combatir los procesos patológicos implicados en la desmielinización y a inducir la remielinización.
Introducción
En el sistema nervioso central (SNC), las células formadoras de mielina (oligodendrocitos, OL) y sus precursores (células precursoras de oligodendrocitos, OPC) son responsables de la mielinización del desarrollo, un proceso que ocurre durante los períodos peri y postnatal, y del recambio y reparación de la mielina (remielinización) en la edad adulta1. Estas células están altamente especializadas, interactuando anatómica y funcionalmente con todos los demás componentes gliales y neuronales, lo que las convierte en una parte fundamental de la estructura y función del SNC.
Los eventos desmielinizantes están implicados en diferentes lesiones y enfermedades delSNC 2,y actúan principalmente sobre OPC y OL mediante mecanismos multifactoriales, tanto durante el desarrollo como en la edad adulta. Los precursores indiferenciados son impulsados por factores diferenciadores, principalmente la hormona tiroidea (TH), en un proceso sincronizado3 que lleva al OPC a reconocer y responder a estímulos específicos que inducen la proliferación, la migración al axón no mielinizado y la diferenciación en OL maduros que a su vez desarrollan la vaina de mielina4. Todos estos procesos están finamente controlados y ocurren en un entorno complejo.
Debido a la naturaleza compleja de los eventos de mielinización, remielinización y desmielinización, existe una gran necesidad de un método in vitro simplificado y confiable para estudiar los mecanismos subyacentes y desarrollar nuevas estrategias terapéuticas, centrándose en el principal actor celular: el OPC5.
Para que un sistema in vitro sea fiable, es necesario tener en cuenta una serie de factores: la complejidad del entorno celular, las diferencias intrínsecas celulares relacionadas con la edad, la diferenciación fisiológica mediada por TH, los mecanismos patológicos y la robustez de los datos6. De hecho, la necesidad insatisfecha en el campo es un modelo que imita la complejidad de la condición in vivo, no lograda con éxito mediante el uso de cultivos OPC puros aislados. Además, los dos componentes principales de los eventos desmielinizantes, la inflamación y la hipoxia/isquemia (HI), involucran directamente a otros componentes celulares que pueden afectar indirectamente la diferenciación fisiológica y la maduración de los OPC, un aspecto que no puede estudiarse en modelos in vitro demasiado simplificados.
Partiendo de un sistema de cultivo altamente predictivo, el desafío posterior y más general es la producción de datos robustos y confiables. En este contexto, el cribado de alto contenido basado en células (HCS) es la técnica más adecuada7,ya que nuestro objetivo es, en primer lugar, analizar todo el cultivo en un flujo de trabajo automático, evitando el sesgo de elegir campos representativos, y en segundo lugar obtener la generación automática y simultánea de datos de alto contenido basados en imágenes8.
Dado que la principal necesidad es lograr el mejor equilibrio entre la simplificación in vitro y la complejidad que imita in vivo, aquí presentamos un método altamente reproducible para la obtención de OPC derivadas de células madre neurales (NSC) aisladas del cerebro anterior fetal y de la zona subventricular adulta (SVZ). Este modelo in vitro abarca todo el proceso de diferenciación de OPC, desde NSC multipotente hasta OL maduro / mielinizante, de una manera fisiológica dependiente de TH. El cultivo resultante es un sistema dinámicamente diferenciador/madurador que da como resultado un cocultivo espontáneo que consiste principalmente en diferenciar OPCs y astrocitos, con un bajo porcentaje de neuronas. Este cultivo primario imita mejor el complejo entorno in vivo, mientras que su derivación de células madre permite realizar manipulaciones simples para obtener el enriquecimiento del linaje celular deseado.
A diferencia de otras estrategias de cribado farmacológico mediante líneas celulares o cultivos puros de OPC primarios, el método aquí descrito permite estudiar el efecto de interferentes patológicos o moléculas terapéuticas en un entorno complejo, sin perder el foco en el tipo celular deseado. El flujo de trabajo de HCS descrito permite un análisis de la viabilidad celular y la especificación del linaje, así como la muerte celular específica del linaje y los parámetros morfológicos.
Protocolo
Todos los protocolos con animales descritos en este documento se llevaron a cabo de acuerdo con las Directivas del Consejo de la Comunidad Europea (86/609/CEE) y cumplen con las directrices publicadas en la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio.
1. Soluciones y reactivos
- Preparar el medio estándar: DMEM / F12 GlutaMAX 1x; 8 mmol/L HEPES; 100 U/100 μg de penicilina/estreptomicina (1% P/S); 1x B27; 1x N-2.
- Preparar el medio de la neuroesfera: agregue 10 ng / ml de bFGF; 10 ng/mL EGF a medio estándar.
- Preparar el medio de la oligosfera/OPC: añadir 10 ng/mL bFGF; 10 ng/mL PDGF-AA a medio estándar.
- Preparar medio de diferenciación de oligodendroctos: agregue 50 nM T3; 10 ng/mL CNTF; 1x N-acetil-L-cisteína (NAC) a medio estándar.
- Prepare un tampón de disociación no enzimática: agregue un 1% de P / S al tampón de disociación no enzimática y mantenga el hielo frío.
- Preparar solución de sacarosa: HBSS, 0,3 g/ml de sacarosa.
- Preparar la solución de lavado BSA: EBSS, 40 mg/mL BSA, 0.02 mL/l HEPES.
- Preparar tampón de disociación enzimática: HBSS, 5,4 mg/mL D-glucosa, 15 mmol/L HEPES, 1,33 mg/mL tripsina, 0,7 mg/mL hialuronidasa, 80 U/mL DNasa.
- Preparar la mezcla de citoquinas: TGF-β1, TNF-α, IL-1β, IL-6, IL-17 e IFN-γ (20 ng/mL cada uno).
- Preparar el vehículo de mezcla de citoquinas: 0,04% del stock (10% glicerol/100 nM glicina/25 nM Tris, pH 7,3).
- Preparar el medio de privación de oxígeno-glucosa: medio estándar usando DMEM sin glucosa. Dependiendo de la rigurosidad de la condición de privación de glucosa deseada, es posible eliminar también B27 y / o N2 del medio para evitar compuestos relacionados con la glucosa (por ejemplo, D-galactosa en B27).
2. Disección y aislamiento NSC
NOTA: Las NSC fetales y adultas se aislaron del cerebro anterior fetal E13.5 o de la zona subventricular adulta (SVZ) de 2.5 meses de edad, siguiendo el protocolo ahlenius y Kokaia9 con modificaciones.
- Cultivos fetales de NSC
NOTA: Antes de comenzar las disecciones, prepare tubos de 1,5 ml que contengan 150 μL de tampón de disociación no enzimática cada uno; limpie las placas de Petri y agregue HBSS helado.- Recolecte los embriones en E13.5 - 14.5 de ratones preñados cronometrados y colóquelos en una placa de Petri que contenga HBSS frío.
- Decapitar los embriones usando fórceps.
- Coloque las cabezas de los embriones en una placa de Petri limpia que contenga PBS helado y retire la piel del cráneo con fórceps, usando lupas o un estereoscopio.
- Una vez que el cerebro esté visible y despejado de piel, exprima mediante la aplicación de presión en los lados con fórceps.
- Retire el cerebelo, mantenga solo el cerebro anterior y retire las meninges con fórceps.
- Coloque el tejido aislado en el tampón de disociación no enzimática y repita los pasos de disección con los otros embriones. Inserte el tejido de 2 a 3 animales en cada tubo que contenga el tampón.
- Incubar a 37 °C durante 15 min bajo agitación continua.
- Después de la incubación, agregue 850 μL de medio estándar y mezcle mediante pipeteo hasta que la suspensión esté libre de grumos.
- Si el tejido no disociado todavía es visible, espere 2 minutos en RT hasta que se deposite en la parte inferior del tubo.
- Cuando se complete la disociación, cuente las células y colóquelas en suspensión a una densidad de 10-50 células/μL en un matraz T-25 o T-45 que contenga 10-30 ml de medio de neuroesfera, mantenido en posición vertical para evitar la adhesión celular.
-
Cultivos adultos de NSC
- Sacrificar animales por luxación cervical.
- Recolecte cerebros de 4 a 5 ratones en un tubo de 50 ml que contiene HBSS helado.
- Coloque el cerebro sobre una superficie estéril fría. Para este propósito, use un matraz T-25 lleno de agua y colocado a -20 ° C durante la noche. En el momento del experimento, cubra el matraz con papel de aluminio estéril.
- Coloque el lado ventral del cerebro hacia abajo, en dirección rostro-caudal, y retire los bulbos olfativos con una cuchilla de afeitar.
- Usando una cuchilla de afeitar, corte 2-3 rodajas coronales de 1 mm de grosor, desde la corteza hasta el quiasma óptico.
- Coloque las rodajas en la superficie fría en una posición ventro-dorsal e identifique el cuerpo calloso y los dos ventrículos laterales.
- Usando lupas o un estereoscopio, aísle las paredes de los ventrículos laterales, teniendo cuidado de no llevar trozos del cuerpo calloso.
- Coloque el tejido aislado en el tampón de disociación enzimática (5-10 ml) e incube a 37 °C durante 15 min.
- Mezclar la solución, pipeteando varias veces (al menos 50), e incubar de nuevo a 37 °C durante 10 min.
- Neutralice la tripsina añadiendo 5 ml de medio de cultivo estándar y filtre la solución con un filtro de 70 μm.
- Centrifugar la solución filtrada durante 5 min a 400 x g.
- Resuspend el pellet en la solución de sacarosa y centrifugar durante 10 min a 500 x g.
- Resuspend el pellet en solución de lavado BSA y centrífuga durante 7 min a 400 x g.
- Vuelva a suspender el pellet en el medio de cultivo estándar, cuente las células y realice el recubrimiento como se describió anteriormente (en el paso 2.1.10).
3. Neuroesferas primarias
- Añadir los factores de crecimiento (bFGF/EGF) cada 2 días.
- Cada 4-6 días (dependiendo de la densidad celular), cambie la mitad del medio de la siguiente manera:
- Transfiera toda la suspensión celular a un tubo de 15 o 50 ml.
- Centrífuga durante 5 min a 400 x g.
- Retire la mitad del volumen.
- Agregue la misma cantidad de medio fresco, mezcle suavemente mediante pipeteo y agregue factores de crecimiento.
4. Oligoesferas
NOTA: La diferenciación de oligodendrocitos se realiza siguiendo el protocolo Chen10 con modificaciones.
- Cuando las neuroesferas alcanzan un diámetro de 100-150 μm, están listas para ser pasadas. Para hacerlo, transfiera toda la suspensión celular a un tubo de 15 o 50 ml y centrífuga durante 5 minutos a 400 x g.
- Evalúe rápidamente el diámetro tomando imágenes de las esferas utilizando un microscopio de luz transmitida invertida y abriéndolas mediante el software ImageJ.
- Haga clic en el menú Analizar y, en la ventana Herramientas, seleccione Barra de escala.
- Establezca 150 μm como Ancho en micras y compare la barra de escala con las esferas.
- Retire todo el volumen por inversión y vuelva a suspender el pellet en 180 μL de medio de cultivo estándar fresco. Pipete 50 veces para permitir la desagregación de las esferas.
- Agregue 810 μL de medio de cultivo estándar fresco, cuente las células y vuelva a colocarlas como se describe para las neuroesferas.
- Añadir bFGF/PDGF-AA 10 ng/mL cada 2 días.
- Cada 4-6 días (dependiendo de la densidad celular), cambie la mitad del medio de la siguiente manera:
- Transfiera toda la suspensión celular a un tubo de 15 o 50 ml.
- Centrífuga durante 5 min a 400 x g.
- Retire la mitad del volumen.
- Agregue la misma cantidad de medio fresco, mezcle suavemente mediante pipeteo y agregue factores de crecimiento.
5. Recubrimiento de la placa
- Recubrimiento de poli-D, L-ornitina / laminina: al menos 2 días antes de emplatar los OPC, agregue 50 μg / ml de solución de poli-D, L-ornitina, diluida en PBS, a cada pozo (40 μL / pocillo para placas de 96 pocillos) e incube en RT durante la noche.
- Al día siguiente, retire el líquido y lave tres veces con agua estéril destilada.
- Deje que las placas se sequen en RT durante la noche. Al día siguiente, añadir una solución de laminina diluida en PBS (5 μg/mL; 40 μL/pocillo para placas de 96 pocillos) e incubar durante 2 h a 37 °C.
6. Siembra celular
- Cuando las oligoesferas alcanzan un diámetro de 100-150 μm, están listas para ser disociadas y sembradas en las placas recubiertas de poli-D, L-ornitina / laminina. Para ello, transfiera toda la suspensión celular a un tubo de 15 o 50 ml y centrífuga durante 5 minutos a 400 x g (como se indica en el paso 4.1)
- Retire todo el volumen por inversión y vuelva a suspender el pellet en 180 μL de medio de cultivo estándar fresco. Pipete 50 veces para permitir la desagregación de las esferas.
- Añadir 810 μL de medio de cultivo estándar fresco y contar las células.
- Retire la solución de laminina de los pocillos y coloque las células a una densidad de 3.000 celdas/cm2 (100 μL/pocillo para placas de 96 pocillos).
7. Inducción de diferenciación OPC
- Después de 3 días, retire todo el medio y agregue el mismo volumen de medio de diferenciación de oligodendrocitos.
- Cambie la mitad del medio cada 4 días y agregue una mezcla de diferenciación fresca (T3 / CNTF / NAC) cada 2 días.
8. Inducción del bloqueo de diferenciación mediado por inflamación
- Después de la disociación de la neuroesfera y la producción de oligoesferas (sección 4), agregue la mezcla de citoquinas al medio de cultivo y mantenga las oligoesferas expuestas a las citoquinas durante toda la etapa de formación de esferas.
NOTA: El volumen depende del número de células, ya que para las esferas que forman las células se siembran a 10-50 células/μL. - Si es necesario cambiar el medio, cambie todo el volumen y agregue la mezcla de citoquinas una vez más.
9. Inducción de la muerte celular por privación de oxígeno-glucosa
- A -1 DIV (2 días después de la siembra celular en placas multipozo), retire el medio y consérvelo en una nueva placa multipozo.
- Añadir la mitad del volumen (50 μL para placas de 96 pocillos) de medio OGD (grupo OGD) o medio fresco (grupo control). La mitad de la cantidad de volumen se utiliza para reducir el intercambio de oxígeno entre el líquido y el aire.
- Coloque los cultivos del grupo OGD en una cámara de hipoxia hermética saturada con 95% N2 y 5% CO2. Para lograr la saturación de la cámara, deje que la mezcla de gas fluya durante 6 min a 25 l/min antes de cerrar las tuberías de la cámara.
- Incubar la cámara hipóxica en la incubadora durante 3 h. El grupo de control y las placas que contienen el medio extraído y conservado en la etapa 9.1 también deben dejarse en la incubadora.
- Retire el medio libre de glucosa (grupo OGD) o el nuevo medio (grupo control) y agregue el medio extraído y conservado en el paso 9.1.
10. Inmunocitoquímica
- En el punto de tiempo deseado, fije las células con paraformaldehído frío al 4% durante 20 min a RT.
- Lavar dos veces con PBS (10 min de incubación por cada lavado en RT).
- Incubar 1 h a RT con la solución bloqueadora (PBS Tritón 0,3% que contiene 1% de BSA y 1% de suero normal de burro/cabra).
- Incubar con mezcla de anticuerpos primarios (Tabla 1), diluido en PBS tritón 0,3%, durante la noche a 4 °C.
- Lavar dos veces con PBS (10 min de incubación por cada lavado en RT).
- Incubar con solución secundaria de anticuerpos (Tabla 1) diluida en PBS tritón 0,3% añadiendo Hoechst 33258 durante 30 min a 37 °C.
- Lavar dos veces con PBS (10 min de incubación por cada lavado en RT).
11. Análisis HCS de la viabilidad celular, la composición del linaje y la muerte celular específica del linaje
NOTA: Las imágenes representativas de HCS y el flujo de trabajo se muestran en la Figura 2A, B.
- Seleccione el algoritmo de análisis compartimental en el menú principal del software (HCS Studio v 6.6.0) y seleccione Escanear en el menú principal Desarrollar ensayo/placa de escaneo.
- En la ventana iDev, seleccione Nuevo y, a continuación, seleccione Herramienta de medición de intensidad general en la plantilla Desarrollar ensayo.
- Haga clic en Crear en el lado derecho del menú, seleccionando el objetivo 10x.
- Esto abrirá el menú Configurar adquisición. En esta ventana, seleccione los siguientes parámetros: (a) número de canales: el primero para la tinción nuclear de Hoechst (BGRFR_386) y uno para cada marcador específico del linaje utilizado en la reacción (b) seleccione el enfoque del software en el canal 1 y el intervalo de enfoque automático como 1 (c) seleccione el modelo de placa de la lista.
- En el menú de adquisición, observe la calidad de la tinción en diferentes pozos y diferentes campos y seleccione manualmente el tiempo de exposición seleccionando Tiempo de exposición fijo en el menú.
- Una vez establecidos los parámetros de adquisición, seleccione Mini Scan en la parte superior del menú y seleccione diez campos por pozo en dos pozos por condición experimental. Esto permitirá la configuración de todos los parámetros de análisis en un subconjunto de campos para toda la placa.
- Cuando finalice el mini escaneo, haga clic en el parámetro Configurar ensayo para configurar el algoritmo del análisis.
- Haga clic en Configurar grupos en el lado derecho de la ventana y arrastre y suelte los pozos del miniscan. Haga clic en el botón Agregar en la subsección Grupos para configurar los diferentes grupos.
- Siga el flujo de trabajo en el lado izquierdo de la ventana paso a paso para desarrollar todo el algoritmo. Primero seleccione Procesar imagen para cada canal y haga clic en Eliminación de fondo y en el nivel deseado.
- Primero identificar y seleccionar los núcleos por tinción nuclear. Haga clic en Identificar objeto primario - Canal 1 para seleccionar los núcleos reales y evitar analizar artefactos y escombros. Para este propósito, amplíe una imagen representativa de la tinción nuclear y verifique si los núcleos están bien rodeados por el perímetro construido por el software. Es posible cambiar el valor de umbral y aplicar algoritmos de segmentación para identificar mejor los núcleos individuales.
- Una vez definidos correctamente los núcleos, haga clic en el siguiente paso: Validar objeto primario. Seleccione Object.BorderObject.Ch1 para evitar el análisis de núcleos en el borde de cada imagen de campo. Seleccione Object.Area.Ch1 y, moviendo las barras "baja" y "alta" en los histogramas, elimine todos los escombros u objetos grandes identificados correspondientes a agregados o artefactos.
- Compruebe todas las imágenes representativas de mini scan de todas las condiciones experimentales para asegurarse de que los parámetros seleccionados encajan con todos ellos.
- Haga clic en Identificar puntos para cada canal correspondiente a los marcadores de linaje específicos y seleccione los valores de anillo: Ancho = 3 y Distancia = 0. Esto permitirá la identificación de la fluorescencia citoplasmática. De acuerdo con la densidad celular, estos valores se pueden adaptar. El software evitará automáticamente la superposición entre anillos adyacentes.
- Seleccione Niveles de referencia en el flujo de trabajo para generar el análisis. El establecimiento de los niveles de referencia permitirá el conteo automático de núcleos condensados, basado en el tamaño nuclear y la intensidad de tinción nuclear, y de células específicas marcadores positivos, basado en la fluorescencia citoplasmática identificada por el Anillo.
- Primero haga clic en Object.Area.Ch1. En las imágenes de mini escaneo, seleccione un núcleo condensado y mueva la barra "LOW" en los histogramas para seleccionar como "condensado" todos los núcleos bajo este tamaño.
- Haga clic en Object.AvgIntensity.Ch1. En las imágenes de mini escaneo, seleccione un núcleo condensado y mueva la barra "ALTA" en los histogramas para seleccionar como "condensados" todos los núcleos por encima de esta intensidad de fluorescencia.
- Haga clic en Object.RingAvgIntensity para cada canal de marcadores específicos del linaje. Seleccione en sus imágenes de mini escaneo una célula positiva y mueva la barra "ALTA" en los histogramas para seleccionar como "positivas" todas las células por encima de esta intensidad de fluorescencia.
- Compruebe todas las imágenes representativas de mini scan de todas las condiciones experimentales para asegurarse de que los parámetros seleccionados encajan con todos ellos.
- En el menú superior, seleccione Caracterización de la población y seleccione Subpoblación de eventos.
- Como Evento de tipo 1, seleccione ObjectAreaCh1 en la lista de la izquierda, luego haga clic en el botón AND > y finalmente seleccione ObjectAvgIntensityCh1. Esto permitirá la identificación de núcleos condensados, como una combinación de área baja y alta intensidad.
- En la misma ventana, anule la selección de todos los límites de análisis.
- Haga clic en Seleccionar características para almacenar en el menú superior, para elegir los parámetros a mantener en el análisis.
- Seleccione Características de pozo y mueva de la lista izquierda a la derecha solo los parámetros deseados: (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (Para cada canal de los marcadores de linaje específicos).
NOTA: Este análisis dará como lectura el número total de células, el porcentaje de núcleos condensados y el porcentaje de células positivas específicas del linaje para cada marcador analizado en el número total de células. Si el porcentaje de los diferentes linajes es necesario solo en células vivas, ¿es posible mantener el valor "High_RingAvgIntensity" para el canal (número absoluto de células positivas) y recalcular el porcentaje sobre el número total de células después de la resta del porcentaje de células muertas?- Alternativamente, es posible eliminar las células muertas del análisis estableciendo los mismos parámetros utilizados para identificar núcleos condensados (pasos 11.14-11.15) en la validación de núcleos (paso 11.11).
- Seleccione Scan Plate en el menú superior principal y haga clic en el símbolo de la placa en el submenú Scan Setting en la sección superior para identificar el pozo a analizar.
- Escriba el nombre del experimento y la descripción y, una vez completadas todas las configuraciones, presione el símbolo de reproducción.
Resultados
La primera fase del cultivo puede variar en duración, dependiendo de la densidad de siembra y de si las esferas son de origen fetal o adulto. Además, las oligoesferas muestran una población reducida que se duplica en comparación con las neuroesferas(Figura 1B). Además, la producción de esferas a partir de tejido adulto es más lenta y puede tomar de 2 a 3 semanas generar oligoesferas en comparación con las fetales que pueden tardar de 1 a 2 semanas, dependiendo de la densidad de siembra.
Una vez sembrados, toda la fase de diferenciación de los cultivos puede ser monitoreada utilizando anticuerpos específicos del linaje. Dado que el objetivo de este protocolo es estudiar la fase final de la diferenciación, no se presenta la composición del cultivo a 0 DIVs. Sin embargo, durante la primera fase de cultivo, las células seguirán siendo nestinas positivas, representando precursores neuronales, y la mayoría de las células también son NG2-positivas (OPC)11. Las células CNPasa positivas, correspondientes a la etapa preOL, serán detectables 3-6 días después de la inducción de diferenciación mediada por T3, mientras que las células MBP positivas aparecerán entre 6 y 12 DIV (OL maduros; ver Figura 2C para la composición de cultivos al final de la fase de diferenciación).
El análisis HCS permite la detección de cada célula individual en el cultivo a través de la tinción nuclear y el análisis de la intensidad de fluorescencia en los canales restantes (Figura 2A,B). La composición del cultivo al final de la fase de diferenciación (12 DIVs) difiere dependiendo de si los cultivos son de origen fetal o adulto, con cultivos fetales más sensibles a la diferenciación mediada por T3 y alcanzando un mayor porcentaje de OL maduros12.
A lo largo de todo el proceso de cultivo, alrededor del 40%-50% de las células son astrocitos (células GFAP-positivas), mientras que un pequeño porcentaje (menos del 0%-10%) son neuronas (células beta-III-tubulina-positivas; Figura 2C). La composición del cultivo puede variar de un 10% entre las diferentes preparaciones de cultivo. Los cultivos adultos y fetales difieren por el rendimiento de la producción de OL maduros al final de la fase de diferenciación, con células fetales que muestran un alto porcentaje de OL maduros, un bajo porcentaje de precursores y alrededor del 30% -40% de los astrocitos. Por otro lado, los cultivos adultos presentan más astrocitos (alrededor del 45%-55%) y menos células diferenciadas después de 12 DIVs de inducción de diferenciación.
Para permitir que el software reconozca las células y proporcione un análisis imparcial adecuado de la composición del cultivo, es importante que la densidad de siembra sea correcta, evitando la superposición entre las células adyacentes. Cuando los OPC derivados de NSC se siembran a alta densidad, tienden a agregarse muy rápidamente, lo que lleva a que toda la superficie del pozo esté ocupada por astrocitos después de unos días. Además, los OL maduros con su característica forma de red de araña no serán visibles debido al espacio limitado(Figura 3A, B).
El bloqueo de diferenciación mediado por inflamación es reproducible por este ensayo in vitro y genera una fuerte disminución de preOL y OL maduros detectados por tinción de CNPasa y MBP tanto en cultivos fetales como adultos. También se produce un aumento en el número de OPC en cultivos adultos(Figura 4A,B). La composición de la mezcla de citoquinas se eligió de experimentos in vivo en un modelo de rata de esclerosis múltiple13,y se probó como un modelo in vitro para el bloqueo de diferenciación mediado por inflamación que ocurre en esta enfermedad.
Mientras que los OPC fetales y adultos muestran la misma vulnerabilidad a la exposición inflamatoria a citoquinas, solo los cultivos derivados del feto son sensibles a la toxicidad de OGD(Figura 5A,B),mostrando un aumento en la muerte celular y deterioro de la diferenciación debido a su diferente perfil metabólico14.

Figura 1: Protocolo de configuración y diferenciación de células precursoras de oligodendrocitos derivadas de células madre neurales. (A) Esquema del procedimiento experimental. (B) Imágenes representativas de neuroesferas a 2, 5 y 7 DIVs, y gráfico que muestra la duplicación de la población de neuroesferas y oligoesferas. Barra de escala: 100 μm. (C) Imágenes representativas de OPC derivadas de la oligosfera sembradas que muestran las diferentes etapas de diferenciación, desde células nestinas y NG2-positivas a 0 DIV (precursor neural/OPCs), pasando por células CNPasa-positivas a 6 DIVs (preOL) y células dobles positivas CNPasa/MBP al final de la fase de diferenciación (12 DIVs; OL maduras). Las células positivas para GFAP (astrocitos) y un pequeño porcentaje de células positivas para beta-III-tubulina (neuronas) están presentes a lo largo de todo el cultivo. Barras de escala: 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
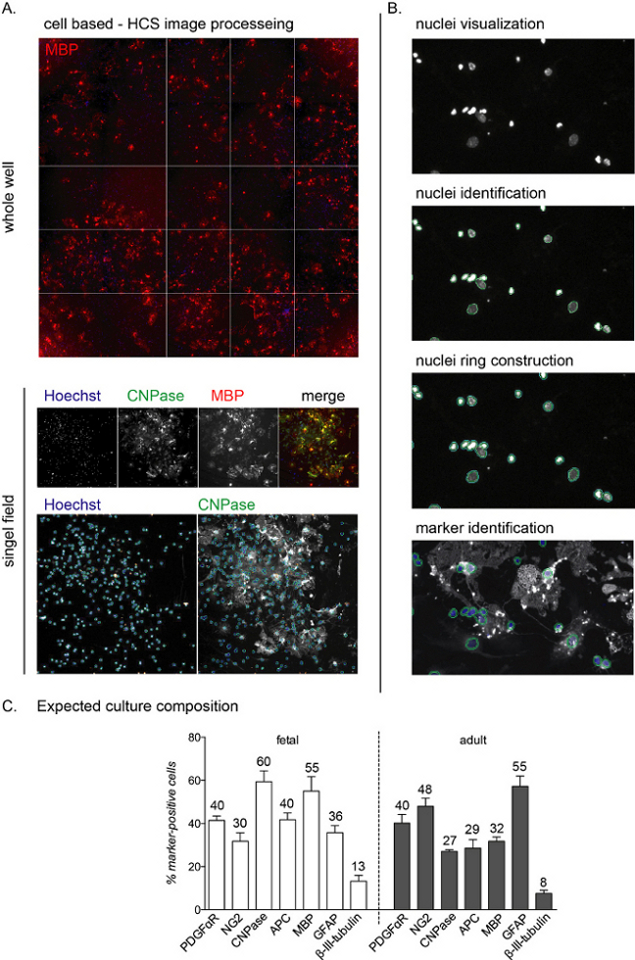
Figura 2: Flujos de trabajo de análisis de detección de alto contenido basados en celdas y lectura de diferenciación esperada. (A) Imágenes representativas de la adquisición de HCS de un pozo entero (placa de 96 pocillos) y un campo único aislado adquirido con un objetivo 10x de un cultivo de 12 DIV de OPC derivados de NSC. (B) Pasos del flujo de trabajo de análisis hcS que incluyen la visualización de núcleos (objetos), identificación y construcción de anillos de núcleos para identificar la tinción citoplasmática y la identificación de marcadores. (C) Gráfico que muestra la composición del cultivo esperado al final de la fase de diferenciación (12 DIVs). Se muestran marcadores para OPC (PDGFαR, NG2), preOL (CNPasa, APC), OL maduros (MBP), astrocitos (GFAP) y neuronas (β-III-tubulina) para cultivos derivados de fetos y adultos. Los porcentajes redondeados para cada marcador celular se incluyen en el gráfico, tenga en cuenta que este es un experimento representativo y los porcentajes pueden ser diferentes alrededor del 5% al 10%. Haga clic aquí para ver una versión más grande de esta figura.
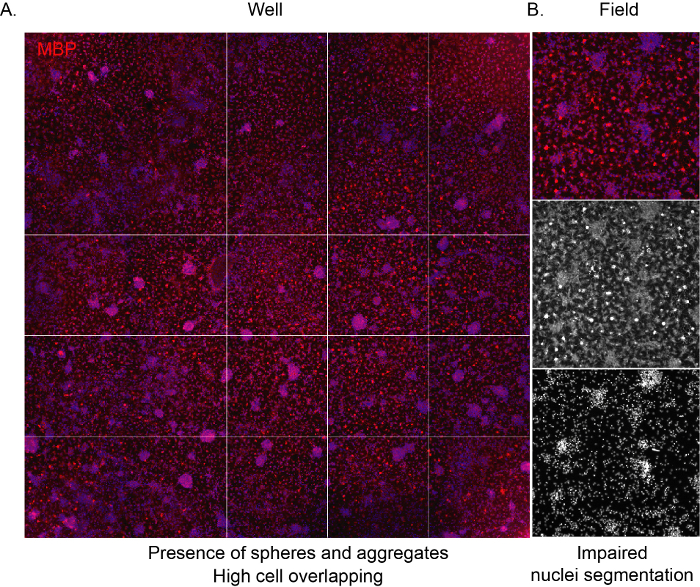
Figura 3: Imágenes representativas de proyección de alto contenido de un cultivo de alta densidad. (A) Imagen representativa de una imagen de pozo (placa de 96 pocillos) adquirida por el objetivo 10x y marcada para la expresión MBP al final de la fase de diferenciación (12 DIVs). (B) Imagen de campo extraída representativa que destaca la presencia de células agregadas y núcleos superpuestos. Haga clic aquí para ver una versión más grande de esta figura.
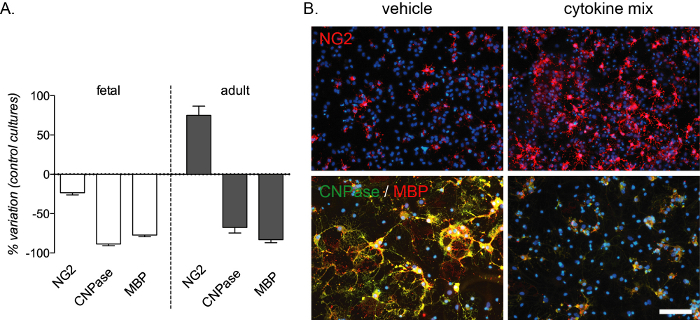
Figura 4: Efecto esperado del tratamiento con citoquinas en cultivos OPC derivados de fetos y adultos. (A) Gráfico que muestra el porcentaje de variación de los cultivos OPC derivados de fetos y adultos en comparación con los cultivos estándar, incluida la cuantificación de OPC (NG2), preOL (CNPasa) y OL maduros (MBP) al final de la fase de diferenciación (12 DIV). (B) Imágenes representativas de cultivos adultos al final de la fase de diferenciación (12 DIV) tratados con vehículo o mezcla de citoquinas y marcados para NG2 o CNPasa/MBP. Barra de escala: 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
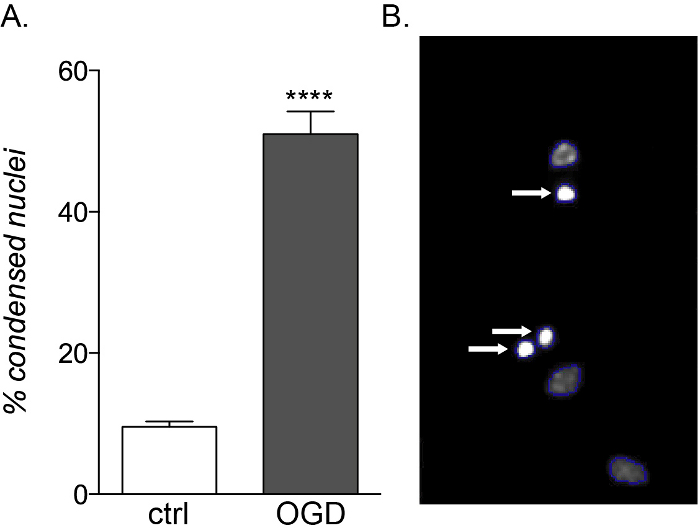
Figura 5: Efecto esperado de la exposición a OGD en cultivos de OPC derivados del feto. (A) Gráfico que muestra el porcentaje de núcleos condensados cuantificados por HCS basados en células en cultivos controlados (ctrl) y expuestos a OGD. (B) Imágenes representativas de objetos procesados por HCS que resaltan los núcleos condensados identificados (flechas blancas). Haga clic aquí para ver una versión más grande de esta figura.
| Anticuerpo | Especie | Dilución | |
| anti-β-III-tubulina (sistema de I+D) | ratón | 1:3000 | |
| anti-GFAP (Dako) | conejo | 1:1000 | |
| anti-NG2 (Millipore) | conejo | 1:350 | |
| anti-PDGFαR (Biotecnología Santa Cruz) | conejo | 1:300 | |
| anti-CNPasa (Millipore) | ratón | 1:500 | |
| IgG2b anti-APC, clon CC1 (Calbiochem) | ratón | 1:100 | |
| Anti-MBP (Dako) | conejo | 1:250 | |
| Anti-nestina (Millipore) | ratón | 1:500 | |
| Alexa Fluor 488-conjugado anti ratón (ThermoFisher Scientific) | burro | 1:500 | |
| Alexa Fluor 647-conjugado anti-ratón IgG2b (ThermoFisher Scientific) | cabra | 1:500 | |
| Alexa 568-conjugado anti-conejo (ThermoFisher Scientific) | burro | 1:500 | |
Tabla 1: Lista de anticuerpos primarios y secundarios.
Discusión
La naturaleza compleja de los procesos de mielinización/remielinización y los eventos desmielinizantes hace que el desarrollo de sistemas predictivos in vitro sea extremadamente desafiante. Los sistemas de cribado de fármacos in vitro más utilizados son en su mayoría líneas celulares humanas o cultivos PRIMARIOS PUROS DE OL, con un uso cada vez mayor de cocultivos u sistemas organotípicos más complejos15. Incluso si tales sistemas se combinan con tecnologías de alto contenido, los cultivos OL puros siguen siendo el método de elección al desarrollar plataformas dedetección 16.
El cultivo mixto espontáneo descrito aquí representa un sistema in vitro útil, que tiene en cuenta todas las variables principales: diferenciación fisiológica de OPC mediada por T3, interferentes patológicos con el proceso, otros componentes celulares y diferencias relacionadas con la edad. El procedimiento contiene una serie de variables derivadas del origen de las células (edad del animal) y de la formación y manipulación de los esferoides. De hecho, un paso crítico es la densidad celular de las NSC que se siembran después del aislamiento del tejido, porque en la condición óptima una sola esfera debe derivar de una sola célula en proliferación. Dado que hemos visto que las NSC aisladas tienden a agregarse y que necesitan sus propios factores paracrinos secretados, sembrarlas en un rango de 10-50 células / μL, en un matraz t25 o t75, es el mejor compromiso para evitar la agregación celular, pero aún así permitir que las células se comuniquen mediante factores secretores.
Las principales limitaciones de la técnica es la falta de una mielinización axonal funcional y una interacción directa con las neuronas, ya que el método tiene en cuenta solo la diferenciación OPC hasta la etapa de OL maduras: células CNPasa/MBP-doble positivas con morfología de red de araña. Para este propósito, los OPC primarios cultivados en ganglios de raíz dorsal aislados siguen siendo la metodología principal17. Sin embargo, la posibilidad de diferenciar estas células de animales a cualquier edad es un punto fundamental en el proceso traslacional, ya que permite la prueba de compuestos y estímulos nocivos sobre células aisladas de la edad de interés. Como se describe aquí, de hecho, las NSC se pueden aislar tanto del cerebro fetal como del adulto. Dado que la mielinización del desarrollo y la remielinización en la edad adulta comparten el mismo objetivo, es decir, alcanzar el axón desnudo y crear la vaina de mielina, originalmente se planteó la hipótesis de que los dos procesos eran idénticos en todos los aspectos, generando la llamada hipótesis de recapitulación18. Sin embargo, ahora está claro que los dos procesos no pueden considerarse iguales y que las diferencias relacionadas con la edad intrínseca de las células están presentes y deben tenerse en cuenta al elegir el modelo in vitro más adecuado para la pregunta experimental19. Los OPC derivados de NSCs adultos, de hecho, muestran fuertes diferencias en la diferenciación fisiológica impulsada por TH y la vulnerabilidad a estímulos nocivos14,20, así como en los OPC primarios21,22. También existe heterogeneidad de la población de OPCs y OLs en tejidos adultos, de particular relevancia para condiciones patológicas23. Los protocolos para el aislamiento primario de OPC de tejidos adultos están disponibles24 y deben considerarse cuando la pregunta experimental se dirige a moléculas que actúan sobre la remielinización en la edad adulta.
La diferenciación de los OPC de los NSC permite la representación in vitro de todo el proceso de diferenciación, desde el precursor indiferenciado hasta el OL maduro. Este proceso se asemeja a la condición in vivo, donde TH es el principal impulsor del proceso, actuando a través de receptores nucleares específicos, y permite la interferencia experimental con este mecanismo para imitar condiciones patológicas en una visión traslacional13.
La última característica fundamental del modelo es la presencia constante de astrocitos a lo largo de todo el cultivo. Si bien esto hace que el cultivo sea más difícil de analizar, su composición celular compleja constituye una clara ventaja. La forma en que los astrocitos contribuyen a la respuesta a eventos nocivos en cultivos neuronales mixtos25 es ampliamente conocida, y la ausencia de este componente principal del SNC hace que el sistema in vitro sea poco predecible y traducible. Por otro lado, para esta característica, los cultivos derivados de NSC tienen la desventaja de ser menos uniformes que los sistemas de tipo unicelular, y esto puede conducir a un análisis sesgado. Sin embargo, la técnica HCS basada en células permite un análisis de todo el cultivo y de todas las poblaciones celulares, eliminando también la aleatorización de campos representativos para el análisis. Suponiendo que el cultivo celular utilizado para el experimento sea de una calidad de siembra confiable, el HCS dará una imagen completa de las condiciones experimentales, generando datos estadísticamente robustos y una serie de análisis automáticos basados en fluorescencia.
En conclusión, el protocolo actual describe el procedimiento para el aislamiento y la diferenciación de los OPC derivados de NSC del cerebro fetal y adulto. Todo el protocolo dura alrededor de 30 días, dependiendo de la edad de los animales y los objetivos experimentales. En particular, la formación de esferas de origen adulto puede tomar el doble de tiempo en comparación con las fetales, a la misma densidad de siembra. El tiempo de 15 días (de -3 a 12 DIVs) después de la siembra en superficie 2D para la inducción de diferenciación es, sin embargo, un tiempo fijo en todas las condiciones. El protocolo completo permite el estudio de todo el proceso de diferenciación mediado por TH en un entorno celular complejo, la interferencia a través de mecanismos patológicos específicos (es decir, citoquinas inflamatorias y HI) y la consiguiente prueba de nuevas estrategias destinadas a superar estos problemas. El acoplamiento del modelo de cultivo con la técnica HCS genera una plataforma de cribado robusta y traducible.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Con el apoyo del proyecto MIUR National Technology Clustersproject IRMI (CTN01_00177_888744), y Regione Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020.
Un agradecimiento especial a la Fundación IRET por acoger el trabajo experimental.
Materiales
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Referencias
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados