Method Article
Selezione ad alto contenuto di differenziazione e analisi della maturazione di colture cellulari precursori di oligodendrociti derivati da cellule staminali neurali fetali e adulte
In questo articolo
Riepilogo
Descriviamo la produzione di colture miste di astrociti e cellule precursori di oligodendrociti derivate da cellule staminali neurali fetali o adulte che si differenziano in oligodendrociti maturi e la modellazione in vitro di stimoli nocivi. L'accoppiamento con una tecnica di screening ad alto contenuto basata su cellule costruisce un sistema di screening dei farmaci affidabile e robusto.
Abstract
L'ostacolo principale nello sviluppo di tecniche di screening farmacologico per valutare l'efficacia delle strategie terapeutiche nelle malattie complesse è trovare un equilibrio tra la semplificazione in vitro e la ricreazione del complesso ambiente in vivo, insieme all'obiettivo principale, condiviso da tutte le strategie di screening, di ottenere dati robusti e affidabili, altamente predittivi per la traduzione in vivo.
Nel campo delle malattie demielinizzanti, la maggior parte delle strategie di screening farmacologico si basa su linee cellulari immortalizzate o colture pure di cellule precursori primarie di oligodendrociti (OPC) isolate da animali appena nati, portando a forti pregiudizi dovuti alla mancanza di differenze legate all'età e di qualsiasi condizione patologica o complessità reale.
Qui mostriamo l'impostazione di un sistema in vitro volto a modellare la fisiologica differenziazione/maturazione delle OPC derivate da cellule staminali neurali (NSC), facilmente manipolabili per imitare le condizioni patologiche tipiche delle malattie demielinizzanti. Inoltre, il metodo include l'isolamento dal cervello fetale e adulto, dando un sistema che si differenzia dinamicamente dagli OPC agli oligodendrociti maturi (OL) in una co-coltura spontanea che include anche gli astrociti. Questo modello assomiglia fisiologicamente al processo di mielinizzazione mediata dall'ormone tiroideo e al processo di riparazione della mielina, consentendo l'aggiunta di interferenti patologici che modellano i meccanismi della malattia. Mostriamo come imitare i due componenti principali delle malattie demielinizzanti (cioè ipossia / ischemia e infiammazione), ricreando il loro effetto sulla mielinizzazione dello sviluppo e sulla riparazione della mielina adulta e prendendo in considerazione tutti i componenti cellulari del sistema in tutto, concentrandoci sulla differenziazione delle OPC.
Questo modello misto spontaneo, abbinato a tecnologie di screening ad alto contenuto cellulari, consente lo sviluppo di un sistema di screening farmacologico robusto e affidabile per strategie terapeutiche volte a combattere i processi patologici coinvolti nella demielinizzazione e nell'indurre la rimielinizzazione.
Introduzione
Nel sistema nervoso centrale (SNC), le cellule che formano la mielina (oligodendrociti, OL) e i loro precursori (cellule precursori degli oligodendrociti, OPC) sono responsabili della mielinizzazione dello sviluppo, un processo che si verifica durante i periodi peri- e post-natale, e del turnover e della riparazione della mielina (rimielinizzazione) in età adulta1. Queste cellule sono altamente specializzate, interagiscono anatomicamente e funzionalmente con tutte le altre componenti gliali e neuronali, rendendole una parte fondamentale della struttura e della funzione del SNC.
Gli eventi demielinizzanti sono coinvolti in diverse lesioni e malattie del SNC2e agiscono principalmente su OPC e OL attraverso meccanismi multifattoriali, sia durante lo sviluppo che in età adulta. I precursori indifferenziati sono guidati da fattori differenzianti, principalmente l'ormone tiroideo (TH), in un processo sincronizzato3 che porta l'OPC a riconoscere e rispondere a stimoli specifici che inducono proliferazione, migrazione verso l'assone non mielinizzato e differenziazione in OL mature che a loro volta sviluppano la guaina mielinica4. Tutti questi processi sono finemente controllati e si verificano in un ambiente complesso.
A causa della natura complessa degli eventi di mielinizzazione, rimielinizzazione e demielinizzazione, c'è un grande bisogno di un metodo in vitro semplificato e affidabile per studiare i meccanismi sottostanti e sviluppare nuove strategie terapeutiche, concentrandosi sul principale attore cellulare: l'OPC5.
Affinché un sistema in vitro sia affidabile, è necessario prendere in considerazione una serie di fattori: la complessità dell'ambiente cellulare, le differenze intrinseche cellulari legate all'età, la differenziazione fisiologica mediata da TH, i meccanismi patologici e la robustezza dei dati6. In effetti, il bisogno insoddisfatto sul campo è un modello che imita la complessità della condizione in vivo, non raggiunta con successo attraverso l'uso di colture OPC pure isolate. Inoltre, le due componenti principali degli eventi demielinizzanti, infiammazione e ipossia/ischemia (HI), coinvolgono direttamente altre componenti cellulari che possono influenzare indirettamente la fisiologica differenziazione e maturazione delle OPC, aspetto che non può essere studiato in modelli in vitro eccessivamente semplificati.
Partendo da un sistema di cultura altamente predittivo, la sfida successiva e più generale è la produzione di dati robusti e affidabili. In questo contesto, lo screening ad alto contenuto cellulare (HCS) è la tecnica più adatta7, poiché il nostro obiettivo è in primo luogo analizzare l'intera cultura in un flusso di lavoro automatico, evitando il pregiudizio di scegliere campi rappresentativi e in secondo luogo ottenere la generazione automatica e simultanea di dati ad alto contenuto basati su imaging8.
Dato che la necessità principale è quella di raggiungere il miglior equilibrio tra semplificazione in vitro e complessità che imita in vivo, qui presentiamo un metodo altamente riproducibile per ottenere OPC derivate da cellule staminali neurali (NSC) isolate dal proencefalo fetale e dalla zona sub-ventricolare adulta (SVZ). Questo modello in vitro comprende l'intero processo di differenziazione OPC, dal NSC multipotente all'OL maturo/mielinizzante, in modo fisiologico TH-dipendente. La coltura risultante è un sistema dinamicamente differenziante/maturante che si traduce in una co-coltura spontanea costituita principalmente da OPC e astrociti differenzianti, con una bassa percentuale di neuroni. Questa coltura primaria imita meglio il complesso ambiente in vivo, mentre la sua derivazione di cellule staminali consente di eseguire semplici manipolazioni per ottenere l'arricchimento del lignaggio cellulare desiderato.
Al contrario di altre strategie di screening farmacologico che utilizzano linee cellulari o colture pure di OPC primarie, il metodo qui descritto consente lo studio dell'effetto di interferenti patologici o molecole terapeutiche in un ambiente complesso, senza perdere l'attenzione sul tipo di cellula desiderato. Il flusso di lavoro HCS descritto consente un'analisi della vitalità cellulare e delle specifiche di lignaggio, nonché della morte cellulare specifica del lignaggio e dei parametri morfologici.
Protocollo
Tutti i protocolli sugli animali qui descritti sono stati eseguiti secondo le direttive del Consiglio della Comunità Europea (86/609/CEE) e sono conformi alle linee guida pubblicate nella Guida NIH per la cura e l'uso degli animali da laboratorio.
1. Soluzioni e reagenti
- Preparare il mezzo standard: DMEM / F12 GlutaMAX 1x; 8 mmol/L HEPES; 100 U/100 μg Penicillina/Streptomicina (1% P/S); 1x B27; 1x N-2.
- Preparare il mezzo della neurosfera: aggiungere 10 ng/mL di bFGF; 10 ng/mL EGF a media standard.
- Preparare il mezzo oligosfera/OPC: aggiungere 10 ng/mL bFGF; 10 ng/mL PDGF-AA a media standard.
- Preparare il mezzo di differenziazione oligodendroctye: aggiungere 50 nM T3; 10 ng/mL CNTF; 1x N-acetil-L-cisteina (NAC) al mezzo standard.
- Preparare il tampone di dissociazione non enzimatico: aggiungere l'1% P/S al tampone di dissociazione non enzimatico e mantenere il ghiaccio freddo.
- Preparare la soluzione di saccarosio: HBSS, 0,3 g/mL di saccarosio.
- Preparare la soluzione di lavaggio BSA: EBSS, 40 mg/mL BSA, 0,02 mL/l HEPES.
- Preparare il tampone di dissociazione enzimatico: HBSS, 5,4 mg/mL D-glucosio, 15 mmol/L HEPES, 1,33 mg/mL di tripsina, 0,7 mg/mL di ialuronidasi, 80 U/mL DNasi.
- Preparare la miscela di citochine: TGF-β1, TNF-α, IL-1β, IL-6, IL-17 e IFN-γ (20 ng / mL ciascuno).
- Preparare il veicolo della miscela di citochine: 0,04% dello stock (10% glicerolo / 100 nM glicina / 25 nM Tris, pH 7,3).
- Preparare il mezzo di privazione di ossigeno-glucosio: mezzo standard utilizzando DMEM senza glucosio. A seconda del rigore della condizione di deprivazione del glucosio desiderata, è possibile rimuovere anche B27 e / o N2 dal mezzo per evitare composti correlati al glucosio (ad esempio, D-galattosio in B27).
2. Dissezione e isolamento NSC
NOTA: Le NSC fetali e adulte sono state isolate dal proencefalo fetale E13.5 o dalla zona sub-ventricolare adulta (SVZ) di 2,5 mesi, seguendo il protocollo Ahlenius e Kokaia9 con modifiche.
- Colture NSC fetali
NOTA: Prima di iniziare le dissezioni, preparare tubi da 1,5 mL contenenti 150 μL di tampone di dissociazione non enzimatico ciascuno; pulire le piastre di Petri e aggiungere HBSS ghiacciato.- Raccogliere gli embrioni a E13.5 - 14.5 da topi gravidi temporizzati e metterli in una capsula di Petri contenente HBSS freddo.
- Decapitare gli embrioni usando una pinza.
- Posizionare le teste degli embrioni in una capsula di Petri pulita contenente PBS ghiacciato e rimuovere la pelle dal cranio con una pinza, usando lenti d'ingrandimento o uno stereoscopio.
- Una volta che il cervello è visibile e ripulito dalla pelle, spremerlo applicando una pressione ai lati con una pinza.
- Rimuovere il cervelletto, tenere solo il proencefalo e rimuovere le meningi con una pinza.
- Posizionare il tessuto isolato nel tampone di dissociazione non enzimatico e ripetere le fasi di dissezione con gli altri embrioni. Inserire il tessuto di 2-3 animali in ogni tubo contenente il tampone.
- Incubare a 37 °C per 15 minuti agitando continuamente.
- Dopo l'incubazione, aggiungere 850 μL di mezzo standard e mescolare mediante pipettaggio fino a quando la sospensione non è priva di grumi.
- Se il tessuto non dissociato è ancora visibile, attendere 2 minuti a RT fino a quando non si deposita nella parte inferiore del tubo.
- Quando la dissociazione è completa, contare le cellule e placcarle in sospensione ad una densità di 10-50 cellule/μL in un pallone T-25 o T-45 contenente 10-30 ml di mezzo della neurosfera, mantenuto in posizione verticale per evitare l'adesione cellulare.
-
Culture NSC adulte
- Sacrificare animali da lussazione cervicale.
- Raccogli il cervello di 4-5 topi in un tubo da 50 ml contenente HBSS ghiacciato.
- Posiziona il cervello su una superficie sterile fredda. A tale scopo, utilizzare un matraccio T-25 riempito d'acqua e posto a -20 °C durante la notte. Al momento dell'esperimento, coprire il pallone con un foglio di alluminio sterile.
- Posizionare il lato ventrale del cervello verso il basso, in direzione rostro-caudale, e rimuovere i bulbi olfattivi usando una lama di rasoio.
- Usando una lama di rasoio, tagliare 2-3 fette coronali di 1 mm di spessore, dalla corteccia al chiasma ottico.
- Posizionare le fette sulla superficie fredda in posizione ventro-dorsale e identificare il corpo calloso e i due ventricoli laterali.
- Utilizzando lenti d'ingrandimento o uno stereoscopio, isolare le pareti dei ventricoli laterali, facendo attenzione a non trasportare pezzi del corpo calloso.
- Mettere il tessuto isolato nel tampone di dissociazione enzimatico (5-10 ml) e incubare a 37 °C per 15 minuti.
- Mescolare la soluzione, pipettando più volte (almeno 50), e incubare nuovamente a 37 °C per 10 minuti.
- Neutralizzare la tripsina aggiungendo 5 ml di terreno di coltura standard e filtrare la soluzione utilizzando un filtro da 70 μm.
- Centrifugare la soluzione filtrata per 5 min a 400 x g.
- Sospendere il pellet nella soluzione di saccarosio e centrifugare per 10 minuti a 500 x g.
- Risospesare il pellet in soluzione di lavaggio BSA e centrifugare per 7 min a 400 x g.
- Risospesso il pellet nel terreno di coltura standard, contare le celle ed eseguire la placcatura come descritto sopra (al punto 2.1.10).
3. Neurosfere primarie
- Aggiungere i fattori di crescita (bFGF/EGF) ogni 2 giorni.
- Ogni 4-6 giorni (a seconda della densità cellulare), cambiare metà del mezzo come segue:
- Trasferire l'intera sospensione cellulare in un tubo da 15 o 50 ml.
- Centrifuga per 5 min a 400 x g.
- Rimuovere metà del volume.
- Aggiungere la stessa quantità di mezzo fresco, mescolare delicatamente mediante pipettaggio e aggiungere fattori di crescita.
4. Oligosfere
NOTA: La differenziazione degli oligodendrociti viene eseguita seguendo il protocollo Chen10 con modifiche.
- Quando le neurosfere raggiungono un diametro di 100-150 μm, sono pronte per essere passate. Per fare ciò, trasferire l'intera sospensione cellulare in un tubo da 15 o 50 ml e centrifugare per 5 minuti a 400 x g.
- Valuta rapidamente il diametro scattando foto delle sfere utilizzando un microscopio a luce trasmessa invertita e aprendole tramite il software ImageJ.
- Fare clic sul menu Analizza e dalla finestra Strumenti selezionare Barra scala.
- Impostare 150 μm come Larghezza in micron e confrontare la barra della scala con le sfere.
- Rimuovere l'intero volume per inversione e risospesciare il pellet in 180 μL di terreno di coltura standard fresco. Pipetta 50 volte per consentire la disaggregazione delle sfere.
- Aggiungere 810 μL di terreno di coltura standard fresco, contare le cellule e ripiazionarle come descritto per le neurosfere.
- Aggiungere bFGF/PDGF-AA 10 ng/mL ogni 2 giorni.
- Ogni 4-6 giorni (a seconda della densità cellulare), cambiare metà del mezzo come segue:
- Trasferire l'intera sospensione cellulare in un tubo da 15 o 50 ml.
- Centrifuga per 5 min a 400 x g.
- Rimuovere metà del volume.
- Aggiungere la stessa quantità di mezzo fresco, mescolare delicatamente mediante pipettaggio e aggiungere fattori di crescita.
5. Rivestimento della piastra
- Rivestimento Poly-D,L-ornitina/laminina: almeno 2 giorni prima della placcatura degli OPC, aggiungere 50 μg/mL di soluzione poli-D,L-ornitina, diluita in PBS, in ciascun pozzetto (40 μL/pozzetto per piastre a 96 pozzetti) e incubare a RT durante la notte.
- Il giorno seguente, rimuovere il liquido e lavare tre volte con acqua sterile distillata.
- Lasciare asciugare le piastre a RT durante la notte. Il giorno seguente, aggiungere una soluzione di laminina diluita in PBS (5 μg/mL; 40 μL/pozzetto per piastre a 96 pozzetti) e incubare per 2 ore a 37 °C.
6. Semina cellulare
- Quando le oligosfere raggiungono un diametro di 100-150 μm, sono pronte per essere dissociate e seminate sulle piastre rivestite di poli-D, L-ornitina/laminina. Per fare ciò, trasferire l'intera sospensione cellulare in un tubo da 15 o 50 ml e centrifugare per 5 minuti a 400 x g (come indicato al punto 4.1)
- Rimuovere l'intero volume per inversione e risospesciare il pellet in 180 μL di terreno di coltura standard fresco. Pipetta 50 volte per consentire la disaggregazione delle sfere.
- Aggiungere 810 μL di terreno di coltura standard fresco e contare le cellule.
- Rimuovere la soluzione di laminina dai pozzetti e placcare le celle a 3.000 celle/cm2 di densità (100 μL/pozzetto per piastre a 96 pozzetti).
7. Induzione della differenziazione OPC
- Dopo 3 giorni, rimuovere l'intero mezzo e aggiungere lo stesso volume di mezzo di differenziazione degli oligodendrociti.
- Cambiare metà del mezzo ogni 4 giorni e aggiungere una miscela di differenziazione fresca (T3 / CNTF / NAC) ogni 2 giorni.
8. Induzione del blocco di differenziazione mediato dall'infiammazione
- Dopo la dissociazione della neurosfera e la produzione di oligosfere (sezione 4), aggiungere la miscela di citochine al terreno di coltura e mantenere le oligosfere esposte alle citochine per l'intera fase di formazione delle sfere.
NOTA: Il volume dipende dal numero di cellule, poiché per le sfere che formano le cellule vengono seminate a 10-50 cellule / μL. - Se il mezzo deve essere cambiato, cambiare l'intero volume e aggiungere nuovamente la miscela di citochine.
9. Induzione della morte cellulare di privazione di ossigeno-glucosio
- A -1 DIV (2 giorni dopo la semina cellulare in piastre multiwell), rimuovere il mezzo e conservarlo in una nuova piastra multiwell.
- Aggiungere metà del volume (50 μL per piastre a 96 pozzetti) di OGD-medium (gruppo OGD) o fresco (gruppo di controllo). La mezza quantità di volume viene utilizzata per ridurre lo scambio di ossigeno tra il liquido e l'aria.
- Posizionare le colture del gruppo OGD in una camera di ipossia ermetica satura di 95% N2 e 5% CO2. Per ottenere la saturazione della camera, lasciare scorrere la miscela di gas per 6 minuti a 25 l / min prima di chiudere i tubi della camera.
- Incubare la camera ipossica nell'incubatrice per 3 ore. Anche il gruppo di controllo e le piastre contenenti il mezzo rimosso e conservato al punto 9.1 devono essere lasciati nell'incubatrice.
- Rimuovere il mezzo senza glucosio (gruppo OGD) o il nuovo mezzo (gruppo di controllo) e aggiungere il mezzo rimosso e conservato al punto 9.1.
10. Immunocitochimica
- Nel punto temporale desiderato, fissare le cellule con paraformaldeide fredda al 4% per 20 minuti a RT.
- Lavare due volte con PBS (10 minuti di incubazione per ogni lavaggio a RT).
- Incubare 1 ora a RT con la soluzione bloccante (PBS Triton 0,3% contenente 1% BSA e 1% asino/capra siero normale).
- Incubare con miscela di anticorpi primari (Tabella 1), diluito in PBS tritone 0,3%, durante la notte a 4 °C.
- Lavare due volte con PBS (10 minuti di incubazione per ogni lavaggio a RT).
- Incubare con anticorpo secondario (Tabella 1) soluzione diluita in PBS tritone 0,3% aggiungendo Hoechst 33258 per 30 minuti a 37 °C.
- Lavare due volte con PBS (10 minuti di incubazione per ogni lavaggio a RT).
11. Analisi HCS della vitalità cellulare, della composizione del lignaggio e della morte cellulare specifica del lignaggio
NOTA: le immagini rappresentative HCS e il flusso di lavoro sono illustrati nella Figura 2A,B.
- Selezionare l'algoritmo di analisi compartimentale dal menu principale del software (HCS Studio v 6.6.0) e selezionare Scansione dal menu principale Sviluppa test/piastra di scansione.
- Nella finestra iDev, selezionare Nuovo, quindi strumento di misurazione generale dell'intensità dal modello Sviluppa test.
- Fai clic su Crea sul lato destro del menu, selezionando l'obiettivo 10x.
- Si aprirà il menu Configura acquisizione. In questa finestra, selezionare i seguenti parametri: (a) numero di canali: il primo per la colorazione nucleare di Hoechst (BGRFR_386) e uno per ogni marcatore specifico del lignaggio utilizzato nella reazione (b) selezionare la messa a fuoco del software sul canale 1 e l'intervallo di messa a fuoco automatica come 1 (c) selezionare il modello di piastra dall'elenco.
- Dal menu di acquisizione, guarda la qualità della colorazione in diversi pozzi e campi diversi e seleziona manualmente il tempo di esposizione selezionando Tempo di esposizione fisso nel menu.
- Una volta impostati i parametri di acquisizione, selezionare Mini Scansione nella parte superiore del menu e selezionare dieci campi per pozzetto in due pozzetti per condizione sperimentale. Ciò consentirà l'impostazione di tutti i parametri di analisi in un sottoinsieme di campi per l'intera piastra.
- Al termine della mini scansione, fare clic su Configura parametro di analisi per configurare l'algoritmo dell'analisi.
- Fare clic su Configura gruppi sul lato destro della finestra e trascinare e rilasciare i pozzetti del miniscan. Fare clic sul pulsante Aggiungi nella sottosezione Gruppi per configurare i diversi gruppi.
- Segui il flusso di lavoro sul lato sinistro della finestra passo dopo passo per sviluppare l'intero algoritmo. Per prima cosa seleziona Elabora immagine per ogni canale e fai clic su Rimozione sfondo e sul livello desiderato.
- Per prima cosa identificare e selezionare i nuclei mediante colorazione nucleare. Fare clic su Identifica oggetto primario - Canale 1 per selezionare i nuclei reali ed evitare di analizzare artefatti e detriti. A tale scopo, ingrandire un'immagine rappresentativa della colorazione nucleare e verificare se i nuclei sono ben circondati dal perimetro costruito dal software. È possibile modificare il valore di soglia e applicare algoritmi di segmentazione per identificare meglio i singoli nuclei.
- Una volta definiti correttamente i nuclei, fare clic sul seguente passaggio: Convalida oggetto primario. Selezionare Object.BorderObject.Ch1 per evitare l'analisi dei nuclei sul bordo di ogni immagine di campo. Selezionare Object.Area.Ch1 e, spostando le barre "bassa" e "alta" sugli istogrammi, rimuovere tutti i detriti o gli oggetti di grandi dimensioni identificati corrispondenti ad aggregati o artefatti.
- Controlla tutte le immagini rappresentative della mini scansione di tutte le condizioni sperimentali per essere sicuro che i parametri selezionati si adattino a tutte loro.
- Fare clic su Identifica punti per ciascun canale corrispondente ai marcatori di lignaggio specifici e selezionare i valori dell'anello: Larghezza = 3 e Distanza = 0. Ciò consentirà l'identificazione della fluorescenza citoplasmatica. In base alla densità cellulare, questi valori possono essere adattati. Il software eviterà automaticamente la sovrapposizione tra anelli adiacenti.
- Selezionare Livelli di riferimento nel flusso di lavoro per compilare l'analisi. L'impostazione dei livelli di riferimento consentirà il conteggio automatico dei nuclei condensati, in base alla dimensione nucleare e all'intensità della colorazione nucleare, e di specifiche cellule marker-positive, in base alla fluorescenza citoplasmatica identificata dall'Anello.
- Per prima cosa clicca su Object.Area.Ch1. Nelle immagini di mini scansione, selezionare un nucleo condensato e spostare la barra "LOW" sugli istogrammi per selezionare come "condensati" tutti i nuclei sotto questa dimensione.
- Fare clic su Object.AvgIntensity.Ch1. Nelle immagini di mini scansione, selezionare un nucleo condensato e spostare la barra "HIGH" sugli istogrammi per selezionare come "condensati" tutti i nuclei al di sopra di questa intensità di fluorescenza.
- Fare clic su Object.RingAvgIntensity per ogni canale di marcatori specifici di lignaggio. Seleziona nelle tue immagini di mini scansione una cella positiva e sposta la barra "HIGH" sugli istogrammi per selezionare come "positive" tutte le cellule al di sopra di questa intensità di fluorescenza.
- Controlla tutte le immagini rappresentative della mini scansione di tutte le condizioni sperimentali per essere sicuro che i parametri selezionati si adattino a tutte loro.
- Nel menu in alto, selezionare Caratterizzazione popolazione e selezionare Sottopopolazione evento.
- Come evento di tipo 1, selezionare ObjectAreaCh1 nell'elenco a sinistra, quindi fare clic sul pulsante AND > e infine selezionare ObjectAvgIntensityCh1. Ciò consentirà l'identificazione di nuclei condensati, come combinazione di area bassa e alta intensità.
- Nella stessa finestra, deselezionare tutti i limiti di scansione.
- Fate clic su Seleziona feature da memorizzare nel menu in alto per scegliere i parametri da mantenere nell'analisi.
- Selezionare Feature pozzo e spostare dall'elenco di sinistra a quello destro solo i parametri desiderati: (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (per ogni canale dei marcatori di derivazione specifici).
NOTA: Questa analisi fornirà come lettura il numero totale di cellule, la percentuale di nuclei condensati e la percentuale di cellule positive specifiche del lignaggio per ciascun marcatore analizzato sul numero totale di cellule. Se la percentuale dei diversi lignaggi è necessaria solo su cellule vive, è possibile mantenere il valore "High_RingAvgIntensity" per il canale (numero assoluto di cellule positive) e ricalcolare la percentuale sul numero totale di cellule dopo la sottrazione della percentuale di cellule morte.- In alternativa, è possibile rimuovere le cellule morte dall'analisi impostando gli stessi parametri utilizzati per identificare i nuclei condensati (passi 11.14–11.15) sulla validazione dei nuclei (passo 11.11).
- Selezionare Scan Plate dal menu principale in alto e fare clic sul simbolo della piastra nel sottomenu Impostazioni scansione nella sezione superiore per identificare il pozzo da analizzare.
- Scrivi il nome dell'esperimento e la descrizione e, una volta completate tutte le impostazioni, premi il simbolo di riproduzione.
Risultati
La prima fase della coltura può variare nella durata, a seconda della densità di semina e del fatto che le sfere siano di origine fetale o adulta. Inoltre, le oligosfere mostrano un raddoppio della popolazione ridotto rispetto alle neurosfere (Figura 1B). Inoltre, la produzione di sfere da tessuto adulto è più lenta e possono essere necessarie 2-3 settimane per generare oligosfere rispetto a quelle fetali che possono richiedere 1-2 settimane, a seconda della densità di semina.
Una volta seminata, l'intera fase di differenziazione delle colture può essere monitorata utilizzando anticorpi specifici del lignaggio. Poiché l'obiettivo di questo protocollo è studiare la fase finale della differenziazione, la composizione della coltura a 0 DIV non viene presentata. Tuttavia, durante la prima fase di coltura, le cellule saranno ancora nestin-positive, rappresentando i precursori neurali, e la maggior parte delle cellule sono anche NG2-positive (OPC)11. Le cellule CNPasi-positive, corrispondenti allo stadio preOL, saranno rilevabili 3-6 giorni dopo l'induzione della differenziazione mediata da T3, mentre le cellule MBP-positive appariranno tra 6 e 12 DIV (OL maturi; vedere Figura 2C per la composizione delle colture alla fine della fase di differenziazione).
L'analisi HCS permette la rilevazione di ogni singola cellula in coltura attraverso la colorazione nucleare e l'analisi dell'intensità di fluorescenza nei restanti canali(Figura 2A,B). La composizione della coltura alla fine della fase di differenziazione (12 DIV) differisce a seconda che le colture siano di origine fetale o adulta, con colture fetali più reattive al differenziamento T3-mediato e raggiungendo una percentuale più alta di OL maturi12.
Durante l'intero processo di coltura, circa il 40%-50% delle cellule sono astrociti (cellule GFAP-positive), mentre una piccola percentuale (meno dello 0%-10%) sono neuroni (cellule beta-III-tubulin-positive; Figura 2C). La composizione della coltura può variare di un 10% tra i diversi preparati di coltura. Le colture adulte e fetali differiscono per la resa della produzione di OL maturi alla fine della fase di differenziazione, con cellule fetali che mostrano un'alta percentuale di OL maturi, una bassa percentuale di precursori e circa il 30%-40% degli astrociti. D'altra parte, le colture adulte presentano più astrociti (circa il 45%-55%) e meno cellule differenziate dopo 12 DIV di induzione della differenziazione.
Per consentire al software di riconoscere le cellule e fornire una corretta analisi imparziale della composizione della coltura, è importante che la densità di semina sia corretta, evitando sovrapposizioni tra cellule adiacenti. Quando gli OPC derivati da NSC vengono seminati ad alta densità, tendono ad aggregarsi molto velocemente, portando l'intera superficie del pozzo ad essere occupata dagli astrociti dopo pochi giorni. Inoltre, gli OL maturi con la loro caratteristica forma a rete a ragno non saranno visibili a causa dello spazio limitato (Figura 3A,B).
Il blocco di differenziazione mediato dall'infiammazione è riproducibile da questo test in vitro e genera una forte diminuzione delle preOL e delle OL mature rilevate dalla colorazione CNPasi e MBP sia in coltura fetale che adulta. Un aumento del numero di OPC si verifica anche nelle colture adulte (Figura 4A,B). La composizione del mix di citochine è stata scelta da esperimenti in vivo in un modello di ratto di sclerosi multipla13ed è stata testata come modello in vitro per il blocco di differenziazione mediato dall'infiammazione che si verifica in questa malattia.
Mentre le OPC fetali e adulte mostrano la stessa vulnerabilità all'esposizione infiammatoria alle citochine, solo le colture di derivazione fetale sono sensibili alla tossicità OGD (Figura 5A, B), mostrando un aumento della morte cellulare e della compromissione della differenziazione a causa del loro diverso profilo metabolico14.

Figura 1: Configurazione della coltura cellulare precursore di oligodendrociti derivati da cellule staminali neurali e protocollo di differenziazione. (A) Schema della procedura sperimentale. (B) Immagini rappresentative di neurosfere a 2, 5 e 7 DIV e grafico che mostra il raddoppio della popolazione di neurosfere e oligosfere. Barra di scala: 100 μm. (C) Immagini rappresentative di OPC derivati da oligosfere seminate che mostrano i diversi stadi di differenziazione, da cellule di nestin e NG2-positive a 0 DIV (precursore neurale/OPC), attraverso cellule CNPasi-positive a 6 DIV (preOL) e cellule cnpasi/MBP doppie positive alla fine della fase di differenziazione (12 DIV; OL maturi). Le cellule GFAP-positive (astrociti) e una piccola percentuale di cellule beta-III-tubulin positive (neuroni) sono presenti in tutta la coltura. Barre di scala: 20 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
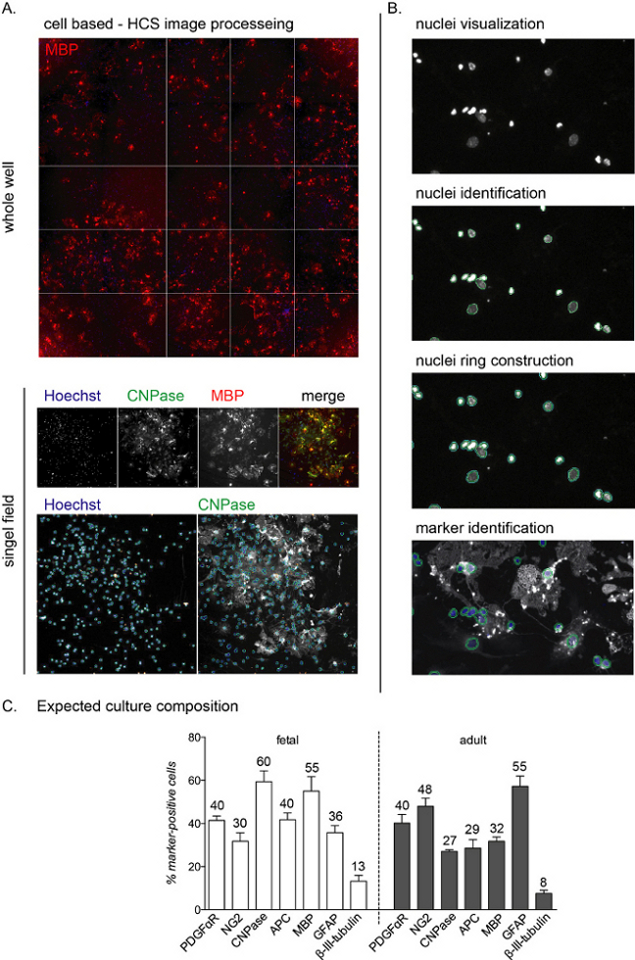
Figura 2: Flussi di lavoro di analisi di screening ad alto contenuto basati su celle e lettura della differenziazione prevista. (A) Immagini rappresentative dell'acquisizione di HCS di un intero pozzo (piastra a 96 pozzetti) e di un singolo campo isolato acquisito con un obiettivo 10x di una coltura di 12 DIV di OPC derivati da NSC. (B) Fasi del flusso di lavoro di analisi HCS tra cui la visualizzazione dei nuclei (oggetti), l'identificazione e la costruzione dell'anello dei nuclei per identificare la colorazione citoplasmatica e l'identificazione dei marcatori. (C) Grafico che mostra la composizione di coltura prevista alla fine della fase di differenziazione (12 DIV). I marcatori per OPC (PDGFαR, NG2), preOL (CNPasi, APC), OL maturi (MBP), astrociti (GFAP) e neuroni (β-III-tubulina) sono mostrati sia per le colture di derivazione fetale che per quella adulta. Le percentuali arrotondate per ogni marcatore di cella sono incluse nel grafico, si noti che si tratta di un esperimento rappresentativo e le percentuali possono essere diverse circa il 5%-10%. Fare clic qui per visualizzare una versione più grande di questa figura.
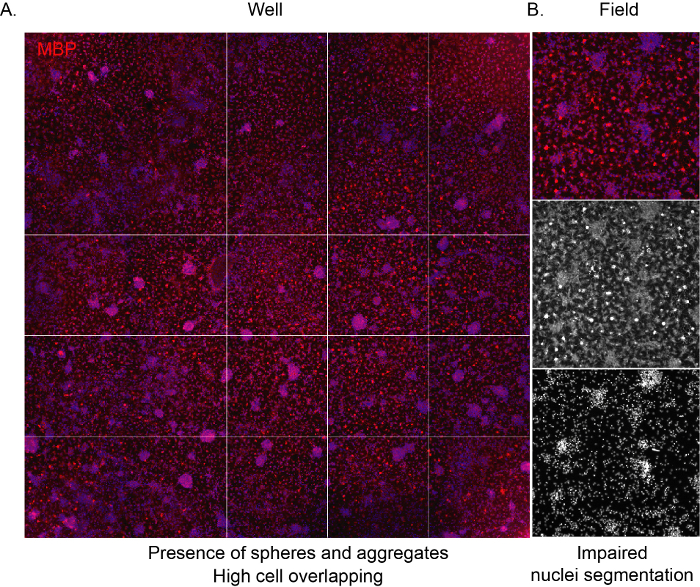
Figura 3: Immagini rappresentative di screening ad alto contenuto di una cultura ad alta densità. (A) Immagine rappresentativa di un'immagine di pozzo (piastra a 96 pozzetti) acquisita da un obiettivo 10x e contrassegnata per l'espressione MBP al termine della fase di differenziazione (12 DIV). (B) Immagine rappresentativa estratta del campo che evidenzia la presenza di cellule aggregate e nuclei sovrapposti. Fare clic qui per visualizzare una versione più grande di questa figura.
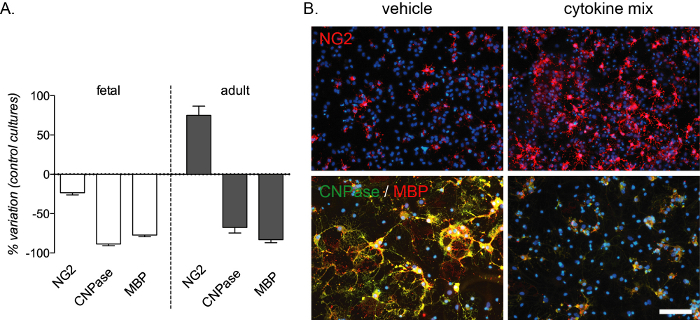
Figura 4: Effetto atteso del trattamento con citochine su colture OPC derivate da feto e da adulti. (A) Grafico che mostra la percentuale di variazione delle colture OPC derivate da fetale e adulta rispetto alle colture standard, compresa la quantificazione di OPC (NG2), preOL (CNPasi) e OL maturi (MBP) alla fine della fase di differenziazione (12 DIV). (B) Immagini rappresentative di colture adulte al termine della fase di differenziazione (12 DIV) trattate con veicolo o miscela di citochine e marcate per NG2 o CNPasi/MBP. Barra della scala: 20 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
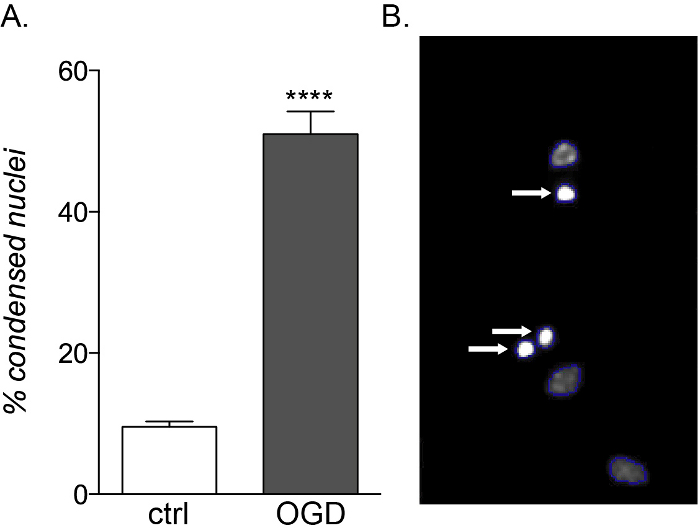
Figura 5: Effetto atteso dell'esposizione all'OGD su colture OPC di derivazione fetale. (A) Grafico che mostra la percentuale di nuclei condensati quantificati da HCS cellulare in colture di controllo (ctrl) e OGD-esposte. (B) Immagini rappresentative di oggetti trattati con HCS che evidenziano i nuclei condensati identificati (frecce bianche). Fare clic qui per visualizzare una versione più grande di questa figura.
| Anticorpo | Specie | Diluizione | |
| β-III-tubulina (sistema di ricerca e sviluppo) | topo | 1:3000 | |
| anti-GFAP (Dako) | coniglio | 1:1000 | |
| anti-NG2 (Millipore) | coniglio | 1:350 | |
| anti-PDGFαR (Santa Cruz Biotechnology) | coniglio | 1:300 | |
| anti-CNPasi (Millipore) | topo | 1:500 | |
| IgG2b anti-APC, clone CC1 (Calbiochem) | topo | 1:100 | |
| Anti-MBP (Dako) | coniglio | 1:250 | |
| Anti-nestin (Millipore) | topo | 1:500 | |
| Alexa Fluor 488-coniugato anti mouse (ThermoFisher Scientific) | asino | 1:500 | |
| Alexa Fluor 647-coniugato anti-mouse IgG2b (ThermoFisher Scientific) | capra | 1:500 | |
| Alexa 568-coniugato anti-coniglio (ThermoFisher Scientific) | asino | 1:500 | |
Tabella 1: Elenco degli anticorpi primari e secondari.
Discussione
La natura complessa dei processi di mielinizzazione/rimielinizzazione e degli eventi demielinizzanti rende estremamente impegnativo lo sviluppo di sistemi predittivi in vitro. I sistemi di screening farmacologico in vitro più utilizzati sono per lo più linee cellulari umane o colture PRIMARIE di OL puro, con un uso crescente di co-colture più complesse o sistemi organotipici15. Anche se tali sistemi sono accoppiati con tecnologie ad alto contenuto, le colture OL pure rimangono il metodo di scelta quando si sviluppano piattaforme di screening16.
La coltura mista spontanea qui descritta rappresenta un utile sistema in vitro, che tiene conto di tutte le principali variabili: differenziamento fisiologico dell'OPC mediato da T3, interferenti patologici con il processo, altre componenti cellulari e differenze legate all'età. La procedura contiene una serie di variabili derivanti dall'origine delle cellule (età dell'animale) e dalla formazione e manipolazione degli sferoidi. Infatti, un passaggio critico è la densità cellulare delle NSC seminate dopo l'isolamento dal tessuto, perché nella condizione ottimale una singola sfera dovrebbe derivare da una singola cellula proliferante. Poiché abbiamo visto che le NSC isolate tendono ad aggregarsi e che hanno bisogno dei propri fattori paracrini secreti, seminarle in un intervallo di 10-50 cellule / μL, in un pallone t25 o t75, è il miglior compromesso per evitare l'aggregazione cellulare ma consentendo comunque alle cellule di comunicare secernendo fattori.
I principali limiti della tecnica sono la mancanza di una mielinizzazione assonale funzionale e di un'interazione diretta con i neuroni, poiché il metodo tiene conto solo della differenziazione OPC fino allo stadio di OL maturi: CNPasi/MBP-cellule doppie positive con morfologia a rete ragnatela. A tal fine, le OPC primarie coltivate su gangli della radice dorsale isolati sono ancora la metodologia principale17. Tuttavia, la possibilità di differenziare queste cellule dagli animali a qualsiasi età è un punto fondamentale nel processo traslazionale, poiché consente la sperimentazione di composti e stimoli nocivi su cellule isolate dall'età di interesse. Come qui descritto, infatti, le NSC possono essere isolate sia dal cervello fetale che da quello adulto. Poiché la mielinizzazione evolutiva e la rimielinizzazione in età adulta condividono lo stesso obiettivo, cioè raggiungere l'assone nudo e creare la guaina mielinica, è stato originariamente ipotizzato che i due processi fossero identici in ogni aspetto, generando la cosiddetta ipotesi di ricapitolazione18. Tuttavia, è ormai chiaro che i due processi non possono essere considerati uguali e che le differenze intrinseche all'età delle cellule sono presenti e dovrebbero essere prese in considerazione quando si sceglie il modello in vitro più adatto per la domanda sperimentale19. Le OPC derivate da NSC adulte, infatti, mostrano forti differenze nella differenziazione fisiologica guidata dal TH e vulnerabilità agli stimoli nocivi14,20 e alle OPC primarie21,22. Esiste anche eterogeneità della popolazione di OPC e OL nei tessuti adulti, di particolare rilevanza per le condizioni patologiche23. I protocolli per l'isolamento delle OPC primarie dai tessuti adulti sono disponibili24 e dovrebbero essere considerati quando la domanda sperimentale è rivolta alle molecole che agiscono sulla rimielinizzazione in età adulta.
La differenziazione degli OPC dalle NSC consente la rappresentazione in vitro dell'intero processo di differenziazione, dal precursore indifferenziato all'OL maturo. Questo processo assomiglia alla condizione in vivo, in cui TH è il principale motore del processo, agendo attraverso specifici recettori nucleari, e consente interferenze sperimentali con questo meccanismo per imitare le condizioni patologiche in una visione traslazionale13.
L'ultima caratteristica fondamentale del modello è la presenza costante di astrociti in tutta la coltura. Mentre questo rende la coltura più difficile da analizzare, la sua complessa composizione cellulare costituisce un netto vantaggio. Il modo in cui gli astrociti contribuiscono alla risposta a eventi nocivi in colture neuronali miste25 è ampiamente noto, e l'assenza di questo componente principale del SNC rende il sistema in vitro scarsamente prevedibile e traducibile. D'altra parte, per questa caratteristica, le colture derivate da NSC hanno lo svantaggio di essere meno uniformi dei sistemi di tipo monocellulare, e questo può portare a un'analisi distorta. Tuttavia, la tecnica HCS cell-based consente un'analisi dell'intera coltura e di tutte le popolazioni cellulari, rimuovendo anche la randomizzazione di campi rappresentativi per l'analisi. Supponendo che la coltura cellulare utilizzata per l'esperimento sia di qualità di semina affidabile, l'HCS fornirà un quadro completo delle condizioni sperimentali, generando dati statisticamente robusti e una serie di analisi automatiche basate sulla fluorescenza.
In conclusione, l'attuale protocollo descrive la procedura per l'isolamento e la differenziazione delle OPC derivate da NSC dal cervello fetale e adulto. L'intero protocollo dura circa 30 giorni, a seconda dell'età degli animali e degli obiettivi sperimentali. In particolare, la formazione di sfere di origine adulta può richiedere il doppio rispetto a quelle fetali, a parità di densità di semina. Il tempo di 15 giorni (da -3 a 12 DIV) dopo la semina su superficie 2D per l'induzione della differenziazione è, comunque, un tempo fisso in tutte le condizioni. Il protocollo completo consente lo studio dell'intero processo di differenziamento mediato da TH in un ambiente cellulare complesso, interferenze attraverso specifici meccanismi patologici (es. citochine infiammatorie e HI) e la conseguente sperimentazione di nuove strategie volte al superamento di tali problematiche. L'accoppiamento del modello di coltura con la tecnica HCS genera una piattaforma di screening robusta e traducibile.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Sostenuto dal PROGETTO IRMI (CTN01_00177_888744) dei Cluster Tecnologici Nazionali del MIUR e dalla Regione Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020.
Un ringraziamento speciale a Fondazione IRET per aver ospitato il lavoro sperimentale.
Materiali
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Riferimenti
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340(2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, Eli Lilly & Company and the National Center for Advancing Translational Sciences. 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, Clifton, N.J. 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443(2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443(2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750(2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419(2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681(2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620(2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon