Method Article
High-Content-Screening-Differenzierungs- und Reifungsanalyse von fetalen und adulten neuralen Stammzellen-abgeleiteten Oligodendrozyten-Vorläuferzellkulturen
In diesem Artikel
Zusammenfassung
Wir beschreiben die Produktion von Mischkulturen von Astrozyten und Oligodendrozyten-Vorläuferzellen, die aus fetalen oder adulten neuralen Stammzellen gewonnen werden, die sich in reife Oligodendrozyten unterscheiden, und in vitro die Modellierung schädlicher Reize. Die Kopplung mit einer zellbasierten High-Content-Screening-Technik bildet ein zuverlässiges und robustes Wirkstoff-Screening-System.
Zusammenfassung
Die Haupthürde bei der Entwicklung von Arzneimittel-Screening-Techniken zur Beurteilung der Wirksamkeit therapeutischer Strategien bei komplexen Krankheiten besteht darin, ein Gleichgewicht zwischen in vitro Vereinfachung und der Wiederherstellung der komplexen In-vivo-Umgebung zu finden, zusammen mit dem Hauptziel, das von allen Screening-Strategien geteilt wird, robuste und zuverlässige Daten zu erhalten, die für die In-vivo-Translation hochprädiktiv sind.
Im Bereich der demyelinisierenden Erkrankungen basiert die Mehrheit der Arzneimittel-Screening-Strategien auf immortalisierten Zelllinien oder reinen Kulturen isolierter primärer Oligodendrozyten-Vorläuferzellen (OPCs) von neugeborenen Tieren, was zu starken Verzerrungen aufgrund des Fehlens altersbedingter Unterschiede und eines realen pathologischen Zustands oder einer realen pathologischen Komplexität führt.
Hier zeigen wir den Aufbau eines In-vitro-Systems, das darauf abzielt, die physiologische Differenzierung / Reifung von aus neuronalen Stammzellen (NSC) abgeleiteten OPCs zu modellieren, die leicht manipuliert werden können, um pathologische Zustände nachzuahmen, die für demyelinisierende Krankheiten typisch sind. Darüber hinaus beinhaltet die Methode die Isolierung von fetalen und erwachsenen Gehirnen, wodurch ein System entsteht, das sich dynamisch von OPCs zu reifen Oligodendrozyten (OLs) in einer spontanen Kokultur unterscheidet, die auch Astrozyten umfasst. Dieses Modell ähnelt physiologisch dem Schilddrüsenhormon-vermittelten Myelinisierungs- und Myelinreparaturprozess, was die Zugabe von pathologischen Interferenzen ermöglicht, die Krankheitsmechanismen modellieren. Wir zeigen, wie man die beiden Hauptkomponenten demyelinisierender Erkrankungen (d.h. Hypoxie/Ischämie und Entzündung) nachahmen kann, indem man ihre Wirkung auf die Entwicklungsmyelinisierung und die adulte Myelinreparatur nachbildet und alle Zellkomponenten des Systems durchgehend berücksichtigt, während wir uns auf die Differenzierung von OPCs konzentrieren.
Dieses spontane Mischmodell, gekoppelt mit zellbasierten High-Content-Screening-Technologien, ermöglicht die Entwicklung eines robusten und zuverlässigen Wirkstoff-Screening-Systems für therapeutische Strategien, die darauf abzielen, die pathologischen Prozesse der Demyelinisierung zu bekämpfen und die Remyelinisierung zu induzieren.
Einleitung
Im zentralen Nervensystem (ZNS) sind myelinbildende Zellen (Oligodendrozyten, OLs) und ihre Vorläufer (Oligodendrozyten-Vorläuferzellen, OPCs) für die Entwicklungsmyelinisierung, ein Prozess, der während der peri- und postnatalen Periode auftritt, sowie für den Myelinumsatz und die Myelinreparatur (Remyelinisierung) im Erwachsenenalter verantwortlich1. Diese Zellen sind hochspezialisiert und interagieren anatomisch und funktionell mit allen anderen glialen und neuronalen Komponenten, was sie zu einem grundlegenden Bestandteil der Struktur und Funktion des ZNS macht.
Demyelinisierende Ereignisse sind an verschiedenen ZNS-Verletzungen und-Erkrankungen 2beteiligt und wirken hauptsächlich über multifaktorielle Mechanismen sowohl während der Entwicklung als auch im Erwachsenenalter auf OPCs und OLs. Die undifferenzierten Vorläufer werden durch differenzierende Faktoren, hauptsächlich Schilddrüsenhormon (TH), in einem synchronisierten Prozess3 angetrieben, der den OPC dazu bringt, spezifische Reize zu erkennen und darauf zu reagieren, die Proliferation, Migration zum nicht myelinisierten Axon und Differenzierung in reife OLs induzieren, die wiederum die Myelinscheide entwickeln4. All diese Prozesse werden fein gesteuert und laufen in einem komplexen Umfeld ab.
Aufgrund der komplexen Natur von Myelinisierungs-, Remyelinisierungs- und Demyelinisierungsereignissen besteht ein großer Bedarf an einer vereinfachten und zuverlässigen In-vitro-Methode, um die zugrunde liegenden Mechanismen zu untersuchen und neue therapeutische Strategien zu entwickeln, wobei der Schwerpunkt auf dem zellulären Hauptakteurliegt:dem OPC 5 .
Damit ein In-vitro-System zuverlässig ist, müssen eine Reihe von Faktoren berücksichtigt werden: die Komplexität der zellulären Umgebung, altersbedingte zellintrinsische Unterschiede, physiologische TH-vermittelte Differenzierung, pathologische Mechanismen und die Robustheit der Daten6. Tatsächlich ist der unerfüllte Bedarf auf diesem Gebiet ein Modell, das die Komplexität des In-vivo-Zustands nachahmt, der durch die Verwendung isolierter reiner OPC-Kulturen nicht erfolgreich erreicht wird. Darüber hinaus betreffen die beiden Hauptkomponenten demyelinisierender Ereignisse, Entzündung und Hypoxie/Ischämie (HI), direkt andere Zellkomponenten, die indirekt die physiologische Differenzierung und Reifung von OPCs beeinflussen können, ein Aspekt, der in zu vereinfachten In-vitro-Modellen nicht untersucht werden kann.
Ausgehend von einem hochprädiktiven Kultursystem besteht die nachfolgende und allgemeinere Herausforderung darin, robuste und zuverlässige Daten zu erzeugen. In diesem Zusammenhang ist das zellbasierte High-Content-Screening (HCS) die am besten geeignete Technik 7 , da es unser Ziel ist, erstens die gesamte Kultur ineinemautomatischen Workflow zu analysieren, die Verzerrung der Auswahl repräsentativer Felder zu vermeiden, und zweitens die automatische und gleichzeitige Generierung von bildgebenden High-Content-Daten zu erhalten8.
Da die Hauptanforderung darin besteht, das beste Gleichgewicht zwischen in vitro Vereinfachung und in vivo-nachahmender Komplexität zu erreichen, stellen wir hier eine hochreproduzierbare Methode zur Gewinnung von OPCs aus neuralen Stammzellen (NSCs) vor, die aus dem fetalen Vorderhirn und der adulten subventrikulären Zone (SVZ) isoliert wurden. Dieses in vitro Modell umfasst den gesamten OPC-Differenzierungsprozess, vom multipotenten NSC bis zur reifen/myelinisierenden OL, physiologisch TH-abhängig. Die resultierende Kultur ist ein dynamisch differenzierendes / reifendes System, das zu einer spontanen Kokultur führt, die hauptsächlich aus differenzierenden OPCs und Astrozyten besteht, mit einem geringen Prozentsatz an Neuronen. Diese Primärkultur ahmt die komplexe In-vivo-Umgebung besser nach, während ihre Stammzellableitung einfache Manipulationen ermöglicht, um die gewünschte Zelllinienanreicherung zu erhalten.
Im Gegensatz zu anderen Drug-Screening-Strategien unter Verwendung von Zelllinien oder Reinkulturen primärer OPCs ermöglicht die hier beschriebene Methode die Untersuchung der Wirkung pathologischer Interferenzen oder therapeutischer Moleküle in einer komplexen Umgebung, ohne den Fokus auf den gewünschten Zelltyp zu verlieren. Der beschriebene HCS-Workflow erlaubt eine Analyse der Zelllebensfähigkeit und Abstammungsspezifikation sowie des linienspezifischen Zelltods und morphologischer Parameter.
Protokoll
Alle hier beschriebenen Tierprotokolle wurden gemäß den Richtlinien des Rates der Europäischen Gemeinschaft (86/609/EWG) durchgeführt und entsprechen den im NIH-Leitfaden für die Pflege und Verwendung von Versuchstieren veröffentlichtenRichtlinien.
1. Lösungen und Reagenzien
- Standardmedium vorbereiten: DMEM/F12 GlutaMAX 1x; 8 mmol/L HEPES; 100 U/100 μg Penicillin/Streptomycin (1% p/s); 1x B27; 1x N-2.
- Neurosphärenmedium vorbereiten: 10 ng/ml bFGF hinzufügen; 10 ng/mL EGF auf Standardmedium.
- Oligosphäre/OPC-Medium vorbereiten: 10 ng/ml bFGF zugeben; 10 ng/mL PDGF-AA auf Standardmedium.
- Oligodendroktye-Differenzierungsmedium vorbereiten: 50 nM T3 hinzufügen; 10 ng/ml CNTF; 1x N-Acetyl-L-Cystein (NAC) zu Standardmedium.
- Nicht-enzymatischen Dissoziationspuffer vorbereiten: 1% P /S in den nicht-enzymatischen Dissoziationspuffer geben und eiskalt halten.
- Saccharoselösung zubereiten: HBSS, 0,3 g/ml Saccharose.
- BSA-Waschlösung vorbereiten: EBSS, 40 mg/ml BSA, 0,02 ml/l HEPES.
- Enzymatischer Dissoziationspuffer herstellen: HBSS, 5,4 mg/ml D-Glucose, 15 mmol/L HEPES, 1,33 mg/ml Trypsin, 0,7 mg/ml Hyaluronidase, 80 U/ml DNase.
- Zytokinmischung vorbereiten: TGF-β1, TNF-α, IL-1β, IL-6, IL-17 und IFN-γ (jeweils 20 ng/ml).
- Zytokin-Mischfahrzeug vorbereiten: 0,04% des Bestands (10% Glycerin/100 nM Glycin/25 nM Tris, pH 7,3).
- Sauerstoff-Glukose-Deprivationsmedium vorbereiten: Standardmedium mit DMEM ohne Glukose. Abhängig von der Stringenz der gewünschten Glukoseentzugsbedingung ist es möglich, auch B27 und/oder N2 aus dem Medium zu entfernen, um glukosebedingte Verbindungen (z. B. D-Galactose in B27) zu vermeiden.
2. Dissektion und NSC-Isolierung
HINWEIS: Fetale und erwachsene NSCs wurden aus E13,5 fetalem Vorderhirn oder 2,5 Monate alter subventrikulärer Zone (SVZ) isoliert, wobei das Ahlenius- und Kokaia-Protokoll9 mit Modifikationen eingehalten wurde.
- Fetale NSC-Kulturen
ANMERKUNG: Bevor Sie mit den Dissektionen beginnen, stellen Sie 1,5 ml Röhrchen mit jeweils 150 μL nicht-enzymatischem Dissoziationspuffer her; Petrischalen reinigen und eiskaltes HBSS hinzufügen.- Entnehmen Sie die Embryonen bei E13.5 - 14.5 von zeitgesteuerten trächtigen Mäusen und legen Sie sie in eine Petrischale mit kaltem HBSS.
- Enthaupten Sie die Embryonen mit einer Pinzette.
- Legen Sie die Köpfe der Embryonen in eine saubere Petrischale mit eiskaltem PBS und entfernen Sie die Haut mit einer Pinzette mit einer Lupe oder einem Stereoskop vom Schädel.
- Sobald das Gehirn sichtbar und von der Haut befreit ist, drücken Sie es aus, indem Sie mit einer Pinzette Druck auf die Seiten ausüben.
- Entfernen Sie das Kleinhirn, behalten Sie nur das Vorderhirn und entfernen Sie die Hirnhäute mit einer Pinzette.
- Legen Sie das isolierte Gewebe in den nicht-enzymatischen Dissoziationspuffer und wiederholen Sie die Dissektionsschritte mit den anderen Embryonen. Führen Sie das Gewebe von 2-3 Tieren in jedes Röhrchen ein, das den Puffer enthält.
- Bei 37 °C für 15 min unter kontinuierlichem Schütteln inkubieren.
- Nach der Inkubation 850 μL Standardmedium zugeben und durch Pipettieren mischen, bis die Suspension frei von Klumpen ist.
- Wenn nicht dissoziiertes Gewebe noch sichtbar ist, warten Sie 2 min bei RT, bis es sich am Boden des Röhrchens ablagert.
- Wenn die Dissoziation abgeschlossen ist, zählen Sie die Zellen und platten Sie sie in Suspension mit einer Dichte von 10-50 Zellen / μL in einem T-25- oder T-45-Kolben mit 10-30 ml Neurosphärenmedium, der in einer vertikalen Position gehalten wird, um eine Zelladhäsion zu vermeiden.
-
Erwachsene NSC-Kulturen
- Opfertiere durch zervikale Luxation.
- Sammeln Sie Gehirne von 4-5 Mäusen in einem 50 ml Röhrchen, das eiskaltes HBSS enthält.
- Legen Sie das Gehirn auf eine kalte sterile Oberfläche. Verwenden Sie zu diesem Zweck einen mit Wasser gefüllten T-25-Kolben, der über Nacht bei -20 °C aufgestellt wird. Zum Zeitpunkt des Experiments den Kolben mit steriler Aluminiumfolie abdecken.
- Legen Sie die Ventralseite des Gehirns nach unten, in rostro-kaudaler Richtung, und entfernen Sie die Riechkolben mit einer Rasierklinge.
- Schneiden Sie mit einer Rasierklinge 2–3 koronale Scheiben von 1 mm Dicke vom Kortex bis zum optischen Chiasma.
- Legen Sie die Scheiben in ventro-dorsaler Position auf die kalte Oberfläche und identifizieren Sie den Corpus callosum und die beiden lateralen Ventrikel.
- Isolieren Sie mit einer Lupe oder einem Stereoskop die Wände der seitlichen Ventrikel und achten Sie darauf, keine Stücke des Corpus callosum zu tragen.
- Das isolierte Gewebe in den enzymatischen Dissoziationspuffer (5–10 ml) geben und bei 37 °C für 15 min inkubieren.
- Mischen Sie die Lösung, pipettieren Sie mehrmals (mindestens 50) und inkubieren Sie erneut bei 37 ° C für 10 min.
- Neutralisieren Sie das Trypsin durch Zugabe von 5 ml Standardkulturmedium und filtern Sie die Lösung mit einem 70 μm-Filter.
- Zentrifugieren Sie die filtrierte Lösung für 5 min bei 400 x g.
- Resuspendieren Sie das Pellet in der Saccharoselösung und zentrifugieren Sie es für 10 min bei 500 x g.
- Resuspendieren Sie das Pellet in BSA-Waschlösung und zentrifugieren Sie es für 7 min bei 400 x g.
- Resuspendieren Sie das Pellet im Standardkulturmedium, zählen Sie die Zellen und führen Sie die Beschichtung wie oben beschrieben durch (in Schritt 2.1.10).
3. Primäre Neurosphären
- Fügen Sie die Wachstumsfaktoren (bFGF/EGF) alle 2 Tage hinzu.
- Wechseln Sie alle 4–6 Tage (abhängig von der Zelldichte) die Hälfte des Mediums wie folgt:
- Übertragen Sie die gesamte Zellsuspension auf ein 15- oder 50-ml-Röhrchen.
- Zentrifuge für 5 min bei 400 x g.
- Entfernen Sie die Hälfte des Volumes.
- Fügen Sie die gleiche Menge frisches Medium hinzu, mischen Sie vorsichtig durch Pipettieren und fügen Sie Wachstumsfaktoren hinzu.
4. Oligosphären
HINWEIS: Die Oligodendrozytendifferenzierung erfolgt nach dem Chen-Protokoll10 mit Modifikationen.
- Wenn die Neurosphären einen Durchmesser von 100–150 μm erreichen, sind sie bereit, passiert zu werden. Dazu die gesamte Zellsuspension in ein 15- oder 50-ml-Röhrchen überführen und 5 min bei 400 x gzentrifugieren.
- Bewerten Sie schnell den Durchmesser, indem Sie Bilder der Kugeln mit einem invertierten Durchlichtmikroskop aufnehmen und sie mit der ImageJ-Software öffnen.
- Klicken Sie auf das Menü Analysieren und wählen Sie im Fenster Extras die Option Maßstabsleiste.
- Stellen Sie 150 μm als Breite in Mikrometern ein und vergleichen Sie den Maßstabsbalken mit den Kugeln.
- Entfernen Sie das gesamte Volumen durch Inversion und resuspenieren Sie das Pellet in 180 μL frischem Standardkulturmedium. 50-mal pipettieren, um eine Disaggregation der Kugeln zu ermöglichen.
- Fügen Sie 810 μL frisches Standardkulturmedium hinzu, zählen Sie die Zellen und platten Sie sie wie für die Neurosphären beschrieben neu.
- Fügen Sie bFGF / PDGF-AA 10 ng / ml alle 2 Tage hinzu.
- Wechseln Sie alle 4–6 Tage (abhängig von der Zelldichte) die Hälfte des Mediums wie folgt:
- Übertragen Sie die gesamte Zellsuspension auf ein 15- oder 50-ml-Röhrchen.
- Zentrifuge für 5 min bei 400 x g.
- Entfernen Sie die Hälfte des Volumes.
- Fügen Sie die gleiche Menge frisches Medium hinzu, mischen Sie vorsichtig durch Pipettieren und fügen Sie Wachstumsfaktoren hinzu.
5. Plattenbeschichtung
- Poly-D, L-Ornithin / Laminin-Beschichtung: mindestens 2 Tage vor dem Plattieren der OPCs, fügen Sie 50 μg / ml Poly-D, L-Ornithin-Lösung, verdünnt in PBS, zu jeder Vertiefung hinzu (40 μL / Well für 96-Well-Platten) und inkubieren Sie bei RT über Nacht.
- Am nächsten Tag die Flüssigkeit entfernen und dreimal mit destilliertem sterilem Wasser waschen.
- Lassen Sie die Platten bei RT über Nacht trocknen. Am nächsten Tag wird eine in PBS verdünnte Lamininlösung (5 μg/ml; 40 μL/Well für 96-Well-Platten) zugegeben und 2 h bei 37 °C inkubiert.
6. Zell-Seeding
- Wenn die Oligosphären einen Durchmesser von 100–150 μm erreichen, sind sie bereit, dissoziiert und auf den Poly-D,L-Ornithin/Laminin-beschichteten Platten ausgesät zu werden. Dazu wird die gesamte Zellsuspension in ein 15- oder 50-ml-Röhrchen überführt und 5 min bei 400 x g zentrifugiert (wie in Schritt 4.1 angegeben).
- Entfernen Sie das gesamte Volumen durch Inversion und resuspenieren Sie das Pellet in 180 μL frischem Standardkulturmedium. 50-mal pipettieren, um eine Disaggregation der Kugeln zu ermöglichen.
- Fügen Sie 810 μL frisches Standardkulturmedium hinzu und zählen Sie die Zellen.
- Entfernen Sie die Lamininlösung aus den Vertiefungen und platten Sie die Zellen mit einer Dichte von 3.000 Zellen/cm2 (100 μL/Well für 96-Well-Platten).
7. OPC-Differenzierungsinduktion
- Entfernen Sie nach 3 Tagen das gesamte Medium und fügen Sie das gleiche Volumen oligodendrozytendifferenzierungsmedium hinzu.
- Wechseln Sie alle 4 Tage die Hälfte des Mediums und fügen Sie alle 2 Tage eine frische Differenzierungsmischung (T3 / CNTF / NAC) hinzu.
8. Induktion eines entzündungsvermittelten Differenzierungsblocks
- Nach der Neurosphärendissoziation und der Oligosphärenproduktion (Abschnitt 4) wird die Zytokinmischung in das Kulturmedium gegeben und die Oligosphären während des gesamten Sphärenbildungsschritts Zytokinen ausgesetzt.
HINWEIS: Das Volumen hängt von der Anzahl der Zellen ab, da für die Kugeln, die Zellen bilden, mit 10–50 Zellen/μL ausgesät werden. - Wenn das Medium gewechselt werden muss, ändern Sie das gesamte Volumen und fügen Sie die Zytokinmischung erneut hinzu.
9. Induktion des Sauerstoff-Glukose-Deprivations Zelltods
- Bei -1 DIV (2 Tage nach dem Cell Seeding in Multiwell-Platten) entfernen Sie das Medium und konservieren es in einer neuen Multiwell-Platte.
- Fügen Sie die Hälfte des Volumens (50 μL für 96-Well-Platten) des OGD-Mediums (OGD-Gruppe) oder des frischen Mediums (Kontrollgruppe) hinzu. Die halbe Volumenmenge wird verwendet, um den Sauerstoffaustausch zwischen der Flüssigkeit und der Luft zu reduzieren.
- Legen Sie die OGD-Gruppenkulturen in eine luftdichte Hypoxiekammer, die mit 95%N2 und 5% CO2 gesättigtist. Um eine Sättigung der Kammer zu erreichen, lassen Sie das Gasgemisch 6 min bei 25 l/min fließen, bevor Sie die Kammerrohre schließen.
- Inkubieren Sie die hypoxische Kammer im Inkubator für 3 h. Die Kontrollgruppe und die Platten, die das in Schritt 9.1 entfernte und konservierte Medium enthalten, sollten ebenfalls im Inkubator verbleiben.
- Entfernen Sie das glucosefreie (OGD-Gruppe) oder das neue Medium (Kontrollgruppe) und fügen Sie das in Schritt 9.1 entfernte und konservierte Medium hinzu.
10. Immunzytochemie
- Fixieren Sie die Zellen zum gewünschten Zeitpunkt mit kaltem 4% Paraformaldehyd für 20 min bei RT.
- Zweimal mit PBS waschen (10 Minuten Inkubation für jede Wäsche bei RT).
- 1 h bei RT mit der Blockierungslösung (PBS Triton 0,3% mit 1% BSA und 1% Esel/Ziege normalem Serum) inkubieren.
- Inkubieren mit primärer Antikörpermischung (Tabelle 1), verdünnt in PBS triton 0,3%, über Nacht bei 4 °C.
- Zweimal mit PBS waschen (10 Minuten Inkubation für jede Wäsche bei RT).
- Inkubieren mit sekundärer Antikörperlösung (Tabelle 1), verdünnt in PBS-Triton 0,3% unter Zugabe von Hoechst 33258 für 30 min bei 37 °C.
- Zweimal mit PBS waschen (10 Minuten Inkubation für jede Wäsche bei RT).
11. HCS-Analyse der Zelllebensfähigkeit, der Abstammungszusammensetzung und des linienspezifischen Zelltods
HINWEIS: Die repräsentativen HCS-Bilder und der Workflow sind in Abbildung 2A,B dargestellt.
- Wählen Sie den Kompartimentanalyse-Algorithmus aus dem Hauptmenü der Software (HCS Studio v 6.6.0) und wählen Sie Scannen aus dem Hauptmenü Assay/Scanplatte entwickeln.
- Wählen Sie im iDev-Fenster Neu und dann in der Vorlage Assay entwickeln die Option Allgemeines Intensitätsmesstool aus.
- Klicke auf der rechten Seite des Menüs auf "Erstellen" und wähle das 10-fache Ziel aus.
- Dadurch wird das Menü Erfassung konfigurieren geöffnet. Wählen Sie in diesem Fenster die folgenden Parameter aus: (a) Anzahl der Kanäle: der erste für die Hoechst-Kernfärbung (BGRFR_386) und einer für jeden in der Reaktion verwendeten linienspezifischen Marker (b) Wählen Sie den Softwarefokus auf Kanal 1 und das Autofokusintervall als 1 (c) wählen Sie das Plattenmodell aus der Liste.
- Schauen Sie sich im Erfassungsmenü die Qualität der Färbung in verschiedenen Vertiefungen und verschiedenen Feldern an und wählen Sie die Belichtungszeit manuell aus, indem Sie im Menü Feste Belichtungszeit auswählen.
- Sobald die Erfassungsparameter eingestellt sind, wählen Sie oben im Menü Mini-Scan und wählen Sie zehn Felder pro Vertiefung in zwei Vertiefungen pro Versuchsbedingung aus. Dies ermöglicht die Einrichtung aller Analyseparameter in einer Teilmenge von Feldern für die gesamte Platte.
- Wenn der Mini-Scan abgeschlossen ist, klicken Sie auf Assay-Parameter konfigurieren, um den Algorithmus der Analyse zu konfigurieren.
- Folgen Sie dem Workflow auf der linken Seite des Fensters Schritt für Schritt, um den gesamten Algorithmus zu entwickeln. Wählen Sie zunächst Prozessabbild für jeden Kanal und klicken Sie auf Hintergrundentfernung und auf die gewünschte Ebene.
- Identifizieren und selektieren Sie zunächst die Kerne durch Kernfärbung. Klicken Sie auf Primäres Objekt identifizieren – Kanal 1, um die realen Kerne auszuwählen und die Analyse von Artefakten und Trümmern zu vermeiden. Zoomen Sie dazu in ein repräsentatives Bild der Kernfärbung und prüfen Sie, ob die Kerne von dem von der Software aufgebauten Perimeter gut umgeben sind. Es ist möglich, den Schwellenwert zu ändern und Segmentierungsalgorithmen anzuwenden, um einzelne Kerne besser zu identifizieren.
- Sobald die Kerne korrekt definiert sind, klicken Sie auf den folgenden Schritt: Primärobjekt validieren. Wählen Sie Object.BorderObject.Ch1 aus, um die Analyse von Kernen am Rand jedes Feldbildes zu vermeiden. Wählen Sie Object.Area.Ch1 und entfernen Sie durch Verschieben der Balken "niedrig" und "hoch" in den Histogrammen alle identifizierten Trümmer oder großformatigen Objekte, die Aggregaten oder Artefakten entsprechen.
- Überprüfen Sie alle repräsentativen Bilder des Mini-Scans aller experimentellen Bedingungen, um sicherzustellen, dass die ausgewählten Parameter mit allen übereinstimmen.
- Klicken Sie auf Spots identifizieren für jeden Kanal, der den spezifischen Abstammungsmarkierungen entspricht, und wählen Sie die Ringwerte aus: Breite = 3 und Abstand = 0. Dies ermöglicht die Identifizierung der zytoplasmatischen Fluoreszenz. Je nach Zelldichte können diese Werte angepasst werden. Die Software vermeidet automatisch die Überlappung benachbarter Ringe.
- Wählen Sie im Workflow Referenzebenen aus, um die Analyse zu erstellen. Die Festlegung der Referenzwerte ermöglicht die automatische Zählung kondensierter Kerne, basierend auf der Kerngröße und der Kernfärbungsintensität, und von spezifischen markerpositiven Zellen, basierend auf der vom Ring identifizierten zytoplasmatischen Fluoreszenz.
- Klicken Sie zunächst auf Object.Area.Ch1. Wählen Sie in den Mini-Scan-Bildern einen kondensierten Kern aus und verschieben Sie den "LOW" -Balken auf den Histogrammen, um alle Kerne unter dieser Größe als "kondensiert" auszuwählen.
- Klicken Sie auf Object.AvgIntensity.Ch1. Wählen Sie in den Mini-Scan-Bildern einen kondensierten Kern aus und verschieben Sie den "HIGH" -Balken auf den Histogrammen, um alle Kerne oberhalb dieser Fluoreszenzintensität als "kondensiert" auszuwählen.
- Klicken Sie auf Object.RingAvgIntensity für jeden Kanal von linienspezifischen Markern. Wählen Sie in Ihren Mini-Scan-Bildern eine positive Zelle aus und verschieben Sie den "HIGH" -Balken auf den Histogrammen, um alle Zellen über dieser Fluoreszenzintensität als "positiv" auszuwählen.
- Überprüfen Sie alle repräsentativen Bilder des Mini-Scans aller experimentellen Bedingungen, um sicherzustellen, dass die ausgewählten Parameter mit allen übereinstimmen.
- Wählen Sie im oberen Menü Populationscharakterisierung und dann Event Subpopulationaus.
- Wählen Sie als Typ-1-Ereignis in der linken Liste ObjectAreaCh1 aus, klicken Sie dann auf die Schaltfläche UND > und wählen Sie schließlich ObjectAvgIntensityCh1. Dies ermöglicht die Identifizierung kondensierter Kerne als Kombination aus geringer Fläche und hoher Intensität.
- Deaktivieren Sie im selben Fenster alle Scan-Limits.
- Klicken Sie im oberen Menü auf Zu speichernde Features auswählen, um die Parameter auszuwählen, die in der Analyse beibehalten werden sollen.
- Wählen Sie Well-Features aus, und wechseln Sie von der linken Liste nach rechts nur die gewünschten Parameter: (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (Für jeden Kanal der spezifischen Abstammungsmarkierungen).
HINWEIS: Diese Analyse liefert als Auslesung die Gesamtzahl der Zellen, den Prozentsatz der kondensierten Kerne und den Prozentsatz der linienspezifischen positiven Zellen für jeden analysierten Marker auf der Gesamtzellzahl. Wenn der Prozentsatz der verschiedenen Linien nur auf lebenden Zellen benötigt wird, ist es möglich, entweder den Wert "High_RingAvgIntensity" für den Kanal beizubehalten (absolute Anzahl der positiven Zellen) und den Prozentsatz der Gesamtzellzahlen nach der Subtraktion des Prozentsatzes der toten Zellen neu zu berechnen.- Alternativ ist es möglich, die toten Zellen aus der Analyse zu entfernen, indem die gleichen Parameter eingestellt werden, die zur Identifizierung kondensierter Kerne (Schritte 11.14–11.15) bei der Kernvalidierung (Schritt 11.11) verwendet werden.
- Wählen Sie Scan Plate aus dem oberen Hauptmenü und klicken Sie auf das Plattensymbol im Untermenü Scan Setting im oberen Bereich, um das zu analysierende Bohrloch zu identifizieren.
- Schreiben Sie den Namen des Experiments und die Beschreibung, und sobald alle Einstellungen abgeschlossen sind, drücken Sie das Wiedergabesymbol.
Ergebnisse
Die erste Phase der Kultur kann in der Dauer variieren, abhängig von der Aussaatdichte und davon, ob die Kugeln fetalen oder erwachsenen Ursprungs sind. Darüber hinaus zeigen Oligosphären eine reduzierte Populationsverdopplung im Vergleich zu Neurosphären (Abbildung 1B). Darüber hinaus ist die Produktion von Kugeln aus erwachsenem Gewebe langsamer und es kann 2-3 Wochen dauern, bis Oligosphären erzeugt werden, verglichen mit fötalen, die je nach Aussaatdichte 1-2 Wochen dauern können.
Einmal ausgesät, kann die gesamte Differenzierungsphase der Kulturen mit linienspezifischen Antikörpern überwacht werden. Da das Ziel dieses Protokolls darin besteht, die letzte Phase der Differenzierung zu untersuchen, wird die Kulturzusammensetzung bei 0 DIVs nicht dargestellt. Während der ersten Kulturphase sind die Zellen jedoch immer noch nestinpositiv, was neuronale Vorläufer darstellt, und die Mehrheit der Zellen ist auch NG2-positiv (OPCs)11. CNPase-positive Zellen, die dem PräOL-Stadium entsprechen, sind 3–6 Tage nach T3-vermittelter Differenzierungsinduktion nachweisbar, während MBP-positive Zellen zwischen 6 und 12 DIVs (reife OLs; siehe Abbildung 2C für die Zusammensetzung der Kulturen am Ende der Differenzierungsphase) auftreten.
Die HCS-Analyse ermöglicht den Nachweis jeder einzelnen Zelle in der Kultur durch die Kernfärbung und die Analyse der Fluoreszenzintensität in den verbleibenden Kanälen (Abbildung 2A,B). Die Zusammensetzung der Kultur am Ende der Differenzierungsphase (12 DIVs) unterscheidet sich je nachdem, ob die Kulturen fetalen oder erwachsenen Ursprungs sind, wobei fetale Kulturen eher auf T3-vermittelte Differenzierung ansprechen und einen höheren Prozentsatz an reifen OLs erreichen12.
Während des gesamten Kulturprozesses sind etwa 40%-50% der Zellen Astrozyten (GFAP-positive Zellen), während ein kleiner Prozentsatz (weniger als 0%-10%) Neuronen sind (Beta-III-Tubulin-positive Zellen; Abbildung 2C). Die Kulturzusammensetzung kann zwischen verschiedenen Kulturpräparaten um 10% variieren. Adulte und fetale Kulturen unterscheiden sich für die Ausbeute der Produktion reifer OLs am Ende der Differenzierungsphase, wobei fetale Zellen einen hohen Prozentsatz an reifen OLs, einen niedrigen Prozentsatz an Vorläufern und etwa 30% -40% der Astrozyten aufweisen. Auf der anderen Seite präsentieren erwachsene Kulturen mehr Astrozyten (etwa 45% -55%) und weniger differenzierte Zellen nach 12 DIVs der Differenzierungsinduktion.
Damit die Software die Zellen erkennen und eine ordnungsgemäße unvoreingenommene Analyse der Kulturzusammensetzung ermöglichen kann, ist es wichtig, dass die Seeding-Dichte korrekt ist und Überschneidungen zwischen benachbarten Zellen vermieden werden. Wenn NSC-abgeleitete OPCs mit hoher Dichte ausgesät werden, neigen sie dazu, sich sehr schnell zu aggregieren, was dazu führt, dass die gesamte Oberfläche des Wohlbefindens nach einigen Tagen von Astrozyten besetzt wird. Darüber hinaus sind ausgewachsene OLs mit ihrer charakteristischen Spinnennetzform aufgrund des begrenzten Platzes nicht sichtbar (Abbildung 3A,B).
Der entzündungsvermittelte Differenzierungsblock ist durch diesen In-vitro-Assay reproduzierbar und erzeugt eine starke Abnahme der präOLs und reifen OLs, die durch CNPase- und MBP-Färbung sowohl in fetalen als auch in adulten Kulturen nachgewiesen werden. Eine Zunahme der Anzahl der OPCs tritt auch in erwachsenen Kulturen auf (Abbildung 4A,B). Die Zusammensetzung der Zytokinmischung wurde aus In-vivo-Experimenten in einem Rattenmodell für Multiple Sklerose13ausgewählt und als In-vitro-Modell für den bei dieser Krankheit auftretenden entzündungsvermittelten Differenzierungsblock getestet.
Während fetale und adulte OPCs die gleiche Anfälligkeit für entzündliche Zytokinexposition aufweisen, sind nur fetale Kulturen empfindlich gegenüberOGD-Toxizität (Abbildung 5A,B),was aufgrund ihres unterschiedlichen metabolischen Profils einen Anstieg des Zelltods und eine Differenzierungsstörung zeigt14.

Abbildung 1: Aufbau und Differenzierungsprotokoll der aus neuralen Stammzellen gewonnenen Oligodendrozyten-Vorläufer-Zellkultur. (A) Schema des Versuchsverfahrens. (B) Repräsentative Bilder von Neurosphären bei 2, 5 und 7 DIVs und Grafik, die die Populationsverdopplung von Neurosphären und Oligosphären zeigt. Maßstabsbalken: 100 μm. (C) Repräsentative Bilder von ausgesäten Oligosphären-abgeleiteten OPCs, die die verschiedenen Stadien der Differenzierung zeigen, von Nestin- und NG2-positiven Zellen bei 0 DIV (neuronaler Vorläufer/OPCs) über CNPase-positive Zellen bei 6 DIVs (PreOLs) und CNPase/MBP-doppelpositive Zellen am Ende der Differenzierungsphase (12 DIVs; reife OLs). GFAP-positive Zellen (Astrozyten) und ein kleiner Prozentsatz von Beta-III-Tubulin-positiven Zellen (Neuronen) sind in der gesamten Kultur vorhanden. Maßstabsbalken: 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
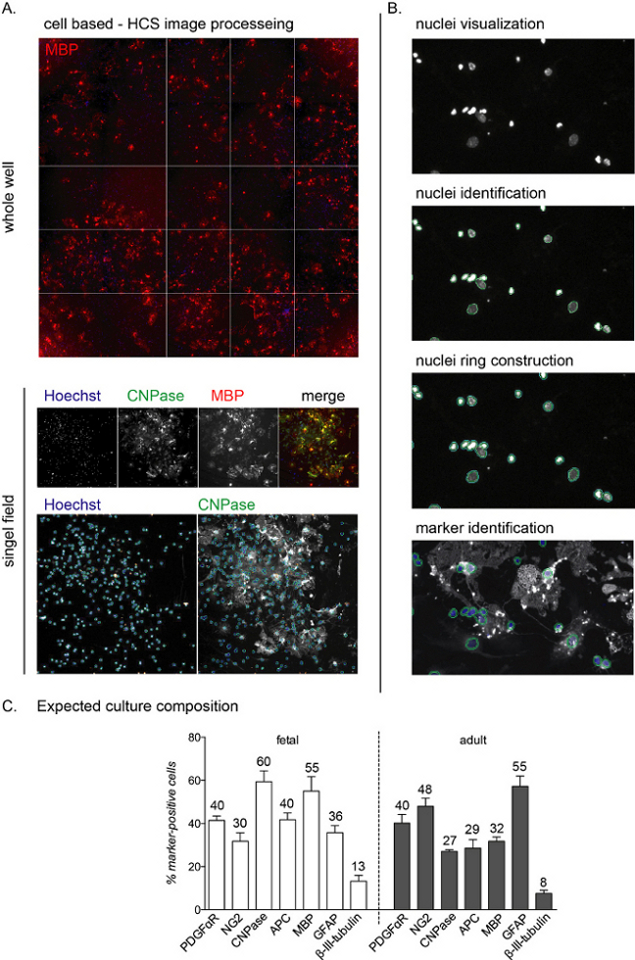
Abbildung 2: Zellbasierte High-Content-Screening-Analyse-Workflows und erwartete Differenzierungsanzeige. (A) Repräsentative Bilder der HCS-Aufnahme eines gesamten Bohrlochs (96-Well-Platte) und eines isolierten Einzelfeldes, aufgenommen mit einem 10-fachen Objektiv einer 12-DIV-Kultur von NSC-abgeleiteten OPCs. (B) HCS-Analyse Workflow-Schritte einschließlich Kerne (Objekte) Visualisierung, Identifizierung und Konstruktion von Kernring zur Identifizierung der zytoplasmatischen Färbung und Markeridentifikation. (C) Grafik mit der erwarteten Kulturzusammensetzung am Ende der Differenzierungsphase (12 DIVs). Marker für OPCs (PDGFαR, NG2), PreOLs (CNPase, APC), reife OLs (MBP), Astrozyten (GFAP) und Neuronen (β-III-Tubulin) werden sowohl für fetale als auch für adulte Kulturen gezeigt. Abgerundete Prozentsätze für jeden Zellmarker sind in der Grafik enthalten, beachten Sie, dass dies ein repräsentatives Experiment ist und die Prozentsätze etwa 5% -10% abweichen können. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
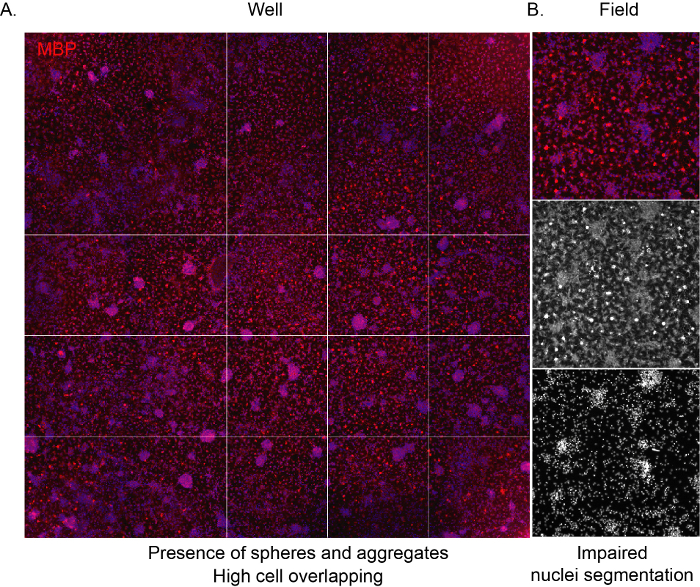
Abbildung 3: Repräsentative High-Content-Screening-Bilder einer Kultur mit hoher Dichte. (A) Repräsentatives Bild eines Well-Bildes (96-Well-Platte), das mit einem 10-fachen Objektiv aufgenommen und am Ende der Differenzierungsphase für die MBP-Expression markiert wurde (12 DIVs). (B) Repräsentatives extrahiertes Feldbild, das das Vorhandensein von aggregierten Zellen und überlappenden Kernen hervorhebt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
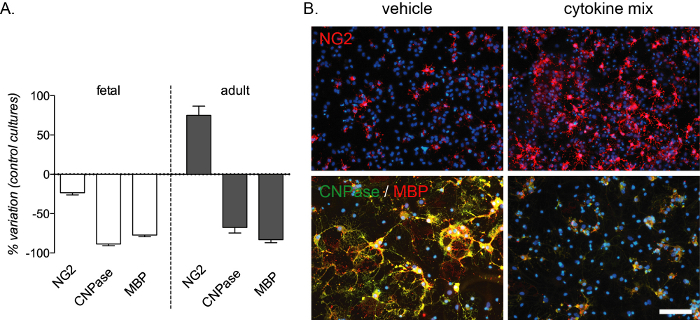
Abbildung 4: Erwartete Wirkung der Zytokinbehandlung auf fetale und adulte OPC-Kulturen. (A) Grafik, die den Prozentsatz der Variation von fetalen und adulten OPC-Kulturen im Vergleich zu Standardkulturen zeigt, einschließlich der Quantifizierung von OPCs (NG2), PreOLs (CNPase) und reifen OLs (MBP) am Ende der Differenzierungsphase (12 DIVs). (B) Repräsentative Bilder von adulten Kulturen am Ende der Differenzierungsphase (12 DIVs), die mit Vehikel- oder Zytokinmischung behandelt und für NG2 oder CNPase/MBP markiert wurden. Maßstabsbalken: 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
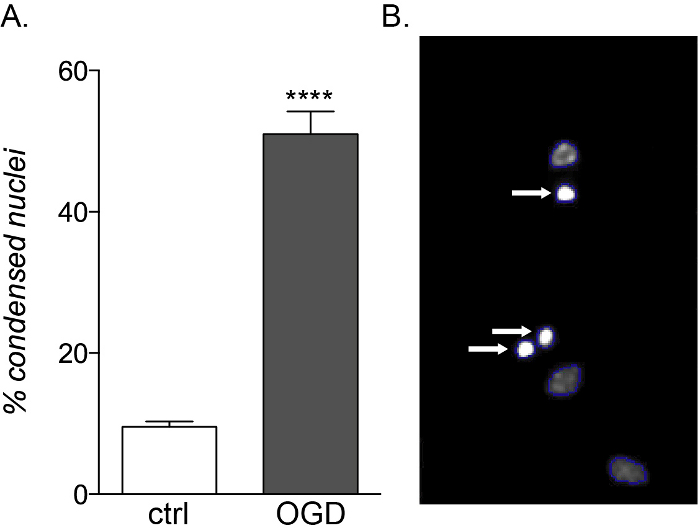
Abbildung 5: Erwartete Wirkung der OGD-Exposition auf fetale OPC-Kulturen. (A) Schaubild, das den Prozentsatz der kondensierten Kerne zeigt, die durch zellbasierte HCS in Kontrollkulturen (ctrl) und OGD-exponierten Kulturen quantifiziert wurden. (B) Repräsentative Bilder von HCS-bearbeiteten Objekten, die die identifizierten kondensierten Kerne hervorheben (weiße Pfeile). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Antikörper | Spezies | Verdünnung | |
| Anti-β-III-Tubulin (F&E-System) | Maus | 1:3000 | |
| Anti-GFAP (Dako) | Kaninchen | 1:1000 | |
| Anti-NG2 (Millipore) | Kaninchen | 1:350 | |
| Anti-PDGFαR (Santa Cruz Biotechnologie) | Kaninchen | 1:300 | |
| Anti-CNPase (Millipore) | Maus | 1:500 | |
| IgG2b Anti-APC, Klon CC1 (Calbiochem) | Maus | 1:100 | |
| Anti-MBP (Dako) | Kaninchen | 1:250 | |
| Anti-Nestin (Millipore) | Maus | 1:500 | |
| Alexa Fluor 488-konjugierte Anti-Maus (ThermoFisher Scientific) | Esel | 1:500 | |
| Alexa Fluor 647-konjugierte Anti-Maus IgG2b (ThermoFisher Scientific) | Ziege | 1:500 | |
| Alexa 568-konjugiertes Anti-Kaninchen (ThermoFisher Scientific) | Esel | 1:500 | |
Tabelle 1: Liste der primären und sekundären Antikörper.
Diskussion
Die Komplexität von Myelinisierungs-/Remyelinisierungsprozessen und demyelinisierenden Ereignissen macht die Entwicklung prädiktiver In-vitro-Systeme extrem herausfordernd. Die am weitesten verbreiteten In-vitro-Wirkstoff-Screening-Systeme sind meist menschliche Zelllinien oder primäre reine OL-Kulturen, wobei zunehmend komplexere Cokulturen oder organotypische Systeme verwendet werden15. Auch wenn solche Systeme mit High-Content-Technologien gekoppelt sind, bleiben reine OL-Kulturen die Methode der Wahl bei der Entwicklung von Screening-Plattformen16.
Die hier beschriebene spontane Mischkultur stellt ein nützliches in vitro System dar, das alle wesentlichen Variablen berücksichtigt: physiologische T3-vermittelte OPC-Differenzierung, pathologische Interferenzen mit dem Prozess, andere zelluläre Komponenten und altersbedingte Unterschiede. Das Verfahren enthält eine Reihe von Variablen, die sich aus dem Ursprung der Zellen (Alter des Tieres) und der Bildung und Manipulation von Sphäroiden ergeben. Tatsächlich ist ein kritischer Schritt die Zelldichte von NSCs, die nach der Isolierung vom Gewebe aussaaten, da im optimalen Zustand eine einzelne Kugel von einer einzigen proliferierenden Zelle abgeleitet werden sollte. Da wir gesehen haben, dass isolierte NSCs dazu neigen, zu aggregieren und dass sie ihre eigenen sezernierten parakrinen Faktoren benötigen, ist es der beste Kompromiss, sie in einem Bereich von 10-50 Zellen / μL in einem t25- oder t75-Kolben zu säen, um die Zellaggregation zu vermeiden, aber dennoch den Zellen zu ermöglichen, durch sekretionierende Faktoren zu kommunizieren.
Die Haupteinschränkungen der Technik sind das Fehlen einer funktionellen axonalen Myelinisierung und eine direkte Interaktion mit Neuronen, da die Methode nur die OPC-Differenzierung bis zum Stadium der reifen OLs berücksichtigt: CNPase/MBP-doppelpositive Zellen mit einer Spinnennetzmorphologie. Zu diesem Zweck sind primäre OPCs, die an isolierten dorsalen Wurzelganglien kultiviert werden, immer noch die Hauptmethodik17. Die Möglichkeit, diese Zellen von Tieren in jedem Alter zu unterscheiden, ist jedoch ein grundlegender Punkt im Translationsprozess, da sie den Test von Verbindungen und schädlichen Reizen an Zellen ermöglicht, die aus dem interessierenden Alter isoliert wurden. Wie hier beschrieben, können NSCs sowohl aus dem fetalen als auch aus dem erwachsenen Gehirn isoliert werden. Da Entwicklungsmyelinisierung und Remyelinisierung im Erwachsenenalter das gleiche Ziel haben, d.h. das nackte Axon zu erreichen und die Myelinscheide zu schaffen, wurde ursprünglich angenommen, dass die beiden Prozesse in jeder Hinsicht identisch waren, was die sogenannte Rekapitulationshypotheseerzeugte 18. Es ist jedoch jetzt klar, dass die beiden Prozesse nicht als gleichwertig angesehen werden können und dass zellintrinsische altersbedingte Unterschiede vorhanden sind und bei der Auswahl des am besten geeigneten In-vitro-Modells für die experimentelle Frage 19 berücksichtigt werdensollten. Adulte NSCs-abgeleitete OPCs zeigen in der Tat starke Unterschiede in der physiologischen TH-getriebenen Differenzierung und Anfälligkeit für schädliche Reize14,20 sowie primäre OPCs21,22. Es gibt auch eine Heterogenität der OPCs- und OLs-Population in adulten Geweben, die für pathologische Zustände von besonderer Bedeutungist 23. Protokolle für die isolierung primärer OPCs aus adultem Gewebe sind verfügbar24 und sollten in Betracht gezogen werden, wenn die experimentelle Frage auf Moleküle gerichtet ist, die auf die Remyelinisierung im Erwachsenenalter wirken.
Die Differenzierung von OPCs von NSCs ermöglicht die In-vitro-Darstellung des gesamten Differenzierungsprozesses, vom undifferenzierten Vorläufer bis zur reifen OL. Dieser Prozess ähnelt dem In-vivo-Zustand, bei dem TH der Haupttreiber des Prozesses ist, der durch spezifische Kernrezeptoren wirkt, und er erlaubt experimentelle Interferenz mit diesem Mechanismus, um pathologische Bedingungen in einer translationalen Ansicht nachzuahmen13.
Das letzte grundlegende Merkmal des Modells ist die ständige Anwesenheit von Astrozyten in der gesamten Kultur. Während dies die Analyse der Kultur erschwert, stellt ihre komplexe Zellzusammensetzung einen deutlichen Vorteil dar. Die Art und Weise, wie Astrozyten zur Reaktion auf schädliche Ereignisse in gemischten neuronalen Kulturen beitragen25 ist weithin bekannt, und das Fehlen dieser Hauptkomponente des ZNS macht das In-vitro-System schlecht vorhersagbar und übersetzbar. Auf der anderen Seite haben NSC-abgeleitete Kulturen für diese Eigenschaft den Nachteil, dass sie weniger einheitlich sind als Einzelzelltypsysteme, was zu einer verzerrten Analyse führen kann. Die zellbasierte HCS-Technik ermöglicht jedoch eine Analyse der gesamten Kultur und aller Zellpopulationen, wodurch auch die Randomisierung repräsentativer Felder für die Analyse entfällt. Unter der Annahme, dass die für das Experiment verwendete Zellkultur von zuverlässiger Seeding-Qualität ist, wird das HCS ein vollständiges Bild der experimentellen Bedingungen liefern und statistisch robuste Daten und eine Reihe von automatischen fluoreszenzbasierten Analysen generieren.
Zusammenfassend beschreibt das aktuelle Protokoll das Verfahren zur Isolierung und Differenzierung von NSC-abgeleiteten OPCs aus dem fetalen und erwachsenen Gehirn. Das gesamte Protokoll dauert etwa 30 Tage, abhängig vom Alter der Tiere und den Experimentellen Zielen. Insbesondere kann die Bildung von Kugeln aus erwachsenem Ursprung im Vergleich zu fötalen bei gleicher Aussaatdichte doppelt so lange dauern. Die Zeit von 15 Tagen (von -3 bis 12 DIVs) nach der Aussaat auf 2D-Oberfläche für die Differenzierungsinduktion ist jedoch unter allen Bedingungen eine feste Zeit. Das vollständige Protokoll ermöglicht die Untersuchung des gesamten TH-vermittelten Differenzierungsprozesses in einer komplexen zellulären Umgebung, die Interferenz durch spezifische pathologische Mechanismen (d.h. entzündliche Zytokine und HI) und die anschließende Erprobung neuer Strategien zur Überwindung dieser Probleme. Durch die Kopplung des Kulturmodells mit der HCS-Technik entsteht eine robuste und übersetzbare Screening-Plattform.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Unterstützt von MIUR National Technology Clustersproject IRMI (CTN01_00177_888744), und Regione Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020.
Besonderer Dank geht an die IRET Foundation für die Durchführung der experimentellen Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Referenzen
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340(2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, Eli Lilly & Company and the National Center for Advancing Translational Sciences. 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, Clifton, N.J. 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443(2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443(2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750(2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419(2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681(2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620(2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten