Method Article
태아 및 성인 신경 줄기 세포의 고함량 선별 분화 및 성숙 분석- 유래 올리고드로시테 전구체 세포 배양
요약
우리는 성숙한 올리고드로시테스로 분화하는 태아 또는 성인 신경 줄기 세포에서 유래한 성상세포및 올리고드엔드로시테 전구세포의 혼합 배양, 유해자극의 시험관내 모델링을 설명한다. 셀 기반 고함량 선별 기술과 결합은 신뢰할 수 있고 견고한 약물 선별 시스템을 구축합니다.
초록
복잡한 질병에서 치료 전략의 효능을 평가하기 위한 약물 선별 기술 개발의 주요 장애물은 생체 내 단순화와 생체 내 환경에서 복잡한 복합체를 재현하는 것 사이의 균형을 맞추는 것이며, 모든 선별 전략에 의해 공유되는 주요 목표와 함께 생체 변환에 대한 예측이 매우 중요합니다.
탈근성 질환 분야에서, 약물 선별 전략의 대부분은 신생아 동물의 고립 된 1 차 성 올리고 드로시테 전구체 (OpC)의 불멸의 세포주 또는 순수한 배양에 기초하여 연령과 관련된 차이의 부족과 실제 병리학 적 상태 또는 복잡성으로 인해 강한 편견으로 이어진다.
여기서 는 신경 줄기 세포 (NSC)에서 파생 된 OpC의 생리적 분화 / 성숙을 모델링하기위한 체외 시스템의 설정을 보여 주며, 탈근 질환의 전형적인 병리학 적 조건을 모방하기 위해 쉽게 조작됩니다. 또한, 이 방법은 태아와 성인용 두뇌로부터의 격리를 포함하며, 성상세포도 포함하는 자발적인 공동 배양에서 OPC에서 성숙한 올리고드로키테스(OLs)로 동적으로 차별화되는 시스템을 제공합니다. 이 모델은 생리학적으로 갑상선 호르몬 매개 myelination 및 myelin 수리 과정과 유사하여 질병 메커니즘을 모델링하는 병리학적 간섭을 첨가할 수 있습니다. 우리는 탈수성 질환 (즉, 저산소증 / 허혈및 염증)의 두 가지 주요 구성 요소를 모방하는 방법을 보여줍니다, 발달 골수화및 성인 myelin 수리에 미치는 영향을 재현하고 전체 계정에 시스템의 모든 세포 구성 요소를 복용, OpC를 차별화에 초점을 맞추고있는 동안.
이 자발적인 혼합 모델은 세포 기반고함량 선별 기술과 결합되어 탈량에 관련된 병리학 적 과정을 퇴치하고 재myelination을 유도하기위한 치료 전략을위한 강력하고 신뢰할 수있는 약물 선별 시스템을 개발 할 수 있습니다.
서문
중추신경계(CNS)에서 미엘린 형성 세포(oligodendrocytes, OLs) 및 그들의 전구체(oligodendrocyte 전구체 세포, OpC)는 발달 근생, peri 및 산후 기간 동안 발생하는 과정, 그리고성년1에서골린 회전율 및 수리(재제동)에 대한 책임이 있다. 이 세포는 고도로 전문화되어 해부학적으로 그리고 다른 모든 신경교 및 신경 성분과 기능적으로 상호 작용하여 CNS 구조 및 기능의 근본적인 부분을 만듭니다.
탈제 이벤트는 다른 CNS 부상과 질병2에관여하고, 주로 개발 및 성인기 동안 다인적 메커니즘의 방법으로 OpC와 OLs에 작용합니다. 미분화 전구체는 분화 요인에 의해 구동되며, 주로 갑상선 호르몬(TH)을 구분하여 OPC가 증식을 유도하는 특정 자극에 인식하고 반응하도록 유도하는 동기화된 과정3, 비골암축으로의 이동, 그리고 성숙한 OLs로의 분화로 전환하여 골린 시스4를차례로 개발한다. 이러한 모든 프로세스는 미세하게 제어되며 복잡한 환경에서 발생합니다.
근생, 재생물 및 탈량 이벤트의 복잡한 특성으로 인해, 기본 메커니즘을 연구하고 주요 세포 플레이어에 초점을 맞춘 새로운 치료 전략을 개발하기 위해 단순화되고 신뢰할 수있는 시험관 내 방법에 대한 큰 필요성이 있다: OPC5.
체외 계통이 신뢰할 수 있도록, 셀룰러 환경의 복잡성, 연령 관련 세포 내재성 차이, 생리적 TH 매개 분화 분화, 병리학 적 메커니즘 및 데이터6의견고성 등 여러 가지 요인을 고려해야합니다. 실제로, 현장에서 충족되지 않은 필요는 고립 된 순수 OPC 문화의 사용을 통해 성공적으로 달성되지 않은 생체 내 상태의 복잡성을 모방한 모델입니다. 또한, 탈밀증 사건의 두 가지 주요 구성 요소, 염증 및 저산소증/허혈 (HI), 직접 간접적으로 APC의 생리적 분화 및 성숙에 영향을 미칠 수있는 다른 세포 구성 요소를 포함, 지나치게 단순화 된 체외 모델에서 공부 할 수없는 측면.
예측이 매우 높은 문화 시스템에서 시작하여 보다 일반적인 과제는 강력하고 신뢰할 수 있는 데이터를 생산하는 것입니다. 이러한 맥락에서, 세포 기반고함량 스크리닝(HCS)은 가장 적합한 기술7이며,우선 전체 문화를 자동 워크플로우로 분석하여 대표 분야를 선택하는 편견을 피하고, 둘째는 이미징 기반고함량 데이터8의자동 및 동시 생성을 얻는 것입니다.
주요 필요는 시험관 내 단순화와 생체 모방 복잡성 사이의 최상의 균형을 달성하는 것입니다 감안할 때, 여기서 우리는 태아 전뇌와 성인 하위 심실 영역 (SVZ)에서 분리 된 신경 줄기 세포 (NSC)에서 파생 된 OpC를 얻기위한 매우 재현 가능한 방법을 제시한다. 이 체외 모델은 다능 NSC에서 성숙한/마일리네팅 OL에 이르기까지 전체 OPC 분화 과정을 생리적인 TH 의존적 방식으로 포괄합니다. 결과 배양은 주로 CPC와 성상 세포를 분화하는 자발적인 공동 배양으로 인해 뉴런의 비율이 낮은 동적으로 차별화/maturating 시스템입니다. 이 1 차 배양은 생체 내 환경에서 복합체를 더 잘 모방하고 줄기 세포 파생은 간단한 조작을 통해 원하는 세포 혈통 농축을 얻을 수 있게 합니다.
1차 OpC의 세포주 또는 순수 배양을 이용한 다른 약물 선별 전략과는 달리, 여기서 설명된 방법은 바람직한 세포 유형에 초점을 잃지 않고 복잡한 환경에서 병리학적 간섭 또는 치료 분자의 효과에 대한 연구를 허용한다. 설명된 HCS 워크플로우는 세포 생존가능성 및 계보 사양뿐만 아니라 계보별 세포 사멸 및 형태학적 매개변수에 대한 분석을 허용합니다.
프로토콜
본 명세서에 기재된 모든 동물 프로토콜은 유럽 공동체 협의회 지침(86/609/EEC)에 따라 수행되었으며 실험실 동물의 치료 및 사용에 대한 NIH 가이드에발표된 지침을 준수하였다.
1. 솔루션 및 시약
- 표준 매체 준비: DMEM/F12 글루타맥스 1배; 8 mmol/L HEPES; 100 U/100 μg 페니실린/연쇄 절제술 (1% P/S); 1x B27; 1x N-2.
- 신경권 배지 준비: 10 ng/mL bFGF를 추가; 표준 매체에 10 ng/mL EGF.
- 올리고스피어/OPC 배지 준비: 10 ng/mL bFGF를 추가하십시오. 표준 매체에 10 ng/mL PDGF-AA.
- 올리고드엔드로티 분화 배지 준비: 50nM T3를 추가하십시오. 10 ng/mL CNTF; 1x N-아세틸-L-시스테인 (NAC) 표준 매체.
- 비 효소 해리 버퍼 를 준비 : 비 효소 해리 버퍼에 1 % P / S를 추가하고 얼음을 차갑게 유지합니다.
- 자당 용액 준비: HBSS, 0.3 g/mL 자당.
- BSA 세척 용액 준비: EBSS, 40 mg/mL BSA, 0.02 mL/l HEPES.
- 효소 해리 버퍼 준비: HBSS, 5.4 mg/mL D-포도당, 15 mmol/L HEPES, 1.33 mg/mL 트립신, 0.7 mg/mL Hyaluronidase, 80 U/mL DNase.
- 세포사구믹 준비: TGF-β1, TNF-α, IL-1β, IL-6, IL-17, IFN-γ(각각 20ng/mL).
- 시토카인 믹스 차량 준비: 주식의 0.04%(글리세롤/100nM 글리신/25 nM Tris, pH 7.3).
- 산소 포도당 박탈 배지 준비: DMEM w/o 포도당을 사용 하 여 표준 매체. 바람직한 포도당 박탈 조건의 스트링성에 따라, 포도당 관련 화합물(예를 들어, B27의 D-Galactose)을 피하기 위해 배지에서 B27 및/또는 N2도 제거할 수 있다.
2. 해부 및 NSC 격리
참고: 태아와 성인 NSC는 수정된 Ahlenius 및 Kokaia 프로토콜9에 따라 E13.5 태아 전뇌 또는 2.5개월 된 성인 심실 영역(SVZ)으로부터 격리되었습니다.
- 태아 NSC 문화
참고: 해부를 시작하기 전에, 비 효소 해리 버퍼의 150 μL을 포함하는 1.5 mL 튜브를 각각 준비; 페트리 요리를 청소하고 얼음 차가운 HBSS를 추가합니다.- E13.5 - 14.5에서 배아를 수집하여 시간 제임신 마우스로부터 14.5마리의 배아를 수집하고 차가운 HBSS를 함유한 페트리 접시에 놓습니다.
- 집게를 사용하여 배아를 참수하십시오.
- 배아의 머리를 얼음 차가운 PBS가 들어있는 깨끗한 페트리 접시에 놓고 돋보기 또는 입체 스코프를 사용하여 집게로 두개골에서 피부를 제거하십시오.
- 일단 뇌가 피부를 보이고 지워지면, 집게로 측면에 압력을 가하여 짜내라.
- 소뇌를 제거하고 전뇌만 유지하고 집게로 수막을 제거하십시오.
- 비 효소 해리 버퍼에 격리 된 조직을 배치하고 다른 배아와 해부 단계를 반복한다. 버퍼를 포함하는 각 관에 2-3 동물에서 조직을 삽입합니다.
- 연속 흔들림하에서 15분 동안 37°C에서 배양합니다.
- 인큐베이션 후 표준 매체850 μL을 추가하고 서스펜션이 덩어리가 없을 때까지 파이펫팅하여 혼합합니다.
- 비 해리 조직이 여전히 보이는 경우, 튜브의 바닥에 예금 될 때까지 RT에서 2 분 기다립니다.
- 해리가 완료되면 세포를 계산하고 T-25 또는 10-30 mL의 신경권 배지를 포함하는 T-45 플라스크에서 10-50 세포/μL의 밀도로 현탁액으로 플레이트, 세포 접착을 피하기 위해 수직 위치에 보관.
-
성인 NSC 문화
- 자궁 경부 탈구로 동물을 희생하십시오.
- 얼음 차가운 HBSS를 포함하는 50 mL 관에 있는 4-5 마우스에서 두뇌를 수집합니다.
- 차가운 멸균 표면에 뇌를 놓습니다. 이를 위해 물로 채워진 T-25 플라스크를 사용하여 하룻밤 동안 -20 °C에 놓습니다. 실험 시 플라스크를 멸균 알루미늄 호일로 덮습니다.
- 뇌 복부 측면을 로스트로-코살 방향으로 아래쪽으로 놓고 면도날을 사용하여 후각 전구를 제거합니다.
- 면도날을 사용하여 피질에서 광학 치아마에 이르기까지 두께 1mm의 2-3 개의 관상 슬라이스를 잘라냅니다.
- 차가운 표면에 슬라이스를 벤트로-등갈 자세로 놓고 코퍼스 캘로섬과 두 개의 측면 심실을 식별합니다.
- 돋보기 안경이나 스테레오스코프를 사용하여 측면 심실의 벽을 분리하여 코퍼스 캘로섬의 조각을 운반하지 않도록 주의하십시오.
- 효소 해리 버퍼(5-10mL)에 격리된 조직을 넣고 15분 동안 37°C에서 배양한다.
- 용액을 여러 번 섞고(최소 50개 이상)에 다시 배양하고 37°C에서 10분 동안 배양합니다.
- 표준 배양 배지의 5mL를 추가하여 트립신을 중화하고 70 μm 필터를 사용하여 용액을 필터링합니다.
- 400 x g에서5 분 동안 필터링 된 솔루션을 원심 분리합니다.
- 자당 용액과 원심분리기에서 500 x g에서 10분 동안 펠릿을 다시 분리합니다.
- BSA 세척 용액및 원심분리기에서 펠릿을 400 x g에서 7분 동안 재차 중단합니다.
- 표준 배양 배지에서 펠릿을 재중단하고, 세포를 계산하고, 위에서 설명한 대로 도금을 수행한다(단계 2.1.10).
3. 1차 신경구
- 성장 인자 (bFGF/EGF) 때마다 추가 2 일.
- 매 4-6 일 (세포 밀도에 따라), 다음과 같이 매체의 절반을 변경:
- 전체 셀 서스펜션을 15 또는 50mL 튜브로 전송합니다.
- 원심 분리기 는 400 x g에서5 분 동안.
- 볼륨의 절반을 제거합니다.
- 동일한 양의 신선한 매체를 추가하고, 파이펫팅으로 부드럽게 섞고, 성장 인자를 추가합니다.
4. 올리고스피어
참고: 올리고덴드로시테 분화는 수정과 함께 첸 프로토콜10에 따라 수행됩니다.
- 신경구가 직경 100-150 μm에 도달하면 통과 할 준비가되어 있습니다. 이렇게 하려면 전체 셀 서스펜션을 15 또는 50mL 튜브로 옮기고 원심분리기를 400 x g에서 5분 동안 이송합니다.
- 반전된 송신광 현미경을 사용하여 구체의 사진을 찍고 ImageJ 소프트웨어로 열면 직경을 빠르게 평가합니다.
- 분석 메뉴를 클릭하고 도구 창에서 배율 막대를 선택합니다.
- 150 μm을 미크론의 너비로 설정하고 스케일 바를 구체와 비교합니다.
- 반전으로 전체 부피를 제거하고 신선한 표준 배양 배지의 180 μL에서 펠릿을 다시 분리합니다. 파이펫은 구체의 분리를 허용하는 50 배.
- 신선한 표준 배양 배지의 810 μL을 추가하고, 세포를 계산하고, 신경구에 대해 설명된 대로 다시 플레이트합니다.
- bFGF/PDGF-AA 를 추가 10 ng/mL 마다 2 일.
- 매 4-6 일 (세포 밀도에 따라), 다음과 같이 매체의 절반을 변경:
- 전체 셀 서스펜션을 15 또는 50mL 튜브로 전송합니다.
- 원심 분리기 는 400 x g에서5 분 동안.
- 볼륨의 절반을 제거합니다.
- 동일한 양의 신선한 매체를 추가하고, 파이펫팅으로 부드럽게 섞고, 성장 인자를 추가합니다.
5. 플레이트 코팅
- 폴리-D, L-ornithine/라미닌 코팅: OpC를 도금하기 최소 2일 전에 PBS로 희석된 50μg/mL 폴리-D, L-ornithine 용액을 각 우물(40μL/well 96웰 플레이트용)에 추가하고 RT에서 하룻밤 사이에 배양합니다.
- 다음 날, 액체를 제거하고 증류 살균 물로 세 번 세척하십시오.
- 하룻밤 동안 RT에서 접시를 건조하게하십시오. 다음 날, PBS(5 μg/mL; 40 μL/96웰 플레이트용 40 μL/well)로 희석된 라미닌 용액을 추가하고 37°C에서 2시간 동안 배양한다.
6. 셀 시드
- 올리고스피어가 직경 100-150 μm에 도달하면 폴리 D, L-ornithine/라미닌 코팅 플레이트에 해리되고 시드될 준비가 되어 있습니다. 이렇게 하려면 전체 셀 서스펜션을 15 또는 50mL 튜브로 옮기고 원심분리기를 400 x g에서 5분 동안 이송합니다(4.1 단계에서 나타낸 대로)
- 반전으로 전체 부피를 제거하고 신선한 표준 배양 배지의 180 μL에서 펠릿을 다시 분리합니다. 파이펫은 구체의 분리를 허용하는 50 배.
- 신선한 표준 배양 배지의 810 μL을 추가하고 세포를 계산합니다.
- 우물에서 라미닌 용액을 제거하고 3,000 셀/cm2 밀도(96웰 플레이트의 경우 100 μL/well)로 세포를 플레이트로 플레이트합니다.
7. OPC 차별화 유도
- 3일 후, 전체 배지를 제거하고 동일한 부피를 올리고드엔드로시테 분화 배지를 추가한다.
- 매체의 절반을 4일마다 변경하고 2일마다 신선한 차별화 믹스(T3/CNTF/NAC)를 추가합니다.
8. 염증 매개 분화 블록의 유도
- 신경권 해리 및 올리고스피어 생성 후(섹션 4), 사이토카인 믹스를 배양 배지에 추가하고 전체 구체 형성 단계에 대해 사이토카인에 노출된 올리고스피어를 유지한다.
참고: 세포를 형성하는 구체의 경우 10-50개의 세포/μL에서 시드되기 때문에 부피는 셀 수에 따라 달라집니다. - 매체를 변경해야 하는 경우 전체 볼륨을 변경하고 사이토카인 믹스를 한 번 더 추가합니다.
9. 산소 포도당 박탈 세포 죽음의 유도
- -1 DIV (멀티웰 플레이트에서 세포 파종 후 2 일)에서 매체를 제거하고 새로운 멀티웰 플레이트에 보존하십시오.
- OGD 매체(OGD 그룹) 또는 신선한 매체(대조군)의 절반 부피(96웰 플레이트의 경우 50 μL)를 추가합니다. 부피의 절반 양은 액체와 공기 사이의 산소 교환을 줄이기 위해 사용됩니다.
- OGD 그룹 배양을 95%N2 및 5% CO2로포화된 밀폐 저산소증 챔버에 놓습니다. 챔버의 포화를 달성하기 위해, 챔버 파이프를 닫기 전에 가스 혼합물이 25 l / 분에서 6 분 동안 흐르게하십시오.
- 인큐베이터에서 저산소 챔버를 3시간 동안 배양한다. 9.1 단계에서 제거 및 보존된 배지를 포함하는 대조군 및 플레이트도 인큐베이터에 남아 있어야 한다.
- 포도당이 없는(OGD 그룹) 또는 새로운 배지(대조군)를 제거하고 9.1단계에서 제거및 보존된 배지를 추가한다.
10. 면역 세포 화학
- 원하는 시점에서, RT에서 20 분 동안 감기 4 % 파라 포름 알데히드로 세포를 고정합니다.
- PBS로 두 번 씻으시면 (RT에서 세척할 때마다 10분 배양).
- 차단 용액 (PBS 트리톤 0.3 % 1 % BSA 및 1 % 당나귀 / 염소 일반 세럼을 포함하는 PBS 트리톤 0.3 %)에서 RT에서 1 h를 배양하십시오.
- 1차 항체 믹스(표1)를배양하여 PBS 트리톤 0.3%, 하룻밤 4°C로 희석한다.
- PBS로 두 번 씻으시면 (RT에서 세척할 때마다 10분 배양).
- PBS 트리톤에서 희석된 이차항체(표 1)용액을 37°C에서 30분 동안 30분 동안 0.3% 첨가한다.
- PBS로 두 번 씻으시면 (RT에서 세척할 때마다 10분 배양).
11. 세포 생존가능성, 계보 조성 및 계보 특이적 세포 사멸의 HCS 분석
참고: HCS 대표 이미지와 워크플로우는 그림 2A, B에표시됩니다.
- 소프트웨어의 메인 메뉴(HCS Studio v 6.6.0)에서 구획 분석 알고리즘을 선택하고 메인 메뉴에서 스캔을 선택하여 분석/스캔 플레이트를 개발한다.
- iDev 창에서 새 값을 선택한 다음 분석 개발 템플릿에서 일반 강도 측정 도구를 선택합니다.
- 10배 목표를 선택하여 메뉴의 오른쪽에 만들기를 클릭합니다.
- 이렇게 하면 수집 구성 메뉴가 열립니다. 이 창에서, 다음 매개 변수를 선택: (a) 채널의 수: Hoechst 핵 염색에 대한 첫 번째 (BGRFR_386) 및 반응 (b)에 사용되는 각 계보 별 마커에 대한 하나 채널에 대한 소프트웨어 초점을 선택하고 1 (c) 목록에서 플레이트 모델을 선택한다.
- 획득 메뉴에서 다른 우물과 다른 필드의 염색 품질을 살펴보고 메뉴에서 고정 노출 시간을 선택하여 노출 시간을 수동으로 선택합니다.
- 인수 매개 변수가 설정되면 메뉴 상단의 Mini 검사를 선택하고 실험 조건당 2개의 우물에서 웰당 10개의 필드를 선택합니다. 이렇게 하면 전체 플레이트에 대한 필드의 하위 집합에 있는 모든 분석 매개 변수를 설정할 수 있습니다.
- 미니 스캔이 완료되면 분석 알고리즘을 구성하려면 분석 매개 변수 구성을 클릭합니다.
- 창 의 오른쪽에 있는 그룹 구성을 클릭하고 미니스캔의 우물을 드래그 앤 드롭합니다. 그룹 하위 섹션의 추가 단추를 클릭하여 다른 그룹을 구성합니다.
- 전체 알고리즘을 개발하기 위해 창 단계의 왼쪽에 있는 워크플로우를 단계별로 따르십시오. 먼저 각 채널에 대한 프로세스 이미지를 선택하고 배경 제거및 원하는 수준에서 클릭합니다.
- 먼저 핵 염색에 의한 핵을 식별하고 선택한다. 1차 개체 식별을 클릭합니다 – 채널 1을 클릭하여 실제 핵을 선택하고 유물과 파편을 분석하지 마십시오. 이를 위해 핵 염색의 대표적인 그림을 확대하고 핵이 소프트웨어에 의해 만들어진 경계에 잘 둘러싸여 있는지 확인하십시오. 임계값 값을 변경하고 단일 핵을 더 잘 식별하기 위해 세분화 알고리즘을 적용할 수 있습니다.
- 핵이 올바르게 정의되면 다음 단계를 클릭합니다. 각 필드 이미지의 경계에서 핵 분석을 피하려면 Object.BorderObject.Ch1을 선택합니다. Object.Area.Ch1을 선택하고 히스토그램의 "낮음" 및 "높음" 막대를 이동하여 집계 또는 아티팩트에 해당하는 식별된 모든 파편 또는 큰 물체를 제거합니다.
- 선택한 매개 변수가 모두 맞는지 확인하려면 모든 실험 조건의 모든 미니 스캔 대표 이미지를 확인합니다.
- 특정 계보 마커에 해당하는 각 채널의 반점 식별을 클릭하고 링 값: 너비 = 3 및 거리 = 0을 선택합니다. 이것은 세포 플라즈마 형광의 식별을 허용할 것입니다. 세포 밀도에 따라 이러한 값을 조정할 수 있습니다. 소프트웨어는 자동으로 인접 한 링 사이의 중복을 방지 합니다.
- 워크플로에서 참조 수준을 선택하여 분석을 빌드합니다. 기준 수준의 설정은 고리에 의해 확인된 세포 플라즈마 형광에 기초하여 핵 크기 및 핵 염색 강도 및 특정 마커 양성 세포의 응축된 핵의 자동 계수를 허용할 것이다.
- Object.Area.Ch1을먼저 클릭합니다. 미니 스캔 이미지에서 응축된 핵을 선택하고 히스토그램의 "LOW" 막대를 이동하여 이 크기 하에서 모든 핵을 "응축"으로 선택합니다.
- 개체를 클릭합니다.AvgIntensity.Ch1. 미니 스캔 이미지에서 응축된 핵을 선택하고 히스토그램의 "HIGH" 막대를 이동하여 이 형광 강도 위의 모든 핵을 "응축"으로 선택합니다.
- 계보 특정 마커의 각 채널에 대해 Object.RingAvgIntensity를 클릭합니다. 미니 스캔 이미지에서 양수 셀을 선택하고 히스토그램의 "HIGH" 막대를 이동하여 이 형광 강도 위의 모든 세포를 "양수"로 선택합니다.
- 선택한 매개 변수가 모두 맞는지 확인하려면 모든 실험 조건의 모든 미니 스캔 대표 이미지를 확인합니다.
- 맨 위 메뉴에서 인구 특성화를 선택하고 이벤트 하위 계층을 선택합니다.
- 유형 1 이벤트로 왼쪽 목록에서 ObjectAreaCh1을 선택한 다음 AND > 버튼을 클릭한 다음 ObjectAvgIntensityCh1을선택합니다. 이것은 낮은 면적과 고강도의 조합으로 응축된 핵의 확인을 허용할 것입니다.
- 동일한 창에서 모든 검사 제한을 선택 해제합니다.
- 상위 메뉴에 저장할 기능 선택(을 클릭하여 분석에 보관할 매개 변수를 선택)을 클릭합니다.
- 잘 기능을 선택하고 왼쪽 목록에서 원하는 매개 변수만 오른쪽으로 이동합니다: (a) 선택한ObjectCountPErValidField (b) %EventType1ObjectCount(c) %High_RingAvgIntensity(특정 계보 마커의 각 채널에 대해).
참고: 이 분석은 총 세포 수, 응축된 핵의 백분율 및 전체 세포 수에 대해 분석된 각 마커에 대한 계보 특이적 양성 세포의 백분율을 판독할 수 있게 한다. 상사 세포에서만 상이한 계보의 백분율이 필요한 경우, 채널에 대한 값 "High_RingAvgIntensity"를 유지하고 죽은 세포의 백분율을 빼고 나서 총 세포 수의 백분율을 다시 계산할 수 있다.- 대안적으로, 핵 검증(steps 11.11)에서 응축된 핵(steps 11.14-11.15)을 식별하는 데 사용되는 동일한 파라미터를 설정하는 분석으로부터 죽은 세포를 제거할 수 있다.
- 메인 탑 메뉴에서 스캔 플레이트를 선택하고 분석할 우물을 식별하려면 상단 섹션의 스캔 설정 하위 메뉴의 플레이트 기호를 클릭합니다.
- 실험 이름과 설명의 이름을 작성하고 모든 설정이 완료되면 재생 기호를 누릅니다.
결과
배양의 첫 번째 단계는 시드 밀도와 구체가 태아 또는 성인 기원인지 여부에 따라 지속 시간이 다를 수 있습니다. 더욱이, 올리고스피어는 신경구(도1B)에비해 두 배로 감소된 인구를 표시한다. 더욱이, 성인 조직에서 구체 생산은 느리고 파종 밀도에 따라 1-2주가 걸릴 수 있는 태아에 비해 올리고스피어를 생성하는 데 2-3주가 걸릴 수 있다.
일단 시드되면, 배양의 전체 분화 단계는 혈통 특정 항체를 사용하여 모니터링될 수 있다. 이 프로토콜의 목적은 분화의 최종 단계를 연구하는 것이므로 0 DIV의 배양 조성은 제시되지 않습니다. 그러나, 제1 배양단계에서, 세포는 신경 전구체를 나타내는 여전히 네신 양성이 될 것이며, 세포의 대부분은 NG2 양성(OpC)11이다. PREOL 단계에 대응하는 CNPase 양성 세포는 T3 매개 분화 유도 후 3~6일 후에 검출될 것이며, MBP 양성 세포는 6~12개의 DIV(성숙한 OL; 분화 단계의 끝에 배양 조성을 위한 도 2C 참조)사이에 나타날 것이다.
HCS 분석은 핵 염색을 통해 배양에서 각 단일 세포의 검출을 허용하고 나머지 채널에서 형광 강도의분석(도 2A, B). 분화 단계(12DiV)의 끝에 있는 배양의 조성은 배양이 태아 또는 성인 기원인지 여부에 따라 다르며, 태아 배양은 T3 중재 분화에 더 민감하고 성숙한OLs(12)의높은 비율에 도달한다.
전체 배양 과정 전반에 걸쳐, 세포의 약 40%-50%는 성상세포(GFAP 양성 세포)이며, 작은 비율(0%-10% 미만)은 뉴런(베타-III-tubulin 양성 세포;; 그림 2C). 배양 구성은 상이한 문화 제제 사이에 10%의 차이가 있을 수 있다. 성인 및 태아 배양은 분화 단계의 끝에 성숙한 OLs 생산의 수율에 대해 다르며, 태아 세포는 성숙한 OLs의 높은 비율, 전구체의 낮은 비율 및 성상 세포의 약 30%-40%를 나타낸다. 한편, 성인 배양은 분화 유도의 12가지 DIV 이후 더 많은 성상세포(약 45%-55%)와 덜 분화된 세포를 제시한다.
소프트웨어가 세포를 인식하고 배양 조성에 대한 적절한 편견 분석을 제공하기 위해, 시드 밀도가 정확하여 인접한 세포 간의 중복을 방지하는 것이 중요합니다. NSC에서 파생된 CPC가 고밀도로 시드될 때, 그들은 매우 빠르게 집계되는 경향이 있으며, 며칠 후 성상세포에 의해 점유되는 우물의 전체 표면으로 이어집니다. 더욱이, 특유의 거미그물 형상을 가진 성숙한 LS는 제한된공간(그림 3A, B)으로인해 보이지 않는다.
염증 매개 분화 블록은 시험관 내 분석에서 재현할 수 있으며 태아와 성인 배양 모두에서 CNPase 및 MBP 염색에 의해 검출된 preOLs 및 성숙한 OLs의 강한 감소를 생성합니다. 성인 문화권에서도 발생하는 CPC의수(그림 4A, B)가증가합니다. 사이토카인 혼합 조성물은 다발성경화증(13)의쥐 모델에서 생체 내 실험에서 선택되었으며, 이 질환에서 발생하는 염증 매개 분화 블록에 대한 시험관 내 모델로 시험되었다.
태아와 성인 OpC는 염증성 사이토카인 노출에 동일한 취약성을 보이지만, 태아 유래 배양만이 OGD독성(도 5A, B)에민감하며, 다른 대사프로필(14)으로인한 세포 사멸 및 분화 장애의 증가를 보여준다.

도 1: 신경 줄기 세포 유래 올리고드엔드로시테 전구체 세포 배양 설정 및 분화 프로토콜. (A)실험 절차의 계획. (B)신경권 2, 5, 7 디비에서 신경구의 대표적인 영상, 및 신경권과 올리고스피어의 인구가 두 배로 증가하는 것을 보여주는 그래프. 스케일 바: 100 μm. (C) 100 μm.(C)종래의 올리고스피어 유래 옵크의 대표적인 이미지는 0DIV에서 네스티노 및 NG2 양성 세포로부터, 6개의 DIV(preOL)와 CNPase/MBP 의 끝에 있는 CNPase 양성 세포를 통해 분화의 상이 다른 단계를 보여주는 대표적인 이미지(12OL) 및 CNPase/MBP 이중 양성 세포(12)의 끝에 있는 다름OL의 끝에 있다. GFAP 양성 세포 (성상 세포) 및 베타-III-tubulin 양성 세포의 작은 비율 (뉴런) 전체 배양에 걸쳐 존재. 스케일 바: 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
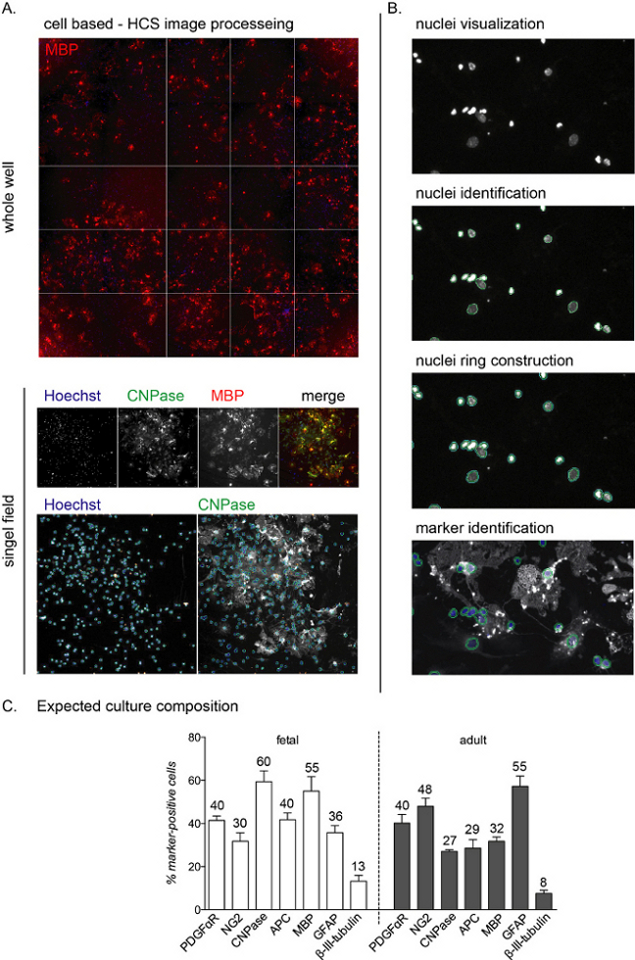
그림 2: 셀 기반 고콘텐츠 스크리닝 분석 워크플로우 및 예상 차별화 판독. (A)NSC에서 파생한 12개의 DIV 배양문화의 10배 목표를 가진 전체 우물(96웰 플레이트)과 고립된 단일 필드의 HCS 인수의 대표적인 이미지. (B)핵(개체) 시각화, 식별 및 핵 고리 생성을 포함하는 HCS 분석 워크플로우 단계는 세포질 염색 및 마커 식별을 식별한다. (C)분화 단계(12DiV)의 끝에 예상되는 배양 조성물을 나타내는 그래프. OpCs (PDGFαR, NG2), preOLs (CNPase, APC), 성숙한 OLs (MBP), 성상세포 (GFAP) 및 뉴런 (β-III-tubulin)에 대한 마커는 태아 와 성인 유래 배양 모두에 대해 표시됩니다. 각 세포 마커에 대한 반올림 백분율은 그래프에 포함되어 있으며, 이는 대표적인 실험이며 백분율은 약 5%-10%가 다를 수 있음을 주목한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
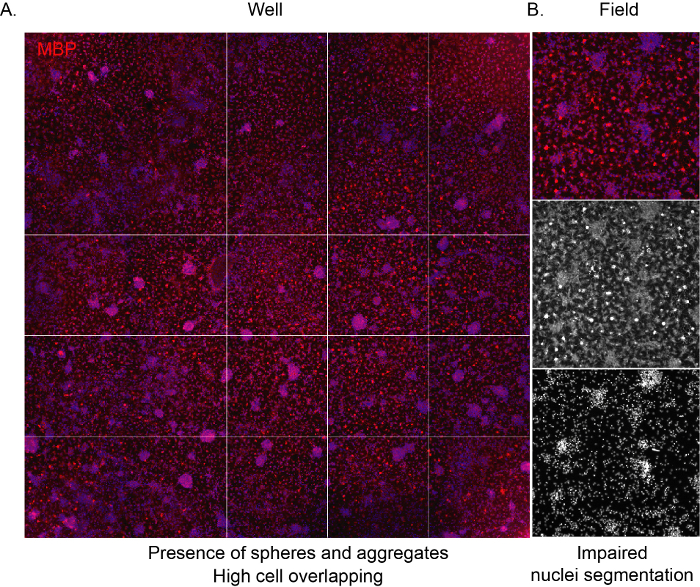
그림 3: 고밀도 문화의 대표적인 고함량 스크리닝 이미지. (A)10배 목표에 의해 획득되고 분화 단계(12DIV)의 끝에 MBP 발현을 표시한 웰(96웰 플레이트) 이미지의 대표적인 이미지. (B)대표적인 추출된 필드 이미지는 응집된 세포와 중첩된 핵의 존재를 강조한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
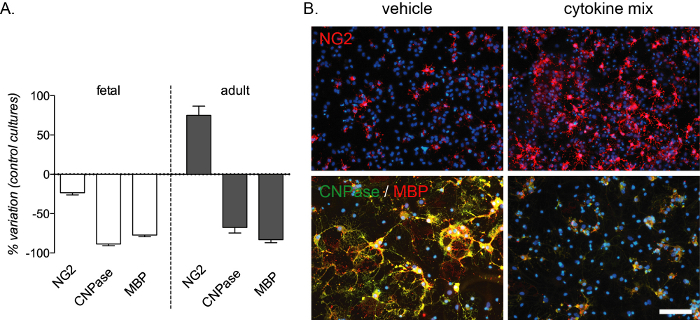
그림 4: 태아 및 성인 유래 OPC 배양에 대한 사이토카인 치료의 예상 효과. (A)차별화 단계(12DiV)의 끝에 있는 OpC(NG2), 프리올(CNPase) 및 성숙한 OL(MBP)의 정량화를 포함하여 표준 배양에 비해 태아 및 성인 유래 OPC 배양의 변형 비율을 나타내는 그래프. (B)차별화 단계(12DiV)의 끝에 있는 성인 배양의 대표적인 이미지는 차량 또는 사이토카인 믹스로 처리되고 NG2 또는 CNPase/MBP로 표시된다. 스케일 바: 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
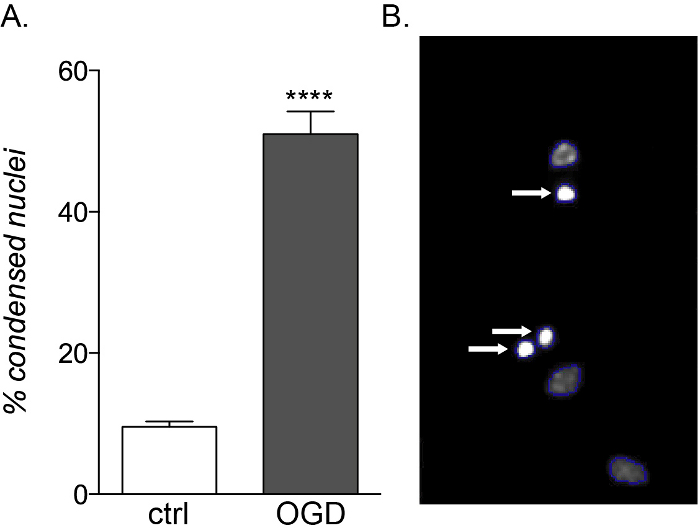
그림 5: 태아 유래 OPC 배양에 OGD 노출의 예상 효과. (A)대조군(ctrl) 및 OGD 노출 배양에서 세포 계 HCS에 의해 정량화된 응축된 핵의 백분율을 나타내는 그래프. (B)확인된 응축된 핵(white arrow)을 강조하는 HCS 처리된 물체의 대표적인 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 항체 | 종 | 희석 | |
| 안티 β-III-튜룰린 (R&D 시스템) | 마우스 | 1:3000 | |
| 안티 GFAP (다코) | 토끼 | 1:1000 | |
| 안티 NG2 (밀리포어) | 토끼 | 1:350 | |
| 안티 PDGFαR (산타 크루즈 생명 공학) | 토끼 | 1:300 | |
| 안티 CNPase (밀리포어) | 마우스 | 1:500 | |
| IgG2b 안티 APC, 클론 CC1 (칼바이오켐) | 마우스 | 1:100 | |
| 안티 MBP (다코) | 토끼 | 1:250 | |
| 안티 네신 (밀리포어) | 마우스 | 1:500 | |
| 알렉사 플루어 488-공주 항 마우스 (ThermoFisher 과학) | 당나귀 | 1:500 | |
| 알렉사 플루어 647-공주 항 마우스 IgG2b (ThermoFisher 과학) | 염소 | 1:500 | |
| 알렉사 568-공주 안티 토끼 (써모 피셔 과학) | 당나귀 | 1:500 | |
표 1: 1차 및 이차 항체 목록.
토론
myelination/remyeliination 프로세스및 탈근 이벤트의 복잡한 특성은 예측 시험관 시스템의 개발을 매우 어렵게 만듭니다. 체외 약물 선별 시스템에서 가장 널리 사용되는 것은 주로 인간 세포주 또는 1차 순수 OL 배양이며, 보다 복잡한 공동 배양 또는 organotypic시스템(15)의사용이 증가하고 있다. 이러한 시스템이 높은 콘텐츠 기술과 결합되어 있더라도, 순수한 OL 문화는 스크리닝플랫폼(16)을개발할 때 선택의 여지가 남아 있다.
여기에 설명된 자발적인 혼합 배양은 모든 주요 변수를 고려하는 체외 계통에서 유용한 것을 나타냅니다: 생리적 T3 매개 OPC 분화, 프로세스를 가진 병리학적 방해, 다른 세포 구성 요소 및 연령 관련 차이. 절차는 세포의 기원 (동물의 나이)과 스페로이드 형성 및 조작으로부터 파생되는 다수의 변수를 포함합니다. 사실, 중요한 단계는 조직으로부터 분리 된 후 NSCs의 세포 밀도이며, 최적 조건에서 단일 구가 단일 증식 세포로부터 파생되어야하기 때문이다. 우리는 고립 된 NSC가 집계하는 경향이 있고 그(것)들이 그들의 자신의 분비한 paracrine 요인을 필요로 한다는 것을 보았기 때문에, t25 또는 t75 플라스크에 있는 10-50 세포/μL의 범위에서 그(것)들을 종자 하는 것은, 세포 집합을 피하기 위하여 가장 좋은 타협입니다 그러나 아직도 세포가 분비 요인에 의해 통신하는 것을 허용합니다.
기술의 주요 한계는 기능적 축 상 골 수 의 부족 및 뉴런과의 직접적인 상호 작용, 방법은 성숙한 OLs의 단계까지 OPC 분화만 고려하기 때문에: CnPase / MBP 이중 양성 세포 거미 그물 형태. 이를 위해, 격리된 등쪽 루트 간질에서 배양된 기본 CPC는 여전히 주요방법론(17)이다. 그러나, 모든 연령대에 동물로부터 이러한 세포를 분화할 가능성은 관심의 시대로부터 분리된 세포에 화합물과 유해자극의 시험을 허용하기 때문에 번역 과정의 기본 포인트이다. 여기에 설명 된 바와 같이, 사실, NSC는 태아와 성인 뇌 모두에서 분리 될 수있다. 성년에서 발달 심분화 및 재분화는 누드 축소에 도달하고 myelin 칼집을 만들기 위해 동일한 목표를 공유하기 때문에 원래 두 과정이 모든 측면에서 동일하다는 가설이 되어 소위 회고가설(18)을생성하였다. 그러나, 이제 두 공정이 동등하게 간주될 수 없고 세포 내내 연령 관련 차이가 존재하며 실험적질문(19)에가장 적합한 시험관내 모델을 선택할 때 고려해야 한다는 것이 분명해졌다. 성인 NSC 유래 CPC, 사실, 유해자극14,20뿐만 아니라 1 차 적인 OpC21,22에생리적인 TH 중심분화 및 취약성에 강한 차이를 보여줍니다. 또한 성인 조직에서 APC 및 OLs 인구의 이질성, 병리학 적 조건에 대한 특정관련성(23)이있다. 성인 조직에서 1 차적인 OpCs 격리를 위한 프로토콜은24유효하고 실험적인 질문이 성인기에 있는 재분화에 작용하는 분자에 해결될 때 고려되어야 합니다.
NPC에서 옵트인을 차별화하면 미분화 전구체에서 성숙한 OL에 이르기까지 전체 차별화 프로세스의 시험관 내 표현을 허용합니다. 이 과정은 TH가 특정 핵 수용체를 통해 작용하는 프로세스의 주요 동인인 생체 내 상태와 유사하며, 이 메커니즘을 통한 실험간섭을 허용하여번역보기(13)에서병리학적 조건을 모방할 수 있다.
모델의 최종 기본 특성은 전체 문화권에 걸쳐 성상세포의 지속적인 존재입니다. 이것은 문화를 분석하기 어렵게 만드는 동안, 그것의 복잡한 세포 조성은 뚜렷한 이점을 구성합니다. 성상세포가 혼합 뉴런배양(25)의 유해한 사건에 대한 반응에 기여하는 방식은 널리 알려져 있으며, CNS의 이 주요 성분의 부재는 체외 계통을 예측가능하고 번역할 수 없는 것으로 알려져 있다. 한편, 이러한 특성상 NSC 유래 배양은 단일 세포 형 시스템보다 균일하지 않다는 단점을 가지며, 이는 편향된 분석으로 이어질 수 있다. 그러나, 세포 기반 HCS 기술은 전체 배양과 모든 세포 집단의 분석을 허용하고, 분석을 위한 대표적인 필드의 무작위화도 제거한다. 실험에 사용되는 세포 배양이 신뢰할 수 있는 파종 품질이라고 가정하면 HCS는 실험 조건에 대한 전체 적인 그림을 제공하여 통계적으로 견고한 데이터와 다수의 자동 형광 기반 분석을 생성합니다.
결론적으로, 현재 프로토콜은 태아와 성인 두뇌에서 NSC 파생 된 OpC의 격리 및 분화에 대한 절차를 설명합니다. 전체 프로토콜은 동물의 나이와 실험 목표에 따라 약 30 일이 걸립니다. 특히, 성인 기원으로부터의 구체 형성은 태아에 비해 두 배의 시간이 걸릴 수 있으며, 동일한 종자 밀도에서. 분화 유도를 위해 2D 표면에 파종 후 15일(-3~12개의 DIV)의 시간은 모든 조건에서 정해진 시간이다. 전체 프로토콜은 복잡한 세포 환경에서 전체 TH 매개 분화 프로세스의 연구, 특정 병리학 적 메커니즘 (즉, 염증 성 사이토 카인 및 HI)을 통한 간섭 및 이러한 문제를 극복하기위한 새로운 전략의 결과적 테스트를 허용합니다. 문화 권 모델을 HCS 기술과 결합하여 강력하고 트랜스랄 수 있는 스크리닝 플랫폼을 생성합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
MIUR 국가 기술 클러스터 프로젝트 IRMI (CTN01_00177_888744) 및 지역 에밀리아 로마냐, Mat2Rep, POR-FESR 2014-2020에 의해 지원.
실험 작업을 주최하기위한 IRET 재단에 특별한 감사.
자료
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
참고문헌
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유