Method Article
عالية المحتوى فحص التمايز وتحليل النضج من الجنين والكبار الخلايا الجذعية العصبية المشتقة من ثقافات الخلايا السليفة Oligodendrocyte
In This Article
Summary
نحن نصف إنتاج الثقافات المختلطة من الخلايا الفلكية وخلايا أوليغودندروسيت السلائف المستمدة من الخلايا الجذعية العصبية الجنينية أو البالغة التي تختلف إلى أوليغودندروسيت ناضجة ، والنمذجة في المختبر من المحفزات الضارة. الاقتران مع تقنية فحص عالية المحتوى تعتمد على الخلية يبني نظام فحص المخدرات موثوقة وقوية.
Abstract
العقبة الرئيسية في تطوير تقنيات فحص الأدوية لتقييم فعالية الاستراتيجيات العلاجية في الأمراض المعقدة هي تحقيق التوازن بين التبسيط في المختبر وإعادة إنشاء المجمع في بيئة الجسم الحي ، جنبا إلى جنب مع الهدف الرئيسي ، الذي تشترك فيه جميع استراتيجيات الفحص ، للحصول على بيانات قوية وموثوقة ، تنبؤية للغاية للترجمة في الجسم الحي.
في مجال الأمراض المزيلة للميالين ، تستند غالبية استراتيجيات فحص الأدوية إلى خطوط الخلايا الخالدة أو الثقافات النقية لخلايا أولية أولية معزولة من السلائف الأولية (OPCs) من الحيوانات الوليدة ، مما يؤدي إلى تحيزات قوية بسبب عدم وجود اختلافات مرتبطة بالعمر وأي حالة مرضية حقيقية أو تعقيد.
هنا نعرض إعداد نظام في المختبر يهدف إلى نمذجة التمايز الفسيولوجي / نضوج الخلايا الجذعية العصبية (NSC) المشتقة من OPCs ، التي يتم التلاعب بها بسهولة لمحاكاة الظروف المرضية النموذجية للأمراض المزيلة للمنافس. وعلاوة على ذلك، تتضمن الطريقة العزلة عن أدمغة الجنين والبالغين، وإعطاء النظام الذي يميز ديناميكيا من OPCs إلى oligodendrocytes ناضجة (OLs) في ثقافة مشتركة عفوية والتي تشمل أيضا الخلايا الفلكية. يشبه هذا النموذج من الناحية الفسيولوجية المايلين بوساطة هرمون الغدة الدرقية وعملية إصلاح المايلين ، مما يسمح بإضافة التدخلات المرضية التي نموذج آليات المرض. نعرض كيفية محاكاة المكونين الرئيسيين للأمراض إزالة الميالين (أي نقص الأكسيا / نقص التروية والالتهاب) ، وإعادة تأثيرها على المايلين التنموي وإصلاح المايلين البالغ وأخذ جميع مكونات الخلية في النظام في الاعتبار طوال الوقت ، مع التركيز على التمييز بين OPCs.
ويتيح هذا النموذج المختلط التلقائي، مقترنا بتكنولوجيات الفحص عالية المحتوى القائمة على الخلايا، تطوير نظام قوي وموثوق لفحص الأدوية من أجل استراتيجيات علاجية تهدف إلى مكافحة العمليات المرضية التي تنطوي عليها إزالة المايلين والحث على إعادة الايلين.
Introduction
في الجهاز العصبي المركزي (CNS) ، تكون خلايا تشكيل المايلين (oligodendrocytes ، OLs) وسلائفها (خلايا أوليغودندروسيت السليفة ، OPCs) مسؤولة عن المايلين التنموي ، وهي عملية تحدث خلال فترات ما حول الولادة وما بعدها ، وبالنسبة لدوران المايلين وإصلاحه(إعادةالايلين) في مرحلة البلوغ 1 . هذه الخلايا هي متخصصة للغاية، والتفاعل تشريحيا ووظيفيا مع جميع المكونات الأخرى الدبقية والخلايا العصبية، مما يجعلها جزءا أساسيا من بنية الجهاز العصبي المركزي ووظيفة.
وتشارك الأحداث إزالة الميالين في إصابات وأمراض الجهاز العصبي المركزي المختلفة2، وتعمل أساسا على OPCs وOLs عن طريق آليات متعددة العوامل ، سواء أثناء النمو والبلوغ. السلائف غير المتمايزة مدفوعة بعوامل متمايزة ، أهمها هرمون الغدة الدرقية (TH) ، في عملية متزامنة3 مما يؤدي إلى التعرف على OPC والاستجابة لمحفزات محددة تحفز الانتشار ، والهجرة إلى المحور غير الميالين ، والتمايز إلى OLs ناضجة والتي بدورها تطور غمد المايلين4. يتم التحكم في كل هذه العمليات بدقة وتحدث في بيئة معقدة.
نظرا للطبيعة المعقدة لأحداث المايلين ، وإعادة الايلين ، وإزالة الميالين ، هناك حاجة كبيرة إلى طريقة مبسطة وموثوقة في المختبر لدراسة الآليات الأساسية وتطوير استراتيجيات علاجية جديدة ، مع التركيز على اللاعب الخلوي الرئيسي: OPC5.
لكي يكون النظام المختبري موثوقا به ، يجب أخذ عدد من العوامل في الاعتبار: تعقيد البيئة الخلوية ، والاختلافات الجوهرية المرتبطة بالعمر ، والتمايز الفسيولوجي بوساطة TH ، والآليات المرضية ، وقوة البيانات6. والواقع أن الحاجة غير الملباة في هذا المجال هي نموذج يحاكي تعقيد الحالة في الجسم الحي، ولا يتحقق بنجاح من خلال استخدام ثقافات OPC النقية المعزولة. بالإضافة إلى ذلك ، فإن المكونين الرئيسيين للأحداث إزالة الميالين ، الالتهاب ونقص الأكسيجة / نقص التروية (HI) ، ينطويان بشكل مباشر على مكونات الخلايا الأخرى التي قد تؤثر بشكل غير مباشر على التمايز الفسيولوجي ونضوج OPCs ، وهو جانب لا يمكن دراسته في نماذج المختبر المبسطة بشكل مفرط.
10 - انطلاقا من نظام ثقافي تنبؤي للغاية، يتمثل التحدي اللاحق والأكثر عمومية في إنتاج بيانات قوية وموثوقة. في هذا السياق ، فحص المحتوى العالي القائم على الخلية (HCS) هو الأسلوب الأنسب 7 ، حيث أنهدفناأولا هو تحليل الثقافة بأكملها في سير عمل تلقائي ، وتجنب التحيز في اختيار الحقول التمثيلية ، وثانيا الحصول على الجيل التلقائي والمتزامن من البيانات عالية المحتوى المستندة إلى التصوير8.
وبالنظر إلى أن الحاجة الرئيسية هي تحقيق أفضل توازن بين التبسيط في المختبر وفي تعقيد محاكاة الجسم الحي ، نقدم هنا طريقة قابلة للاستنساخ للغاية للحصول على OPCs المستمدة من الخلايا الجذعية العصبية (NSCs) المعزولة عن الجنين الأمامي ومنطقة البطين الفرعي للبالغين (SVZ). يشمل هذا النموذج في المختبر عملية التمايز OPC بأكملها ، من NSC متعدد القدرات إلى OL الناضج / الميالين ، بطريقة فسيولوجية تعتمد على TH. الثقافة الناتجة هي نظام التفريق الديناميكي / النضج الذي يؤدي إلى ثقافة مشتركة عفوية تتكون أساسا من التمييز بين OPCs والخلايا الفلكية ، مع نسبة منخفضة من الخلايا العصبية. هذه الثقافة الأولية تحاكي بشكل أفضل المجمع في بيئة الجسم الحي ، في حين أن اشتقاق الخلايا الجذعية يسمح بإجراء عمليات تلاعب بسيطة للحصول على إثراء نسب الخلية المطلوب.
على العكس من استراتيجيات فحص الأدوية الأخرى باستخدام خطوط الخلايا أو الثقافات النقية ل OPCs الأولية ، فإن الطريقة الموصوفة هنا تسمح بدراسة تأثير التداخلات المرضية أو الجزيئات العلاجية في بيئة معقدة ، دون فقدان التركيز على نوع الخلية المطلوب. يسمح سير عمل HCS بتحليل قابلية الخلية للحياة ومواصفات النسب ، وكذلك موت الخلايا الخاصة بالنسب والمعلمات المورفولوجية.
Protocol
تم تنفيذ جميع بروتوكولات الحيوانات الموصوفة هنا وفقا لتوجيهات مجلس الجماعة الأوروبية (86/609/EEC) والامتثال للمبادئ التوجيهية المنشورة في دليل المعاهد القومية للصحة لرعاية واستخدام المختبر.
1. الحلول والكواشف
- إعداد المتوسطة القياسية: DMEM/F12 الغلوتاماكس 1x; 8 مليمول/لتر HEPES؛ 100 U/100 ميكروغرام البنسلين/ستريبتومايسين (1٪ P/S)؛ 1x B27; 1x N-2.
- إعداد الوسط العصبي: إضافة 10 نانوغرام / مل bFGF; 10 نانوغرام / مل EGF إلى المتوسطة القياسية.
- إعداد oligosphere / OPC المتوسطة: إضافة 10 نانوغرام / مل bFGF; 10 نانوغرام / مل PDGF-AA إلى المتوسطة القياسية.
- إعداد oligodendroctye التمايز المتوسطة: إضافة 50 NM T3; 10 نانوغرام/مل CNTF؛ 1x N-أسيتيل-L-السيستين (NAC) إلى المتوسطة القياسية.
- إعداد العازلة الفصام غير الأنزيمية: إضافة 1٪ P / S إلى العازلة التفكك غير الأنزيمية والحفاظ على الجليد الباردة.
- إعداد محلول السكروز: HBSS، 0.3 غرام / مل السكروز.
- إعداد محلول غسيل BSA: EBSS، 40 ملغم/مل BSA، 0.02 مل/لتر HEPES.
- إعداد العازلة الانزيمية الفصام: HBSS, 5.4 ملغم/مل د-الجلوكوز, 15 مليمول/L HEPES, 1.33 ملغم/مل تريبسين, 0.7 ملغم/مل هيالورونيداز, 80 U/mL DNase.
- إعداد مزيج السيتوكين: TGF-β1، TNF-α، IL-1β، IL-6، IL-17، وIFN-γ (20 نانوغرام / مل لكل منهما).
- إعداد مركبة مزيج السيتوكين: 0.04٪ من المخزون (10٪ الجلسرين/100 nM الجليسين/25 nM تريس، pH 7.3).
- إعداد الأكسجين والجلوكوز الحرمان المتوسطة: المتوسطة القياسية باستخدام DMEM ث / س الجلوكوز. اعتمادا على الوترية من حالة الحرمان الجلوكوز المطلوب، فمن الممكن لإزالة أيضا B27 و / أو N2 من المتوسط لتجنب المركبات المرتبطة بالجلوكوز (على سبيل المثال، D-Galactose في B27).
2. تشريح وعزل مجلس الأمن القومي
ملاحظة: تم عزل NSCs الجنينية والبالغة من الدماغ الأمامي الجنيني E13.5 أو منطقة البطين الفرعي للبالغين البالغين البالغين من العمر 2.5 شهرا (SVZ) ، بعد بروتوكول Ahlenius وKokaia9 مع التعديلات.
- ثقافات NSC الجنينية
ملاحظة: قبل بدء تشريح، وإعداد أنابيب 1.5 مل تحتوي على 150 ميكرولتر من العازلة غير الإنزيمية الانفصال لكل منهما؛ تنظيف أطباق بيتري وإضافة الجليد HBSS الباردة.- جمع الأجنة في E13.5 - 14.5 من الفئران الحوامل في الوقت المناسب ومكان في طبق بيتري التي تحتوي على HBSS الباردة.
- قطع رأس الأجنة باستخدام ملقط.
- ضع رؤوس الأجنة في طبق بيتري نظيف يحتوي على برنامج تلفزيوني بارد جليدي وأزل الجلد من الجمجمة باستخدام ملقط، باستخدام نظارات مكبرة أو مجسمة.
- بمجرد أن يكون الدماغ مرئيا ومخلوا من الجلد ، اعصره عن طريق الضغط على الجانبين باستخدام ملقط.
- إزالة المخيخ، والحفاظ على الدماغ الأمامي فقط وإزالة السحايا مع ملقط.
- ضع الأنسجة المعزولة في العازلة غير الإنزيمية للتفكك وكرر خطوات التشريح مع الأجنة الأخرى. أدخل الأنسجة من 2-3 في كل أنبوب يحتوي على العازلة.
- احتضان عند 37 درجة مئوية لمدة 15 دقيقة تحت اهتزاز مستمر.
- بعد الحضانة، أضف 850 ميكرولتر من الوسط القياسي واخلطها عن طريق الأنابيب حتى يصبح التعليق خاليا من الكتل.
- إذا كانت الأنسجة غير المفككة لا تزال مرئية، فانتظر دقيقتين في RT حتى تترسب في أسفل الأنبوب.
- عند اكتمال الانفصال، عد الخلايا ولوحها في تعليق بكثافة 10-50 خلية/ميكرولتر في قارورة T-25 أو T-45 تحتوي على 10-30 مل من الوسط العصبي، يتم الاحتفاظ بها في وضع عمودي لتجنب التصاق الخلايا.
-
ثقافات مجلس الأمن القومي للبالغين
- التضحية بالحيوانات عن طريق خلع عنق الرحم.
- جمع العقول من الفئران 4-5 في أنبوب 50 مل تحتوي على الجليد HBSS الباردة.
- ضع الدماغ على سطح معقم بارد. لهذا الغرض، استخدم قارورة T-25 مليئة بالماء ووضعها في -20 درجة مئوية بين عشية وضحاها. في وقت التجربة، قم بتغطية القارورة بورق الألمنيوم العقيم.
- ضع الجانب البطني للدماغ إلى الأسفل، في اتجاه rostro-caudal، وأزل المصابيح الشمية باستخدام شفرة حلاقة.
- باستخدام شفرة حلاقة، وقطع 2-3 شرائح تاجية من سمك 1 ملم، من القشرة إلى شياسما البصرية.
- ضع الشرائح على السطح البارد في وضع البطين الظهري وحدد كالوسوم الجسم البطينين الجانبيين.
- باستخدام النظارات المكبرة أو المجسمة، عزل جدران البطينين الجانبيين، مع الحرص على عدم حمل قطع من كالوسوم الجسم.
- ضع الأنسجة المعزولة في حاجز الانزيم (5-10 مل) واحتضنها عند 37 درجة مئوية لمدة 15 دقيقة.
- مزيج الحل، pipetting عدة مرات (على الأقل 50)، واحتضان مرة أخرى في 37 درجة مئوية لمدة 10 دقيقة.
- تحييد التريبسين بإضافة 5 مل من متوسط الثقافة القياسية وتصفية الحل باستخدام مرشح 70 ميكرومتر.
- الطرد المركزي الحل تصفية لمدة 5 دقائق في 400 × ز.
- Resuspend بيليه في محلول السكروز والطرد المركزي لمدة 10 دقيقة في 500 x ز.
- Resuspend بيليه في محلول الغسيل BSA والطرد المركزي لمدة 7 دقائق في 400 x ز.
- Resuspend بيليه في المتوسط الثقافة القياسية، عد الخلايا، وأداء الطلاء كما هو موضح أعلاه (في الخطوة 2.1.10).
3. الخلايا العصبية الأولية
- أضف عوامل النمو (bFGF/EGF) كل يومين.
- كل 4-6 أيام (اعتمادا على كثافة الخلية)، تغيير نصف المتوسط على النحو التالي:
- نقل تعليق الخلية بأكمله إلى أنبوب 15 أو 50 مل.
- جهاز طرد مركزي لمدة 5 دقائق عند 400 × ز.
- إزالة نصف وحدة التخزين.
- إضافة نفس الكمية من المتوسطة الطازجة، مزيج بلطف عن طريق pipetting، وإضافة عوامل النمو.
4. الغلاف الأرضي
ملاحظة: يتم تنفيذ التمايز Oligodendrocyte بعد بروتوكول تشن10 مع التعديلات.
- عندما تصل الخلايا العصبية إلى قطر يتراوح بين 100 و150 ميكرومتر، تكون جاهزة ل تمريرها. للقيام بذلك، نقل تعليق الخلية بأكملها إلى أنبوب 15 أو 50 مل، والطرد المركزي لمدة 5 دقائق في 400 × ز.
- تقييم قطر بسرعة من خلال التقاط صور للمجالات باستخدام المجهر الخفيفة المرسلة مقلوب وفتحها من قبل برنامج ImageJ.
- انقر على القائمة تحليل ومن نافذة الأدوات، حدد شريط المقياس.
- تعيين 150 ميكرومتر كما العرض في ميكرون ومقارنة شريط مقياس مع المجالات.
- إزالة حجم كامل عن طريق عكس وإعادة إنفاق بيليه في 180 ميكرولتر من المتوسطة الثقافة القياسية الطازجة. ماصة 50 مرة للسماح بتصنيف المجالات.
- إضافة 810 ميكرولتر من المتوسطة الثقافة القياسية الطازجة، عد الخلايا، وإعادة لوحة لهم كما هو موضح للغلاف العصبي.
- إضافة bFGF/PDGF-AA 10 نانوغرام/مل كل يومين.
- كل 4-6 أيام (اعتمادا على كثافة الخلية)، تغيير نصف المتوسط على النحو التالي:
- نقل تعليق الخلية بأكمله إلى أنبوب 15 أو 50 مل.
- جهاز طرد مركزي لمدة 5 دقائق عند 400 × ز.
- إزالة نصف وحدة التخزين.
- إضافة نفس الكمية من المتوسطة الطازجة، مزيج بلطف عن طريق pipetting، وإضافة عوامل النمو.
5. طلاء لوحة
- بولي-D,L-ornithine/laminin طلاء: على الأقل 2 أيام قبل طلاء OPCs, إضافة 50 ميكروغرام/مل بولي-D,L-ornithine الحل, المخفف في برنامج تلفزيوني, إلى كل بئر (40 ميكرولتر / جيدا لوحات 96-جيدا) واحتضان في RT بين عشية وضحاها.
- في اليوم التالي، قم بإزالة السائل واغسله ثلاث مرات بالماء المقطر المعقم.
- دع اللوحات تجف في RT بين عشية وضحاها. في اليوم التالي، إضافة محلول صفح المخفف في برنامج تلفزيوني (5 ميكروغرام / مل؛ 40 ميكرولتر / جيدا لوحات 96 بئر) واحتضان لمدة 2 ساعة في 37 درجة مئوية.
6. زرع الخلايا
- عندما يصل قطر الغلاف الأرضي إلى 100-150 ميكرومتر، فإنها تكون جاهزة للانشقاق والبذور على لوحات المغلفة بولي-D،L-ornithine/laminine. للقيام بذلك، قم بنقل تعليق الخلية بالكامل إلى أنبوب 15 أو 50 مل، وأجهزة الطرد المركزي لمدة 5 دقائق عند 400 × ز (كما هو موضح في الخطوة 4.1)
- إزالة حجم كامل عن طريق عكس وإعادة إنفاق بيليه في 180 ميكرولتر من المتوسطة الثقافة القياسية الطازجة. ماصة 50 مرة للسماح بتصنيف المجالات.
- إضافة 810 ميكرولتر من الثقافة القياسية الطازجة المتوسطة والعد الخلايا.
- إزالة محلول صفح من الآبار ولوحة الخلايا في 3000 خلية / سم2 الكثافة (100 ميكرولتر / جيدا لوحات 96 بئر).
7. OPC التمايز التعريفي
- بعد 3 أيام، وإزالة المتوسطة بأكملها وإضافة نفس الحجم من oligodendrocyte التمايز المتوسطة.
- تغيير نصف المتوسطة كل 4 أيام وإضافة مزيج التمايز الطازج (T3/CNTF/NAC) كل يومين.
8. تحريض كتلة التمايز بوساطة الالتهاب
- بعد تفكك الغلاف العصبي وإنتاج الغلاف الأرضي (القسم 4) ، أضف مزيج السيتوكين إلى وسط الثقافة والحفاظ على السواقي عرضة للسيتوكينات لخطوة تكوين المجالات بأكملها.
ملاحظة: يعتمد الحجم على عدد الخلايا، حيث أن المجالات التي تشكل الخلايا يتم زرعها في 10-50 خلية/ميكرولتر. - إذا كان الوسط يحتاج إلى تغيير، تغيير وحدة التخزين بأكملها وإضافة مزيج السيتوكين مرة أخرى.
9. تحريض الأوكسجين والجلوكوز الحرمان موت الخلية
- في -1 DIV (2 بعد أيام من بذر الخلايا في لوحات متعددة بويل)، وإزالة المتوسط والحفاظ عليه في لوحة متعددة بويلات جديدة.
- أضف نصف حجم (50 ميكرولتر ل 96 لوحة بئر) من OGD-medium (مجموعة OGD) أو متوسطة جديدة (مجموعة التحكم). يستخدم نصف حجم الكمية للحد من تبادل الأكسجين بين السائل والهواء.
- ضع ثقافات مجموعة OGD في غرفة نقص الأكاسيد محكمة الإغلاق المشبعة بنسبة 95٪ N2 و 5٪ CO2. لتحقيق تشبع الغرفة، دع خليط الغاز يتدفق لمدة 6 دقائق عند 25 لتر/دقيقة قبل إغلاق أنابيب الغرفة.
- احتضان غرفة نقص الأكدمة في الحاضنة لمدة 3 ساعة. وينبغي أيضا ترك مجموعة التحكم واللوحات التي تحتوي على الوسيطة التي تمت إزالتها وحفظها في الخطوة 9.1 في الحاضنة.
- إزالة خالية من الجلوكوز (مجموعة OGD) أو المتوسطة الجديدة (مجموعة التحكم) وإضافة المتوسط إزالتها وحفظها في الخطوة 9.1.
10. الكيمياء المناعية
- عند النقطة الزمنية المطلوبة، قم بإصلاح الخلايا مع البارافورمالديهايد البارد 4٪ لمدة 20 دقيقة في RT.
- اغسل مرتين مع برنامج تلفزيوني (10 دقائق من الحضانة لكل غسل في RT).
- احتضان 1 ساعة في RT مع حل حجب (PBS تريتون 0.3٪ تحتوي على 1٪ BSA و 1٪ حمار / مصل الماعز العادي).
- احتضان مع مزيج الأجسام المضادة الأولية (الجدول 1), المخفف في PBS تريتون 0.3٪, بين عشية وضحاها في 4 °C.
- اغسل مرتين مع برنامج تلفزيوني (10 دقائق من الحضانة لكل غسل في RT).
- احتضان مع الأجسام المضادة الثانوية (الجدول 1) حل مخفف في PBS triton 0.3٪ إضافة Hoechst 33258 لمدة 30 دقيقة في 37 °C.
- اغسل مرتين مع برنامج تلفزيوني (10 دقائق من الحضانة لكل غسل في RT).
11. تحليل HCS من صلاحية الخلية، وتكوين النسب، وموت الخلية النسب محددة
ملاحظة: يتم عرض الصور التمثيلية وسير العمل HCS في الشكل 2A, B.
- حدد خوارزمية التحليل المجزأ من القائمة الرئيسية للبرنامج (HCS Studio v 6.6.0) وحدد المسح الضوئي من القائمة الرئيسية تطوير المقايسة / لوحة المسح الضوئي.
- في إطار iDev، حدد جديد ثم حدد أداة قياس الكثافة العامة من قالب تطوير المقايسة.
- انقر على إنشاء على الجانب الأيمن من القائمة، واختيار الهدف 10x.
- سيؤدي ذلك إلى فتح القائمة تكوين اكتساب. في هذه النافذة، حدد المعلمات التالية: (أ) عدد من القنوات: أول واحد لتلطيخ هويشست النووية (BGRFR_386) وواحد لكل علامة النسب محددة المستخدمة في رد الفعل (ب) حدد تركيز البرنامج على القناة 1 والفاصل الزمني التركيز البؤري التلقائي كما 1 (ج) حدد نموذج لوحة من القائمة.
- من قائمة الاستحواذ، انظر إلى جودة التلطيخ في الآبار المختلفة والحقول المختلفة وحدد وقت التعرض يدويا عن طريق تحديد وقت التعرض الثابت في القائمة.
- بمجرد تعيين معلمات الاستحواذ، حدد Mini Scan في أعلى القائمة وحدد عشرة حقول لكل بئر في بئرين لكل حالة تجريبية. سيسمح هذا إعداد كافة معلمة التحليل في مجموعة فرعية من الحقول للوحة بأكملها.
- عند الانتهاء من الفحص المصغر، انقر فوق تكوين المعلمة المقايسة لتكوين خوارزمية التحليل.
- انقر على تكوين مجموعات في الجانب الأيمن من النافذة وسحب وإسقاط آبار miniscan. انقر فوق الزر إضافة في القسم الفرعي مجموعات لتكوين مجموعات مختلفة.
- اتبع سير العمل على الجانب الأيسر من النافذة خطوة بخطوة لتطوير الخوارزمية بأكملها. حدد أولا صورة العملية لكل قناة وانقر على إزالة الخلفية وعلى المستوى المطلوب.
- أولا تحديد واختيار النوى عن طريق تلطيخ النووية. انقر على تحديد الكائن الأساسي - القناة 1 لتحديد النوى الحقيقية وتجنب تحليل القطع الأثرية والحطام. لهذا الغرض، قم بتكبير صورة تمثيلية للتلطيخ النووي وتحقق مما إذا كانت النوى محاطة بشكل جيد بالمحيط الذي بناه البرنامج. من الممكن تغيير قيمة العتبة وتطبيق خوارزميات التقسيم لتحديد النوى المفردة بشكل أفضل.
- بمجرد تعريف النوى بشكل صحيح، انقر فوق الخطوة التالية: التحقق من صحة الكائن الأساسي. حدد Object.BorderObject.Ch1 لتجنب تحليل النوى عند حدود كل صورة حقل. حدد Object.Area.Ch1، ومن خلال تحريك الأشرطة "المنخفضة" و"العالية" على المدرجات التكرارية، قم بإزالة جميع الحطام المحدد أو الأجسام الكبيرة المقابلة للمجاميع أو القطع الأثرية.
- تحقق من جميع الصور التمثيلية المسح الضوئي مصغرة من جميع الشروط التجريبية للتأكد من أن المعلمات المحددة تناسب مع كل منهم.
- انقر على تحديد البقع لكل قناة المقابلة لعلامات النسب محددة، وحدد القيم الدائرية: العرض = 3 والمسافة = 0. وهذا سيسمح بتحديد الفلورية الخلوية. وفقا لكثافة الخلية، يمكن تكييف هذه القيم. سوف البرنامج تلقائيا تجنب التداخل بين الحلقات المجاورة.
- حدد مستويات المرجع في سير العمل لإنشاء التحليل. وسيسمح تحديد المستويات المرجعية بالعد التلقائي للنوى المكثفة، استنادا إلى الحجم النووي وكثافة التلطيخ النووي، والخلايا الإيجابية المحددة، استنادا إلى الفلورة الخلوية التي حددها الخاتم.
- انقر أولا على Object.Area.Ch1. في صور المسح المصغرة، حدد نواة مكثفة ونقل شريط "LOW" على المدرجات التكرارية من أجل تحديد كل النوى تحت هذا الحجم ك "مكثف".
- انقر على Object.AvgIntensity.Ch1. في صور المسح المصغر، حدد نواة مكثفة وحرك شريط "HIGH" على المدرجات التكرارية من أجل تحديد جميع النوى فوق هذه الكثافة الفلورية ك "مكثف".
- انقر على Object.RingAvgIntensity لكل قناة من علامات النسب محددة. حدد في الصور المسح المصغرة خلية إيجابية وتحريك شريط "عالية" على المدرجات التكرارية من أجل تحديد بأنها "إيجابية" جميع الخلايا فوق هذه الكثافة الفلورية.
- تحقق من جميع الصور التمثيلية المسح الضوئي مصغرة من جميع الشروط التجريبية للتأكد من أن المعلمات المحددة تناسب مع كل منهم.
- في القائمة العلوية، حدد توصيف السكان وحدد "السكان الفرعيين الأحداث".
- كما نوع 1 الحدث، حدد ObjectAreaCh1 على القائمة اليسرى، ثم انقر على زر AND > وأخيرا حدد ObjectAvgIntensityCh1. وهذا سيسمح بتحديد النوى المكثفة، كمزيج من المساحة المنخفضة والكثافة العالية.
- في نفس الإطار، قم بإلغاء تحديد كافة حدود المسح الضوئي.
- انقر على تحديد ميزات لتخزين في القائمة العلوية، لاختيار المعلمات للحفاظ على التحليل.
- حدد ميزات Well ثم انتقل من القائمة اليسرى إلى اليمين فقط المعلمات المطلوبة: (أ) SelectedObjectCountPErValidField (ب) ٪EventType1ObjectCount (ج) ٪High_RingAvgIntensity (لكل قناة من علامات النسب المحددة).
ملاحظة: هذا التحليل سوف تعطي كما قراءات العدد الإجمالي للخلايا، النسبة المئوية للنوى المكثفة، والنسبة المئوية للخلايا الإيجابية النسب محددة لكل علامة تحليلها على عدد الخلايا الإجمالية. إذا كانت هناك حاجة إلى النسبة المئوية للأناساب المختلفة فقط على الخلايا الحية، هل من الممكن إما الاحتفاظ بقيمة "High_RingAvgIntensity" للقناة (العدد المطلق للخلايا الإيجابية) وإعادة حساب النسبة المئوية على إجمالي أرقام الخلايا بعد طرح النسبة المئوية للخلايا الميتة.- بدلا من ذلك، من الممكن إزالة الخلايا الميتة من التحليل الذي يحدد نفس المعلمات المستخدمة لتحديد النوى المكثفة (الخطوات 11.14-11.15) على التحقق من صحة النوى (الخطوة 11.11).
- حدد Scan Plate من القائمة العلوية الرئيسية وانقر على رمز اللوحة في القائمة الفرعية Scan Setting في القسم العلوي لتحديد البئر لتحليلها.
- اكتب اسم التجربة والوصف وبمجرد الانتهاء من جميع الإعدادات، اضغط على رمز التشغيل.
النتائج
قد تختلف المرحلة الأولى من الثقافة في المدة ، اعتمادا على كثافة البذر وعلى ما إذا كانت المجالات ذات أصل جنيني أو بالغ. وعلاوة على ذلك، تظهر الغلاف الأرضي تضاعفا في عدد السكان مقارنة بالغلاف العصبي(الشكل 1B). وعلاوة على ذلك، فإن إنتاج المجالات من الأنسجة البالغة أبطأ وقد يستغرق توليد الغلاف الأرضي 2-3 أسابيع مقارنة بالجنين الذي قد يستغرق 1-2 أسابيع، اعتمادا على كثافة البذر.
وبمجرد زرعها، يمكن رصد مرحلة التمايز بأكملها من الثقافات باستخدام أجسام مضادة خاصة بالنسب. وبما أن الهدف من هذا البروتوكول هو دراسة المرحلة النهائية من التمايز، فإن التكوين الثقافي في 0 DIVs لا يقدم. ومع ذلك ، خلال مرحلة الثقافة الأولى ، ستظل الخلايا إيجابية العشين ، وتمثل السلائف العصبية ، وغالبية الخلايا هي أيضا إيجابية NG2 (OPCs)11. الخلايا الإيجابية CNPase، المقابلة لمرحلة preOL، سوف تكون قابلة للكشف بعد 3-6 أيام من تحريض التمايز بوساطة T3، في حين ستظهر الخلايا الإيجابية ميغابت في الثانية بين 6 و 12 DIVs (OLs ناضجة؛ انظر الشكل 2C لتكوين الثقافات في نهاية مرحلة التمايز).
يسمح تحليل HCS باكتشاف كل خلية واحدة في الثقافة من خلال التلطيخ النووي وتحليل كثافة الفلورسينس في القنوات المتبقية(الشكل 2A، B). يختلف تكوين الثقافة في نهاية مرحلة التمايز (12 DIVs) اعتمادا على ما إذا كانت الثقافات ذات أصل جنيني أو بالغ ، مع ثقافات الجنين الأكثر استجابة للتمايز بوساطة T3 والوصول إلى نسبة أعلى من OLs12الناضجة.
طوال عملية الثقافة بأكملها، حوالي 40٪ -50٪ من الخلايا هي الخلايا الفلكية (الخلايا الإيجابية GFAP)، في حين أن نسبة صغيرة (أقل من 0٪-10٪) هي الخلايا العصبية (بيتا-III-tubulin إيجابية الخلايا؛ الشكل 2C). قد يختلف تكوين الثقافة بنسبة 10٪ بين الاستعدادات الثقافية المختلفة. تختلف ثقافات البالغين والجنين عن غلة إنتاج OLs الناضج في نهاية مرحلة التمايز ، حيث تظهر خلايا الجنين نسبة عالية من ال OLs الناضجة ، ونسبة منخفضة من السلائف وحوالي 30٪ -40٪ من الخلايا الفلكية. من ناحية أخرى، تقدم ثقافات البالغين المزيد من الخلايا الفلكية (حوالي 45٪-55٪) وخلايا أقل تمايزا بعد 12 DIVs من تحريض التمايز.
للسماح للبرنامج بالتعرف على الخلايا وتقديم تحليل مناسب غير متحيز لتكوين الثقافة ، من المهم أن تكون كثافة البذر صحيحة ، وتجنب التداخل بين الخلايا المجاورة. عندما يتم بذر OPCs المشتقة من NSC بكثافة عالية ، فإنها تميل إلى التجميع بسرعة كبيرة ، مما يؤدي إلى أن يشغل الخلايا الفلكية سطح البئر بأكمله بعد بضعة أيام. وعلاوة على ذلك، سوف OLs ناضجة مع شكلها المميز شبكة العنكبوت لا تكون مرئية بسبب المساحة المحدودة (الشكل 3A، B).
كتلة التمايز بوساطة الالتهاب قابلة للاستنساخ من خلال هذا الفحص المختبري وتولد انخفاضا قويا في preOLs وOLs الناضجة التي اكتشفها CNPase وMBP تلطيخ في كل من الثقافات الجنينية والكبار. كما تحدث زيادة في عدد مراكز زراعة المركبات في ثقافات الكبار(الشكل 4ألف وباء). تم اختيار تكوين مزيج السيتوكين من تجارب في الجسم الحي في نموذج الفئران من التصلب المتعدد13، وتم اختباره كنموذج في المختبر لكتلة التمايز بوساطة الالتهاب التي تحدث في هذا المرض.
في حين أن الأجنة والكبار OPCs تظهر نفس الضعف للتعرض للسيتوكين الالتهابي، إلا أن الثقافات المشتقة من الجنين حساسة لسمية OGD (الشكل 5A، B)، مما يدل على زيادة في موت الخلايا وضعف التمايز بسبب اختلاف ملامحها الأيضية14.

الشكل 1: الخلايا الجذعية العصبية المشتقة من oligodendrocyte السلائف إعداد ثقافة الخلية وبروتوكول التمايز. (أ)مخطط الإجراء التجريبي. (ب) صور تمثيلية للغلاف العصبي في 2 و 5 و 7 DIVs ، ورسم بياني يظهر تضاعف عدد السكان من الغلاف العصبي والغلاف البري. شريط المقياس: 100 ميكرومتر (C) صور تمثيلية ل OPCs المشتقة من اللويغوسفير البذري والتي تظهر المراحل المختلفة للتمايز ، من الخلايا الإيجابية نستين وNG2 في 0 DIV (السلائف العصبية / OPCs) ، من خلال الخلايا الإيجابية CNPase في 6 DIVs (preOLs) وCNPase / MBP خلايا إيجابية مزدوجة في نهاية مرحلة التمايز (12 DIVs ؛ OLs ناضجة). الخلايا الإيجابية GFAP (الخلايا الفلكية) ونسبة صغيرة من بيتا الثالث توبولين الخلايا الإيجابية (الخلايا العصبية) موجودة في جميع أنحاء الثقافة بأكملها. أشرطة المقياس: 20 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
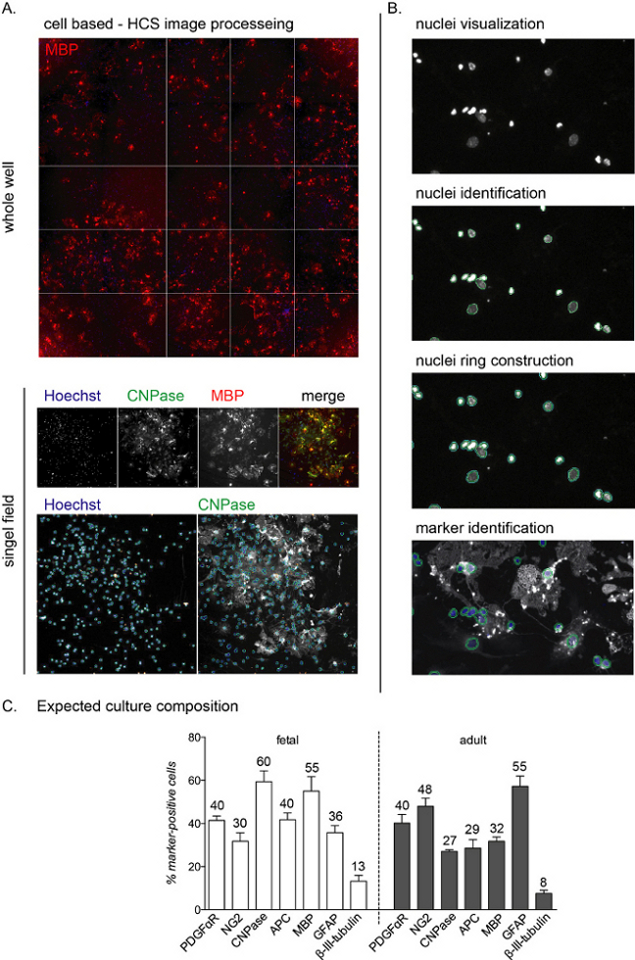
الشكل 2: سير عمل تحليل الفحص عالي المحتوى المستند إلى الخلية والقراءة المتوقعة للتمايز. (أ)صور تمثيلية لاقتناء HCS من بئر كامل (لوحة 96 بئر) وحقل واحد معزول المكتسبة مع هدف 10x من ثقافة 12 DIVs من OPCs المستمدة من NSC. (ب) خطوات سير العمل تحليل HCS بما في ذلك تصور النوى (الكائنات) ، وتحديد ، وبناء حلقة النوى لتحديد تلطيخ السيتوبلازمية وتحديد علامة. (ج) رسم بياني يوضح التكوين الثقافي المتوقع في نهاية مرحلة التمايز (12 DIVs). علامات لOPCs (PDGFαR، NG2)، preOLs (CNPase، APC)، OLs ناضجة (MBP)، الخلايا الفلكية (GFAP) والخلايا العصبية (β-III-tubulin) تظهر لكل من الثقافات المشتقة من الجنين والكبار. يتم تضمين نسب مئوية لكل علامات الخلية في الرسم البياني ، لاحظ أن هذه تجربة تمثيلية وقد تكون النسب المئوية مختلفة حول 5٪-10٪. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
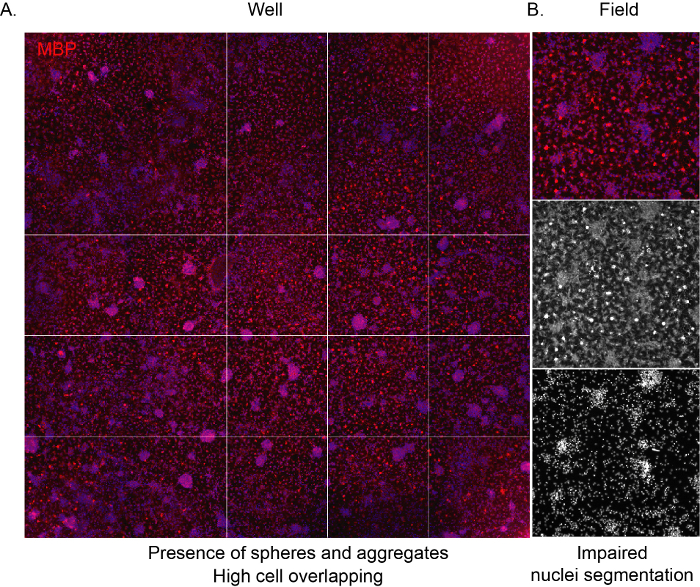
الشكل 3: صور فحص تمثيلية عالية المحتوى لثقافة عالية الكثافة. صورةتمثيلية لصورة البئر (96-well plate) التي تم الحصول عليها من خلال هدف 10x وتم وضع علامة عليها للتعبير عن MBP في نهاية مرحلة التمايز (12 DIVs). (ب) صورة ميدانية مستخرجة ممثلة تبرز وجود خلايا مجمعة ونوى متداخلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
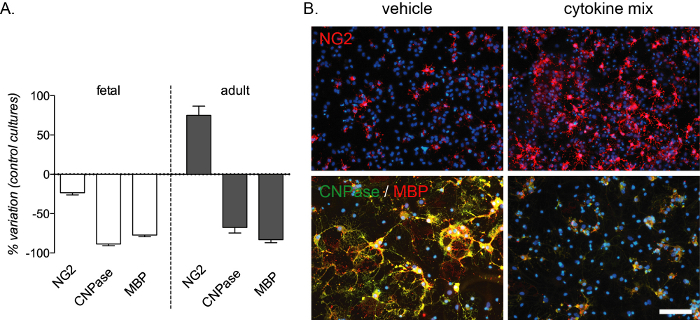
الشكل 4: التأثير المتوقع لعلاج السيتوكين على ثقافات OPC المشتقة من الجنين والبالغين. (أ)رسم بياني يبين النسبة المئوية للتباين في ثقافات OPC المشتقة من الجنين والبالغين مقارنة بالثقافات القياسية، بما في ذلك القياس الكمي لمركبات OPCs (NG2) وpreOLs (CNPase) وOLs الناضجة (MBP) في نهاية مرحلة التمايز (12 DIVs). (ب)صور تمثيلية لثقافات البالغين في نهاية مرحلة التمايز (12 DIVs) تعامل مع مزيج السيارة أو السيتوكين ووضع علامة لNG2 أو CNPase / MBP. شريط المقياس: 20 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
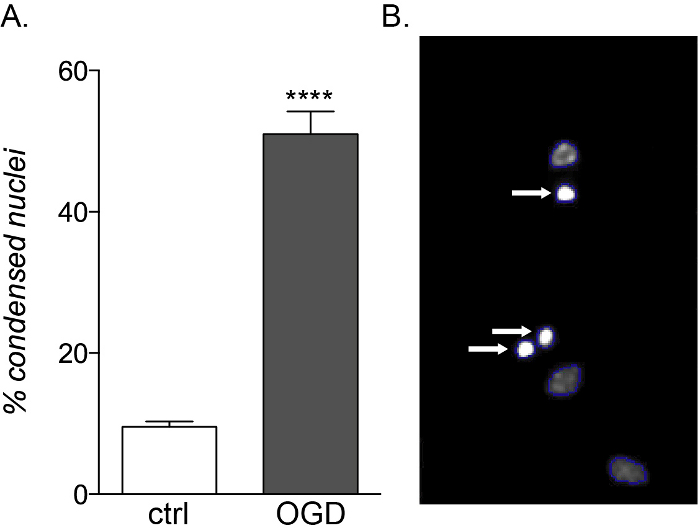
الشكل 5: التأثير المتوقع للتعرض ل OGD على ثقافات OPC المشتقة من الجنين. (أ)رسم بياني يبين النسبة المئوية للنوى المكثفة التي تم قياسها كميا بواسطة HCS القائم على الخلايا في الثقافات المتحكمة (ctrl) وOGD المعرضة. (ب) صور تمثيلية للأجسام المجهزة ب HCS التي تبرز النوى المكثفة المحددة (السهام البيضاء). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| جسم | جنس | التخفيف | |
| مضاد β-III-توبولين (نظام البحث والتطوير) | فأر | 1:3000 | |
| مكافحة GFAP (داكو) | أرنب | 1:1000 | |
| المضادة لNG2 (ميليبور) | أرنب | 1:350 | |
| مكافحة PDGFαR (سانتا كروز التكنولوجيا الحيوية) | أرنب | 1:300 | |
| مكافحة CNPase (ميليبور) | فأر | 1:500 | |
| IgG2b المضادة لل APC، استنساخ CC1 (كالبيوكيم) | فأر | 1:100 | |
| مكافحة ميغابت في الثانية (داكو) | أرنب | 1:250 | |
| مضاد للنستين (ميليبور) | فأر | 1:500 | |
| اليكسا فلور 488-اقتران الماوس المضادة (ThermoFisher العلمية) | حمار | 1:500 | |
| اليكسا فلور 647-اقتران المضادة للفأرة IgG2b (ThermoFisher العلمية) | ماعز | 1:500 | |
| اليكسا 568 مترافقة المضادة للأرانب (ThermoFisher العلمية) | حمار | 1:500 | |
الجدول 1: قائمة بالأجسام المضادة الأولية والثانوية.
Discussion
إن الطبيعة المعقدة لعمليات المايلين/إعادة التهييض والأحداث التي تزيل الميالين تجعل تطوير النظم التنبؤية في المختبر أمرا صعبا للغاية. الأكثر استخداما في المختبر نظم فحص المخدرات هي في الغالب خطوط الخلايا البشرية أو الثقافات OL نقية الأولية, مع زيادة استخدام الثقافات المشتركة أكثر تعقيدا أو النظم organotypic15. حتى لو اقترنت هذه الأنظمة بتقنيات عالية المحتوى ، فإن ثقافات OL النقية تظل الطريقة المفضلة عند تطوير منصات الفحص16.
تمثل الثقافة المختلطة العفوية الموصوفة هنا نظاما مفيدا في المختبر ، والذي يأخذ جميع المتغيرات الرئيسية في الاعتبار: تمايز OPC الفسيولوجي بوساطة T3 ، والتدخلات المرضية في العملية ، والمكونات الخلوية الأخرى ، والاختلافات المتعلقة بالعمر. يحتوي الإجراء على عدد من المتغيرات المستمدة من أصل الخلايا (عمر الحيوان) وتشكيل الكرويات والتلاعب بها. في الواقع ، فإن الخطوة الحاسمة هي كثافة الخلية من البذر NSCs بعد العزلة عن الأنسجة ، لأنه في الحالة المثلى يجب أن يستمد كرة واحدة من خلية واحدة متكاثرة. وبما أننا رأينا أن NSCs المعزولة تميل إلى التجميع وأنها تحتاج إلى عوامل الباراكرين الخاصة بها، فإن بذرها في نطاق من 10-50 خلية/ميكرولتر، في قارورة t25 أو t75، هو أفضل حل وسط لتجنب تجميع الخلايا ولكن لا يزال يسمح للخلايا بالتواصل عن طريق عوامل التفرز.
القيود الرئيسية لهذه التقنية هو عدم وجود المايلين المحوري وظيفية والتفاعل المباشر مع الخلايا العصبية، لأن الأسلوب يأخذ في الاعتبار فقط التمايز OPC حتى مرحلة OLs ناضجة: CNPase / MBP-مزدوجة الخلايا الإيجابية مع مورفولوجيا شبكة العنكبوت. لهذا الغرض، لا تزال OPCs الأولية المستزرعة على العقد الجذرية الظهرية المعزولة هي المنهجية الرئيسية17. ومع ذلك ، فإن إمكانية تمييز هذه الخلايا عن الحيوانات في أي عمر هي نقطة أساسية في العملية التحويلية ، لأنها تسمح باختبار المركبات والمحفزات الضارة على الخلايا المعزولة عن عمر الاهتمام. كما هو موضح هنا، في الواقع، يمكن عزل NSCs من كل من الجنين والدماغ البالغ. منذ المايلين التنموية وremyelination في مرحلة البلوغ تشترك في نفس الهدف، أي للوصول إلى محور عري وخلق غمد المايلين، كان من المفترض أصلا أن العمليتين كانت متطابقة في كل جانب، وتوليد ما يسمى فرضية التلخيص18. ومع ذلك، فمن الواضح الآن أن العمليتين لا يمكن اعتبارهما متساويتين وأن الاختلافات المرتبطة بالعمر المتأصلة في الخلية موجودة وينبغي أخذها في الاعتبار عند اختيار النموذج الأنسب في المختبر للمسألة التجريبية19. الكبار NSCs المشتقة من OPCs، في الواقع، تظهر اختلافات قوية في التمايز الفسيولوجية التي تحركها TH والتعرض للمحفزات الضارة14،20، فضلا عن OPCsالأولية 21،22. هناك أيضا عدم تجانس OPCs وOLs السكان في الأنسجة البالغة ، ذات أهمية خاصة للحالات المرضية23. بروتوكولات عزل OPCs الأولية من الأنسجة البالغة متاحة24 وينبغي النظر فيها عندما يتم توجيه السؤال التجريبي إلى الجزيئات التي تعمل على إعادة الايلين في مرحلة البلوغ.
10- ويتيح التمييز بين المركبات المثيلة في شكل برامجية من البلدان النامية تمثيلا في المختبر لعملية التمايز برمتها، من السلائف غير المتمايزة إلى OL الناضجة. تشبه هذه العملية حالة الجسم الحي ، حيث تكون TH هي المحرك الرئيسي للعملية ، وتعمل من خلال مستقبلات نووية محددة ، وتسمح بالتدخل التجريبي مع هذه الآلية لمحاكاة الظروف المرضية في عرضترجمة 13.
السمة الأساسية النهائية للنموذج هو الوجود المستمر للخلايا الفلكية في جميع أنحاء الثقافة بأكملها. في حين أن هذا يجعل الثقافة أكثر صعوبة في التحليل ، فإن تكوين خلاياها المعقد يشكل ميزة متميزة. الطريقة التي تساهم بها الخلايا الفلكية في الاستجابة للأحداث الضارة في الثقافات العصبية المختلطة25 معروفة على نطاق واسع ، وعدم وجود هذا المكون الرئيسي من CNS يجعل النظام في المختبر غير متوقع وقابل للترجمة بشكل سيئ. ومن ناحية أخرى، فإن الثقافات المشتقة من مجلس الأمن القومي، لهذه الخاصية، لها عيب في أن تكون أقل اتساقا من نظم نوع الخلية الواحدة، وهذا قد يؤدي إلى تحليل متحيز. ومع ذلك ، فإن تقنية HCS المستندة إلى الخلية تسمح بتحليل الثقافة بأكملها وجميع مجموعات الخلايا ، وإزالة أيضا العشوائية للحقول التمثيلية للتحليل. وبافتراض أن ثقافة الخلية المستخدمة في التجربة ذات نوعية بذر موثوقة، فإن الهيدروفلوروفلورية ستعطي صورة كاملة عن الظروف التجريبية، وتولد بيانات قوية إحصائيا وعددا من التحليلات التلقائية القائمة على الفلورسينس.
في الختام، يصف البروتوكول الحالي إجراء عزل وتمايز OPCs المشتقة من NSC عن دماغ الجنين والبالغين. يستغرق البروتوكول بأكمله حوالي 30 يوما ، اعتمادا على عمر الحيوانات والأهداف التجريبية. على وجه الخصوص ، قد يستغرق تكوين المجالات من أصل بالغ وقتا مضاعفا مقارنة بمجالات الجنين ، بنفس كثافة البذر. الوقت من 15 يوما (من -3 إلى 12 DIVs) بعد البذر على سطح 2D للتحريض التمايز هو، ومع ذلك، وقت محدد في جميع الظروف. يسمح البروتوكول الكامل بدراسة عملية التمايز بوساطة TH بأكملها في بيئة خلوية معقدة ، والتدخل من خلال آليات مرضية محددة (أي السيتوكينات الالتهابية وHI) وما يترتب على ذلك من اختبار استراتيجيات جديدة تهدف إلى التغلب على هذه القضايا. إن اقتران نموذج الثقافة بتقنية HCS يولد منصة فحص قوية وقابلة للترجمة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
بدعم من مجموعة التكنولوجيا الوطنية MIUR IRMI (CTN01_00177_888744)، والمنطقة إميليا رومانيا، Mat2Rep، POR-FESR 2014-2020.
شكر خاص لمؤسسة IRET لاستضافة العمل التجريبي.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
References
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved