Method Article
胎児および成人神経幹細胞由来オリゴデンドロビテ前駆細胞培養の高含有スクリーニング分化と成熟解析
要約
成熟したオリゴデンドロサイトに分化する胎児または成体の神経幹細胞に由来するアストロサイトとオリゴデンドロサイト前駆細胞の混合培養の生成と、有害刺激のインビトロモデリングについて述べています。細胞ベースの高含有スクリーニング技術との結合は信頼でき、強い薬物スクリーニングシステムを造る。
要約
複雑な疾患における治療戦略の有効性を評価するための薬物スクリーニング技術の開発における主なハードルは、生体内環境における複雑な簡素化と複雑なインビボ環境の再現と、すべてのスクリーニング戦略によって共有される主な目的とのバランスを取り、堅牢で信頼性の高いデータを得ることです。
脱髄疾患の分野では、薬物スクリーニング戦略の大半は、新生児動物からの単離された原発オリゴデンドロサイト前駆細胞(OpCs)の不死化細胞株または純粋な培養物に基づいており、年齢に関連する差異の欠如および実際の病理学的状態または複雑さによる強い偏見をもたらす。
ここでは、脱髄性疾患に典型的な病理的状態を模倣するために容易に操作できる神経幹細胞(NSC)由来のOpPCの生理的分化/成熟をモデル化することを目的としたin vitroシステムの設定を示す。さらに、この方法には胎児および成人の脳からの分離が含まれており、アストロサイトを含む自発的な共培養において、OPCから成熟したオリゴデンドロサイト(OLs)に動的に分化するシステムを与える。このモデルは、甲状腺ホルモン媒介性骨髄化およびミエリン修復プロセスに生理的に似ており、疾患メカニズムをモデル化する病理学的干渉者の追加を可能にする。脱髄性疾患(低酸素/虚血および炎症)の2つの主要成分を模倣する方法を示し、発達髄鞘化および成人ミエリン修復への影響を再現し、システムのすべての細胞成分を全体に考慮しながら、OpPcの区別に焦点を当てています。
この自発的混合モデルは、細胞ベースの高含有スクリーニング技術と相まって、脱髄に関与する病理学的プロセスとの闘いと再髄化を誘発することを目的とした治療戦略のための堅牢で信頼性の高い薬物スクリーニングシステムの開発を可能にする。
概要
中枢神経系(CNS)では、ミエリン形成細胞(オリゴデンドロサイト、OLs)およびその前駆体(オリゴデンドロサイト前駆細胞、OPC)が発達性髄鞘形成、出生前後の期間に起こるプロセス、および成人期におけるミエリンの代謝および修復(remyelieli)を担う。これらの細胞は高度に特殊化されており、他のすべてのグリアおよび神経細胞成分と解剖学的かつ機能的に相互作用し、CNSの構造と機能の基本的な部分を占めています。
脱髄事象は、異なるCNS傷害および疾患2に関与し、主に発達中および成人期の両方の多因子メカニズムを用いてOPCおよびOLsに作用する。未分化前駆体は、主に甲状腺ホルモン(TH)の分化因子によって駆動され、OPCが増殖を誘発する特定の刺激を認識して応答し、非髄系軸索への移行、および成熟したOLへの分化を導く同期プロセス3 において、ミエリン鞘4を発症する。これらのプロセスはすべて細かく制御され、複雑な環境で発生します。
髄鞘化、再髄鞘化、脱髄イベントの複雑な性質により、基底のメカニズムを研究し、新しい治療戦略を開発するための簡単で信頼性の高いin vitro方法が非常に必要です。
in vitroシステムが信頼できるように、細胞環境の複雑さ、細胞内の細胞内の違い、生理学的TH媒介分化、病理学的メカニズム、およびデータの堅牢性を考慮する必要があります。実際、現場でのアンメットニーズは、生体内状態の複雑さを模倣するモデルであり、単離された純粋なOPC培養物の使用によって達成されない。また、脱髄事象の2つの主要成分である炎症および低酸素/虚血(HI)は、APCの生理的分化および成熟に間接的に影響を及ぼす可能性のある他の細胞成分を直接関与し、体外モデルでは過度に単純化できない側面である。
高度な予測型の文化システムから始めて、その後のより一般的な課題は、堅牢で信頼性の高いデータの生成です。この文脈において、細胞系高含有スクリーニング(HCS)は最も適した技術7であり、我々の目的は、まず、自動ワークフローで培養全体を分析し、代表分野を選択する偏りを回避し、第2に、イメージングベースの高コンテンツデータ8の自動かつ同時生成を得ることを目的としている。
インビトロ簡略化と生体内模倣の複雑さの間で最良のバランスを達成することが主な必要性であることを考えると、ここでは胎児前脳と成体心室領域(SVZ)から分離された神経幹細胞(NSC)に由来するOPCを得るための非常に再現可能な方法を提示する。このインビトロモデルは、多能性NSCから成熟/髄形成OLまで、生理学的TH依存的な方法で、OPC分化プロセス全体を包含する。結果として生じる培養は、主に分化するOPCとアストロサイトからなる自発的な共培養を生じ、ニューロンの割合が低い、動的に分化/交配するシステムである。この一次培養は、生体内環境における複合体をよりよく模倣し、その幹細胞誘導により、必要な細胞系統の濃縮を得るための単純な操作を可能にする。
細胞株または一次性APCの純粋な培養物を用いた他の薬物スクリーニング戦略とは対照的に、ここで説明する方法は、所望の細胞タイプに焦点を失うことなく、複雑な環境における病理学的干渉または治療分子の効果の研究を可能にする。HCSワークフローは、細胞生存率と系統仕様の分析、ならびに系統特異的細胞死および形態学的パラメータの分析を可能にする。
プロトコル
ここに記載されているすべての動物プロトコルは、欧州共同体理事会指令(86/609/EEC)に従って実施され、 実験動物のケアと使用のためのNIHガイドに掲載されたガイドラインに従った。
1. ソリューションおよび試薬
- 標準培地を準備する:DMEM/F12グルタマックス1倍;8ミリモル/Lヘペス;100 U/100 μgペニシリン/ストレプトマイシン(1%P/S);1x B27;1x N-2.
- 神経圏培地を準備する: 10 ng/mL bFGFを追加します。標準培地に10 ng /mL EGF。
- オリゴスフィア/OPC培地を準備する:10 ng / mL bFGFを追加します。標準培地に10 ng /mL PDGF-AA。
- オリデンドロチ分化培地を準備する:50 nM T3を追加します。10 ng/mL CNTF;1x N-アセチル-L-システイン(NAC)を標準培地に。
- 非酵素解離バッファーを準備する:非酵素解離バッファーに1%P/Sを追加し、氷を冷たく保ちます。
- ショ糖溶液を準備する:HBSS、0.3 g/mLスクロース。
- BSA洗浄液を準備する:EBSS、40 mg/mL BSA、0.02 mL/l HEPES。
- 酵素解離バッファーを準備する:HBSS、5.4 mg/mL Dグルコース、15ミリモル/L HEPES、1.33 mg/mLトリプシン、0.7 mg/mLヒアルロニダーゼ、80 U/mL DNase。
- サイトカインミックスを準備する:TGF-β1、TNF-α、IL-1β、IL-6、IL-17、およびIFN-γ(それぞれ20 ng/mL)。
- サイトカイン混合車両を準備する:在庫の0.04%(10%グリセロール/100 nMグリシン/25 nMトリス、pH 7.3)。
- 酸素グルコース欠乏培地を準備する:DMEM w/oグルコースを使用した標準培地。所望のグルコース欠乏状態のストリンジェンシーに応じて、グルコース関連化合物(例えば、B27中のD-ガラクトース)を避けるために培地からB27および/またはN2も除去することができる。
2. 解剖とNSCの分離
注:胎児および成人NSCは、E13.5胎児前脳または2.5ヶ月齢の成人副心室帯(SVZ)から分離され、アーレニウスとコカイアプロトコル9 に続いて修正された。
- 胎児のNSC文化
注:解剖を開始する前に、150 μLの非酵素解離バッファーをそれぞれ含む1.5 mLチューブを準備してください。ペトリ料理をきれいにし、氷冷のHBSSを追加します。- 時を取った妊娠中のマウスからE13.5-14.5で胚を収集し、冷たいHBSSを含むペトリ皿に入れます。
- 鉗子を使用して胚の首を切る。
- 氷冷PBSを含むきれいなペトリ皿に胚の頭部を置き、虫眼鏡またはステレオスコープを使用して、鉗子で頭蓋骨から皮膚を取り除きます。
- 脳が見え、皮膚を取り除いたら、鉗子で側面に圧力をかけることによってそれを絞り出す。
- 小脳を取り除き、前脳だけを維持し、鉗子で髄を取り除く。
- 単離した組織を非酵素解離バッファーに入れ、他の胚と解剖ステップを繰り返す。2~3匹の動物の組織を、バッファーを含む各チューブに挿入します。
- 連続振盪下で37°Cで15分間インキュベートします。
- インキュベーション後、850 μLの標準培地を加え、懸濁液に塊がなくなるまでピペッティングして混合します。
- 解き分けのない組織がまだ見える場合は、チューブの底に沈着するまでRTで2分間待ちます。
- 解離が完了したら、細胞を数え、10~30mLの神経球媒質を含むT-25またはT-45フラスコの10〜50細胞/μLの密度で懸濁液に入れ、細胞接着を避けるために垂直位置に保管します。
-
成人のNSC文化
- 子宮頸部脱臼による動物の犠牲。
- 氷冷HBSSを含む50 mLチューブ内の4~5匹のマウスから脳を集める。
- 脳を冷たい無菌の表面に置きます。この目的のために、水で満たされ、一晩で-20°Cに置かれたT-25フラスコを使用してください。実験時に、フラスコを滅菌アルミニウム箔で覆います。
- 脳腹側を下向きに、ロストロ-尾状方向に置き、カミソリの刃を使用して嗅球を取り除きます。
- カミソリの刃を使用して、皮質から光学チアスマまで、厚さ1mmの2~3コロナスライスをカットします。
- 冷たい表面にスライスを腹腔-後ろ位置に置き、コーパス梁と2つの側心室を特定します。
- 拡大鏡やステレオスコープを使用して、心室の側面を分離し、コーパス梁の破片を運ばないように注意してください。
- 単離した組織を酵素解離バッファー(5~10 mL)に入れ、37°Cで15分間インキュベートします。
- 溶液を混合し、数回(少なくとも50回)ピペット処理し、37°Cで再び10分間インキュベートする。
- 5 mLの標準培養培地を加えてトリプシンを中和し、70 μmのフィルターを使用して溶液をフィルター処理します。
- 400 x gで 5 分間フィルターした溶液を遠心分離します。
- ショ糖溶液中のペレットを再懸濁し、遠心分離機を500xgで10分間再懸濁する。
- BSA洗浄液と遠心分離機のペレットを400xgで7分間再懸濁します。
- 標準培地中のペレットを再懸濁し、細胞をカウントし、上述したようにめっきを行う(ステップ2.1.10)。
3. 一次神経球
- 2日ごとに成長因子(bFGF/EGF)を追加します。
- 4~ 6 日ごとに(細胞密度に応じて)、次のように培地の半分を変更します。
- 細胞懸濁液全体を15または50mLチューブに移します。
- 400 x gで 5 分間の遠心分離機。
- ボリュームの半分を取り外します。
- 同じ量の新鮮な培地を加え、ピペットで軽く混ぜ、成長因子を加えます。
4. オリゴスフィア
注:オリゴデンドロサイト分化は、変更を伴うChenプロトコル10 に続いて行われる。
- 神経球は直径100~150μmに達すると、通過可能です。そのためには、セル懸濁液全体を15または50mLチューブに移し、遠心分離機を400xgで5分間移動 します。
- 逆透過光顕微鏡を用いて球体の写真を撮り、ImageJソフトウェアで開くことで、素早く直径を評価します。
- [ 分析 ] メニューをクリックし、[ ツール] ウィンドウの [ スケール バー] を選択します。
- ミ クロン単位で幅 として150 μmを設定し、スケールバーと球を比較します。
- 反転によってボリューム全体を取り除き、新鮮な標準培養培地の180 μLでペレットを再中断します。ピペットは球体の分解を可能にする50回。
- 810 μLの新鮮な標準培養培地を加え、細胞を数え、神経球に関して説明されているように再板状にします。
- bFGF/PDGF-AA 10 ng/mLを2日ごとに追加します。
- 4~ 6 日ごとに(細胞密度に応じて)、次のように培地の半分を変更します。
- 細胞懸濁液全体を15または50mLチューブに移します。
- 400 x gで 5 分間の遠心分離機。
- ボリュームの半分を取り外します。
- 同じ量の新鮮な培地を加え、ピペットで軽く混ぜ、成長因子を加えます。
5. プレートコーティング
- ポリD、L-オルニチン/ラミニンコーティング:オプチをめっきする少なくとも2日前に、PBSで希釈した50 μg/mLポリD、L-オルニチン溶液を各ウェル(96ウェルプレートの場合は40 μL/well)に加え、RTで一晩インキュベートします。
- 翌日、液体を取り出し、蒸留滅菌水で3回洗浄します。
- 一晩RTでプレートを乾燥させます。翌日、PBS(5 μg/mL、96ウェルプレートの場合は40 μL/ウェル)で希釈したラミニン溶液を加え、37°Cで2時間インキュベートします。
6. 細胞の播種
- オリゴスフィアは直径100~150μmに達すると、ポリD、L-オルニチン/ラミニンコーティングプレートに解約して播種する準備が整います。これを行うには、セル懸濁液全体を15または50 mLチューブに移し、遠心分離機を400 x g で5分間(ステップ4.1で示す)
- 反転によってボリューム全体を取り除き、新鮮な標準培養培地の180 μLでペレットを再中断します。ピペットは球体の分解を可能にする50回。
- 810 μLの新鮮な標準培養培地を加え、細胞を数えます。
- ウェルからラミニン溶液を取り出し、セルを3,000セル/cm2 密度(96ウェルプレートの場合は100 μL/well)でプレートします。
7. OPC分化誘導
- 3日後、培地全体を取り出し、同じ量のオリゴデンドロサイト分化培地を加えます。
- 培地の半分を4日ごとに変更し、2日ごとに新鮮な分化ミックス(T3/CNTF/NAC)を追加します。
8. 炎症媒介分化ブロックの誘導
- 神経球解離とオリゴスフィア産生(セクション4)の後、サイトカインミックスを培養培地に加え、球全体の形成ステップのためにオリゴ球をサイトカインにさらしておく。
注:細胞を形成する球体の場合、細胞を形成するセルは10~50個のセル/μLで播種されるため、体積は細胞の数によって異なります。 - 培地を変更する必要がある場合は、ボリューム全体を変更し、サイトカインミックスをもう一度追加します。
9. 酸素グルコース欠乏細胞死の誘導
- -1 DIV(マルチウェルプレートで細胞播種の2日後)で、培地を取り除き、新しいマルチウェルプレートで保存します。
- OGD培地(OGD群)または新鮮な培地(対照群)の半分のボリューム(96ウェルプレートの場合は50μL)を加えます。体積の半分の量は、液体と空気の間の酸素交換を減らすために使用されます。
- OGD群培養物を95%N2と5%CO2で飽和した気密性低酸素室に入れます。チャンバの飽和を達成するために、チャンバーパイプを閉じる前に、25 l /分で6分間の混合気を流します。
- インキュベーター内の低酸素室を3時間インキュベートする。培地を含む対照群およびプレートは、ステップ9.1で除去され保存され、インキュベーターに残す必要があります。
- グルコースフリー(OGD基)または新しい培地(対照群)を除去し、ステップ9.1で除去して保存した培地を加える。
10. 免疫細胞化学
- 所望の時点で、細胞を20分間、RTで20分間、冷たい4%パラホルムアルデヒドで固定します。
- PBSで2回洗浄する(RTで洗うごとに10分間のインキュベーションを行う)。
- ブロッキング溶液を用いてRTで1時間インキュベート(PBSトリトン0.3%は1%BSAおよび1%ロバ/ヤギ正常血清を含む)。
- 一次抗体ミックス(表1)でインキュベートし、PBSトリトン0.3%で希釈し、4°Cで一晩。
- PBSで2回洗浄する(RTで洗うごとに10分間のインキュベーションを行う)。
- 2次抗体を用いてインキュベートする(表1)溶液をPBSトリトン0.3%で希釈し、37°Cで30分間のHoechst 33258を添加した。
- PBSで2回洗浄する(RTで洗うごとに10分間のインキュベーションを行う)。
11. 細胞生存率、系統組成、および系統特異的細胞死のHCS解析
注: HCS の代表的なイメージとワークフローを 図 2A,Bに示します。
- ソフトウェアのメインメニューから コンパートメント分析 アルゴリズム(HCS Studio v 6.6.0)を選択し、メインメニュー の [ アッセイ/スキャンプレートを開発]から[スキャン]を選択します。
- iDevウィンドウで、[新規] を選択し、アッセイの開発テンプレートから一般強度測定ツールを選択します。
- メニューの右側にある[ 作成] をクリックし、10倍の目標を選択します。
- これにより、[ 取得の構成] メニューが開きます。このウィンドウで、(a)チャネルの数を選択します:(a)チャネルの数:Hoechst核染色(BGRFR_386)の最初のチャンネルと、反応(b)で使用される各系統特異的マーカーのための1つは、チャンネル1にソフトウェアフォーカスを選択し、1(c)としてオートフォーカス間隔として、プレートモデルを選択します。
- 取得メニューから、異なるウェルと異なるフィールドでの染色の品質を確認し、メニューの [固定露出時間 ]を選択して、露出時間を手動で選択します。
- 取得パラメータを設定したら、メニューの上部にある [ミニスキャン ]を選択し、実験条件ごとに2つのウェルでウェルごとに10個のフィールドを選択します。これにより、プレート全体のフィールドのサブセット内のすべての解析パラメータを設定できるようになります。
- ミニスキャンが終了したら、[ アッセイパラメータの設定] をクリックして解析のアルゴリズムを設定します。
- ウィンドウの右側にある[グループを設定]をクリックし、ミニスキャンのウェルをドラッグアンドドロップします。[グループ] サブセクションの [追加] ボタンをクリックして、さまざまなグループを構成します。
- ウィンドウの左側のワークフローに従って、ステップバイステップでアルゴリズム全体を開発します。まず、各チャンネルの プロセスイメージ を選択し、 背景の削除 と希望のレベルをクリックします。
- まず核染色で核を同定し、選択する。 主オブジェクトの識別 - チャネル 1 をクリックして、実際の核を選択し、アーティファクトや破片の分析を避けます。この目的のために、核染色の代表的な画像を拡大し、核がソフトウェアによって構築された境界によって十分に囲まれているかどうかを確認します。しきい値を変更し、単一の核をより適切に識別するためにセグメンテーション アルゴリズムを適用することができます。
- 核が正しく定義されたら、次の手順を クリックします。各フィールド イメージの境界での核の解析を避けるには、[ オブジェクト.BorderObject.Ch1] を選択します。 Object.Area.Ch1 を選択し、ヒストグラムの「低」および「高」のバーを移動することで、集約またはアーティファクトに対応する識別されたすべての破片または大きなオブジェクトを除去します。
- すべての実験条件のミニスキャンの代表的な画像をすべてチェックして、選択したパラメータがそれらのすべてに適合していることを確認します。
- 特定の系統マーカーに対応する各チャンネルの スポットを識別 する をクリックし、リング値を選択します: 幅 = 3 と距離 = 0.これにより、細胞プラズマ蛍光の同定が可能になります。細胞密度に応じて、これらの値を適合させることができる。ソフトウェアは自動的に隣接リング間の重複を回避します。
- ワークフローで [参照レベル] を選択して、分析をビルドします。基準レベルの設定により、リングによって同定された細胞プラズマ蛍光に基づいて、核サイズと核染色強度、および特異的マーカー陽性細胞に基づいて、凝縮核の自動カウントが可能になる。
- まず 、オブジェクトをクリックします。ミニスキャン画像では、凝縮された核を選択し、ヒストグラムの「LOW」バーを動かして、このサイズの下にあるすべての核を「凝縮」として選択します。
- オブジェクトをクリックします 。ミニスキャン画像では、凝縮された核を選択し、ヒストグラムの「HIGH」バーを動かして、この蛍光強度より上のすべての核を「凝縮」として選択します。
- リネージュ固有マーカーの各チャネルの オブジェクトリングAvgIntensity をクリックします。あなたのミニスキャン画像で正の細胞を選択し、この蛍光強度を超えるすべての細胞を「陽性」として選択するためにヒストグラムの「HIGH」バーを動かします。
- すべての実験条件のミニスキャンの代表的な画像をすべてチェックして、選択したパラメータがそれらのすべてに適合していることを確認します。
- トップ メニューで、[ 母集団の特性評価 ] を選択し、[ イベント のサブ人口] を選択します。
- タイプ 1イベントとして、左側のリストで[ObjectAreaCh1]を選択し、[AND >]ボタンをクリックして、最後に[ObjectAvgIntensityCh1]を選択します。これは、低領域と高強度の組み合わせとして、凝縮核の同定を可能にする。
- 同じウィンドウで、すべてのスキャン制限の選択を解除します。
- 上部メニューの [保存するフィーチャの選択 ] をクリックして、解析に保持するパラメータを選択します。
- [よく機能] を選択し、左側のリストから目的のパラメーターだけを右に移動します High_RingAvgIntensity。
注: この分析は、合計セル数、凝縮された核の割合、および合計セル数の各分析マーカーの系統特異的陽性細胞の割合を読み出しとして与えます。異なる系統のパーセンテージが生きたセルにのみ必要な場合、チャネルの値を「High_RingAvgIntensity」に保ち(正のセルの絶対数)、死んだ細胞の割合を減算した後の合計セル数のパーセンテージを再計算することが可能です。- あるいは、核検証(ステップ11.11)で凝縮核を同定するために使用される同じパラメータ(ステップ11.14~11.15)を設定して、分析から死んだ細胞を除去することができる。
- メイントップメニューから [スキャンプレート ]を選択し、上部セクションの [スキャン設定] サブメニューのプレートシンボルをクリックして、分析するウェルを識別します。
- 実験の名前と説明を書き、すべての設定が完了したら、 再生 記号を押します。
結果
培養の第1段階は、播種密度と球体が胎児または成人起源であるかどうかによって、持続時間が異なる場合がある。さらに、オリゴスフィアは、神経球と比較して倍増する人口の減少を示す(図1B)。さらに、成体組織からの球体の生成は遅く、播種密度に応じて1~2週間かかる胎児と比較して、オリゴ球の生成に2~3週間かかる場合があります。
播種したら、培養物の全分化段階を系統特異的抗体を用いてモニタリングすることができる。このプロトコルの目的は、分化の最終段階を研究することなので、0のDIVでの培養組成は提示されない。しかしながら、第1培養段階では、細胞は依然としてネチン陽性であり、神経前駆体を表し、細胞の大部分もNG2陽性(OPC)11である。プレOL段階に対応するCNPase陽性細胞は、T3媒介分化誘導の3~6日後に検出可能となり、MBP陽性細胞は6~12個のDIV(成熟したOL、分化段階終了時の培養組成については図2C参照)の間に出現する。
HCS分析により、残りのチャネルにおける核染色および蛍光強度の分析を通じて、培養中の各単一細胞の検出が可能になります(図2A,B)。分化段階の終わりに培養物の組成(12個のDIV)は、培養物が胎児由来か成人由来かによって異なり、胎児培養はT3媒介分化に対してより応答性が高く、成熟したOLs12のより高い割合に達する。
培養プロセス全体を通じて、細胞の約40%〜50%がアストロサイト(GFAP陽性細胞)であり、小さな割合(0%〜10%未満)がニューロン(β-III-チューブリン陽性細胞)である。 図2C)。培養組成物は、異なる培養製剤間で10%の変化を有し得る。成人と胎児の培養は分化段階の終わりに成熟したOLs産生の収量が異なり、胎児細胞は成熟したOLsの高い割合、前駆体の割合が低く、アストロサイトの約30%から40%を示す。一方、成人培養物は、分化誘導の12個のDIV後に、より多くのアストロサイト(約45%〜55%)と分化細胞の減少を示します。
ソフトウェアが細胞を認識し、培養組成物の適切な非バイアス分析を提供するためには、隣接する細胞間の重なりを避け、播種密度が正しいことが重要である。NSC由来のOpPCが高密度で播種されると、それらは非常に速く凝集する傾向があり、数日後にアストロサイトによって占められている井戸の表面全体につながります。また、特徴的なスパイダーネット形状の成熟したOは、限られたスペースのために見えません(図3A,B)。
炎症媒介分化ブロックは、このインビトロアッセイによって再現可能であり、胎児および成人培養物の両方でCNPaseおよびMBP染色によって検出される前オールおよび成熟したOLsの強い減少を生み出す。APCの数の増加は、成人培養でも起こります(図4A,B)。サイトカインミックス組成物は、多発性硬化症13のラットモデルでインビボ実験から選択し、この疾患で発生する炎症媒介分化ブロックのインビトロモデルとして試験した。
胎児および成人のAPCは炎症性サイトカイン曝露に対して同じ脆弱性を示しているが、胎児由来培養物のみがOGD毒性に敏感である(図5A,B)、それらの異なる代謝プロファイル14による細胞死および分化障害の増加を示す。

図1:神経幹細胞由来オリゴデンドロシテ前駆細胞培養のセットアップおよび分化プロトコル(A) 実験手順のスキーム。(B)2、5、7のDIVにおける神経球の代表的な画像と、神経圏およびオリゴスフィアの人口倍増を示すグラフ。スケールバー:100μm(C)0 DIV(神経前駆体/OPC)のネスチン細胞およびNG2陽性細胞から、分化相(preOL)のCNPase陽性細胞および分化相(12 DI;成熟O)の終わりにCNPase/MBP二重陽性細胞を通じて、分化の異なる段階を示す播種されたオリゴスフィア由来のOPCの代表的な画像。GFAP陽性細胞(アストロサイト)およびβ-III-tubulin陽性細胞(ニューロン)のごく一部は、培養全体にわたって存在する。スケールバー:20 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
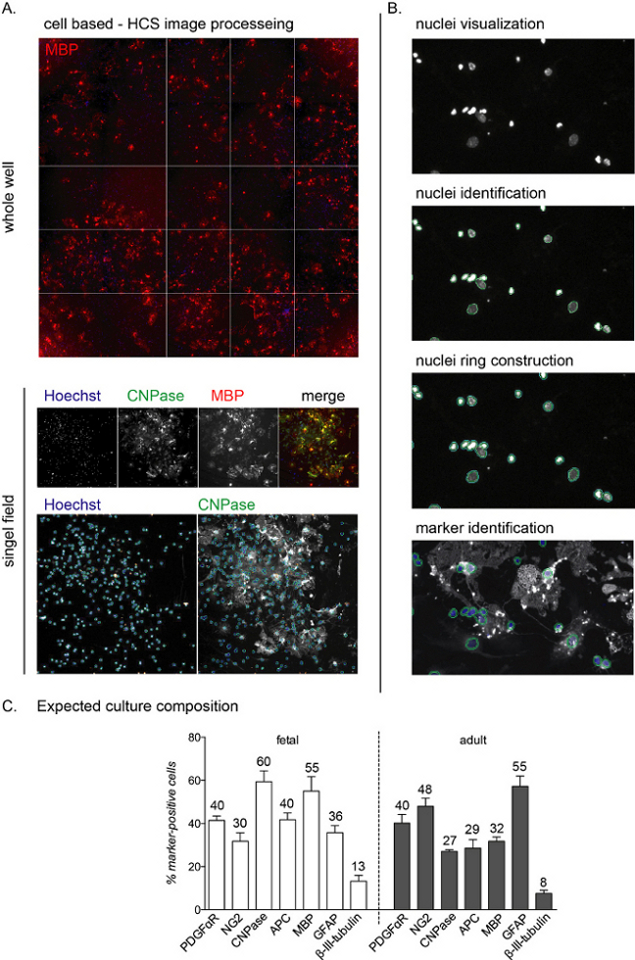
図2:セルベースの高コンテンツスクリーニング解析ワークフローと期待される分化読み出し(A) 全ウェル(96ウェルプレート)のHCS取得と、NSC由来のAPCの12個のDIV文化の10倍の目的で取得した単一の分野の抽出の代表的な画像。(B) 細胞質染色とマーカー同定を同定するための核(物体)の可視化、同定、核環の構築を含むHCS解析ワークフローステップ。(C)分化フェーズの終了時に期待される培養組成を示すグラフ(12個のDIV)。OPC(PDGFαR、NG2)、プレオール(CNPase、APC)、成熟したOLs(MBP)、アストロサイト(GFAP)およびニューロン(β-III-tubulin)のマーカーは、胎児由来および成人由来の培養物の両方に対して示されている。各セルマーカーの丸めされたパーセンテージはグラフに含まれていますが、これは代表的な実験であり、パーセンテージは約5%から10%異なる可能性があることに注意してください。 この図の大きなバージョンを表示するには、ここをクリックしてください。
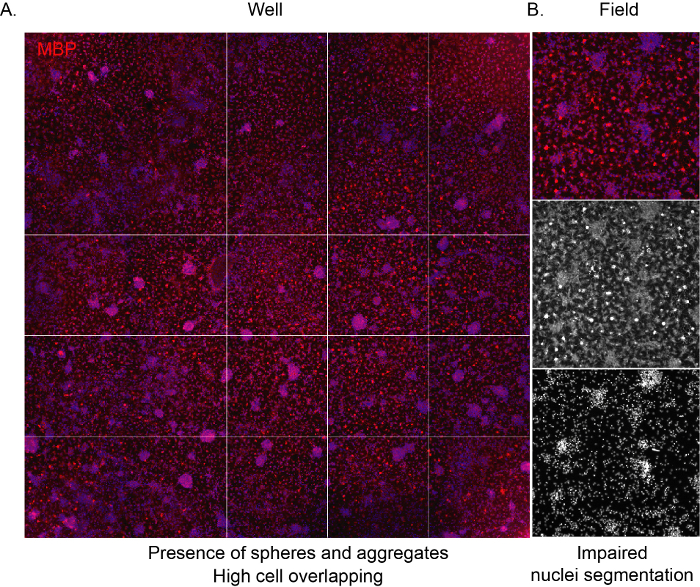
図3:高密度培養物の代表的な高コンテンツスクリーニング画像。(A) 10x 目的で取得し、分化フェーズ(12個のDIV)の終了時にMBP発現用にマークされたウェル(96ウェルプレート)画像の代表的な画像。(B)代表的な抽出されたフィールド画像は、凝集した細胞と重なり合う核の存在を強調する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
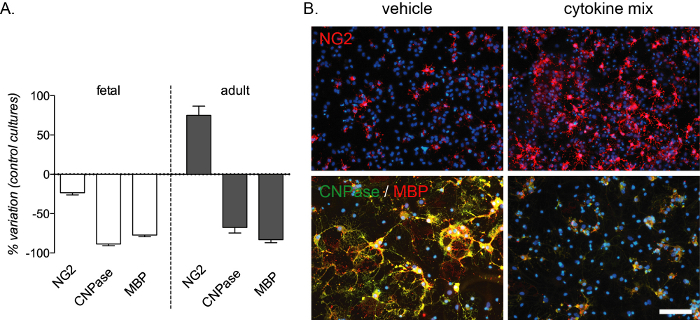
図4:胎児および成人由来のOPC培養物に対するサイトカイン治療の期待される効果(A) 分化フェーズ(12 DUV)の終了時にOPC(NG2)、プレオール(CNPase)、成熟OL(MBP)の定量化を含む標準培養物と比較した、胎児由来および成人由来OPC培養の変動割合を示すグラフ。(B) 分化フェーズの終わりに成人培養物の代表的な画像 (12 枚の DIV) 車両またはサイトカインミックスで処理し、NG2 または CNPase/MBP のマークを付けた。スケールバー:20 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
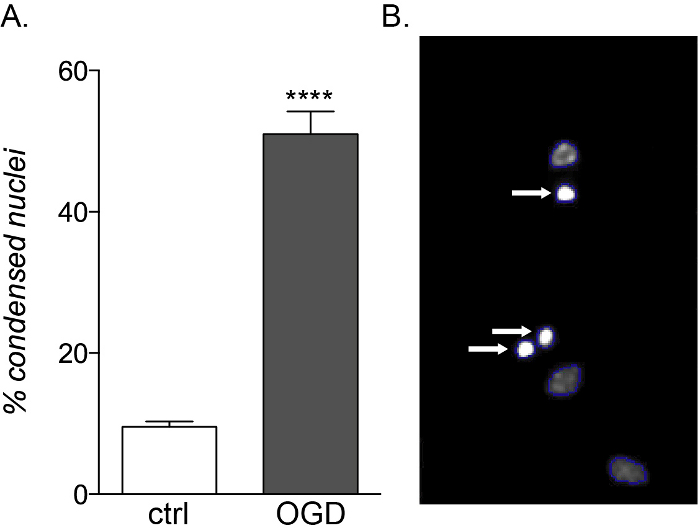
図5:胎児由来OPC培養に対するOGD曝露の期待される効果(A)対照(ctrl)およびOGD暴露培養における細胞ベースHCSによって定量された凝縮核の割合を示すグラフ。(B) 同定された凝縮核(白矢印)を強調するHCS処理された物体の代表的な画像。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 抗体 | 種 | 希釈 | |
| 抗β-III-チューブリン(研究開発システム) | 鼠 | 1:3000 | |
| 抗GFAP (ダコ) | 兎 | 1:1000 | |
| 抗NG2 (ミリポア) | 兎 | 1:350 | |
| 抗PDGFαR(サンタクルスバイオテクノロジー) | 兎 | 1:300 | |
| 抗CNPase(ミリポア) | 鼠 | 1:500 | |
| IgG2b抗APC、クローンCC1(カルバイオケム) | 鼠 | 1:100 | |
| アンチMBP(ダコ) | 兎 | 1:250 | |
| アンチネスチン(ミリポア) | 鼠 | 1:500 | |
| アレクサフルオール488コンジュゲートアンチマウス(サーモフィッシャーサイエンティフィック) | 驢馬 | 1:500 | |
| アレクサフルオール647コンジュゲートアンチマウスIgG2b(サーモフィッシャーサイエンティフィック) | 山羊 | 1:500 | |
| アレクサ568コンジュゲートアンチラビット(サーモフィッシャーサイエンティフィック) | 驢馬 | 1:500 | |
表1:一次抗体と二次抗体のリスト。
ディスカッション
髄鞘化/再髄化プロセスと脱髄事象の複雑な性質により、インビトロシステムの予測開発は非常に困難です。最も広く使用されているインビトロ薬物スクリーニングシステムは、主にヒト細胞株または一次純粋なOL培養物であり、より複雑な共培養またはorganotypicシステム15の使用が増加している。そのようなシステムが高いコンテンツ技術と結合されていても、純粋なOL培養はスクリーニングプラットフォーム16を開発する際の選択の方法であり続ける。
ここで説明する自発的混合培養は、生理学的T3媒介OPC分化、プロセスに対する病理学的干渉、他の細胞成分、および年齢関連の違いなど、すべての主要な変数を考慮に入れている有用なインビトロ系を表す。この手順には、細胞の起源(動物の年齢)と回転楕円体の形成と操作から派生する変数が数多く含まれています。実際、重要なステップは、組織からの分離後に播種するNSCの細胞密度であり、最適な状態では単一の球体が単一の増殖細胞から派生する必要があるためである。孤立したNSCは凝集する傾向があり、独自の分泌パラクリン因子が必要であることを見てきたので、t25またはt75フラスコの10〜50個のセル/μLの範囲に播種することは、細胞凝集を避けながらも、細胞が分泌因子によって通信することを可能にする最善の妥協点です。
この技術の主な制限は、機能的軸索筋伝達とニューロンとの直接の相互作用の欠如であり、この方法は成熟したOLの段階までOPC分化のみを考慮に入れるため、CNPase/MBP-double陽性細胞はクモの正形を有する。この目的のために、孤立した底根神経節上で培養されたプライマリOpCは依然として主要な方法論である17.しかし、これらの細胞をあらゆる年齢で動物と区別する可能性は、対象年齢から分離された細胞に対する化合物および有害刺激の試験を可能にするため、翻訳プロセスの基本的なポイントである。ここで述べたように、実際には、NSCは胎児と成人の脳の両方から隔離することができる。成人期の発達筋腫と再髄鞘は同じ目的を共有しているため、すなわち、ヌード軸索に到達し、ミエリン鞘を作り出すために、2つのプロセスがあらゆる面で同一であると仮定され、いわゆる要約仮説18を生成した。しかし、2つのプロセスが等しいとは考えることができず、細胞内組み込みの加齢に関連する差異が存在し、実験問題19に最も適したin vitroモデルを選択する際に考慮されるべきであることは明らかである。成人のNSC由来のOpPcは、実際には、有害な刺激14、20だけでなく、プライマリオプチ21、22に対する生理的TH駆動分化および脆弱性に強い違いを示す。また、成人組織におけるOPCおよびOL集団の不均一性もあり、病理学的状態23に対する特に関連性がある。成人組織からの一次性OpCc分離のためのプロトコルは24利用可能であり、実験的な質問が成人期の再髄鞘化に作用する分子に対処される場合に考慮されるべきである。
NPCとの差別化により、未分化前駆体から成熟したOLまで、分化プロセス全体のインビトロ表現が可能になります。このプロセスは、THがプロセスの主な原動力であるin vivo状態に似ており、特定の核受容体を介して作用し、この機構との実験的干渉を許容し、トランスレーショナルビュー13において病理学的状態を模倣する。
モデルの最終的な基本的な特徴は、文化全体を通してアストロサイトの絶え間ない存在です。これにより、培養の分析が困難になりますが、その複雑な細胞組成は明確な利点を構成します。アストロサイトが混合神経培養25 における有害事象に対する応答に寄与する方法が広く知られており、CNSのこの主成分がないことは、インビトロ系を予測しやすく、翻訳可能にする。一方、この特性に対して、NSC由来の培養物は単細胞系より均一性が低いという欠点があり、偏った分析を招く可能性がある。しかし、細胞ベースのHCS技術は、培養物全体および全ての細胞集団の分析を可能にし、分析のための代表的なフィールドのランダム化も除去する。実験に使用される細胞培養物が信頼性の高い播種品質であると仮定すると、HCSは実験条件の全体像を示し、統計的に堅牢なデータと多数の自動蛍光ベースの分析を生成します。
結論として、現在のプロトコルは、胎児および成人の脳からのNSC由来のOpPcの分離および分化のための手順を記述する。全体のプロトコルは、動物の年齢と実験目標に応じて、約30日かかります。特に、成体起源からの球形成は、同じ播種密度で胎児と比較して2倍の時間を要する可能性がある。分化誘導のための2D表面への播種後の15日(-3~12個のDIV)の時間は、全ての条件で一定の時間となる。完全なプロトコルは、複雑な細胞環境におけるTH媒介分化プロセス全体の研究、特定の病理学的メカニズム(すなわち、炎症性サイトカインおよびHI)を介した干渉、およびこれらの問題を克服することを目的とした新しい戦略の結果的なテストを可能にする。培養モデルとHCS技術の結合により、堅牢で翻訳可能なスクリーニングプラットフォームが生成されます。
開示事項
著者らは開示するものは何もない。
謝辞
MIURナショナルテクノロジークラスタープロジェクトIRMI(CTN01_00177_888744)、リージョンエミリア・ロマーニャ、Mat2Rep、POR-FESR 2014-2020によってサポートされています。
実験的な作品を主催してくれたIRET財団に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
参考文献
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved