Method Article
Скрининг с высоким содержанием скрининговой дифференцировки и анализа созревания культур клеток-предшественников олигодендроцитов, полученных из нервных стволовых клеток
В этой статье
Резюме
Описано производство смешанных культур астроцитов и клеток-предшественников олигодендроцитов, полученных из фетальных или взрослых нервных стволовых клеток, дифференцирующихся в зрелые олигодендроциты, и моделирование in vitro вредных раздражителей. Соединение с клеточной техникой скрининга с высоким содержанием создает надежную и надежную систему скрининга лекарств.
Аннотация
Основным препятствием в разработке методов скрининга лекарств для оценки эффективности терапевтических стратегий при сложных заболеваниях является достижение баланса между упрощением in vitro и воссозданием сложной среды in vivo, наряду с основной целью, общей для всех стратегий скрининга, получение надежных и надежных данных, высоко прогностических для трансляции in vivo.
В области демиелинизирующих заболеваний большинство стратегий скрининга лекарств основаны на увековеченных клеточных линиях или чистых культурах изолированных первичных клеток-предшественников олигодендроцитов (OPC) новорожденных животных, что приводит к сильным предубеждениям из-за отсутствия возрастных различий и любого реального патологического состояния или сложности.
Здесь мы показываем установку системы in vitro, направленной на моделирование физиологической дифференцировки/созревания OPC, полученных из нервных стволовых клеток (NSC), которыми легко манипулировать, чтобы имитировать патологические состояния, типичные для демиелинизирующих заболеваний. Кроме того, метод включает изоляцию от мозга плода и взрослого человека, давая систему, которая динамически дифференцируется от OPC к зрелым олигодендроцитам (OL) в спонтанной кокультуре, которая также включает астроциты. Эта модель физиологически напоминает опосредованную гормонами щитовидной железы миелинизацию и процесс восстановления миелина, что позволяет добавлять патологические интерференты, которые моделируют механизмы заболевания. Мы показываем, как имитировать два основных компонента демиелинизирующих заболеваний (т.е. гипоксию/ишемию и воспаление), воссоздавая их влияние на развитие миелинизации и восстановление миелина у взрослых и принимая во внимание все клеточные компоненты системы, уделяя особое внимание дифференциации OPC.
Эта спонтанная смешанная модель в сочетании с клеточными технологиями скрининга с высоким содержанием позволяет разработать надежную и надежную систему скрининга лекарств для терапевтических стратегий, направленных на борьбу с патологическими процессами, связанными с демиелинизацией, и на индуцирование ремиелинизации.
Введение
В центральной нервной системе (ЦНС) миелинообразующие клетки (олигодендроциты, ОЛС) и их предшественники (клетки-предшественники олигодендроцитов, ОПК) отвечают за развитие миелинизации, процесс, который происходит в пери- и послеродовой периоды, и за оборот и восстановление миелина (ремиелинизацию) во взросломвозрасте1. Эти клетки являются высокоспециализированными, взаимодействуя анатомически и функционально со всеми другими глиальными и нейронными компонентами, что делает их фундаментальной частью структуры и функции ЦНС.
Демиелинизирующие события участвуют в различных травмах и заболеваниях ЦНС2и в основном действуют на OPC и OL посредством многофакторных механизмов, как во время развития, так и во взрослой жизни. Недифференцированные предшественники обусловлены дифференцирующими факторами, главным образом гормоном щитовидной железы (TH), в синхронизированном процессе3, который заставляет OPC распознавать и реагировать на специфические стимулы, которые индуцируют пролиферацию, миграцию к немиелинизированному аксону и дифференцировку в зрелые OL, которые, в свою очередь, развивают миелиновую оболочку4. Все эти процессы тонко контролируются и происходят в сложной среде.
Из-за сложного характера событий миелинизации, ремиелинизации и демиелинизации существует большая потребность в упрощенном и надежном методе in vitro для изучения основных механизмов и разработки новых терапевтических стратегий, ориентированных на основного клеточного игрока: OPC5.
Чтобы система in vitro была надежной, необходимо учитывать ряд факторов: сложность клеточной среды, возрастные клеточные внутренние различия, физиологическая TH-опосредованная дифференциация, патологические механизмы и надежность данных6. Действительно, неудовлетворенная потребность в этой области является моделью, которая имитирует сложность состояния in vivo, не успешно достигнутую за счет использования изолированных чистых культур OPC. Кроме того, два основных компонента демиелинизирующих событий, воспаление и гипоксия / ишемия (HI), непосредственно связаны с другими клеточными компонентами, которые могут косвенно влиять на физиологическую дифференцировку и созревание OPC, аспект, который не может быть изучен в чрезмерно упрощенных моделях in vitro.
Начиная с высокопрогностической системы культуры, последующей и более общей задачей является получение надежных и надежных данных. В этом контексте клеточный скрининг с высоким содержанием (HCS) является наиболее подходящим методом7,поскольку наша цель состоит в том, чтобы, во-первых, проанализировать всю культуру в автоматическом рабочем процессе, избегая смещения выбора репрезентативных полей, и, во-вторых, получить автоматическую и одновременную генерацию данных с высоким содержанием изображений8.
Учитывая, что основная потребность заключается в достижении наилучшего баланса между упрощением in vitro и сложностью in vivo-mimicing, здесь мы представляем высоковоспроизводимый метод получения OPC, полученных из нервных стволовых клеток (NSC), выделенных из переднего мозга плода и взрослой субвентрикулярной зоны (SVZ). Эта модель in vitro охватывает весь процесс дифференцировки OPC, от мультипотентного NSC до зрелого / миелинизирующего OL, физиологическим TH-зависимым образом. Полученная культура представляет собой динамически дифференцирующуюся/созревающую систему, которая приводит к спонтанной кокультуре, состоящей в основном из дифференцированных OPC и астроцитов, с низким процентом нейронов. Эта первичная культура лучше имитирует сложную среду in vivo, в то время как ее получение стволовых клеток позволяет выполнять простые манипуляции для получения желаемого обогащения клеточной линии.
В отличие от других стратегий скрининга лекарств с использованием клеточных линий или чистых культур первичных OPC, описанный здесь метод позволяет изучать влияние патологических интерферентов или терапевтических молекул в сложной среде, не теряя фокуса на желаемом типе клеток. Описанный рабочий процесс HCS позволяет анализировать жизнеспособность клеток и спецификацию родословной, а также специфическую для линии клеточную гибель и морфологические параметры.
протокол
Все протоколы о животных, описанные в настоящем документе, были выполнены в соответствии с директивами Совета Европейского сообщества (86/609/EEC) и соответствуют руководящим принципам, опубликованным в Руководстве NIH по уходу за лабораторными животными и их использованию.
1. Растворы и реагенты
- Подготовьте стандартный носитель: DMEM/F12 GlutaMAX 1x; 8 ммоль/л HEPES; 100 ЕД/100 мкг Пенициллина/Стрептомицина (1% П/С); 1x B27; 1x Н-2.
- Подготовьте невросферную среду: добавьте 10 нг/мл bFGF; 10 нг/мл EGF к стандартной среде.
- Приготовить олигосферу/OPC-среду: добавить 10 нг/мл bFGF; 10 нг/мл PDGF-AA к стандартной среде.
- Готовят олигодендроктные дифференцировочные среды: добавляют 50 нМ Т3; 10 нг/мл CNTF; 1x N-ацетил-L-цистеин (NAC) до стандартной среды.
- Подготовьте буфер неферментативной диссоциации: добавьте 1% P/S к буферу неферментативной диссоциации и держите лед холодным.
- Приготовить раствор сахарозы: HBSS, 0,3 г/мл сахарозы.
- Приготовьте моющий раствор BSA: EBSS, 40 мг/мл BSA, 0,02 мл/л HEPES.
- Подготовьте ферментативный диссоциационный буфер: HBSS, 5,4 мг/мл D-глюкозы, 15 ммоль/л HEPES, 1,33 мг/мл трипсина, 0,7 мг/мл гиалуронидазы, 80 Ед/мл ДНКазы.
- Приготовьте смесь цитокинов: TGF-β1, TNF-α, IL-1β, IL-6, IL-17 и IFN-γ (по 20 нг/мл).
- Готовят цитокиновую смесь носителя: 0,04% от запаса (10% глицерина/100 нМ глицина/25 нМ триса, рН 7,3).
- Приготовьте кислородно-глюкозную депривационную среду: стандартную среду с использованием DMEM без глюкозы. В зависимости от жесткости желаемого состояния депривации глюкозы, можно также удалить B27 и / или N2 из среды, чтобы избежать соединений, связанных с глюкозой (например, D-галактозы в B27).
2. Рассечение и изоляция НСК
ПРИМЕЧАНИЕ: Фетальные и взрослые НСК были выделены из E13.5 переднего мозга плода или 2,5-месячной взрослой субвентрикулярной зоны (SVZ) в соответствии с протоколом Ahlenius и Kokaia9 с изменениями.
- Фетальные культуры НСК
ПРИМЕЧАНИЕ: Перед началом рассечения подготовьте 1,5 мл пробирок, содержащих по 150 мкл неферментативного диссоциативного буфера в каждой; очистите чашку Петри и добавьте холодный HBSS.- Соберите эмбрионы на E13,5 - 14,5 у беременных мышей и поместите в чашку Петри, содержащую холодный HBSS.
- Обезглавливайте эмбрионы с помощью щипцов.
- Поместите головки эмбрионов в чистую чашку Петри, содержащую ледяной PBS, и удалите кожу с черепа щипцами, используя увеличительные стекла или стереоскоп.
- Как только мозг будет виден и очищен от кожи, выдавите ее, оказывая давление по бокам щипцами.
- Удалить мозжечок, оставить только передний мозг и удалить мозговые оболочки щипцами.
- Поместите изолированную ткань в буфер неферментативной диссоциации и повторите этапы рассечения с другими эмбрионами. Вставьте ткань 2–3 животных в каждую трубку, содержащую буфер.
- Инкубировать при 37 °C в течение 15 мин при непрерывном встряхивании.
- После инкубации добавляют 850 мкл стандартной среды и перемешивают путем пипетки до тех пор, пока суспензия не освободится от сгустков.
- Если недиссоциированная ткань все еще видна, подождите 2 мин на RT, пока она не отпадет на дне трубки.
- Когда диссоциация завершена, подсчитайте клетки и поместите их в суспензию при плотности 10-50 клеток / мкл в колбе Т-25 или Т-45, содержащей 10-30 мл среды нейросферы, удерживаемой в вертикальном положении, чтобы избежать адгезии клеток.
-
Взрослые культуры НСК
- Жертвоприношение животных при вывихе шейки матки.
- Соберите мозг 4-5 мышей в трубку объемом 50 мл, содержащую ледяной HBSS.
- Поместите мозг на холодную стерильную поверхность. Для этого используйте колбу Т-25, наполненную водой и поставленную при -20 °C на ночь. Во время эксперимента накройте колбу стерильной алюминиевой фольгой.
- Поместите вентральную сторону мозга вниз, в ростро-каудальном направлении, и удалите обонятельные луковицы с помощью лезвия бритвы.
- Используя лезвие бритвы, вырежьте 2–3 корональных среза толщиной 1 мм, от коры до оптической хиазмы.
- Поместите ломтики на холодную поверхность в вентродорсальное положение и определите мозолистое тело и два боковых желудочка.
- С помощью увеличительных стекол или стереоскопа изолируйте стенки боковых желудочков, следя за тем, чтобы не переносить кусочки мозолистого тела.
- Поместите изолированную ткань в буфер ферментативной диссоциации (5–10 мл) и инкубируют при 37 °C в течение 15 мин.
- Перемешать раствор, пипетируя несколько раз (не менее 50), и снова инкубировать при 37 °С в течение 10 мин.
- Нейтрализуют трипсин путем добавления 5 мл стандартной питательной среды и фильтруют раствор с помощью фильтра 70 мкм.
- Центрифугируйте отфильтрованный раствор в течение 5 мин при 400 х г.
- Повторно суспендировать гранулы в растворе сахарозы и центрифуге в течение 10 мин при 500 х г.
- Повторно суспендировать гранулы в моющем растворе И центрифуге BSA в течение 7 мин при 400 х г.
- Повторно суспендируют гранулу в стандартной питательной среде, подсчитывают клетки и выполняют покрытие, как описано выше (на этапе 2.1.10).
3. Первичные невросферы
- Добавляйте факторы роста (bFGF/EGF) каждые 2 дня.
- Каждые 4–6 дней (в зависимости от плотности клеток) меняйте половину среды следующим образом:
- Переложите всю клеточную суспензию в трубку объемом 15 или 50 мл.
- Центрифуга в течение 5 мин при 400 х г.
- Удалите половину тома.
- Добавьте такое же количество свежей среды, аккуратно перемешайте путем пипетки и добавьте факторы роста.
4. Олигосферы
ПРИМЕЧАНИЕ: Дифференцировка олигодендроцитов выполняется в соответствии с протоколомЧен 10 с модификациями.
- Когда невросферы достигают диаметра 100–150 мкм, они готовы к прохождению. Для этого переложите всю клеточную суспензию в пробирку объемом 15 или 50 мл и центрифугу в течение 5 мин при 400 х г.
- Быстро оценивайте диаметр, делая снимки сфер с помощью инвертированного прозрачного светового микроскопа и открывая их с помощью программного обеспечения ImageJ.
- Щелкните меню Анализ и в окне Инструменты выберите Масштабная панель.
- Установите 150 мкм в качестве Ширины в микронах и сравните шкалу со сферами.
- Удалите весь объем путем инверсии и повторно суспендируйте гранулу в 180 мкл свежей стандартной питательной среды. Пипетка 50 раз, чтобы позволить дезагрегировать сферы.
- Добавьте 810 мкл свежей стандартной питательной среды, подсчитайте клетки и повторно разложите их, как описано для невросфер.
- Добавляйте bFGF/PDGF-AA 10 нг/мл каждые 2 дня.
- Каждые 4–6 дней (в зависимости от плотности клеток) меняйте половину среды следующим образом:
- Переложите всю клеточную суспензию в трубку объемом 15 или 50 мл.
- Центрифуга в течение 5 мин при 400 х г.
- Удалите половину тома.
- Добавьте такое же количество свежей среды, аккуратно перемешайте путем пипетки и добавьте факторы роста.
5. Покрытие пластин
- Поли-D, L-орнитин/ламининовое покрытие: не менее чем за 2 дня до нанесения покрытия ОПК добавляют 50 мкг/мл раствора поли-D,L-орнитина, разбавленного в ПБС, в каждую скважину (40 мкл/лунку для 96-луночных пластин) и инкубируют на РТ в течение ночи.
- На следующий день удалите жидкость и трижды промойте дистиллированной стерильной водой.
- Дайте пластинам высохнуть в RT в течение ночи. На следующий день добавляют раствор ламинина, разведенный в ПБС (5 мкг/мл; 40 мкл/лунка для 96-луночных пластин) и инкубируют в течение 2 ч при 37°С.
6. Посев клеток
- Когда олигосферы достигают диаметра 100–150 мкм, они готовы к диссоциации и посеву на пластины с поли-D, L-орнитиновым/ламининовым покрытием. Для этого перенесите всю клеточную суспензию в трубку объемом 15 или 50 мл и центрифугу в течение 5 мин при 400 х г (как указано на этапе 4.1).
- Удалите весь объем путем инверсии и повторно суспендируйте гранулу в 180 мкл свежей стандартной питательной среды. Пипетка 50 раз, чтобы позволить дезагрегировать сферы.
- Добавьте 810 мкл свежей стандартной питательной среды и подсчитайте клетки.
- Извлеките раствор ламинина из скважин и обложите ячейки плотностью 3000 клеток/см2 (100 мкл/лунка для плит с 96 скважинами).
7. Индукция дифференциации OPC
- Через 3 дня удалить всю среду и добавить такой же объем среды дифференцировки олигодендроцитов.
- Меняйте половину среды каждые 4 дня и добавляйте свежую дифференцированную смесь (T3 / CNTF / NAC) каждые 2 дня.
8. Индукция блока опосредованной воспалением дифференцировки
- После диссоциации нейросферы и производства олигосферы (раздел 4) добавляют цитокиновую смесь в культуральную среду и сохраняют олигосферы, подвергающиеся воздействию цитокинов, на протяжении всего этапа формирования сфер.
ПРИМЕЧАНИЕ: Объем зависит от количества клеток, так как для сфер, образующих клетки, засеиваются на 10–50 клеток/мкл. - Если среда нуждается в изменении, измените весь объем и добавьте смесь цитокинов еще раз.
9. Индукция кислородно-глюкозной депривации гибели клеток
- При -1 DIV (через 2 дня после посева клеток в многоязычные пластины) удалите среду и сохраните ее в новой многоязычной пластине.
- Добавьте половину объема (50 мкл для плит с 96 скважинами) среды OGD (группа OGD) или свежей среды (контрольная группа). Половинное количество объема используется для уменьшения обмена кислорода между жидкостью и воздухом.
- Поместите групповые культуры OGD в герметичную камеру гипоксии, насыщенную 95%N2 и 5% CO2. Для достижения насыщения камеры дайте газовой смеси течь в течение 6 мин при 25 л/мин перед закрытием труб камеры.
- Инкубируют гипоксическую камеру в инкубаторе в течение 3 ч. Контрольную группу и пластины, содержащие среду, удаленную и сохраненную на стадии 9.1, также следует оставить в инкубаторе.
- Удалите не содержащую глюкозы (группа OGD) или новую среду (контрольная группа) и добавьте среду, удаленную и сохраненную на стадии 9.1.
10. Иммуноцитохимия
- В нужный момент времени зафиксируйте клетки холодным 4% параформальдегидом в течение 20 мин при РТ.
- Дважды промыть PBS (10 мин инкубации для каждой промывки при RT).
- Инкубировать 1 ч на RT с блокирующим раствором (PBS Triton 0,3%, содержащий 1% BSA и 1% ослиную/козью нормальную сыворотку).
- Инкубат со смесью первичных антител(таблица 1),разведенный в тритоне PBS 0,3%, на ночь при 4 °C.
- Дважды промыть PBS (10 мин инкубации для каждой промывки при RT).
- Инкубат с вторичным антителом(таблица 1)раствором разводят в тритоне PBS 0,3%, добавляя Hoechst 33258 в течение 30 мин при 37 °C.
- Дважды промыть PBS (10 мин инкубации для каждой промывки при RT).
11. HCS-анализ жизнеспособности клеток, состава линии и гибели клеток, специфичных для линии
ПРИМЕЧАНИЕ: Репрезентативные изображения HCS и рабочий процесс показаны на рисунке 2A, B.
- Выберите алгоритм анализа компартментов в главном меню программного обеспечения (HCS Studio v6.6.0) и выберите Сканировать в главном меню Разработка анализа/Сканирующей пластины.
- В окне iDev выберите Создать, а затем выберите Инструмент измерения общей интенсивности в шаблоне Разработка анализа.
- Нажмите «Создать» в правой части меню, выбрав цель 10x.
- Откроется меню Настройка получения. В этом окне выберите следующие параметры: (a) количество каналов: первый для ядерного окрашивания Hoechst (BGRFR_386) и один для каждого маркера, специфичного для линии, используемого в реакции, (b) выберите программный фокус на канале 1 и интервал автофокусировки как 1 (c) выберите модель пластины из списка.
- В меню сбора посмотрите на качество окрашивания в разных скважинах и на разных полях и вручную выберите время экспозиции, выбрав Фиксированное время экспозиции в меню.
- После установки параметров закупок выберите Mini Scan в верхней части меню и выберите десять полей на скважину в двух скважинах на экспериментальное состояние. Это позволит настроить все параметры анализа в подмножестве полей для всей пластины.
- Когда мини-сканирование будет завершено, нажмите на параметр Configure Assay Parameter (Настроить параметр анализа), чтобы настроить алгоритм анализа.
- Нажмите «Настроить группы» в правой части окна и перетащите колодцы минискана. Нажмите кнопку Добавить в подразделе Группы, чтобы настроить различные группы.
- Следуйте рабочему процессу в левой части окна шаг за шагом, чтобы разработать весь алгоритм. Сначала выберите «Образ обработки» для каждого канала и нажмите «Удаление фона» и на нужном уровне.
- Сначала идентифицируйте и выбирайте ядра путем ядерного окрашивания. Нажмите «Идентифицировать первичный объект — канал 1», чтобы выбрать реальные ядра и избежать анализа артефактов и обломков. Для этого увеличьте репрезентативную картину ядерного окрашивания и проверьте, хорошо ли ядра окружены периметром, построенным программным обеспечением. Можно изменить пороговое значение и применить алгоритмы сегментации для лучшей идентификации отдельных ядер.
- После того, как ядра определены правильно, нажмите на следующий шаг: Проверка основного объекта. Выберите Object.BorderObject.Ch1, чтобы избежать анализа ядер на границе каждого изображения поля. Выберите Object.Area.Ch1 и, переместив «низкую» и «высокую» полосы на гистограммах, удалите все идентифицированные обломки или крупные объекты, соответствующие агрегатам или артефактам.
- Проверьте все репрезентативные изображения мини-сканирования всех экспериментальных условий, чтобы убедиться, что выбранные параметры соответствуют всем из них.
- Нажмите «Определить пятна» для каждого канала, соответствующего определенным маркерам линии, и выберите значения Ring: Width = 3 и Distance = 0. Это позволит идентифицировать цитоплазматическую флуоресценцию. В зависимости от плотности клеток эти значения могут быть адаптированы. Программа автоматически избежит перекрытия между соседними кольцами.
- Выберите Ссылочные уровни в рабочем процессе, чтобы построить анализ. Установка опорных уровней позволит автоматически подсчитывать конденсированные ядра на основе размера ядра и интенсивности ядерного окрашивания, а также конкретных маркер-положительных клеток на основе цитоплазматической флуоресценции, идентифицированной Кольцом.
- Сначала нажмите на Object.Area.Ch1. На изображениях мини-сканирования выберите конденсированное ядро и переместите полосу «LOW» на гистограммах, чтобы выбрать как «конденсированные» все ядра под этим размером.
- Щелкните Object.AvgIntensity.Ch1. На изображениях мини-сканирования выберите конденсированное ядро и переместите полосу «HIGH» на гистограммах, чтобы выбрать как «конденсированные» все ядра выше этой интенсивности флуоресценции.
- Нажмите на Object.RingAvgIntensity для каждого канала маркеров линии. Выберите в своих мини-сканирующих изображениях положительную ячейку и переместите полосу «HIGH» на гистограммах, чтобы выбрать как «положительные» все клетки выше этой интенсивности флуоресценции.
- Проверьте все репрезентативные изображения мини-сканирования всех экспериментальных условий, чтобы убедиться, что выбранные параметры соответствуют всем из них.
- В верхнем меню выберите Характеристика популяции и выберите Подпополнение событий.
- В качестве события типа 1 выберите ObjectAreaCh1 в левом списке, затем нажмите кнопку AND > и, наконец, выберите ObjectAvgIntensityCh1. Это позволит идентифицировать конденсированные ядра, как сочетание низкой площади и высокой интенсивности.
- В том же окне снимите флажок Все ограничения сканирования.
- Нажмите «Выбрать функции для хранения» в верхнем меню, чтобы выбрать параметры для сохранения в анализе.
- Выберите Well Features и переместите из левого списка вправо только нужные параметры: (a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (Для каждого канала определенных маркеров родословной).
ПРИМЕЧАНИЕ: Этот анализ даст в качестве считывания общее количество клеток, процент конденсированных ядер и процент специфических для линии положительных клеток для каждого анализируемого маркера на общее число клеток. Если процент различных линий нужен только на живых клетках, можно ли либо сохранить значение «High_RingAvgIntensity» для канала (абсолютное число положительных клеток), так и пересчитать процент от общего числа клеток после вычитания процента мертвых клеток.- Альтернативно, можно удалить мертвые клетки из анализа, установив те же параметры, которые используются для идентификации конденсированных ядер (шаги 11.14–11.15) при валидации ядер (шаг 11.11).
- Выберите Scan Plate в главном верхнем меню и нажмите на символ пластины в подменю Scan Setting в верхней части, чтобы определить скважину для анализа.
- Напишите название эксперимента и описание и, как только все настройки будут завершены, нажмите символ воспроизведения.
Результаты
Первая фаза культуры может варьироваться по продолжительности, в зависимости от плотности посева и от того, имеют ли сферы фетального или взрослого происхождения. Кроме того, олигосферы демонстрируют снижение удвоения популяции по сравнению с невросферами(рисунок 1B). Кроме того, производство сфер из взрослой ткани происходит медленнее, и для создания олигосфер может потребоваться 2-3 недели по сравнению с плодом, что может занять 1-2 недели, в зависимости от плотности посева.
После посева вся фаза дифференцировки культур может контролироваться с использованием специфических для линии антител. Поскольку целью данного протокола является изучение заключительной фазы дифференциации, состав культуры при 0 DIV не представлен. Однако во время первой фазы культивирования клетки будут по-прежнему нестино-положительными, представляя собой нейронные предшественники, и большинство клеток также являются NG2-положительными (OPCs)11. CNPase-положительные клетки, соответствующие стадии preOL, будут обнаруживаться через 3-6 дней после Т3-опосредованной индукции дифференцировки, в то время как MBP-положительные клетки будут появляться между 6 и 12 DIV (зрелыми OL; см. Рисунок 2C для состава культур в конце фазы дифференцировки).
Анализ HCS позволяет обнаружить каждую отдельную клетку в культуре посредством ядерного окрашивания и анализа интенсивности флуоресценции в остальных каналах(рисунок 2A,B). Состав культуры в конце фазы дифференцировки (12 DIV) различается в зависимости от того, имеют ли культуры фетального или взрослого происхождения, причем фетальные культуры более чувствительны к Т3-опосредованной дифференциации и достигают более высокого процента зрелыхОЛ 12.
На протяжении всего процесса культивирования около 40-50% клеток являются астроцитами (GFAP-положительными клетками), в то время как небольшой процент (менее 0%-10%) являются нейронами (бета-III-тубулин-положительные клетки; Рисунок 2C). Состав культуры может варьироваться на 10% между различными препаратами культуры. Взрослые и фетальные культуры различаются по выходу зрелой продукции ОЛ в конце фазы дифференцировки, причем клетки плода показывают высокий процент зрелых ОЛ, низкий процент предшественников и около 30-40% астроцитов. С другой стороны, взрослые культуры имеют больше астроцитов (около 45-55%) и менее дифференцированные клетки после 12 DIV дифференцировки индукции.
Чтобы программное обеспечение могло распознавать клетки и обеспечивать надлежащий непредвзятый анализ состава культуры, важно, чтобы плотность посева была правильной, избегая перекрытия между соседними клетками. Когда ОПК, полученные из NSC, засеиваются с высокой плотностью, они, как правило, накапливаются очень быстро, что приводит к тому, что вся поверхность колодца занята астроцитами через несколько дней. Более того, зрелые ОЛ с их характерной формой паутины не будут видны из-за ограниченного пространства(рисунок 3A,B).
Блок дифференцировки, опосредованный воспалением, воспроизводится с помощью этого анализа in vitro и генерирует сильное снижение преОЛ и зрелых ОЛ, обнаруженных окрашиванием CNPase и MBP как в фетальной, так и во взрослой культурах. Увеличение числа OPC также происходит в культурах взрослых(рисунок 4A,B). Композиция смеси цитокинов была выбрана из экспериментов in vivo на крысиной модели рассеянного склероза13и была протестирована в качестве модели in vitro для блока дифференцировки, опосредованной воспалением, происходящей при этом заболевании.
В то время как фетальные и взрослые OPC демонстрируют одинаковую уязвимость к воздействию воспалительных цитокинов, только культуры, полученные из плода, чувствительны к токсичности OGD(рисунок 5A, B),показывая увеличение гибели клеток и нарушения дифференцировки из-за их различного метаболического профиля14.

Рисунок 1: Настройка и протокол дифференцировки культуры клеток-предшественников олигодендроцитов, полученных из нервных стволовых клеток. (А) Схема экспериментальной процедуры. (B)Репрезентативные изображения невросфер на 2, 5 и 7 DIV и график, показывающий удвоение популяции невросфер и олигосфер. Шкала: 100 мкм.(C)Репрезентативные изображения засеянных ОПК, полученных из олигосферы, показывающие различные стадии дифференцировки, от гнездиновой и NG2-положительной клеток при 0 DIV (нейронный предшественник / OPCs), через CNPase-положительные клетки при 6 DIV (preOL) и CNPase / MBP двойные положительные клетки в конце фазы дифференцировки (12 DIV; зрелые OG). GFAP-положительные клетки (астроциты) и небольшой процент бета-III-тубулин-положительных клеток (нейронов) присутствуют во всей культуре. Шкала: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
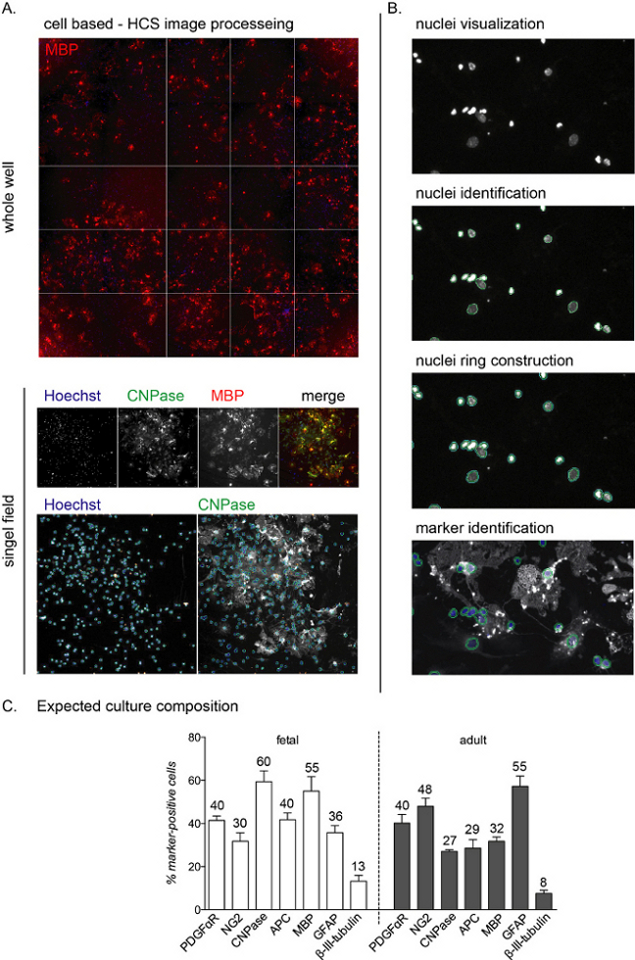
Рисунок 2: Рабочие процессы анализа скрининга высокого содержания на основе ячеек и ожидаемое считывание дифференциации. (A)Репрезентативные изображения получения HCS целой скважины (плита из 96 скважин) и изолированного отдельного месторождения, полученного с 10-кратной целью культуры 12 DIV ОПК, полученных из NSC. (B)Этапы рабочего процесса анализа HCS, включая визуализацию ядер (объектов), идентификацию и построение кольца ядер для идентификации цитоплазматического окрашивания и идентификации маркеров. (C)График, показывающий ожидаемый состав культуры в конце фазы дифференцировки (12 DIV). Маркеры для OPCs (PDGFαR, NG2), преОЛ (CNPase, APC), зрелых OL (MBP), астроцитов (GFAP) и нейронов (β-III-тубулин) показаны как для фетальной, так и для взрослой культуры. Округленные проценты для каждой ячейки маркеров включены в график, обратите внимание, что это репрезентативный эксперимент и проценты могут отличаться примерно на 5-10%. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
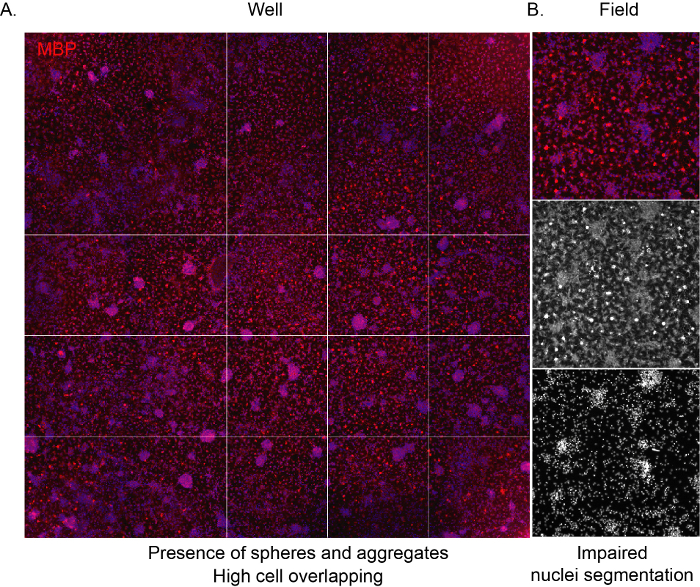
Рисунок 3: Репрезентативные изображения с высоким содержанием скрининга культуры высокой плотности. (A)Репрезентативное изображение скважины (96-луночная пластина), полученное 10-кратным объективом и отмеченное для экспрессии MBP в конце фазы дифференциации (12 DIV). (B) Репрезентативное извлеченное полевое изображение, подчеркивающее наличие агрегированных клеток и перекрывающихся ядер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
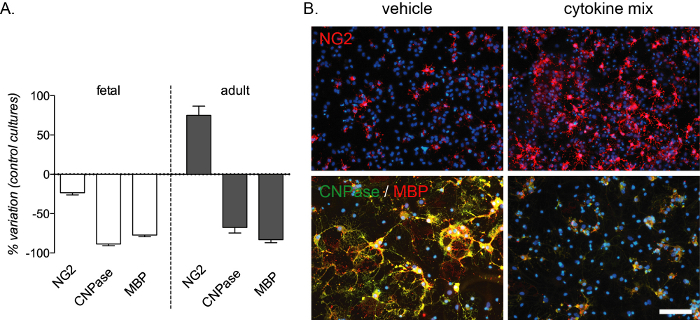
Рисунок 4: Ожидаемое влияние лечения цитокинами на культуры OPC плода и взрослого происхождения. (A)График, показывающий процент вариаций культур OPC плодного и взрослого происхождения по сравнению со стандартными культурами, включая количественную оценку OPC (NG2), преОЛ (CNPase) и зрелых OG (MBP) в конце фазы дифференцировки (12 DIV). (B)Репрезентативные изображения взрослых культур в конце фазы дифференцировки (12 DIV), обработанные смесью носителей или цитокинов и маркированные для NG2 или CNPase/MBP. Шкала: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
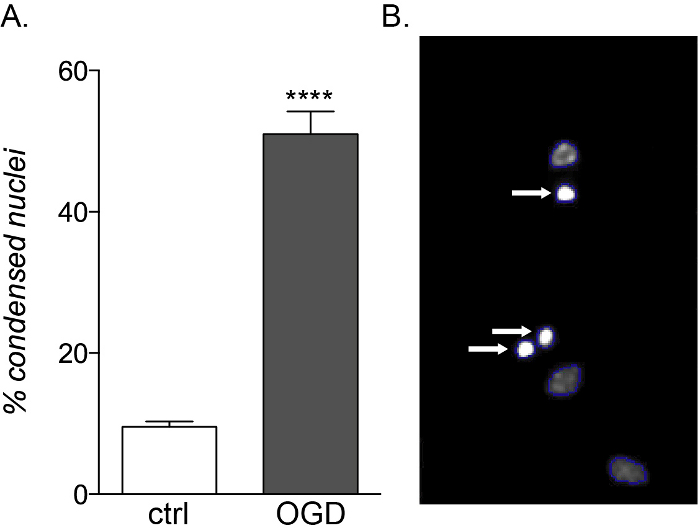
Рисунок 5: Ожидаемое влияние воздействия OGD на фетальные культуры OPC. (A)График, показывающий процент конденсированных ядер, количественно определенных клеточными HCS в контрольных (ctrl) и OGD-экспонированных культурах. (B)Репрезентативные изображения объектов, обработанных HCS, с выделением идентифицированных конденсированных ядер (белые стрелки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Антитело | Вид | Разбавление | |
| анти-β-III-тубулин (система ИССЛЕДОВАНИЙ и разработок) | мышь | 1:3000 | |
| анти-GFAP (Дако) | кролик | 1:1000 | |
| анти-NG2 (Миллипор) | кролик | 1:350 | |
| анти-PDGFαR (Биотехнология Санта-Крус) | кролик | 1:300 | |
| анти-CNPase (Millipore) | мышь | 1:500 | |
| IgG2b анти-APC, клон CC1 (Calbiochem) | мышь | 1:100 | |
| Анти-MBP (Дако) | кролик | 1:250 | |
| Анти-нестин (Миллипор) | мышь | 1:500 | |
| Alexa Fluor 488-сопряженная антимышка (ThermoFisher Scientific) | осел | 1:500 | |
| Alexa Fluor 647-конъюгированный антимышечный IgG2b (ThermoFisher Scientific) | коза | 1:500 | |
| Alexa 568-сопряженный анти-кролик (ThermoFisher Scientific) | осел | 1:500 | |
Таблица 1: Перечень первичных и вторичных антител.
Обсуждение
Сложный характер процессов миелинизации/ремиелинизации и демиелинизирующих событий делает разработку прогностических систем in vitro чрезвычайно сложной. Наиболее широко используемыми системами скрининга лекарственных средств in vitro являются в основном клеточные линии человека или первичные чистые OL-культуры, с все более широким использованием более сложных кокультур или органотипических систем15. Даже если такие системы сочетаются с технологиями с высоким содержанием, чистые OL-культуры остаются методом выбора при разработке скрининговых платформ16.
Спонтанная смешанная культура, описанная здесь, представляет собой полезную систему in vitro, которая учитывает все основные переменные: физиологическую Т3-опосредованную дифференциацию OPC, патологические интерференты в процессе, другие клеточные компоненты и возрастные различия. Процедура содержит ряд переменных, вытекающих из происхождения клеток (возраст животного) и образования сфероидов и манипуляций. Фактически, критическим этапом является плотность клеток посева НСК после выделения из ткани, поскольку в оптимальном состоянии одна сфера должна происходить от одной пролиферирующей клетки. Поскольку мы видели, что изолированные НСК имеют тенденцию к агрегации и что им нужны свои собственные секретируемые паракринные факторы, посев их в диапазоне 10-50 клеток / мкл, в колбу t25 или t75, является лучшим компромиссом, чтобы избежать агрегации клеток, но все же позволяет клеткам общаться с помощью секретирующих факторов.
Основными ограничениями методики является отсутствие функциональной аксональной миелинизации и прямого взаимодействия с нейронами, так как метод учитывает только дифференцировку OPC до стадии зрелых ОЛ: CNPase/MBP-двойные положительные клетки с морфологией паутинной сети. Для этой цели первичные OPC, культивируемые на изолированных дорсальных корневых ганглиях, по-прежнему являются основной методологией17. Однако возможность дифференцировать эти клетки от животных в любом возрасте является основополагающим моментом в трансляционном процессе, поскольку позволяет тестировать соединения и вредные раздражители на клетках, выделенных из интересующего возраста. Как описано здесь, на самом деле НСК могут быть изолированы как от мозга плода, так и от мозга взрослого человека. Поскольку миелинизация развития и ремиелинизация во взрослом возрасте имеют одну и ту же цель, то есть достичь обнаженного аксона и создать миелиновую оболочку, первоначально было выдвинуто предположение, что эти два процесса идентичны во всех аспектах, порождая так называемую гипотезу рекапитуляции18. Однако теперь ясно, что эти два процесса не могут считаться равными и что клеточные возрастные различия присутствуют и должны быть приняты во внимание при выборе наиболее подходящей модели in vitro для экспериментального вопроса19. Взрослые ОПК, полученные из НСК, фактически, демонстрируют сильные различия в физиологической дифференциации, обусловленной ТГ, и уязвимости к вредным раздражителям14,20, а также первичным ОПК21,22. Существует также неоднородность популяции ОПК и ОЛ во взрослых тканях, что особенно актуально для патологических состояний23. Протоколы выделения первичных ОПК из тканей взрослых доступны24 и должны рассматриваться при рассмотрении экспериментального вопроса о молекулах, действующих на ремиелинизацию во взрослом возрасте.
Дифференциация OPC от НСК позволяет in vitro представлять весь процесс дифференциации, от недифференцированного предшественника до зрелого OL. Этот процесс напоминает состояние in vivo, где TH является основным драйвером процесса, действующим через специфические ядерные рецепторы, и это позволяет экспериментальному вмешательству в этот механизм имитировать патологические состояния в трансляционном представлении13.
Конечной фундаментальной характеристикой модели является постоянное присутствие астроцитов на протяжении всей культуры. Хотя это затрудняет анализ культуры, ее сложный клеточный состав представляет собой явное преимущество. Способ, которым астроциты способствуют реакции на вредные события в смешанных нейронных культурах25, широко известен, и отсутствие этого основного компонента ЦНС делает систему in vitro плохо предсказуемой и транслируемой. С другой стороны, для этой характеристики культуры, полученные из NSC, имеют недостаток в том, что они менее однородны, чем системы одноклеточного типа, и это может привести к предвзятому анализу. Тем не менее, клеточный метод HCS позволяет анализировать всю культуру и все клеточные популяции, удаляя также рандомизацию репрезентативных полей для анализа. Предполагая, что клеточная культура, используемая для эксперимента, имеет надежное качество посева, HCS даст полную картину экспериментальных условий, генерируя статистически надежные данные и ряд автоматических флуоресцентных анализов.
В заключение, текущий протокол описывает процедуру выделения и дифференциации ОПК, полученных из НСК, из мозга плода и взрослого человека. Весь протокол занимает около 30 дней, в зависимости от возраста животных и целей эксперимента. В частности, формирование сфер взрослого происхождения может занимать вдвое больше времени по сравнению с фетальными, при той же плотности посева. Время 15 дней (от -3 до 12 DIV) после посева на 2D-поверхности для индукции дифференцировки является, однако, фиксированным временем во всех условиях. Полный протокол позволяет изучать весь процесс дифференцировки TH-опосредованной в сложной клеточной среде, интерференцию через конкретные патологические механизмы (т.е. воспалительные цитокины и HI) и последующее тестирование новых стратегий, направленных на преодоление этих проблем. Соединение модели культуры с техникой HCS создает надежную и переводимую платформу скрининга.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
При поддержке проекта MIUR National Technology Clusters project IRMI (CTN01_00177_888744) и Regione Emilia-Romagna, Mat2Rep, POR-FESR 2014-2020.
Отдельное спасибо Фонду IRET за проведение экспериментальной работы.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
Ссылки
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены