Method Article
胎儿和成体神经干细胞衍生少突胶质细胞前体细胞培养物的高内涵筛选分化与成熟分析
摘要
我们描述了星形胶质细胞和少突胶质细胞前体细胞的混合培养物的产生,这些细胞来自胎儿或成体神经干细胞,分化成成熟的少突胶质细胞,以及有毒刺激的体外建模。与基于细胞的高内涵筛选技术相结合,构建了一个可靠而强大的药物筛选系统。
摘要
开发用于评估复杂疾病治疗策略有效性的药物筛选技术的主要障碍是在体外简化和重建复杂的体内环境之间取得平衡,以及所有筛选策略共享的主要目标,即获得强大而可靠的数据,高度预测体内翻译。
在脱髓鞘疾病领域,大多数药物筛选策略都是基于永生化细胞系或从新生动物中分离的原代少突胶质细胞前体细胞(OPCs)的纯培养物,由于缺乏与年龄相关的差异以及任何真实的病理状况或复杂性,导致强烈的偏见。
在这里,我们展示了一个体外系统的设置,旨在模拟神经干细胞(NSC)衍生的OPCs的生理分化/成熟,易于操纵以模仿脱髓鞘疾病的典型病理状况。此外,该方法包括从胎儿和成人大脑中分离出来,从而在自发共培养物(也包括星形胶质细胞)中提供从OPC动态区分到成熟少突胶质细胞(OL)的系统。该模型在生理上类似于甲状腺激素介导的髓鞘形成和髓鞘修复过程,允许添加模拟疾病机制的病理干扰物。我们展示了如何模仿脱髓鞘疾病的两个主要成分(即缺氧/缺血和炎症),重现它们对发育性髓鞘形成和成人髓鞘修复的影响,并在整个过程中考虑系统的所有细胞成分,同时专注于分化OPCs。
这种自发的混合模型,加上基于细胞的高内涵筛选技术,可以开发一种强大而可靠的药物筛选系统,用于治疗策略,旨在对抗脱髓鞘和诱导髓鞘再生所涉及的病理过程。
引言
在中枢神经系统(CNS)中,髓鞘形成细胞(少突胶质细胞,OLs)及其前体(少突胶质细胞前体细胞,OPCs)负责发育髓鞘形成,该过程发生在围产期和产后期间,以及成年期髓鞘周转和修复(髓鞘再生)1。这些细胞是高度专业化的,在解剖学和功能上与所有其他神经胶质和神经元成分相互作用,使它们成为CNS结构和功能的基本组成部分。
脱髓鞘事件涉及不同的中枢神经系统损伤和疾病2,并且主要通过多因素机制作用于OPC和OL,无论是在发育过程中还是成年期。未分化的前体由分化因子驱动,主要是甲状腺激素(TH),在同步过程3 中,这导致OPC识别并响应诱导增殖的特定刺激,迁移到非髓鞘轴突,并分化成成熟的OL,从而发展髓鞘4。所有这些过程都经过精心控制,并在复杂的环境中发生。
由于髓鞘形成,髓鞘再生和脱髓鞘事件的复杂性质,因此非常需要一种简化可靠的体外方法来研究潜在的机制并开发新的治疗策略,重点关注主要细胞参与者:OPC5。
为了使体外系统可靠,需要考虑许多因素:细胞环境的复杂性,与年龄相关的细胞内在差异,生理TH介导的分化,病理机制以及数据的鲁棒性6。事实上,该领域未满足的需求是模仿体内条件复杂性的模型,而不是通过使用分离的纯OPC培养物成功实现的。此外,脱髓鞘事件的两个主要成分,炎症和缺氧/缺血(HI),直接涉及可能间接影响OPCs生理分化和成熟的其他细胞成分,这是过度简化的体外模型无法研究的一个方面。
从高度预测的培养系统开始,随后和更普遍的挑战是产生强大而可靠的数据。在这种情况下,基于细胞的高内涵筛选(HCS)是最合适的技术7,因为我们的目标首先是在自动工作流程中分析整个培养物,避免选择代表性领域的偏见,其次是获得基于成像的高内涵数据的自动和同步生成8。
鉴于主要需求是实现体外简化和体内模拟复杂性之间的最佳平衡,这里我们提出了一种高度可重复的方法,用于获得来自从胎儿前脑和成人心室下区(SVZ)分离的神经干细胞(NSC)衍生的OPCs。这种体外模型以生理TH依赖性方式涵盖了从多能NSC到成熟/髓鞘OL的整个OPC分化过程。所得培养物是一个动态分化/成熟的系统,其产生自发共培养物,主要由分化的OPC和星形胶质细胞组成,神经元百分比较低。这种原代培养物更好地模仿了复杂的体内环境,而其干细胞衍生允许进行简单的操作以获得所需的细胞谱系富集。
与使用细胞系或原代OPCs纯培养物的其他药物筛选策略相反,这里描述的方法允许研究复杂环境中病理干扰物或治疗分子的作用,而不会失去对所需细胞类型的关注。所描述的HCS工作流程允许分析细胞活力和谱系规格,以及谱系特异性细胞死亡和形态学参数。
研究方案
本文中描述的所有动物方案均根据欧洲共同体理事会指令(86/609 / EEC)进行,并符合 NIH实验室动物护理和使用指南中发布的指南。
1. 溶液和试剂
- 制备标准培养基:DMEM/F12 GlutaMAX 1x;8毫摩尔/升肝素;100 U / 100μg青霉素/链霉素(1%P / S);1x B27;1x N-2。
- 准备神经球培养基:加入10 ng / mL bFGF;10 ng/mL EGF 至标准培养基。
- 制备寡球/OPC培养基:加入10纳克/毫升bFGF;10 ng/mL PDGF-AA 至标准培养基。
- 制备少突霉分化培养基:加入50 nM T3;10 纳克/毫升 CNTF;1x N-乙酰基-L-半胱氨酸(NAC)至标准培养基。
- 制备非酶解解缓冲液:在非酶解解缓冲液中加入1%P/ S并保持冰冷。
- 制备蔗糖溶液:HBSS,0.3 g / mL蔗糖。
- 准备生物链氨基酸洗涤液:EBSS,40毫克/毫升生物链氨基酸,0.02毫升/升HEPES。
- 制备酶解解缓冲液:HBSS,5.4 mg / mL D-葡萄糖,15 mmol / L HEPES,1.33 mg / mL胰蛋白酶,0.7 mg / mL透明质酸酶,80 U / mL DNase。
- 制备细胞因子混合物:TGF-β1,TNF-α,IL-1β,IL-6,IL-17和IFN-γ(每个20ng / mL)。
- 制备细胞因子混合载体:储备的0.04%(10%甘油/ 100nM甘氨酸/ 25 nM Tris,pH 7.3)。
- 制备缺氧葡萄糖培养基:使用不含葡萄糖的DMEM的标准培养基。根据所需葡萄糖剥夺条件的严重程度,还可以从培养基中除去B27和/或N2,以避免葡萄糖相关化合物(例如,B27中的D-半乳糖)。
2. 解剖和NSC分离
注意:胎儿和成年NSCs从E13.5胎儿前脑或2.5个月大的成人心室下区(SVZ)中分离出来,遵循Ahlenius和Kokaia方案9 并进行了修改。
- 胎儿 NSC 培养
注意:在开始解剖之前,准备1.5mL试管,每个试管含有150μL非酶解离缓冲液;清洁培养皿,加入冰冷的哈佛商学院。- 从定时怀孕的小鼠中收集E13.5 - 14.5的胚胎,并放入含有冷HBSS的培养皿中。
- 使用镊子斩首胚胎。
- 将胚胎的头部放在含有冰冷PBS的干净培养皿中,并使用放大镜或立体镜用镊子将皮肤从颅骨上取出。
- 一旦大脑可见并清除了皮肤,用镊子在两侧施加压力将其挤出。
- 切除小脑,只保留前脑,用镊子切除脑膜。
- 将分离的组织置于非酶解离缓冲液中,并与其他胚胎重复解剖步骤。将2-3只动物的组织插入含有缓冲液的每个管中。
- 在连续振荡下在37°C孵育15分钟。
- 孵育后,加入850μL标准培养基并通过移液混合,直到悬浮液没有团块。
- 如果未解离的组织仍然可见,则在室温下等待2分钟,直到它沉积在管的底部。
- 当解离完成时,计数细胞并以10-50个细胞/ μL的密度将其悬浮在含有10-30mL神经球培养基的T-25或T-45烧瓶中,保持垂直位置以避免细胞粘附。
-
成人 NSC 培养
- 通过颈椎脱位献祭动物。
- 将4-5只小鼠的大脑收集在含有冰冷HBSS的50 mL管中。
- 将大脑放在冰冷的无菌表面上。为此,使用装满水并在-20°C下放置过夜的T-25烧瓶。在实验时,用无菌铝箔盖住烧瓶。
- 将脑腹侧向下放置,朝下,朝尾方向,然后用剃须刀片取出嗅球。
- 使用剃须刀片,从皮层到光学视交叉切割2-3个1毫米厚的冠状切片。
- 将切片放在腹背位置的冷表面上,并识别胼胝体和两个侧心室。
- 使用放大镜或立体镜,隔离侧脑室壁,注意不要携带胼胝体碎片。
- 将分离的组织置于酶解解缓冲液(5-10mL)中,并在37°C下孵育15分钟。
- 混合溶液,移液几次(至少50次),然后在37°C下再次孵育10分钟。
- 通过加入5mL标准培养基中和胰蛋白酶,并使用70μm过滤器过滤溶液。
- 将过滤后的溶液在400×g下离心5分钟。
- 将沉淀重悬于蔗糖溶液中,并在500×g下离心10分钟。
- 将沉淀重悬于BSA洗涤溶液中,并在400×g下离心7分钟。
- 将沉淀重悬于标准培养基中,计数细胞,并如上所述进行接种(在步骤2.1.10中)。
3. 初级神经球
- 每 2 天添加一次生长因子 (bFGF/EGF)。
- 每4-6天(取决于细胞密度),更换一半培养基,如下所示:
- 将整个细胞悬浮液转移到15或50 mL管中。
- 在400×g下离心5分钟。
- 卸下一半的音量。
- 加入相同量的新鲜培养基,通过移液轻轻混合,并加入生长因子。
4. 寡球层
注意:少突胶质细胞分化是在Chen方案10 之后进行的,并进行了修改。
- 当神经球达到直径100-150μm时,它们就可以通过。为此,将整个细胞悬浮液转移到15或50mL管中,并在400×g下离心5分钟。
- 通过使用倒置透射光显微镜拍摄球体的照片并通过ImageJ软件打开它们来快速评估直径。
- 单击" 分析 "菜单,然后从 "工具" 窗口中选择" 比例尺"。
- 将 150 μm 设置为 宽度(以微米为单位), 并将比例尺与球体进行比较。
- 通过倒置除去整个体积,并将沉淀重悬于180μL新鲜标准培养基中。移液50次,以允许球体的分解。
- 加入810μL新鲜标准培养基,计数细胞,并按照神经球的描述重新接种它们。
- 每 2 天添加一次 bFGF/PDGF-AA 10 ng/mL。
- 每4-6天(取决于细胞密度),更换一半培养基,如下所示:
- 将整个细胞悬浮液转移到15或50 mL管中。
- 在400×g下离心5分钟。
- 卸下一半的音量。
- 加入相同量的新鲜培养基,通过移液轻轻混合,并加入生长因子。
5. 板材涂装
- 聚-D,L-鸟氨酸/层粘连蛋白包衣:在电镀OPC前至少2天,向每个孔(96孔板为40μL/孔)中加入50μg/mL聚-D,L-鸟氨酸溶液,稀释在PBS中,并在室温下孵育过夜。
- 第二天,取出液体,用蒸馏无菌水清洗三次。
- 让板在室温下干燥过夜。第二天,加入稀释在PBS中的层粘连蛋白溶液(5μg/ mL;96孔板为40μL/孔),并在37°C下孵育2小时。
6. 细胞接种
- 当寡球层达到直径100-150μm时,它们准备好解离并接种在聚-D,L-鸟氨酸/层粘连蛋白包被板上。为此,将整个细胞悬浮液转移到15或50mL管中,并在400×g下离心5分钟(如步骤4.1所示)
- 通过倒置除去整个体积,并将沉淀重悬于180μL新鲜标准培养基中。移液50次,以允许球体的分解。
- 加入810μL新鲜标准培养基并计数细胞。
- 从孔中取出层粘连蛋白溶液,并以3,000个细胞/ cm2 密度(96孔板为100μL /孔)接种细胞。
7. OPC分化诱导
- 3天后,取出整个培养基并加入相同体积的少突胶质细胞分化培养基。
- 每4天更换一半培养基,每2天加入新鲜的分化混合物(T3 / CNTF / NAC)。
8. 诱导炎症介导的分化阻滞
- 在神经球解离和寡球产生(第4节)之后,将细胞因子混合物加入培养基中,并使寡球暴露于细胞因子以进行整个球体形成步骤。
注意:体积取决于细胞的数量,因为对于形成细胞的球体,接种在10-50个细胞/ μL。 - 如果需要更换培养基,请改变整个体积并再次加入细胞因子混合物。
9. 诱导缺氧-葡萄糖细胞死亡
- 在-1 DIV(细胞接种后2天在多孔板中),取出培养基并将其保存在新的多孔板中。
- 加入OGD培养基(OGD组)或新鲜培养基(对照组)的一半体积(50μL用于96孔板)。体积的一半用于减少液体和空气之间的氧气交换。
- 将OGD组培养物置于充满95%N2和5%CO 2的气密缺氧室中。为了达到腔室的饱和度,在关闭腔室管道之前,让气体混合物以25升/分钟的速度流动6分钟。
- 将缺氧室在培养箱中孵育3小时。在步骤9.1中取出并保存含有培养基的对照组和板也应留在培养箱中。
- 除去无葡萄糖(OGD组)或新培养基(对照组),并加入在步骤9.1中除去并保守的培养基。
10. 免疫细胞化学
- 在所需的时间点,用冷的4%多聚甲醛在室温下固定细胞20分钟。
- 用PBS洗涤两次(每次在室温下洗涤10分钟)。
- 用封闭溶液(PBS Triton 0.3%含有1%BSA和1%驴/山羊正常血清)在室温下孵育1小时。
- 用一抗混合物(表1)孵育,在PBS triton中稀释0.3%,在4°C下过夜。
- 用PBS洗涤两次(每次在室温下洗涤10分钟)。
- 用二抗(表1)溶液在PBS triton 0.3%中稀释,加入Hoechst 33258在37°C下孵育30分钟。
- 用PBS洗涤两次(每次在室温下洗涤10分钟)。
11. 细胞活力、谱系组成和谱系特异性细胞死亡的HCS分析
注:HCS代表性图像和工作流程如图 2A,B所示。
- 从软件的主菜单(HCS Studio v 6.6.0)中选择区室分析算法,然后从主菜单中选择扫描开发测定/扫描板。
- 在iDev窗口中,选择新建,然后从开发检测模板中选择常规强度测量工具。
- 点击菜单右侧的 创建 ,选择 10 倍物镜。
- 这将打开 "配置采集 "菜单。在此窗口中,选择以下参数:(a)通道数:第一个通道用于Hoechst核染色(BGRFR_386),一个用于反应中使用的每个谱系特异性标记(b)选择软件聚焦通道1和自动对焦间隔,因为1(c)从列表中选择板模型。
- 从采集菜单中,查看不同孔和不同领域的染色质量,并通过在菜单中选择 固定曝光时间手动选择曝光时间 。
- 设置采集参数后,选择菜单顶部的 Mini Scan, 并在每个实验条件下的两个孔中选择每个孔的十个字段。这将允许在整个板的字段子集中设置所有分析参数。
- 迷你扫描完成后,单击 配置分析参数 以配置分析算法。
- 单击窗口右侧的"配置组",然后拖放迷你扫描器的孔。单击"组"子部分中的"添加"按钮以配置不同的组。
- 按照窗口左侧的工作流程逐步开发整个算法。首先为每个通道选择" 处理图像 ",然后单击" 背景删除" 并在所需级别上单击。
- 首先通过核染色鉴定和选择细胞核。单击识别 主要对象 – 通道 1 以选择真正的原子核,并避免分析伪影和碎片。为此,放大核染色的代表性图片,并检查原子核是否被软件构建的周边所包围。可以更改阈值并应用分割算法来更好地识别单个原子核。
- 正确定义原子核后,单击以下步骤: 验证主对象。选择 Object.BorderObject.Ch1 可避免在每个场图像的边界处分析原子核。选择 Object.Area.Ch1, 然后通过移动直方图上的"低"和"高"条,移除所有已识别的碎片或与聚集体或伪影相对应的大物体。
- 检查所有实验条件的所有迷你扫描代表性图像,以确保所选参数符合所有参数。
- 单击与特定沿袭标记对应的每个通道的 识别点 ,然后选择环值:宽度 = 3 和距离 = 0。这将允许鉴定细胞质荧光。根据细胞密度,可以调整这些值。该软件将自动避免相邻环之间的重叠。
- 在工作流中选择 "参考水平 "以构建分析。参考水平的设置将允许根据核大小和核染色强度自动计数凝聚核,并根据Ring鉴定的细胞质荧光自动计数特定的标记阳性细胞。
- 首先点击 Object.Area.Ch1。在迷你扫描图像中,选择一个凝聚的原子核并移动直方图上的"LOW"条,以便选择该尺寸下的所有原子核作为"凝聚"核。
- 单击 Object.AvgIntensity.Ch1。在迷你扫描图像中,选择一个凝聚的原子核并移动直方图上的"HIGH"条,以便选择该荧光强度以上的所有原子核作为"凝聚"的。
- 单击 Object.RingAvgIntensity, 了解每个通道的谱系特定标记。在迷你扫描图像中选择一个阳性细胞,然后移动直方图上的"HIGH"条,以便选择高于此荧光强度的所有细胞为"阳性"。
- 检查所有实验条件的所有迷你扫描代表性图像,以确保所选参数符合所有参数。
- 在顶部菜单中,选择"种群特征",然后选择"事件子种群"。
- 作为 类型1 事件,选择左侧列表中的 ObjectAreaCh1, 然后单击 AND > 按钮,最后选择 ObjectAvgIntensityCh1。这将允许识别凝聚的原子核,作为低面积和高强度的组合。
- 在同一窗口中,取消选择所有扫描限制。
- 单击顶部菜单中 的选择要存储的要素 ,以选择要保留在分析中的参数。
- 选择 井特征 ,然后从左侧列表向右移动所需的参数:(a) SelectedObjectCountPErValidField (b) %EventType1ObjectCount (c) %High_RingAvgIntensity (对于特定谱系标记的每个通道)。
注意:该分析将给出细胞总数,凝聚核的百分比以及总细胞数上每个分析标记物的谱系特异性阳性细胞的百分比。如果仅在活细胞上需要不同谱系的百分比,是否可以保留通道的值"High_RingAvgIntensity"(阳性细胞的绝对数),并在减去死细胞百分比后重新计算总细胞数的百分比。- 或者,可以从分析中移除死细胞,设置用于在细胞核验证(步骤11.11)上识别凝聚原子核的相同参数(步骤11.14-11.15)。
- 从主顶部菜单中选择 扫描板 ,然后单击顶部" 扫描设置 "子菜单上的板符号,以确定要分析的孔。
- 写下实验的名称和说明,完成所有设置后,按 播放 符号。
结果
培养的第一阶段可能持续时间不同,这取决于播种密度以及球体是胎儿还是成人起源。此外,与神经球相比,寡球层显示出减少的种群数量翻了一番(图1B)。此外,成体组织的球体产生速度较慢,与胎儿相比,可能需要2-3周才能产生寡球,这取决于播种密度。
一旦接种,可以使用谱系特异性抗体监测培养物的整个分化阶段。由于该方案的目标是研究分化的最终阶段,因此未呈现0 DIV处的培养物组成。然而,在第一个培养阶段,细胞仍将是巢蛋白阳性,代表神经前体,并且大多数细胞也是NG2阳性(OPCs)11。对应于OL前期的CNPase阳性细胞在T3介导的分化诱导后3-6天可检测到,而MBP阳性细胞将出现在6至12个DIV之间(成熟的OL;分化阶段结束时的培养物组成见图2C)。
HCS分析允许通过核染色检测培养物中的每个单个细胞,并分析其余通道中的荧光强度(图2A,B)。分化阶段(12个DIV)结束时培养物的组成取决于培养物是胎儿还是成人起源,胎儿培养物对T3介导的分化反应更灵敏,并且达到更高百分比的成熟OL12。
在整个培养过程中,大约40%-50%的细胞是星形胶质细胞(GFAP阳性细胞),而一小部分(小于0%-10%)是神经元(β-III-微管蛋白阳性细胞; 图 2C)。不同培养制剂之间的培养物组成可以变化10%。在分化阶段结束时,成体和胎儿培养物的成熟OL产量不同,胎儿细胞显示出成熟OL的高百分比,前体的低百分比和星形胶质细胞的约30%-40%。另一方面,在12次分化诱导的DIV后,成体培养物呈现更多的星形胶质细胞(约45%-55%)和更少的分化细胞。
为了使软件能够识别细胞并提供对培养物成分的适当无偏分析,重要的是接种密度是正确的,避免相邻细胞之间的重叠。当NSC衍生的OPC以高密度播种时,它们往往聚集得非常快,导致几天后整个孔表面被星形胶质细胞占据。此外,由于空间有限,具有其特征蜘蛛网形状的成熟OL将不可见(图3A,B)。
炎症介导的分化阻滞可通过这种体外测定重复,并且在胎儿和成人培养物中通过CNP酶和MBP染色检测到的preOLs和成熟OL显着减少。OPCs数量的增加也发生在成人培养物中(图4A,B)。细胞因子混合物的组成是从多发性硬化症13大鼠模型的体内实验中选择的,并作为该疾病中发生的炎症介导的分化阻滞的体外模型进行测试。
虽然胎儿和成人OPC对炎症细胞因子暴露表现出相同的易感性,但只有胎儿来源的培养物对OGD毒性敏感(图5A,B),由于其不同的代谢特征,显示出细胞死亡和分化损伤的增加14。

图1:神经干细胞来源的少突胶质细胞前体细胞培养设置和分化方案。(一)实验程序方案。(B) 2、5 和 7 DIV 处神经球的代表性图像,以及显示神经球和寡球层人口翻倍的图表。比例尺:100μm.(C)接种寡球衍生OPC的代表性图像,显示不同的分化阶段,从0 DIV(神经前体/ OPCs)的巢蛋白和NG2阳性细胞到6个DIV(preOL)的CNP酶阳性细胞和分化阶段结束时的CNPase / MBP双阳性细胞(12个DIV;成熟OL)。GFAP阳性细胞(星形胶质细胞)和一小部分β-III-微管蛋白阳性细胞(神经元)存在于整个培养过程中。比例尺:20 μm。请单击此处查看此图的放大版本。
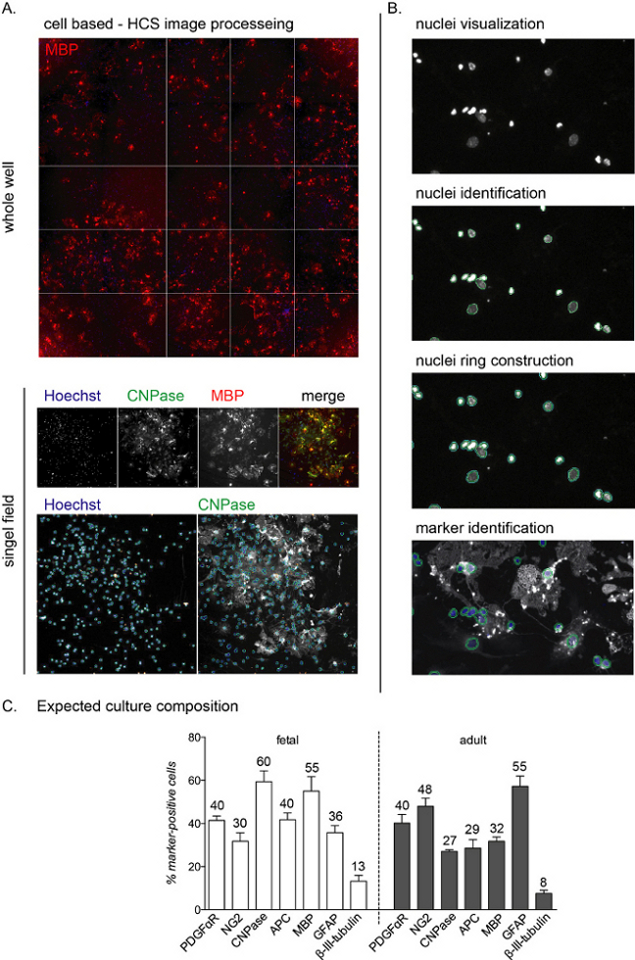
图2:基于细胞的高内涵筛选分析工作流程和预期的分化读数。(A) HCS采集整个孔(96孔板)和孤立的单场采集的代表性图像,其目标是12个DIV培养物的10倍NSC衍生OPC培养物。(B)HCS分析工作流程步骤包括细胞核(物体)的可视化、鉴定、细胞环的构建,以鉴定细胞质染色和标记物鉴定。(C) 显示分化阶段结束时预期培养物成分的图表(12 个 DIV)。OPCs(PDGFαR,NG2),preOL(CNPase,APC),成熟OL(MBP),星形胶质细胞(GFAP)和神经元(β-III-微管蛋白)的标志物在胎儿和成人来源的培养物中均显示。图表中包括每个细胞标记物的四舍五入百分比,请注意,这是一个代表性实验,百分比可能相差约5%-10%。请点击此处查看此图的放大版本。
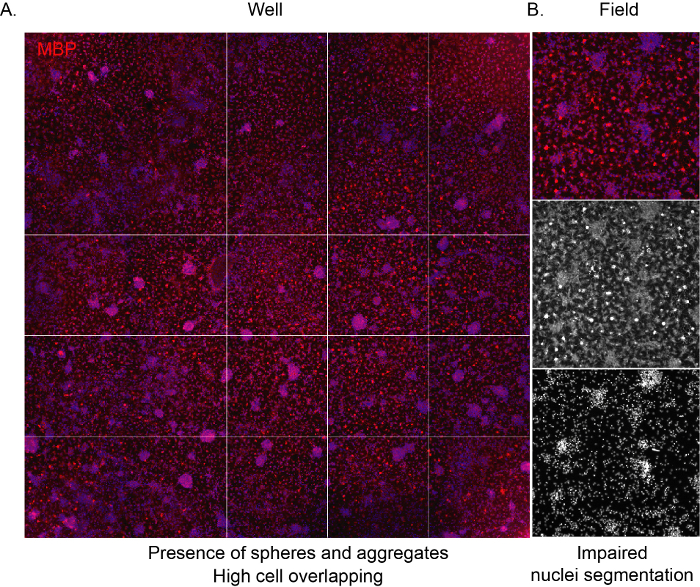
图 3:高密度培养物的代表性高内涵筛选图像。(A) 由10倍物镜获取的孔(96孔板)图像的代表性图像,并在分化阶段(12个DIV)结束时标记为MBP表达。(B) 具有代表性的提取场图像,突出显示聚集细胞和重叠细胞核的存在。 请点击此处查看此图的放大版本。
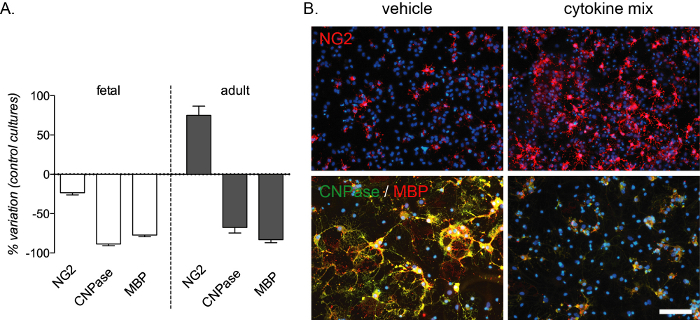
图4:细胞因子处理对胎儿和成人来源的OPC培养物的预期效果。(A) 图表显示了胎儿和成人来源的OPC培养物与标准培养物相比的变异百分比,包括分化阶段结束时OPC(NG2),preOL(CNPase)和成熟OLs(MBP)的定量(12 DIV)。(B)在分化阶段结束时(12个DIV)的成人文化的代表性图像,用载体或细胞因子混合物处理并标记为NG2或CNP酶/ MBP。比例尺:20 μm。请单击此处查看此图的放大版本。
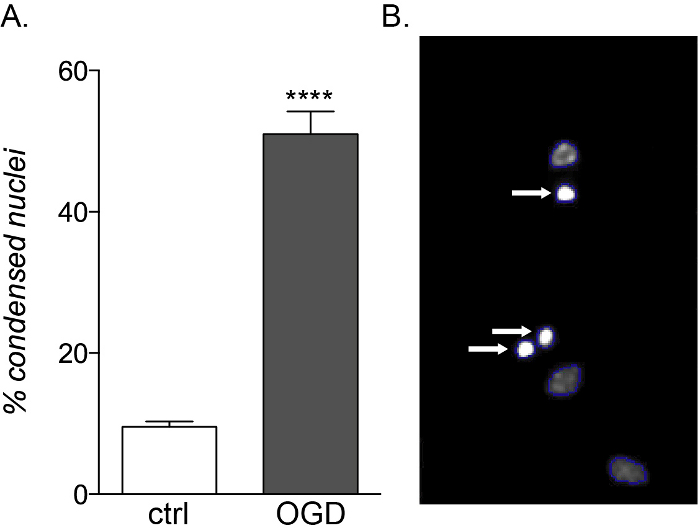
图5:OGD暴露对胎儿来源OPC培养物的预期影响。(A) 图表显示基于细胞的HCS在对照(ctrl)和OGD暴露培养物中定量的凝聚核的百分比。(B) HCS处理过的物体的代表性图像,突出显示已识别的凝聚原子核(白色箭头)。 请点击此处查看此图的放大版本。
| 抗体 | 物种 | 稀释 | |
| 抗β-III-微管蛋白(研发系统) | 鼠 | 1:3000 | |
| 反GFAP(Dako) | 兔 | 1:1000 | |
| 抗NG2(微孔) | 兔 | 1:350 | |
| 抗PDGFαR(圣克鲁斯生物技术) | 兔 | 1:300 | |
| 抗中核酶(微孔) | 鼠 | 1:500 | |
| IgG2b抗APC,克隆CC1(钙生物化学) | 鼠 | 1:100 | |
| Anti-MBP (Dako) | 兔 | 1:250 | |
| 抗巢蛋白(微孔) | 鼠 | 1:500 | |
| Alexa Fluor 488共轭反小鼠(ThermoFisher Scientific) | 驴 | 1:500 | |
| Alexa Fluor 647 共轭抗小鼠 IgG2b (ThermoFisher Scientific) | 山羊 | 1:500 | |
| Alexa 568共轭反兔(ThermoFisher Scientific) | 驴 | 1:500 | |
表1:一抗和二抗列表。
讨论
髓鞘形成/髓鞘再生过程和脱髓鞘事件的复杂性使得预测性体外系统的开发极具挑战性。使用最广泛的体外药物筛选系统大多是人细胞系或原代纯OL培养物,并且越来越多地使用更复杂的共培养物或有机型系统15。即使这样的系统与高内涵技术相结合,纯OL培养物仍然是开发筛选平台16时的首选方法。
这里描述的自发混合培养代表了一种有用的体外系统,该系统考虑了所有主要变量:生理性T3介导的OPC分化,对该过程的病理干扰,其他细胞成分以及与年龄相关的差异。该过程包含许多变量,这些变量来自细胞的起源(动物的年龄)以及球体的形成和操作。事实上,一个关键步骤是从组织中分离出来后接种的NSCs细胞密度,因为在最佳条件下,单个球体应该来自单个增殖细胞。由于我们已经看到分离的NSCs倾向于聚集并且它们需要自己分泌的旁分泌因子,因此将它们接种在t25或t75烧瓶中的10-50个细胞/ μL范围内,是避免细胞聚集但仍允许细胞通过分泌因子进行通信的最佳折衷方案。
该技术的主要局限性是缺乏功能性轴突髓鞘形成和与神经元的直接相互作用,因为该方法仅考虑OPC分化,直到成熟OL的阶段:CNPase / MBP双阳性细胞具有蜘蛛网形态。为此目的,在分离的背根神经节上培养的原代OPC仍然是主要方法17。然而,在任何年龄将这些细胞与动物区分开来的可能性是转化过程中的一个基本点,因为它允许在从目标年龄分离的细胞上测试化合物和有毒刺激。正如这里所描述的,事实上,NSC可以从胎儿和成人的大脑中分离出来。由于成年期的发育性髓鞘化和髓鞘再生具有相同的目标,即达到裸轴突并产生髓鞘,因此最初假设这两个过程在各个方面都是相同的,从而产生了所谓的概括假设18。然而,现在很明显,这两个过程不能被认为是相等的,并且存在与细胞内在年龄相关的差异,并且在为实验问题19选择最合适的体外模型时应予以考虑。事实上,成人NSCs衍生的OPC在生理TH驱动的分化和对有害刺激14,20以及初级OPCs21,22的脆弱性方面显示出强烈的差异。成人组织中OPC和OL群体也存在异质性,与病理状况特别相关23。从成人组织中分离出原发性 OPCs 的方案24可用,当实验问题涉及成年期髓鞘再生的分子时,应考虑这些方案。
OPCs与NSCs的分化允许整个分化过程的体外表征,从未分化的前体到成熟的OL。该过程类似于体内条件,其中TH是该过程的主要驱动因素,通过特定的核受体起作用,并且它允许对该机制的实验干扰以模拟平移视图中的病理条件13。
该模型的最后一个基本特征是星形胶质细胞在整个培养物中持续存在。虽然这使得培养物更难以分析,但其复杂的细胞组成构成了一个明显的优势。星形胶质细胞对混合神经元培养物25 中有害事件的反应的方式广为人知,并且CNS的这一主要成分的缺乏使得体外系统的可预测性和可翻译性较差。另一方面,对于这一特征,NSC衍生培养物的缺点是不如单细胞类型系统均匀,这可能导致有偏见的分析。然而,基于细胞的HCS技术允许分析整个培养物和所有细胞群,也消除了代表性场的随机化以进行分析。假设用于实验的细胞培养物具有可靠的接种质量,HCS将提供实验条件的全貌,生成统计上可靠的数据和许多基于荧光的自动分析。
总之,目前的方案描述了从胎儿和成人大脑中分离和分化NSC衍生的OPC的程序。整个方案大约需要30天,具体取决于动物的年龄和实验目标。特别是,在相同的播种密度下,与胎儿相比,从成体起源形成的球体可能需要两倍的时间。然而,在所有条件下,在2D表面上播种后15天(从-3到12个DIV)的时间是固定的。完整的方案允许在复杂的细胞环境中研究整个TH介导的分化过程,通过特定的病理机制(即炎症细胞因子和HI)进行干扰,以及随后测试旨在克服这些问题的新策略。培养模型与HCS技术的耦合产生了一个强大且可翻译的筛选平台。
披露声明
作者没有什么可透露的。
致谢
由MIUR国家技术集群项目IRMI(CTN01_00177_888744)和 Regione Emilia-Romagna,Mat2Rep,POR-FESR 2014-2020提供支持。
特别感谢IRET基金会主办实验工作。
材料
| Name | Company | Catalog Number | Comments |
| 96-well plates - untreated | NUNC | 267313 | |
| B27 supplement (100x) | GIBCO | 17504-044 | |
| basic Fibroblast Growth Factor (bFGF) | GIBCO | PHG0024 | |
| BSA | Sigma-Aldrich | A2153 | |
| Ciliary Neurotropic Factor (CNTF) | GIBCO | PHC7015 | |
| DMEM w/o glucose | GIBCO | A14430-01 | |
| DMEM/F12 GlutaMAX | GIBCO | 31331-028 | |
| DNase | Sigma-Aldrich | D5025-150KU | |
| EBSS | GIBCO | 14155-048 | |
| Epidermal Growth Factor (EGF) | GIBCO | PHG6045 | |
| HBSS | GIBCO | 14170-088 | |
| HEPES | GIBCO | 15630-056 | |
| Hyaluronidase | Sigma-Aldrich | H3884 | |
| IFN-γ | Origene | TP721239 | |
| IL-17A | Origene | TP723199 | |
| IL-1β | Origene | TP723210 | |
| IL-6 | Origene | TP723240 | |
| laminin | GIBCO | 23017-051 | |
| N-acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| N2 supplement (50x) | GIBCO | 17502-048 | |
| Non-enzymatic dissociation buffer | GIBCO | 13150-016 | |
| PBS | GIBCO | 70011-036 | |
| Penicillin / Streptomycin | Sigma-Aldrich | P4333 | |
| Platelet Derived Growth Factor (PDGF-AA) | GIBCO | PHG0035 | |
| poly-D,L-ornitine | Sigma-Aldrich | P4957 | |
| TGF-β1 | Origene | TP720760 | |
| TNF-α | Origene | TP723451 | |
| Triiodothyronine | Sigma-Aldrich | T2752-1G | |
| Trypsin | Sigma-Aldrich | T1426 |
参考文献
- Michalski, J. P., Kothary, R. Oligodendrocytes in a nutshell. Frontiers in Cellular Neuroscience. 9, 340 (2015).
- Verden, D., Macklin, W. B. Neuroprotection by central nervous system remyelination: molecular, cellular, and functional considerations. Journal of Neuroscience Research. 94, 1411-1420 (2016).
- Raff, M. C., Lillien, L. E., Richardson, W. D., Burne, J. F., Noble, M. D. Platelet-derived growth factor from astrocytes drives the clock that times oligodendrocyte development in culture. Nature. 333, 562-565 (1988).
- Crawford, A. H., Chambers, C., Franklin, R. J. M. Remyelination: The true regeneration of the central nervous system. Journal of Comparative Pathology. 149, 242-254 (2013).
- Butt, A. M., Papanikolaou, M., Rivera, A. Physiology of oligodendroglia. Advances in Experimental Medicine and Biology. 11175, 117-128 (2019).
- Baldassarro, V. A., Giardino, L., Calzà, L. Oligodendrocytes in a dish for the drug discovery pipeline: the risk of oversimplification. Neural Regeneration Research. 16, 291-293 (2021).
- Buchser, W. Assay development guidelines for image-based high content screening, high content analysis and high content imaging. Assay Guidance Manual. 1, 1-80 (2014).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends in Biotechnology. 28, 237-245 (2010).
- Ahlenius, H., Kokaia, Z. Isolation and generation of neurosphere cultures from embryonic and adult mouse brain. Methods in Molecular Biology. 633, 241-252 (2010).
- Chen, Y., et al. Isolation and culture of rat and mouse Oligodendrocyte Precursor Cells. Nature Protocols. 2 (5), 1044-1051 (2007).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Baldassarro, V. A., et al. The role of nuclear receptors in the differentiation of Oligodendrocyte Precursor Cells derived from fetal and adult neural stem cells. Stem Cell Research. 37, 101443 (2019).
- Fernández, M., Baldassarro, V. A., Sivilia, S., Giardino, L., Calzà, L. Inflammation severely alters thyroid hormone signaling in the central nervous system during experimental allergic encephalomyelitis in rat: direct impact on OPCs differentiation failure. Glia. 64, 1573-1589 (2016).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. Differential effects of glucose deprivation on the survival of fetal versus adult neural stem cells-derived Oligodendrocyte Precursor Cells. Glia. , 23750 (2019).
- Merrill, J. E. In vitro and in vivo pharmacological models to assess demyelination and remyelination. Neuropsychopharmacology. 34, 55-73 (2009).
- Lariosa-Willingham, K. D., et al. A high throughput drug screening assay to identify compounds that promote oligodendrocyte differentiation using acutely dissociated and purified oligodendrocyte precursor cells. BMC Research Notes. 9, 419 (2016).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. Journal of Neuroscience Methods. 209, 219-226 (2012).
- Fancy, S. P. J., Chan, J. R., Baranzini, S. E., Franklin, R. J. M., Rowitch, D. H. Myelin regeneration: a recapitulation of development. Annual Review of Neuroscience. 34, 21-43 (2011).
- Franklin, R. J. M., Ffrench-Constant, C. Regenerating CNS Myelin - from mechanisms to experimental medicines. Nature Reviews Neuroscience. 18, 753-769 (2017).
- Baldassarro, V. A., Marchesini, A., Giardino, L., Calzà, L. PARP activity and inhibition in fetal and adult Oligodendrocyte Precursor Cells: effect on cell survival and differentiation. Stem Cell Research. 22, 54-60 (2017).
- Leong, S. Y., et al. Oligodendrocyte Progenitor Cells (OPCs) from adult human brain expressed distinct microRNAs compared to OPCs in development. Neurology. 82, (2014).
- Bribián, A., et al. Functional heterogeneity of mouse and human brain OPCs: relevance for preclinical studies in multiple sclerosis. Journal of Clinical Medicine. 9, 1681 (2020).
- Jäkel, S., et al. Altered Human Oligodendrocyte Heterogeneity In Multiple Sclerosis. Nature. 566, 543-547 (2019).
- Medina-Rodríguez, E. M., Arenzana, F. J., Bribián, A., de Castro, F. Protocol to isolate a large amount of functional oligodendrocyte precursor cells from the cerebral cortex of adult mice and humans. PloS One. 8, 81620 (2013).
- Baldassarro, V. A., et al. Cell death in pure-neuronal and neuron-astrocyte mixed primary culture subjected to oxygen-glucose deprivation: the contribution of poly(ADP-Ribose) polymerases and caspases. Microchemical Journal. 136, 215-222 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。