Method Article
Yüzey Plazmon Rezonans Teknolojisi ile PD-1/PD-L1 İnhibitörlerinin Tanımlanması
Bu Makalede
Özet
Bu protokol, yüzey plazmon rezonans teknolojisini kullanan PD-1/PD-L1 inhibitörleri için bir blokaj testini tanımlar. Yanıt birimlerini doğru bir şekilde ölçmek için çift aşamalı bir immobilizasyon stratejisi ve özel bir tampon sistemi kullanır ve bileşikler veya biyolojik maddeler için blokaj oranlarının değerlendirilmesini kolaylaştırır. Ek olarak, PD-1/PD-L1 inhibitörlerinin yüksek verimli tanımlamasını destekler.
Özet
PD-1/PD-L1 etkileşiminin bozulması, kanser immünoterapisi için umut verici bir stratejidir. PD-1/PD-L1 inhibitörlerinin etkinliğini değerlendirmek için güvenilir tarama platformları gereklidir. Yüzey Plazmon Rezonansı (SPR) teknolojisini (birinci nesil PD-1 / PD-L1 inhibitörü SPR tarama platformu) kullanan daha önce kurulmuş bir insan PD-1 / PD-L1 blokaj testi, Homojen Zaman Çözümlü Floresan (HTRF) ve hücre bazlı testler yoluyla elde edilenlerle karşılaştırılabilir sonuçlar gösterdi ve büyük ölçekli tarama potansiyeli ile. Burada, bu testin optimize edilmiş bir versiyonu (ikinci nesil PD-1 / PD-L1 inhibitörü SPR tarama platformu) sunulmaktadır ve çip üzerinde PD-1 oryantasyon kontrolünü geliştirmek ve PD-1 protein tüketimini azaltmak için amin ve biyo-streptavidin eşleşmesini birleştiren çift aşamalı bir birleştirme işlemine sahiptir. Güncellenen platform, PD-1/PD-L1 inhibitörü BMS-1166 kullanılarak başarıyla doğrulandı ve önceki SPR tabanlı yöntem ve ELISA gibi diğer yerleşik tekniklerle karşılaştırılabilir blokaj etkileri gösterdi. Bu sonuçlar yaklaşımın güvenilirliğini doğrulamaktadır. Bu optimize edilmiş SPR tarama platformu, yeni PD-1/PD-L1 inhibitörlerini tanımlamak, kanser immünoterapi araştırmalarını ilerletmek ve immün kontrol noktası inhibitörü taramasında SPR'nin potansiyelini vurgulamak için yüksek verimli ve güvenilir bir araç sunar.
Giriş
İmmün kontrol noktası blokaj tedavileri, özellikle Programlanmış Hücre Ölümü-1 (PD-1) ve Programlanmış Hücre Ölümü-Ligand 1'i (PD-L1) hedefleyenler, kanser immünoterapi stratejilerinin ön saflarında yer almaktadır. Anti-PD-1/PD-L1 tedavileri, hematolojik, kutanöz, pulmoner, hepatik, idrar kesesi ve böbrek kanserleri gibi çeşitli kanser türlerinde kullanım için onay almıştır1. PD-1, immünoglobulin süper ailesine ait bir transmembran glikoproteindir, N-terminalinde tek bir immünoglobulin değişkeni (IgV) benzeri alan, IgV alanını plazma zarından ayıran kabaca 20 amino asitlik bir sap, bir transmembran alanı ve tirozin bazlı sinyal motifleri içeren bir sitoplazmik kuyruk2. PD-1 için ligandlardan biri olarak tanımlanan PD-L1, bir transmembran bölgesi, iki hücre dışı alan (immünoglobulin sabiti (IgC) ve IgV) ve hücre içi sinyal yollarını tetikleyen nispeten kısa bir sitoplazmik alan içeren bir tip I transmembran proteinidir3. PD-1 / PD-L1 inhibitör yolu, T hücresi aktivasyonunu ve otoimmüniteyi düzenleyen kritik bir bağışıklık kontrol noktası olarak hizmet eder4. PD-1, PD-L1 ile etkileşime girdiği, T hücresi reseptör sinyalini inhibe ettiği ve antijen sunan hücreler ve T hücreleri5 üzerinde CD28 ve CD80 moleküllerinin uyarılmasını bloke ettiği T hücreleri üzerinde eksprese edilir. Kanser dokuları, kaçış fazı sırasında PD-L1'i aşırı eksprese ederek bu fizyolojik mekanizmadan yararlanır, böylece tümör büyümesini ve ilerlemesini destekleyen immünosupresif bir ortam yaratır6. PD-1 ve PD-L1 inhibitörleri bu etkileşimi bozarak bağışıklık sisteminin tümör kaynaklı baskılanmadan kaçmasını ve T hücresi aracılı tümör hücresi ölüm sürecini yeniden başlatmasını sağlar7.
İmmün kontrol noktası blokaj tedavilerinin önemli rolü ile atılan temel üzerine inşa edilen PD-1/PD-L1 inhibitörlerinin geliştirilmesi, kanser immünoterapisinde önemli bir ilerlemeye işaret etmiştir. ABD Gıda ve İlaç Dairesi (FDA), özellikle PD-1 / PD-L1 yolunu hedef alan dokuz bağışıklık kontrol noktası inhibitörünü onaylamıştır. Bunlar arasında altı PD-1 inhibitörü-pembrolizumab, dostarlimab, nivolumab, cemiplimab, oripalimab ve tislelizumab - ve üç PD-L1 inhibitörü-atezolizumab, avelumab ve durvalumab 8,9 bulunur. Bu tedaviler, melanom, akciğer kanseri, ürotelyal kanser, rahim ağzı kanseri, mide veya gastroözofageal kanser ve diğer katı tümörler gibi çeşitli kanserleri tedavi etmek için etkili bir şekilde kullanılmaktadır10. Etkinliklerine rağmen, monoklonal antikor bazlı tedaviler, düşük yanıt oranları, yüksek maliyetler, uzun yarılanma ömürleri, bağışıklıkla ilişkili ciddi advers olaylar ve intravenöz veya deri altı doğumda kısıtlamalar dahil olmak üzere önemli sınırlamalarla karşı karşıyadır 11,12,13. Sonuç olarak, araştırmalar giderek daha fazla PD-1 / PD-L1 eksenini hedefleyen küçük moleküllü inhibitörler geliştirmeye odaklanmaktadır. Bu küçük moleküller, daha az yan etki ile karşılaştırılabilir terapötik sonuçlar elde etmek amacıyla, gelişmiş hücresel penetrasyon, çeşitli biyolojik hedeflerin modülasyonu, gelişmiş oral biyoyararlanım ve düşük maliyetler gibi belirgin avantajlar sunar14. Bununla birlikte, PD-1 / PD-L1 etkileşimini hedefleyen küçük molekül inhibitörlerinin geliştirilmesi, öncelikle güvenilir bir yüksek verimli tarama platformunun olmaması nedeniyle erken aşamalarındadır. Bu tür platformlar, küçük moleküllerin geniş kütüphanelerini hızlı bir şekilde değerlendirmek ve daha fazla doğrulama ve optimizasyon için kurşun bileşiklerini tanımlamak için gereklidir. Bu zorluğun üstesinden gelmek, kanser immünoterapisini ilerletmek için kritik öneme sahiptir.
Yüzey Plazmon Rezonansı (SPR) teknolojisi, antikor antijenleri, enzimler, nükleik asitler ve ilaçlar dahil olmak üzere çeşitli biyomoleküllerin tespit edilmesinde yaygın olarak kullanılmaktadır ve özellikle küçük moleküllü ilaç taramasında etkilidir15,16. Diğer biyofiziksel tekniklerin aksine, SPR etiketsiz algılama, gerçek zamanlı kinetik veriler ve geniş bir algılama aralığı sunar. Buna karşılık, İzotermal Titrasyon Kalorimetrisi gerçek zamanlı kinetik içgörülerden yoksundur ve daha büyük numune hacimleri gerektirerek verimi sınırlar. Mikro Ölçekli Termoforez, tampon girişime eğilimlidir ve kinetik veri sağlayamazken, Biyokatman İnterferometrisi, moleküler boyut ve özelliklere dayalı olarak uygulamaya özel sınırlamalara sahiptir. Homojen Zamanla Çözülen Floresan, etiketleme gerektirir ve floresan girişimine karşı hassastır. HTRF'nin PD-1 / PD-L1 inhibitörlerini keşfetmek için başka bir uygun teknoloji olduğunu kabul ediyoruz. SPR ile karşılaştırıldığında HTRF'nin doğal bir sınırlaması, molekül içi uyarma işlemi (örneğin, elektron transferi, FRET ve ağartma) ile dış etkileşimlerin neden olduğu floresan söndürmedir, küçük pencere aralığı nedeniyle ilaç tarama işleminde duyarlılık çok düşüktür ve floresan kütüphane bileşiklerinden veya biyolojik proteinlerden kaynaklanan girişim17. Bu özellikler, SPR'yi ilaç keşfi için üstün bir araç olarak konumlandırmaktadır. Önceki çalışmalarımız, SPR'nin küçük moleküllerin PD-1 / PD-L1'e karşı blokaj etkisini belirleyebildiğini göstermiştir, bu da yüksek etiketleme teknolojisi gereksinimleri, çoklu adımlar, zayıf özgüllük ve ilaç keşif sürecinde yüksek maliyet gerektiren diğer tekniklere göre avantajlıdır18.
Bu çalışma, çip üzerindeki PD-1 oryantasyonunu geliştirmek ve protein kullanımını en aza indirmek için hem amin hem de biyo-streptavidin eşleşmesini kullanan çift aşamalı bir birleştirme işlemini entegre eden optimize edilmiş SPR tabanlı bir platform sunmaktadır. Bu güncellenmiş yaklaşım, pozitif bir kontrol bağlayıcı olarak PD-1/PD-L1 inhibitörü BMS-1166 kullanılarak başarıyla doğrulandı ve hem önceki SPR yöntemimiz hem de ELISA19,20 gibi diğer yerleşik tekniklerle karşılaştırılabilir blokaj etkileri gösterdi. Bu sadece protokolümüzün güvenilirliğini ve tekrarlanabilirliğini doğrulamakla kalmaz, aynı zamanda modifiye edilmiş platformumuzun PD-1/PD-L1 inhibitörlerinin yüksek verimli taramasını kolaylaştırmadaki etkinliğini de gösterir. Biyo-streptavidin yakalama adımının dahil edilmesi, rastgele protein oryantasyonundan ziyade bölgeye yönelik sağlar, bu da PD-1 konsantrasyonunun azaltılmasına (40 μg / mL'ye karşı 10 μg / mL) ve son kullanıcının streptavidin (SA) ticarileştirilmiş önceden hareketsiz hale getirilmiş SA çiplerine daha ucuz bir alternatif olan bir CM5 çipine hareketsiz hale getirilmesini sağlayarak maliyet tasarrufu sağlar. Bu, bileşik/peptit kütüphanelerinin büyük ölçekli, uygun maliyetli taramaları için avantajlı hale getirir. PD-1/PD-L1 inhibitörlerinin kansere karşı klinik potansiyelini değerlendirmek için in silico, in vitro ve in vivo testler dahil olmak üzere ek karakterizasyon yöntemleri gerekli olsa da, gelişmiş SPR tabanlı tarama platformumuz, PD-1/PD-L1 inhibitörlerinin büyük ölçekli taraması için etkili bir araç olarak öne çıkmaktadır.
Protokol
Reaktifler ve ekipman, Malzeme Tablosunda listelenmiştir.
1. Streptavidin (SA) proteininin CM5 çipi üzerinde immobilizasyonu
- SPR cihazında immobilizasyon yöntemini ayarlayın: Açık/yeni sihirbaz şablonu, immobilizasyonu seçin, çip tipini CM5 olarak ayarlayın ve döngü başına akış hücrelerini 1 olarak ayarlayın. İmmobilize akış hücresi 1'i ve akış hücresi 2'yi kontrol edin.
- Amin'i immobilizasyon yöntemi olarak ayarlayın. İmmobilize seviye için hedef belirleyin, ligand konsantrasyonu: 40 μg/mL streptavid, hedef seviye: 2000 RU, yıkama çözeltisi: 50 mM NaOH. Ardından, çalıştırmadan önce astarı kontrol edin.
- Aşağıdaki tüpleri hazırlayın: R2 B1 ve R2 C1 - 40 μg / mL streptavidin; R2 B2 ve R2 C2: 50 mM NaOH; R2 B3 ve R2 C3: EDC; R2 B4 ve R2 C4: NHS; R2 B5 ve R2 C5: Boş; R2 B6 ve R2 C6: etanolamin.
NOT: EDC ve NHS, CM5 çipindeki karboksil gruplarını aktive ederek ligand üzerindeki aminlerle kovalent eşleşmeye izin verir. Etanolamin, immobilizasyon sırasında spesifik olmayan bağlanmayı önlemek için bir bloke edici tampon olarak kullanılır. - 200 mL 1× HBS-EP + çalışan tampon çözeltisi hazırlamak için 20 mL HBS-EP + tamponunu 180 mL deiyonize (DI) su içinde ×10 oranında seyreltin.
- 1 mg streptavidine 1 mL DNaz içermeyen su ekleyin ve oda sıcaklığında 30 dakika inkübe edin. Daha sonra, streptavidin çözeltisini asetat tamponunda (pH 4.5) 40 μg / mL'ye seyreltin. Amin Birleştirme reaktif kiti reaktiflerini üreticinin talimatlarına göre hazırlayın ve ilgili tüm reaktif düzenlerini adım 1.2'de belirtildiği gibi yerleştirin.
- Bakım sensörü çipini CM5 çipi ile değiştirin, ardından Tüp A'yı hazırlanan 1× HBS-EP+ tamponuna yerleştirin, immobilizasyon yöntemini yeniden açın ve tüpleri adım 1.2 düzenine göre yerleştirin. Yöntemi çalıştırın ve sonuç dosyasını kaydedin.
- Çalışma sonrası bakım: CM5 çipini bakım sensörü çipiyle değiştirin, Tüp A'yı deiyonize suyla dolu bir şişeye yerleştirin ve astarı çalıştırın. CM5 çipini çıkardıktan sonra, çipi birkaç damla DI su ile yıkayın ve havayla kurutun. Çipi 4 °C'de 50 mL'lik bir tüpe yerleştirin.
NOT: Hareketsiz hale getirilmiş SA, CM5 yongasının bir SA yongası olarak işlev görmesini sağlar.
2. PD-1 proteininin SA çipi üzerinde immobilizasyonu
- SPR cihazında immobilizasyon yöntemini ayarlayın: Açık/yeni sihirbaz şablonu, immobilizasyonu seçin, çip tipini SA olarak ayarlayın ve döngü başına akış hücreleri 1 olarak ayarlayın. Akış hücresi 1 ve hücre 2'yi hareketsiz hale getirin.
- Yöntem olarak SA-biotin yakalamayı ayarlayın. Hücre 1 için boş immobilizasyonu ayarlayın, hücre 2 için immobilize seviyeyi, ligand olarak 10 μg / mL PD-1'i hedefleyin, hedef seviye: 4000 RU'yu ayarlayın, ardından çalıştırmadan önce amayı kontrol edin.
NOT: Aşağıdaki tüpleri hazırlayın - R2 B1 ve R2 C1: 1 M NaCl, 50 mM NaOH; R2 B2 ve R2 C2: %50 izopropanol/50 mM NaOH/1 m NaCl; R2 C3: 10 μg/mL PD-1.
- Yöntem olarak SA-biotin yakalamayı ayarlayın. Hücre 1 için boş immobilizasyonu ayarlayın, hücre 2 için immobilize seviyeyi, ligand olarak 10 μg / mL PD-1'i hedefleyin, hedef seviye: 4000 RU'yu ayarlayın, ardından çalıştırmadan önce amayı kontrol edin.
- 1 M NaCl ve 50 mM NaOH çözeltisini hazırlamak için 58.44 mg NaCl'yi 1 mL 50 mM NaOH içinde çözün. 500 μL suda 58.44 mg NaCl ve 4.0 mg NaOH'yi çözün, ardından %50 İzopropanol/50 mM NaOH/1 M NaCl çözeltisini hazırlamak için 500 μL izopropanol ekleyin.
- PD-1 çözeltisini hazırlayın: 100 μg Biyotinile İnsan PD-1'e (Fc ve Avitagged) 200 μL DNaz içermeyen su ekleyin ve oda sıcaklığında 30 dakika stabilize edin, ardından asetat tamponunda (pH 5.0) 10 μg / mL'ye seyreltin.
- Tüm reaktif düzenlerini adım 2.1'de açıklandığı gibi yerleştirin. Tüp A'yı 1× HBS-EP + çalışan tampon çözeltisine yerleştirin, ardından bakım sensörü çipini çıkarın ve SA çipini takın (5. adımdan itibaren streptavidin proteini ile kaplanmış CM1 çipi). İmmobilizasyon yöntemini yeniden açın, reaktif rafı 2'yi takın ve konumları kontrol edin, ardından tahmini çalışma süresi boyunca yöntemi çalıştırın.
- Adım 1.6'yı tekrarlayın.
3. PD-1 ve PD-L1 için rejenerasyon keşfi
- Rejenerasyon keşif yöntemini ayarlayın: Açık/yeni sihirbaz şablonu, Rejenerasyon Scouting'i seçin, akış yolunu ayarlayın: 2-1, 4-3, çip tipini SA olarak ayarlayın, çalıştırma koşullandırma döngüsünü kontrol edin, çözeltiyi HBS-EP+ olarak kaydedin, temas süresi 30 s, enjeksiyon sayısı 3, çözelti PD-L1 olarak, temas süresi: 30 s, akış hızı: 30 μL/dak.
- Rejenerasyon parametreleri için akış hızı 30 μL/dk ve stabilizasyon süresi 300 s'dir. Deneysel tasarımda, koşul sayısını 4 ve her koşul için döngü sayısını 2 olarak ayarlayın. Koşulları 4 olarak ayarlayın, rejenerasyon çözeltisi: Glisin 1.5, 2.0, 2.5, 3.0, temas süreleri: 30 s, ardından çalıştırmadan önce astarı kontrol edin.
- Her PD-L1 konsantrasyonunu 96 oyuklu bir mikroplaka düzeninde ayrı bir numune kuyusu konumu olarak ayarlayın: R1 A1 ila R1 A9: 1 μM PD-L1; R1 A10 - R1 A12: HBS-EP+ tamponu; R1 B1: Glisin 1.5; R1 B2: Glisin 2; R1 B3: Glisin 2.5; R1 B4: Glisin 3.
NOT: Rejenerasyon tamponu olarak farklı pH'lara sahip glisin tamponu kullanılır. - PD-L1 çözeltisini hazırlayın: 100 μg İnsan PD-L1 Fc Tag proteinine (9.42 μM) 200 μL DNaz içermeyen su ekleyin, ardından HBS-EP + tamponunda 1 μM'ye seyreltin.
- İlgili tüm reaktifleri adım 3.2'de açıklandığı gibi düzene yerleştirin. Tüp A'yı 1× HBS-EP+ arabelleğine yerleştirin, ardından bakım sensörü çipini SA çipiyle değiştirin. Rejenerasyon İzciliği yöntemini yeniden açın, adım 3.2'deki tüp konumunu takip edin, reaktif rafını yerleştirin ve ardından tahmini çalışma süresi boyunca yöntemi çalıştırın .
- Adım 1.6'yı tekrarlayın.
4. PD-1/PD-L1 etkileşiminin doğrulanması
NOT: Doğrulama için, daha önce yayınlanmış bir rapor18'i küçük ayarlamalar izlemiştir.
- Genel Ayarlar, Tahlil Adımları ve Döngü Türleri altında yayınlanan raporla aynı parametreleri kullanın, temas süresini 60 s'ye, ayrışma süresini 60 s'ye ve akış hızını 30 μL/dk'ya ayarlayın. Yöntem değişkenleri, değerlendirme değişkenleri ve komutlar altında, Glisin 2.0'ı Rejenerasyon olarak kullanmak dışında aynı ayarı kullanın, akış hızını 30 μL/dk'ya ayarlayın, 1, 2, 3, 4 akış yolundan geçer.
- Ardından çalıştırmayı ayarlayın ve akış yolunu seçin: 2-1, 4-3. 0 μM, 0.037 μM, 0.111 μM, 0.333 μM konsantrasyonlar ve 51.300 Da moleküler ağırlığa sahip PD-L1 girin. Doğrulama için tüm tahlil adımlarını kontrol edin ve çalıştırmadan önce primer'ı seçin.
- Ardından her bir PD-L1 konsantrasyonunu bir Reaktif Raf 2 düzeninde ayrı bir numune kuyusu konumu olarak ayarlayın: R2 B1: PD-L1 0 μM; R2 B2: PD-L1 0,037 μM; R2 B3: PD-L1 0,111 μM; R2 B4: PD-L1 0,333 μM; R2 A1: Rejenerasyon tamponu olarak Glisin 2.0; R2 A2: Başlangıç arabelleği olarak HBS-EP+.
- 200 mL 1× HBS-EP + çalışan tampon çözeltisi hazırlayın. PD-L1 konsantrasyonlarını hazırlayın: PD-L1 proteinini HBS-EP + içinde 9.42 μM ila 0.333 μM, 0.111 μM ve 0.037 μM'de seyreltin. Ardından ilgili tüm reaktifleri adım 4.1.2'de açıklandığı gibi düzene yerleştirin.
- Tüp A'yı 1× HBS-EP+ çalışan tampon çözeltisine yerleştirin, bakım sensörü çipini çıkarın ve SA çipini takın. Rejenerasyon keşif yöntemini yeniden açın, adım 4.1'deki tüp konumlandırmasını takip edin, reaktif rafı 2'yi takın ve yöntemi tahmini süre boyunca çalıştırın .
- Adım 1.6'yı tekrarlayın.
5. Küçük molekül inhibitörü ile PD-1 / PD-L1 blokaj testi: BMS-1166
NOT: Abluka testi için, daha önce yayınlanmış bir rapor18'i küçük ayarlamalarla takip etti.
- Genel Ayarlar, Tahlil Adımları ve Döngü Türleri altında yayınlanan raporla aynı parametreleri kullanın, temas süresini 60 s'ye, ayrışma süresini 60 s'ye ve akış hızını 30 μL/dk'ya ayarlayın. Yöntem değişkenleri altında, değerlendirme değişkenleri ve komutlar da aynı ayarı kullanır, Glisin 2.0'ın Rejenerasyon olarak kullanılması dışında, akış hızını 30 μL/dk'ya ayarlayın, 1, 2, 3, 4 akış yolundan geçer.
- Ardından çalıştırmayı ayarlayın ve akış yolunu seçin: 2-1, 4-3. Örnek çözeltiyi girin: 0 μM, 0.125 μM, 0.625 μM, 3.125 μM'de BMS-1166 ile PD-L1 (0.111 μM, 51.300 Da moleküler ağırlık). Doğrulama için tüm test adımlarını kontrol edin ve çalıştırmadan önce primer'ı seçin.
- Ardından her bir PD-L1 konsantrasyonunu bir Reaktif Raf 2 düzeninde ayrı bir numune kuyusu konumu olarak ayarlayın: R2 B1: PD-L1 (0,111 μM) + BMS-1166 0 μM R2 B2: PD-L1 (0,111 μM) + BMS-1166 0,125 μM; R2 B3: PD-L1 (0,111 μM) + BMS-1166 0,625 μM; R2 B4: PD-L1 (0.111 μM) + BMS-1166 3.125 μM; R2 A1: Rejenerasyon için Glisin 2.0.
- 200 mL 1× HBS-EP + çalışan tampon çözeltisi hazırlayın. BMS-1166/PD-L1 karışımını hazırlayın: 100 mM'lik bir stok çözeltisi hazırlamak için 5 mg BMS-1166'yı 77.99 μL Dimetil sülfoksit (DMSO) içinde çözün. Stok çözeltisini PD-L1 proteini (0.11 μM) ile HBS-EP + 'da 0 μM, 0.125 μM, 0.625 μM ve 3.125 μM'de BMS-1166 hedef konsantrasyonlarına seyreltin. İlgili tüm reaktif düzenini adım 5.1.2'de açıklandığı gibi yerleştirin.
- Tüp A'yı 1× HBS-EP+ çalışan arabellek çözeltisine yerleştirin, ardından bakım sensörü çipini çıkarın ve SA çipini takın. Rejenerasyon keşif yöntemini yeniden açın, 5.1'den itibaren tüp konumunu takip edin ve reaktif rafı 2'yi takın, ardından tahmini çalışma süresi boyunca yöntemi çalıştırın .
- Adım 1.6'yı tekrarlayın.
Sonuçlar
SA'nın CM5 çipi üzerinde immobilizasyonu
Veriler, akış hücresi 1 ve akış hücresi 2'de SA proteininin hedef RU'suna (2000 RU) başarılı bir şekilde ulaşıldığını gösteren SPR cihazından ve ilgili analiz yazılımından elde edilen çıktı aracılığıyla analiz edildi. Akış hücreleri 1 ve 2, CM5 çip yüzeyinde SA (40 μg/mL) ile hareketsiz hale getirildi ve akış hücresi 1'de 1902.3 RU (Şekil 1A) ve akış hücresi 2'de 1900.7 RU (Şekil 1B) nihai yanıt verildi.
PD-1'in SA çipi üzerinde immobilizasyonu
SPR cihazından ve ilgili yazılımdan elde edilen çıktıya dayalı veri analizi, akış hücresi 1'deki boş hücre için düşük bir yanıt birimi (RU) ve akış hücresi 2'deki PD-1 ligandı için hedef RU'ya (4000 RU) başarılı bir şekilde ulaşıldığını gösterdi. Akış hücresi 1, -161.0 RU'luk bir nihai yanıt verecek şekilde boş olarak immobilize edildi (Şekil 2A), akış hücresi 2, SA çipi üzerinde kaplanmış biyotinile PD-1 proteini (10 μg / mL) ile immobilize edildi ve 3698.5 RU'luk bir nihai yanıt ile sonuçlandı (Şekil 2B).
PD-1 ve PD-L1 için rejenerasyon keşfi.
Rejenerasyon keşfi, akış hücresi 2 üzerinde hareketsiz hale getirilmiş PD-1 ve çeşitli Glisin pH seviyelerinde (0.1, 1.5 μM) çözelti içinde (0.1 μM) PD-L3 ile stabil bir taban çizgisi ve numune yanıtı ile sonuçlanan rejenerasyon çözeltisinin belirlenmesi için gerçekleştirildi. Veriler, SPR cihazından ve analiz yazılımından elde edilen çıktı aracılığıyla analiz edildi ve hem taban çizgisi hem de numune yanıtı için yanıttaki minimum değişiklikler nedeniyle optimal rejenerasyon koşulu olarak Glisin (pH 2.0) ile sonuçlandı, bu da minimum PD-1 protein kaybını ve PD-L1 proteininin çip yüzeyinden başarılı bir şekilde çıkarılmasını gösterir. Glisin pH 2.0'da, başlangıç yanıtı nispeten sabit kaldı ve analit yanıtı stabildi ve deneyin başlangıcındaki yanıta yakındı, bu da test edilen dört glisin pH koşulu arasında en optimal rejenerasyon tamponunu gösteriyordu. Daha yüksek bir pH yetersizdir ve daha düşük bir pH çok serttir; pH 2.0 en uygun rejenerasyon koşulu olarak tanımlanmıştır (Şekil 3).
PD-1/PD-L1 etkileşiminin doğrulanması
Veriler, ilgili değerlendirme yazılımı kullanılarak analiz edildi. Kinetik/Benzeşim bölümünün altında, "yüzeye bağlı"yı seçin, 2-1 eğrisini seçin, kinetik modeli 1:1 bağlamaya ayarlayın ve ilişkilendirme oranını (ka), ayrışma oranını (kd) ve denge ayrışma sabitini (KD) belirlemek için RI parametresini sabit bir uyuma ayarlayın. PD-L1'in değişen konsantrasyonlarda PD-1 ile bağlanma etkileşimi ölçüldü ve ölçülebilir bir yanıt verdi (Şekil 4). Analiz edilen bağlanma parametreleri arasında 3.611 × 104 (1/Ms) bir birleşme oranı (ka), 0.0236 (1/s) ayrışma hızı (kd) ve 10-7 M'× 6.536 denge ayrışma sabiti (KD) vardı.
Yerleşik küçük molekül inhibitörü ile PD-1/PD-L1 blokaj testi: BMS-1166
Veriler karşılık gelen veriler kullanılarak analiz edilmiştir. Kinetik/Benzeşim altında, yüzeye bağlı'yı seçin, 2-1 eğrisini seçin, ardından sonucun ve yanıt biriminin görselleştirilmiş eğrisini elde edin. PD-1/PD-L1 bağlanma etkileşiminin blokaj etkisi, HBS EP+ tamponunda 0.11 μM PD-L1 proteini ile BMS-1166 (0-3.125 μM) ile gözlendi (Şekil 5). En yüksek yanıt birimi tek başına PD-L1 ile tanımlanırken, artan BMS-1166 konsantrasyonu ile bağlanma yanıt birimi orantılı olarak azalır.

Şekil 1: SA'nın CM5 çipi üzerinde immobilizasyonu. Streptavidin proteininin CM5 çip akış hücresi 1 (A) ve akış hücresi 2 (B) üzerindeki immobilizasyon eğrileri gösterilmiştir. İlk olarak, SA proteininin beş ön konsantrasyonu, akış hücreleri 1 ve 2 üzerinden aktı, ardından bir NaOH yıkaması ve stabil bir taban çizgisinin oluşturulması. Daha sonra, EDC ve NHS eklendi ve daha sonra bir etanolamin hidroklorür yıkaması yapıldı. Daha sonra, hedef seviyeye (2000 RU) ulaşmak için beş PD-1 darbesi gerçekleştirildi, ardından elektrostatik olarak bağlı ligandları çıkarmak ve reaktif olmayan NHS-esterlerini devre dışı bırakmak için bir etanolamin hidroklorür yıkaması yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 2: PD-1'in SA çipi üzerinde immobilizasyonu. (A) sadece SA ile kaplanmış boş akış hücresi 1'in ve (B) akış hücresi 2'deki SA çipi üzerindeki PD-1 proteininin immobilizasyon eğrileri gösterilmiştir. Boşluk için (akış hücresi 1), 1 M NaCl ve 50 mM NaOH üç kez enjekte edildi, ardından %50 izopropanol/1 M NaCl/50 mM NaOH ile yıkama yapıldı. PD-1 proteini (akış hücresi 2) için, 1 M NaCl ve 50 mM NaOH üç kez enjekte edildi, ardından 4000 RU'luk hedef seviyeye ulaşmak için beş PD-1 proteini darbesi ve %50 izopropanol/1 M NaCl/50 mM NaOH'lik bir son yıkama yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Resim 3: PD-1 ve PD-L1 için rejenerasyon keşfi. Numune testinden önce optimal rejenerasyon çözeltisini belirlemek için pH 1.5, 2, 2.5 ve 3'te Glisin ile dört rejenerasyon koşulu için taban çizgisi ve numune yanıtı elde edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: PD-1/PD-L1 etkileşiminin doğrulanması. Streptavidin kaplı talaş yüzeyinde PD-L1'in (0.037 μM, 0.111 μM ve 0.333 μM) farklı konsantrasyonlarının PD-1'e bağlanma kinetiği. PD-L1, PD-1 ile belirgin bir ilişki (0-60 sn) ve ayrışma fazları (61-120 sn) gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
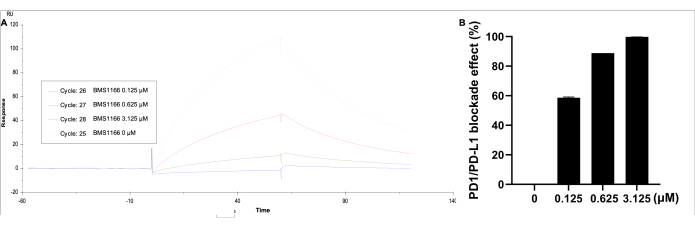
Şekil 5: Çözelti içinde PD-L1 (0.11 μM) ve BMS-1166 (0-3.125 μM) ile SA ile hareketsizleştirilmiş bir CM5 çipi üzerine kaplanmış PD-1'in SPR analizi. (A) BMS-1166 ile PD-1/PD-L1 arasındaki bağlanma reaksiyonlarının temsili bir gerçek zamanlı SPR yanıtı. (B) PD-1 / PD-L1 etkileşim bağlama kinetiği üzerindeki BMS-1166 yüzde blokaj etkisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: PD-1 protein immobilizasyon stratejilerinin karşılaştırılması. Amin kaplini (A) vs. çift aşamalı Streptavidin-biyotin bağlantısı (B). Amin bağlanması, erişilebilir bağlanma bölgelerinin sınırlı mevcudiyeti, bağlanmaya sterik engel ve immobilizasyon sırasında PD-1 bağlanma bölgelerinin potansiyel modifikasyonu dahil olmak üzere zorluklar sunar. Buna karşılık, çift aşamalı Streptavidin-biyotin yaklaşımı, hareketsizleştirilmiş PD-1 üzerindeki serbest bağlanma bölgelerinin mevcudiyetini arttırır ve çözelti içinde PD-L1 ile daha iyi etkileşimi kolaylaştırır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Son birkaç on yılda, kanser aşıları, bağışıklık kontrol noktası inhibitörleri ve CAR T hücresi tedavileri dahil olmak üzere çeşitli immünoterapi yaklaşımları, kanser tedavisini önemli ölçüde ilerletmiştir21. İmmün kontrol noktaları, patojenik yanıtlar sırasında immün hücre aracılı kollateral hasarın önlenmesinde ve otoimmünitenin baskılanmasında çok önemli bir rol oynar. Önemli bir örnek, kanser hücrelerinin bağışıklık gözetiminden kaçmasına izin veren önemli bir bağışıklık kontrol noktası oluşturan PD-L1 ve PD-1 arasındaki etkileşimdir. Monoklonal antikorlarla PD-1/PD-L1 yolağının hedeflenmesi klinik onkolojide kayda değer bir başarı sağlamıştır. Bununla birlikte, monoklonal antikor tedavileri ile ilişkili sınırlamalar ve bağışıklıkla ilişkili advers olayların artan insidansı nedeniyle, PD-1 / PD-L1'i hedefleyen küçük moleküllü inhibitörlerin geliştirilmesine artan bir ilgi vardır 9,22.
Küçük moleküllü PD-1/PD-L1 inhibitörleri için mevcut tarama stratejileri öncelikle ELISA, hücre bazlı raportör tahlilleri ve T-hücresi tahlilleri gibi biyo-tahlil tekniklerine odaklanmaktadır. SPR ve biyokatman İnterferometrisi (BLI) dahil olmak üzere biyofiziksel teknikler, bağlanma afinitelerinin karakterizasyonu için yaygın olarak kullanılmaktadır, ancak tarama araçları olarak kullanılma potansiyelleri hafife alınmaktadır23. Bu çalışma, küçük moleküllü PD-1/PD-L1 inhibitörü keşfi için uygun yüksek verimli bir platform sunan optimize edilmiş bir SPR tabanlı PD-1/PD-L1 blokaj testi geliştirmiştir. SA ~ 2000 RU'ya immobilize edildi, ardından biyotin-streptavidin etkileşimi yoluyla biyotinile PD-1 (~ 4000 RU) izledi. Bu sağlam bağlanma, spesifik olmayan bağlanmayı en aza indirerek ve protein kullanımını (10 μg/mL) azaltarak, optimum oryantasyonlu güvenli PD-1 kaplaması sağladı. Sahaya yönelik immobilizasyon, geleneksel yöntemlere kıyasla verimliliği artırdı. Glisin tamponu (pH 2.0), döngüler arasında sensör yüzeyini yeniden oluşturmak, deneysel bütünlüğü korumak ve spesifik olmayan bağlanmayı önlemek için kullanıldı.
Standart immünolojik yöntemler ve ELISA ile karşılaştırıldığında, bu SPR yaklaşımı, yüksek hassasiyet ve özgüllük ile gerçek zamanlı, etiketsiz algılama sundu. Ayrıca, 120 s/numune çalışma süresi ile yüksek verimli taramaya olanak tanır ve PD-1/PD-L1 hedefleme bileşiklerinin ve biyolojik maddelerin blokaj verimliliğini değerlendirmede biyolojik tahlilleri tamamlar. Elde edilen immobilizasyon seviyesi, benzer bir PD-1/PD-L1 etkileşim afinitesi (KD = 6.536 × 10-7 M'ye karşı 1.295 × 10-7 M) ile önceki platformla (3698.5 RU vs. 3688.5 RU) karşılaştırılabilirdi. BMS-1166 inhibitörü, daha önceki platformla karşılaştırılabilir blokaj etkileri ile daha düşük bir konsantrasyonda daha yüksek bir ayrışma oranı gösterdi (3.125 μM'de% 99.8'e karşı% 94.2). BMS-1166, HTRF ve hücre bazlı deneylerde sırasıyla 1.4 nM ve 96 nM'lik IC50 değerleri ile desteklenen PD-1 / PD-L1 blokaj oranlarını gösterdi24. Ek olarak, diğer çalışmalar, HTRF ve immün kontrol noktası blokaj ko-kültür test yöntemleri kullanılarak 3.9 nM ve 1574 nM'lik IC 50değerlerini bildirmiştir25. Önceki sonuçlarımız, BMS-1166'nın IC50 değerlerinin 85.4 nM olduğunu gösterdi, bu da bu önceki bulgularlatutarlıdır 18. Bu eleme platformunun bir diğer avantajı da sağlamlığı ve yüksek verimidir. Bu yöntem, her 10 numune için pozitif kontroller olarak dahil edilen BMS-1166 ve BMS-202 ile 384 oyuklu bir plaka formatı kullanılarak yüksek verimli taramada yaygın olarak uygulandı. Blokaj oranı aralıkları BMS-1166 için% 29.8 -% 38.1 ve, 10 nM'de BMS-202 için% 6.0 -% 10.4 idi (plaka başına n = 11).
DMSO'nun, yerel bileşimlerine ve yapılarına bağlı olarak, heterojen biyolojik zarlar üzerinde, zarla ilişkili biyolojik işlevleri potansiyel olarak etkileyen çeşitli etkilere sahip olması muhtemeldir. Nispeten düşük konsantrasyonlarda DMSO, çözeltideki protein özelliklerini değiştirerek denatürasyona, agregasyona veya bozulmaya yol açabilir. Ek olarak, DMSO, proteinlerin26,27 görünür bağlanma özelliklerini değiştirebilir. Ayrıca, DMSO paraziti ile ilgili önceki endişeleri gidermek için, bu protokolde DMSO konsantrasyonunu %0,003'e düşürdük (önceki platformda %0,01 DMSO kullanılmıştır).
Önceki bir çalışmada, PD-1 proteinleri, çip üzerindeki karboksimetil gruplarını aktive etmek için EDC/NHS kimyasını kullanan ve PD-1 üzerinde amin grupları ile kovalent bağlar oluşturan amin eşleşmesi kullanılarak sensör çipleri üzerinde hareketsiz hale getirildi. PD-1'in 288 amino asidi boyunca çoklu amin gruplarının varlığı nedeniyle, bu yöntem doğal olarak rastgele yönelimlerle sonuçlanır. Daha spesifik bir yönelim elde etmek için, bu çalışmada biyotinile edilmiş insan PD-1 (Fc, Avitag) ile bir yakalama birleştirme stratejisi kullandık. Avitag'daki tek lizin kalıntısı, PD-1'in Fc bölgesinde enzimatik olarak biyotinile edilir ve biyotin ve streptavidin arasındaki yüksek afiniteli etkileşim yoluyla hassas immobilizasyon sağlar (Şekil 6). Teorik olarak, bu yaklaşım, PD-1'in değişken alanının açıkta kalmasını sağlayarak tampondaki PD-L1 ile optimum etkileşimi kolaylaştırır. Bununla birlikte, bu varsayım, protein oryantasyonunu doğrulamak için kriyo-EM veya kristalografi gibi tekniklerin kullanılmasıyla daha fazla doğrulama gerektirir.
Glisin 2.0, hareketsizleştirilmiş PD-1'i azaltmadan PD-L1'i etkili bir şekilde uzaklaştıran hafif bir rejenerasyon tamponu olarak kullanıldı. Bununla birlikte, sıkıca bağlı inhibitörler veya protein agregatları için, sonraki numunelerle etkileşimi önlemek için %0.5 SDS veya 50-100 mM NaOH gibi daha güçlü rejenerasyon tamponları gerekebilir.
Bu çalışmanın bazı sınırlılıkları vardır. İlk olarak, SPR enstrümantasyonunun yüksek maliyeti erişilebilirliği sınırlayabilir, ancak protokol genellikle benzer yeteneklere sahip diğer SPR sistemleri için uyarlanabilir. Protein konsantrasyonu ve birleşme/ayrışma süreleri gibi parametreler, belirli SPR platformlarına uyacak şekilde ayarlanabilir. Diğer bir sınırlama, doğal protein etkileşimlerini tamamen kopyalayamayan rekombinant proteinlere dayanmasıdır. SPR verilerini yorumlarken ve sonuçları hücre bazlı tahliller veya in vivo modeller gibi tamamlayıcı tekniklerle karşılaştırırken bu faktörler göz önünde bulundurulmalıdır.
Bu sınırlamalara rağmen, optimize edilmiş SPR yöntemi, PD-1/PD-L1 etkileşiminin küçük moleküllü inhibitörlerini taramak için hızlı, gerçek zamanlı, yüksek verimli ve etiketsiz bir yaklaşım sunar. PD-1 / PD-L1 etkileşimini hedefleyen küçük molekülleri ve biyolojikleri karakterize etmek için biyofiziksel teknikleri önemli ölçüde geliştirir. Yüksek hassasiyeti ile platform, bağışıklık kontrol noktası etkileşimlerini ve daha geniş protein-protein etkileşimlerini (PPI) incelemek için özellikle değerlidir ve bu da onu PPI ilaç keşfini ilerletmek için güçlü bir araç haline getirir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar, Ulusal Sağlık Enstitüleri'nin (NIH) bir bileşeni olan Ulusal Araştırma Kaynakları Merkezi'nden (NCRR) Grant P20GM103430 tarafından desteklenen Rhode Island Üniversitesi'ndeki RI-INBRE çekirdek tesisini kabul etmektedir. Bu araştırma, Rhode Island Üniversitesi Eczacılık Fakültesi'nden bir Pilot Hibe Ödülü, Rhode Island Yaşam Bilimleri Merkezi'nden (RILSH) bir Küçük Hibe Ödülü ve bir Rhode Island Vakfı hibesi ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 50 mM NaOH | Cytiva Life Sciences | 100358 | |
| 50 mM NaOH | Fisher Scientific | 905376 | |
| 96-Well Polystyrene Microplates | Cytiva Life Sciences | BR100503 | |
| Amine Coupling Kit | Cytiva Life Sciences | 35120 | |
| Biacore T200 SPR System and Evaluation Software 3.2 | Cytiva Life Sciences | 28975001 | |
| Biotinylated Human PD-1 Fc, Avitag Protein | Acro Biosystems | PD1-H82F1 | |
| BMS1166 | MedChemExpress | HY-102011 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 276855 | |
| DNase Free Water | Fisher Scientific | 188506 | |
| Glycine 1.5 | Cytiva Life Sciences | BR100354 | |
| Glycine 2.0 | Cytiva Life Sciences | BR100355 | |
| Glycine 2.5 | Cytiva Life Sciences | BR100356 | |
| Glycine 3.0 | Cytiva Life Sciences | BR100357 | |
| HBS-EP+ Buffer | Cytiva Life Sciences | BR100669 | |
| Human PD-L1 Fc Tag Protein | Acro Biosystems | PD-1-H5258 | |
| Isopropanol | Fisher Scientific | BP2618-1 | |
| Microplate Foil, 96-Well | Cytiva Life Sciences | 28975816 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Plastic Vials 7 mm | Cytiva Life Sciences | BR100212 | |
| Rubber Caps, Type 3 | Cytiva Life Sciences | BR100502 | |
| Series S Sensor Chip CM5 | Cytiva Life Sciences | 29149603 | |
| Sodium Acetate 4.5 | Cytiva Life Sciences | 100350 | |
| Sodium Acetate 5.0 | Cytiva Life Sciences | 100351 | |
| Streptavidin | Sigma-Aldrich | S4762 |
Referanslar
- Ribas, A., Wolchok, J. D. Cancer immunotherapy using checkpoint blockade. Science. 359 (6382), 1350-1355 (2018).
- Zhang, X., et al. Structural and functional analysis of the costimulatory receptor programmed death-1. Immunity. 20 (3), 337-347 (2004).
- Freeman, G. J., et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 192 (7), 1027-1034 (2000).
- Han, Y., Liu, D., Li, L. PD-1/PD-L1 pathway: Current researches in cancer. Am J Cancer Res. 10 (3), 727-742 (2020).
- Lyu, N., et al. Recognition of PDL1/L2 by different induced-fit mechanisms of PD1: A comparative study of molecular dynamics simulations. Phys Chem Chem Phys. 22 (3), 1276-1287 (2020).
- Taube, J. M., et al. Colocalization of inflammatory response with B7-H1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Trans Med. 4 (127), 127ra37 (2012).
- Sun, X., et al. Immune-related adverse events associated with programmed cell death protein-1 and programmed cell death ligand 1 inhibitors for non-small cell lung cancer: A PRISMA systematic review and meta-analysis. BMC Cancer. 19 (1), 558 (2019).
- Alkholifi, F. K., Alsaffar, R. M. Dostarlimab an inhibitor of PD-1/PD-L1: A new paradigm for the treatment of cancer. Medicina. 58 (11), 1572 (2022).
- Uzar, W., et al. An updated patent review on PD-1/PD-L1 antagonists (2022-present). Expert Opin Ther Pat. 34 (8), 627-650 (2024).
- Ai, L., et al. Research status and outlook of PD-1/PD-L1 inhibitors for cancer therapy. Drug Des Devel Ther. 14, 3625-3649 (2020).
- Conroy, M., Naidoo, J. Immune-related adverse events and the balancing act of immunotherapy. Nat Commun. 13 (1), 392 (2022).
- Guzik, K., et al. Small-molecule inhibitors of the Programmed Cell Death-1/Programmed Death-Ligand 1 (PD-1/PD-L1) interaction via transiently induced protein states and dimerization of PD-L1. J Med Chem. 60 (13), 5857-5867 (2017).
- Sifniotis, V., Cruz, E., Eroglu, B., Kayser, V. Current advancements in addressing key challenges of therapeutic antibody design, manufacture, and formulation. Antibodies. 8 (2), 36 (2019).
- Beck, H., Härter, M., Haß, B., Schmeck, C., Baerfacker, L. Small molecules and their impact in drug discovery: A perspective on the occasion of the 125th anniversary of the Bayer Chemical Research Laboratory. Drug Discov Today. 27 (6), 1560-1574 (2022).
- Nguyen, H. H., Park, J., Kang, S., Kim, M. Surface plasmon resonance: A Versatile technique for biosensor applications. Sensors (Basel, Switzerland). 15 (5), 10481-10510 (2015).
- Liu, C., Seeram, N. P., Ma, H. Small molecule inhibitors against PD-1/PD-L1 immune checkpoints and current methodologies for their development: A review. Cancer Cell Int. 21 (1), 239 (2021).
- Hu, K., Li, X. -. J., Asmamaw, M. D., Shi, X. -. J., Liu, H. -. M. Establishment of high-throughput screening HTRF assay for identification small molecule inhibitors of Skp2-Cks1. Sci Rep. 11 (1), 21105 (2021).
- Puopolo, T., et al. Establishment of human PD-1/PD-L1 blockade assay based on surface plasmon resonance (SPR) biosensor. Bio-protoc. 13 (15), e4765 (2023).
- Ding, M., Chen, Y., Lang, Y., Cui, L. The role of cellular prion protein in cancer biology: A potential therapeutic target. Front Oncol. 11, 742949 (2021).
- Li, H., Seeram, N. P., Liu, C., Ma, H. Further investigation of blockade effects and binding affinities of selected natural compounds to immune checkpoint PD-1/PD-L1. Front Oncol. 12, 995461 (2022).
- Kamrani, A., et al. New immunotherapeutic approaches for cancer treatment. Pathol Res Pract. 248, 154632 (2023).
- Yan, Y., Zhang, L., Zuo, Y., Qian, H., Liu, C. Immune checkpoint blockade in cancer immunotherapy: mechanisms, clinical outcomes, and safety profiles of PD-1/PD-L1 inhibitors. Arch Immunol Ther Exp. 68 (6), 36 (2020).
- Chandrasekharan, G., Unnikrishnan, M. High throughput methods to study protein-protein interactions during host-pathogen interactions. Eur J Cell Biol. 103 (2), 151393 (2024).
- Zhang, Y., et al. BMS-202, a PD-1/PD-L1 inhibitor, decelerates the profibrotic effects of fibroblasts derived from scar tissues via ERK and TGFβ1/Smad signaling pathways. Immun Inflamm Dis. 10 (1), e591 (2022).
- Surmiak, E., et al. PD-L1 inhibitors: Different classes, activities, and mechanisms of action. Int J Mol Sci. 22 (21), 11797 (2021).
- Feoli, A., Sarno, G., Castellano, S., Sbardella, G. DMSO-Related effects on ligand-binding properties of lysine methyltransferases G9a and SETD8. ChemBioChem. 25 (4), e202300809 (2024).
- Tjernberg, A., Markova, N., Griffiths, W. J., HalléN, D. DMSO-Related effects in protein characterization. SLAS Discov. 11 (2), 131-137 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır