Method Article
تحديد مثبطات PD-1 / PD-L1 باستخدام تقنية رنين البلازمون السطحي
In This Article
Summary
يصف هذا البروتوكول اختبار الحصار لمثبطات PD-1 / PD-L1 باستخدام تقنية رنين البلازمون السطحي. يستخدم استراتيجية تثبيت مزدوجة الخطوتين ونظام عازل مخصص لقياس وحدات الاستجابة بدقة ، مما يسهل تقييم معدلات الحصار للمركبات أو الأدوية البيولوجية. بالإضافة إلى ذلك ، فهو يدعم تحديد مثبطات PD-1 / PD-L1 عالية الإنتاجية.
Abstract
يعد تعطيل تفاعل PD-1 / PD-L1 استراتيجية واعدة للعلاج المناعي للسرطان. تعد منصات الفحص الموثوقة ضرورية لتقييم فعالية مثبطات PD-1 / PD-L1. أظهر اختبار الحصار البشري PD-1 / PD-L1 الذي تم إنشاؤه مسبقا باستخدام تقنية الرنين البلازمي السطحي (SPR) (الجيل الأول من منصة فحص مثبط SPR PD-1 / PD-L1) نتائج مماثلة لتلك التي تم الحصول عليها من خلال التألق المتجانس الذي تم حله بمرور الوقت (HTRF) والمقايسات القائمة على الخلايا ، مع إمكانية الفحص على نطاق واسع. هنا ، يتم تقديم نسخة محسنة من هذا الاختبار (منصة فحص SPR مثبطة PD-1 / PD-L1 من الجيل الثاني) ، والتي تتميز بعملية اقتران مزدوجة الخطوة تجمع بين اقتران الأمين والستربتافيدين الحيوي لتعزيز التحكم في اتجاه PD-1 على الرقاقة وتقليل استهلاك بروتين PD-1. تم التحقق من صحة النظام الأساسي المحدث بنجاح باستخدام مثبط PD-1 / PD-L1 BMS-1166 ، مما يدل على تأثيرات الحصار المماثلة للطريقة السابقة القائمة على SPR والتقنيات الأخرى المعمول بها مثل ELISA. تؤكد هذه النتائج موثوقية النهج. توفر منصة فحص SPR المحسنة هذه أداة عالية الإنتاجية وموثوقة لتحديد مثبطات PD-1 / PD-L1 الجديدة ، وتعزيز أبحاث العلاج المناعي للسرطان ، وتسليط الضوء على إمكانات SPR في فحص مثبطات نقاط التفتيش المناعية.
Introduction
تقف علاجات الحصار المناعي لنقاط التفتيش ، لا سيما تلك التي تستهدف موت الخلايا المبرمج -1 (PD-1) و Programmed Cell Death-Ligand 1 (PD-L1) ، في طليعة استراتيجيات العلاج المناعي للسرطان. حصلت العلاجات المضادة ل PD-1 / PD-L1 على الموافقة على استخدامها في أنواع مختلفة من السرطان ، مثل سرطان الدم والجلد والرئة والكبد والمثانة البولية والكلى1. PD-1 هو بروتين سكري عبر الغشاء ينتمي إلى عائلة الغلوبولين المناعي الفائقة ، ويتميز بمجال شبيه بمتغير الغلوبولين المناعي (IgV) في الطرف N ، وساق من الأحماض الأمينية تقريبا 20 تفصل مجال IgV عن غشاء البلازما ، ومجال الغشاء ، وذيل سيتوبلازمي يحتوي على أشكال إشارات قائمة على التيروزين2. PD-L1 ، الذي تم تحديده على أنه أحد روابط PD-1 ، هو بروتين غشاء من النوع الأول يتميز بمنطقة عبر الغشاء ، ومجالين خارج الخلية - ثابت الغلوبولين المناعي (IgC) و IgV - ومجال سيتوبلازم قصير نسبيا يؤدي إلى مسارات الإشارات داخل الخلايا3. يعمل المسار المثبط PD-1 / PD-L1 كنقطة تفتيش مناعية حرجة تنظم تنشيط الخلايا التائية والمناعة الذاتية4. يتم التعبير عن PD-1 على الخلايا التائية ، حيث يتفاعل مع PD-L1 ، ويمنع إشارات مستقبلات الخلايا التائية ، ويمنع تحفيز جزيئات CD28 و CD80 على الخلايا العارضة للمستضد والخلايا التائية5. تستغل الأنسجة السرطانية هذه الآلية الفسيولوجية عن طريق الإفراط في التعبير عن PD-L1 أثناء مرحلة الهروب ، وبالتالي خلق بيئة مثبطة للمناعة تعزز نمو الورموتطوره 6. تعطل مثبطات PD-1 و PD-L1 هذا التفاعل ، مما يمكن الجهاز المناعي من التهرب من القمع الناجم عن الورم وإعادة بدء عملية موت الخلايا السرطانية بوساطة الخلاياالتائية 7.
بناء على الأساس الذي أرساه الدور البارز لعلاجات الحصار المناعي لنقاط التفتيش ، أدى تطوير مثبطات PD-1 / PD-L1 إلى تقدم كبير في العلاج المناعي للسرطان. أيدت إدارة الغذاء والدواء الأمريكية (FDA) تسعة مثبطات لنقاط التفتيش المناعية التي تستهدف على وجه التحديد مسار PD-1 / PD-L1. وتشمل هذه ستة مثبطات PD-1 - بيمبروليزوماب ، ودوستارليماب ، ونيفولوماب ، وسيميبليماب ، وأوريباليماب ، وتيسليليزوماب - وثلاثة مثبطات PD-L1 - أتيزوليزوماب ، أفيلوماب ، ودورفالوماب8،9. تم استخدام هذه العلاجات بشكل فعال لعلاج مجموعة متنوعة من السرطانات ، مثل الورم الميلانيني وسرطان الرئة وسرطان الظهارة البولية وسرطان عنق الرحم وسرطان المعدة أو المريء والأورام الصلبةالأخرى 10. على الرغم من فعاليتها ، تواجه العلاجات القائمة على الأجسام المضادة أحادية النسيلة قيودا كبيرة ، بما في ذلك معدلات الاستجابة المنخفضة ، والتكاليف المرتفعة ، وفترات النصف الطويلة ، والأحداث الضائرة الشديدة المرتبطة بالمناعة ، والقيود المفروضة على الولادة الوريدية أو تحت الجلد11 ، 12 ، 13. وبالتالي ، تركز الأبحاث بشكل متزايد على تطوير مثبطات جزيئات صغيرة تستهدف محور PD-1 / PD-L1. توفر هذه الجزيئات الصغيرة مزايا مميزة ، مثل تحسين الاختراق الخلوي ، وتعديل الأهداف البيولوجية المتنوعة ، وتعزيز التوافر البيولوجي عن طريق الفم ، وخفض التكاليف ، بهدف تحقيق نتائج علاجية قابلة للمقارنة مع آثار ضارةأقل 14. ومع ذلك ، فإن تطوير مثبطات الجزيئات الصغيرة التي تستهدف تفاعل PD-1 / PD-L1 لا يزال في مراحله الأولى ، ويرجع ذلك أساسا إلى عدم وجود منصة فحص موثوقة عالية الإنتاجية. هذه المنصات ضرورية للتقييم السريع للمكتبات الواسعة من الجزيئات الصغيرة وتحديد مركبات الرصاص لمزيد من التحقق والتحسين. التغلب على هذا التحدي أمر بالغ الأهمية للنهوض بالعلاج المناعي للسرطان.
يتم استخدام تقنية رنين البلازمون السطحي (SPR) على نطاق واسع في الكشف عن الجزيئات الحيوية المختلفة ، بما في ذلك مستضدات الأجسام المضادة والإنزيمات والأحماض النووية والأدوية ، وهي فعالة بشكل خاص في فحص الأدوية الجزيئات الصغيرة15،16. على عكس التقنيات الفيزيائية الحيوية الأخرى ، يوفر SPR اكتشافا خاليا من الملصقات ، وبيانات حركية في الوقت الفعلي ، ونطاق كشف واسع. في المقابل، يفتقر كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة إلى رؤى حركية في الوقت الفعلي ويتطلب أحجام عينات أكبر، مما يحد من الإنتاجية. الرحلان الحراري المجهري عرضة للتداخل المؤقت ولا يمكنه توفير بيانات حركية ، في حين أن قياس تداخل الطبقة الحيوية له قيود خاصة بالتطبيق بناء على الحجم الجزيئي وخصائصه. يتطلب التألق المتجانس الذي تم حله زمنيا وضع العلامات وهو عرضة للتداخل الفلوري. نحن نقر بأن HTRF هي تقنية أخرى مناسبة لاستكشاف مثبطات PD-1 / PD-L1. أحد القيود المتأصلة في HTRF ، مقارنة ب SPR ، هو التبريد الفلوري الناجم عن التفاعلات الخارجية مع عملية الإثارة داخل الجزيئات (على سبيل المثال ، نقل الإلكترون ، FRET ، والتبييض) ، والحساسية منخفضة جدا في عملية فحص الأدوية بسبب نطاق النافذة الصغير ، والتداخل من مركبات مكتبة الفلورسنت أو البروتينات البيولوجية17. تضع هذه الميزات SPR كأداة متفوقة لاكتشاف الأدوية. أظهرت دراساتنا السابقة أن SPR قادر على تحديد تأثير الحصار للجزيئات الصغيرة ضد PD-1 / PD-L1 ، وهو أمر مفيد على التقنيات الأخرى التي تتطلب متطلبات تقنية وضع العلامات العالية ، وخطوات متعددة ، وخصوصية رديئة ، وتكلفة عالية في عملية اكتشافالدواء 18.
تقدم هذه الدراسة نظاما أساسيا محسنا قائما على SPR ، يدمج عملية اقتران مزدوجة الخطوة تستخدم كلا من اقتران الأمين والستربتافيدين الحيوي لتعزيز اتجاه PD-1 على الرقاقة وتقليل استخدام البروتين. تم التحقق من صحة هذا النهج المحدث بنجاح باستخدام مثبط PD-1 / PD-L1 BMS-1166 كموثق تحكم إيجابي ، مما يدل على تأثيرات الحصار المماثلة لكل من طريقة SPR السابقة والتقنيات الأخرى الراسخة مثل ELISA19،20. هذا لا يؤكد موثوقية بروتوكولنا وقابليته للتكرار فحسب ، بل يوضح أيضا فعالية منصتنا المعدلة في تسهيل الفحص عالي الإنتاجية لمثبطات PD-1 / PD-L1. يوفر دمج خطوة التقاط الستربتافيدين الحيوي توجيها موجها للموقع بدلا من اتجاه البروتين العشوائي ، مما يسمح بتقليل تركيز PD-1 (40 ميكروغرام / مل مقابل 10 ميكروغرام / مل) وتوفير التكاليف من خلال تمكين المستخدم النهائي من شل حركة الستربتافيدين (SA) إلى شريحة CM5 ، وهو بديل أقل تكلفة لرقائق SA المسموقة مسبقا. هذا يجعلها مفيدة للفحوصات واسعة النطاق والفعالة من حيث التكلفة للمكتبات المركبة / الببتيد. على الرغم من أن طرق التوصيف الإضافية ، بما في ذلك المقايسات في السيليكو ، في المختبر ، وفي الجسم الحي ، ضرورية لتقييم الإمكانات السريرية لمثبطات PD-1 / PD-L1 ضد السرطان ، إلا أن منصة الفحص المحسنة القائمة على SPR تبرز كأداة فعالة للفحص على نطاق واسع لمثبطات PD-1 / PD-L1.
Protocol
الكواشف والمعدات مدرجة في جدول المواد.
1. تثبيت بروتين الستربتافيدين (SA) على شريحة CM5
- قم بإعداد طريقة تثبيت الحركة على أداة SPR: قالب معالج مفتوح/جديد ، واختر التثبيت وتعيين نوع الرقاقة إلى CM5، وخلايا التدفق لكل دورة إلى 1. تحقق من تثبيت خلية التدفق 1 وخلية التدفق 2.
- قم بتعيين Amine كطريقة الشلل. حدد الهدف لمستوى الجمود ، تركيز الترابط: 40 ميكروغرام / مل ستربتافيدين ، المستوى المستهدف: 2000 RU ، محلول الغسيل: 50 ملي هيدروكسيد الصوديوم. بعد ذلك ، تحقق من Prime قبل التشغيل.
- تحضير الأنابيب التالية: R2 B1 و R2 C1 - 40 ميكروغرام / مل ستربتافيدين ؛ R2 B2 و R2 C2: 50 ملي من هيدروكسيد الصوديوم ؛ R2 B3 و R2 C3: EDC; R2 B4 و R2 C4: NHS; R2 B5 و R2 C5: فارغة; R2 B6 و R2 C6: الإيثانولامين.
ملاحظة: يقوم EDC و NHS بتنشيط مجموعات الكربوكسيل على شريحة CM5 ، مما يسمح بالاقتران التساهمي مع الأمينات الموجودة على الترابط. يستخدم الإيثانولامين كمخزن مؤقت لمنع الارتباط غير المحدد أثناء الشلل. - قم بتخفيف 20 مل من المخزن المؤقت HBS-EP + 10× في 180 مل من الماء منزوع الأيونات (DI) لتحضير 200 مل من محلول عازل تشغيل 1× HBS-EP +.
- أضف 1 مل من الماء الخالي من DNase إلى 1 مجم من الستربتافيدين واحتضنه في درجة حرارة الغرفة لمدة 30 دقيقة. بعد ذلك ، قم بتخفيف محلول الستربتافيدين إلى 40 ميكروغرام / مل في محلول الأسيتات (الرقم الهيدروجيني 4.5). قم بإعداد كواشف مجموعة كاشف Amine Coupling وفقا لتعليمات الشركة المصنعة وضع جميع تخطيطات الكاشف ذات الصلة كما هو موضح في الخطوة 1.2.
- استبدل شريحة مستشعر الصيانة بشريحة CM5 ، ثم ضع الأنبوب A في المخزن المؤقت 1× HBS-EP + المحضر ، وأعد فتح طريقة الشلل ، وأدخل الأنابيب وفقا لتخطيط الخطوة 1.2. قم بتشغيل الطريقة واحفظ ملف النتائج.
- صيانة ما بعد التشغيل: استبدل شريحة CM5 بشريحة مستشعر الصيانة ، ضع الأنبوب A في زجاجة مملوءة بالماء منزوع الأيونات ، وقم بتشغيل الأنبوب الأول. بعد إخراج شريحة CM5 ، اغسل الشريحة ببضع قطرات من ماء DI وجففها في الهواء. ضع الشريحة في أنبوب سعة 50 مل عند 4 درجات مئوية.
ملاحظة: يتيح SA الثابت لشريحة CM5 العمل كشريحة SA.
2. تثبيت بروتين PD-1 على شريحة SA
- قم بتعيين طريقة تثبيت الحركة على أداة SPR: قالب معالج مفتوح/جديد ، واختر التثبيت وتعيين نوع الرقاقة إلى SA، وتدفق الخلايا لكل دورة إلى 1. تحقق من تثبيت خلية التدفق 1 والخلية 2.
- اضبط التقاط SA-biotin كطريقة. بالنسبة للخلية 1 ، قم بتعيين الشلل الفارغ ، بالنسبة للخلية 2 ، حدد الهدف للمستوى الثابت ، 10 ميكروغرام / مل PD-1 باعتباره الترابط ، المستوى المستهدف: 4000 RU ، ثم تحقق من الأولوية قبل التشغيل.
ملاحظة: قم بإعداد الأنابيب التالية - R2 B1 و R2 C1: 1 م من كلوريد الصوديوم ، 50 ملي مولار من هيدروكسيد الصوديوم ؛ R2 B2 و R2 C2: 50٪ إيزوبروبانول / 50 ملي مولار من هيدروكسيد الصوديوم / 1 م من كلوريد الصوديوم ؛ R2 C3: 10 ميكروغرام / مل PD-1.
- اضبط التقاط SA-biotin كطريقة. بالنسبة للخلية 1 ، قم بتعيين الشلل الفارغ ، بالنسبة للخلية 2 ، حدد الهدف للمستوى الثابت ، 10 ميكروغرام / مل PD-1 باعتباره الترابط ، المستوى المستهدف: 4000 RU ، ثم تحقق من الأولوية قبل التشغيل.
- قم بإذابة 58.44 مجم من كلوريد الصوديوم في 1 مل من 50 ملي هيدروكسيد الصوديوم لتحضير 1 متر من كلوريد الصوديوم و 50 ملي مولار من محلول هيدروكسيد الصوديوم. قم بإذابة 58.44 مجم من كلوريد الصوديوم و 4.0 مجم من هيدروكسيد الصوديوم في 500 ميكرولتر من الماء ، ثم أضف 500 ميكرولتر من الأيزوبروبانول لتحضير محلول 50٪ من الأيزوبروبانول / 50 ملي هيدروكسيد الصوديوم / 1 م كلوريد الصوديوم.
- تحضير محلول PD-1: أضف 200 ميكرولتر من الماء الخالي من DNase إلى 100 ميكروغرام من PD-1 البشري الحيوي (Fc and Avitagged) واستقر في درجة حرارة الغرفة لمدة 30 دقيقة ، ثم خفف إلى 10 ميكروغرام / مل في مخزن الأسيتات (درجة الحموضة 5.0).
- ضع جميع تخطيطات الكاشف كما هو موضح في الخطوة 2.1. ضع الأنبوب A في محلول المخزن المؤقت للتشغيل 1× HBS-EP + ، ثم أخرج شريحة مستشعر الصيانة وأدخل شريحة SA (شريحة CM5 مطلية ببروتين الستربتافيدين من الخطوة 1). أعد فتح طريقة الشلل ، وأدخل رف الكاشف 2 ، وتحقق من المواضع ، ثم قم بتشغيل الطريقة لوقت التشغيل المقدر.
- كرر الخطوة 1.6.
3. استكشاف التجديد ل PD-1 و PD-L1
- قم بإعداد طريقة استكشاف التجديد: قالب معالج مفتوح / جديد ، واختر استكشاف التجديد ، واضبط مسار التدفق: 2-1 ، 4-3 ، ونوع الرقاقة إلى SA ، وتحقق من دورة تكييف التشغيل ، وسجل الحل ك HBS-EP + ، ووقت الاتصال على أنه 30 ثانية ، وعدد الحقن ك 3 ، والمحلول ك PD-L1 ، وقت الاتصال: 30 ثانية ، معدل التدفق: 30 ميكرولتر / دقيقة.
- بالنسبة لمعلمات التجديد ، يبلغ معدل التدفق 30 ميكرولتر / دقيقة ، وفترة الاستقرار 300 ثانية. في التصميم التجريبي ، قم بتعيين عدد الشروط على أنه 4 ، وعدد الدورات لكل شرط على أنه 2. اضبط الشروط على أنها 4 ، محلول التجديد: جلايسين 1.5 ، 2.0 ، 2.5 ، 3.0 ، أوقات الاتصال: 30 ثانية ، ثم تحقق من الأولوية قبل التشغيل.
- اضبط كل تركيز PD-L1 كموضع بئر عينة منفصل في تخطيط صفيحة دقيقة 96 بئرا: R1 A1 إلى R1 A9: 1 ميكرومتر PD-L1 ؛ R1 A10 إلى R1 A12: المخزن المؤقت HBS-EP+; R1 B1: جلايسين 1.5 ؛ R1 B2: الجلايسين 2 ؛ R1 B3: جلايسين 2.5 ؛ R1 B4: الجلايسين 3.
ملاحظة: يتم استخدام المخزن المؤقت للجلايسين بدرجة حموضة مختلفة كمخزن مؤقت للتجديد. - تحضير محلول PD-L1: أضف 200 ميكرولتر من الماء الخالي من DNase إلى 100 ميكروغرام من بروتين PD-L1 Fc Tag البشري (9.42 ميكرومتر) ، ثم خفف إلى 1 ميكرومتر في المخزن المؤقت HBS-EP +.
- ضع جميع الكواشف ذات الصلة في التخطيط كما هو موضح في الخطوة 3.2. ضع الأنبوب A في المخزن المؤقت 1× HBS-EP+ ، ثم استبدل شريحة مستشعر الصيانة بشريحة SA. أعد فتح طريقة Regenerate Scouting ، واتبع موضع الأنبوب من الخطوة 3.2، وأدخل حامل الكاشف، ثم قم بتشغيل الطريقة لوقت التشغيل المقدر.
- كرر الخطوة 1.6.
4. التحقق من صحة تفاعل PD-1 / PD-L1
ملاحظة: للتحقق من الصحة، تم اتباع تقريرمنشور سابقا 18 بتعديلات طفيفة.
- استخدم نفس المعلمات مثل التقرير المنشور ضمن الإعدادات العامة وخطوات الفحص وأنواع الدورات، واضبط وقت الاتصال على 60 ثانية، ووقت التفكك على 60 ثانية، ومعدل التدفق إلى 30 ميكرولتر/دقيقة. ضمن متغيرات الطريقة ومتغيرات التقييم والأوامر ، استخدم نفس الإعداد ، باستثناء استخدام Glycine 2.0 كتجديد ، ومعدل تدفق الإعداد إلى 30 ميكرولتر / دقيقة ، يمر عبر مسار التدفق 1 ، 2 ، 3 ، 4.
- ثم قم بإعداد التشغيل، واختر مسار التدفق: 2-1، 4-3. أدخل PD-L1 بتركيزات من 0 ميكرومتر ، 0.037 ميكرومتر ، 0.111 ميكرومتر ، 0.333 ميكرومتر ، ووزن جزيئي يبلغ 51,300 دال. تحقق من جميع خطوات الفحص للتحقق وحدد العدد الأولي قبل التشغيل.
- ثم قم بتعيين كل تركيز PD-L1 كموضع بئر عينة منفصل في تخطيط رف الكاشف 2: R2 B1: PD-L1 0 ميكرومتر؛ R2 B2: PD-L1 0.037 ميكرومتر; R2 B3: PD-L1 0.111 ميكرومتر ؛ R2 B4: PD-L1 0.333 ميكرومتر؛ R2 A1: الجلايسين 2.0 كمخزن مؤقت للتجدد. R2 A2: HBS-EP+ كمخزن مؤقت لبدء التشغيل.
- قم بإعداد 200 مل من محلول المخزن المؤقت للتشغيل 1× HBS-EP+. تحضير تركيزات PD-L1: قم بتخفيف بروتين PD-L1 عند 9.42 ميكرومتر إلى 0.333 ميكرومتر و 0.111 ميكرومتر و 0.037 ميكرومتر في HBS-EP +. ثم ضع جميع الكواشف ذات الصلة في التخطيط كما هو موضح في الخطوة 4.1.2.
- أدخل الأنبوب A في حل المخزن المؤقت للتشغيل 1× HBS-EP+ ، وأخرج شريحة مستشعر الصيانة ، وأدخل شريحة SA. أعد فتح طريقة استكشاف التجديد ، واتبع موضع الأنبوب من الخطوة 4.1 ، وأدخل رف الكاشف 2 ، وقم بتشغيل الطريقة للمدة المقدرة.
- كرر الخطوة 1.6.
5. اختبار الحصار PD-1 / PD-L1 مع مثبط جزيء صغير: BMS-1166
ملاحظة: بالنسبة لمقايسة الحصار ، تم اتباع تقريرنشر سابقا رقم 18 بتعديلات طفيفة.
- استخدم نفس المعلمات مثل التقرير المنشور ضمن الإعدادات العامة وخطوات الفحص وأنواع الدورات، واضبط وقت الاتصال على 60 ثانية، ووقت التفكك على 60 ثانية، ومعدل التدفق إلى 30 ميكرولتر/دقيقة. تحت متغيرات الطريقة ، تستخدم متغيرات التقييم والأوامر أيضا نفس الإعداد ، باستثناء استخدام Glycine 2.0 كتجديد ، ومعدل تدفق الإعداد إلى 30 ميكرولتر / دقيقة ، ويمر عبر مسار التدفق 1 ، 2 ، 3 ، 4.
- ثم قم بإعداد التشغيل، واختر مسار التدفق: 2-1، 4-3. أدخل محلول العينة: PD-L1 (0.111 ميكرومتر ، الوزن الجزيئي 51,300 Da) مع BMS-1166 عند 0 ميكرومتر ، 0.125 ميكرومتر ، 0.625 ميكرومتر ، 3.125 ميكرومتر. تحقق من جميع خطوات الفحص للتحقق وحدد العدد الأولي قبل التشغيل.
- ثم اضبط كل تركيز PD-L1 كموضع بئر عينة منفصل في تخطيط رف الكاشف 2: R2 B1: PD-L1 (0.111 ميكرومتر) + BMS-1166 0 ميكرومتر R2 B2: PD-L1 (0.111 ميكرومتر) + BMS-1166 0.125 ميكرومتر؛ R2 B3: PD-L1 (0.111 ميكرومتر) + BMS-1166 0.625 ميكرومتر؛ R2 B4: PD-L1 (0.111 ميكرومتر) + BMS-1166 3.125 ميكرومتر؛ R2 A1: جلايسين 2.0 للتجديد.
- قم بإعداد 200 مل من محلول المخزن المؤقت للتشغيل 1× HBS-EP+. تحضير خليط BMS-1166 / PD-L1: قم بإذابة 5 مجم من BMS-1166 في 77.99 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO) لتحضير محلول مخزون 100 ملم. قم بتخفيف محلول المخزون ببروتين PD-L1 (0.11 ميكرومتر) إلى التركيزات المستهدفة ل BMS-1166 عند 0 ميكرومتر و 0.125 ميكرومتر و 0.625 ميكرومتر و 3.125 ميكرومتر في HBS-EP +. ضع جميع تخطيطات الكواشف ذات الصلة كما هو موضح في الخطوة 5.1.2.
- ضع الأنبوب A في حل المخزن المؤقت للتشغيل 1× HBS-EP+ ، ثم أخرج شريحة مستشعر الصيانة وأدخل شريحة SA. أعد فتح طريقة استكشاف التجديد ، واتبع موضع الأنبوب من 5.1 ، وأدخل رف الكاشف 2 ، ثم قم بتشغيل الطريقة لوقت التشغيل المقدر.
- كرر الخطوة 1.6.
النتائج
تثبيت SA على شريحة CM5
تم تحليل البيانات عبر مخرجات من أداة SPR وبرنامج التحليل المرتبط بها مما يشير إلى التحقيق الناجح للهدف RU (2000 RU) لبروتين SA على خلية التدفق 1 وخلية التدفق 2. تم تثبيت خلايا التدفق 1 و 2 باستخدام SA (40 ميكروغرام / مل) على سطح شريحة CM5 مع استجابة نهائية تبلغ 1902.3 RU على خلية التدفق 1 (الشكل 1 أ) و 1900.7 RU على خلية التدفق 2 (الشكل 1 ب).
تثبيت PD-1 على شريحة SA
وأشار تحليل البيانات المستند إلى المخرجات من أداة SPR والبرمجيات المرتبطة بها إلى وجود وحدة استجابة منخفضة (RU) للخلية الفارغة في خلية التدفق 1 وتحقيق ناجح للوحدة RU المستهدفة (4000 RU) لترابط PD-1 على خلية التدفق 2. تم تجميد خلية التدفق 1 كفارغة ، مما أدى إلى استجابة نهائية تبلغ -161.0 RU (الشكل 2 أ) ، بينما تم تثبيت خلية التدفق 2 ببروتين PD-1 الحيوي (10 ميكروغرام / مل) المطلي على شريحة SA ، مما أدى إلى استجابة نهائية تبلغ 3698.5 RU (الشكل 2 ب).
استكشاف التجديد ل PD-1 و PD-L1.
تم إجراء استكشاف التجديد باستخدام PD-1 الثابت على خلية التدفق 2 ، و PD-L1 في المحلول (0.1 ميكرومتر) عند مستويات مختلفة من الأس الهيدروجيني للجلايسين (1.5 و 2 و 2.5 و 3) لتحديد محلول التجديد مما أدى إلى خط أساس مستقر واستجابة عينة. تم تحليل البيانات عبر الإخراج من أداة SPR وبرنامج التحليل ، مما أدى إلى الجلايسين (درجة الحموضة 2.0) كحالة تجديد مثالية بسبب الحد الأدنى من التغييرات في الاستجابة لكل من خط الأساس واستجابة العينة ، مما يشير إلى الحد الأدنى من فقدان بروتين PD-1 والإزالة الناجحة لبروتين PD-L1 من سطح الشريحة. في الرقم الهيدروجيني للجلايسين 2.0 ، ظلت استجابة خط الأساس ثابتة نسبيا ، وكانت استجابة التحليل مستقرة وقريبة من الاستجابة في بداية التجربة ، مما يشير إلى المخزن المؤقت الأمثل للتجديد بين ظروف الأس الهيدروجيني الأربعة للجلايسين المختبرة. درجة الحموضة العالية غير كافية ، ودرجة الحموضة المنخفضة قاسية للغاية. يتم تحديد الرقم الهيدروجيني 2.0 على أنه أنسب حالة تجديد (الشكل 3).
التحقق من صحة تفاعل PD-1/PD-L1
تم تحليل البيانات باستخدام برنامج التقييم المقابل. ضمن قسم الحركية / التقارب ، حدد "السطح المرتبط" ، واختر المنحنى 2-1 ، واضبط نموذج الحركية على ربط 1: 1 ، واضبط معلمة RI على ملاءمة ثابتة لتحديد معدل الارتباط (ka) ، ومعدل التفكك (kd) ، وثابت تفكك التوازن (KD). تم تحديد تفاعل الربط ل PD-L1 بتركيزات متفاوتة مع PD-1 ، مما أدى إلى استجابة قابلة للقياس (الشكل 4). تضمنت معلمات الربط التي تم تحليلها معدل ارتباط (ka) قدره 3.611 × 104 (1 / مللي ثانية) ، ومعدل تفكك (kd) قدره 0.0236 (1 / s) ، وثابت تفكك التوازن (KD) قدره 6.536 × 10-7 M.
مقايسة الحصار PD-1 / PD-L1 مع مثبط الجزيئات الصغيرة الثابت: BMS-1166
تم تحليل البيانات باستخدام المقابل. ضمن الحركية/التقارب، حدد السطح المرتبط، واختر المنحنى 2-1، ثم احصل على المنحنى المرئي لوحدة النتيجة والاستجابة. لوحظ تأثير الحصار لتفاعل ربط PD-1 / PD-L1 مع BMS-1166 (0-3.125 ميكرومتر) مع 0.11 ميكرومتر بروتين PD-L1 في HBS EP + المخزن المؤقت (الشكل 5). يتم تحديد أعلى وحدة استجابة بواسطة PD-L1 وحده ، بينما مع زيادة تركيز BMS-1166 ، تنخفض وحدة استجابة الربط بشكل متناسب.

الشكل 1: تثبيت SA على شريحة CM5. يتم عرض منحنيات تثبيت بروتين الستربتافيدين على خلية تدفق رقاقة CM5 1 (A) وخلية التدفق 2 (B). أولا ، تدفقت خمسة تركيزات مسبقة من بروتين SA فوق خليتي التدفق 1 و 2 ، تليها غسل هيدروكسيد الصوديوم وإنشاء خط أساس مستقر. بعد ذلك ، تمت إضافة EDC و NHS ، ثم تم إجراء غسل هيدروكلوريد الإيثانول ألامين. بعد ذلك ، تم إجراء خمس نبضات من PD-1 للوصول إلى المستوى المستهدف (2000 RU) ، متبوعا بغسل هيدروكلوريد الإيثانول أمين لإزالة الروابط المرتبطة بالكهرباء الساكنة وتعطيل استرات NHS التي تظل غير متفاعلة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
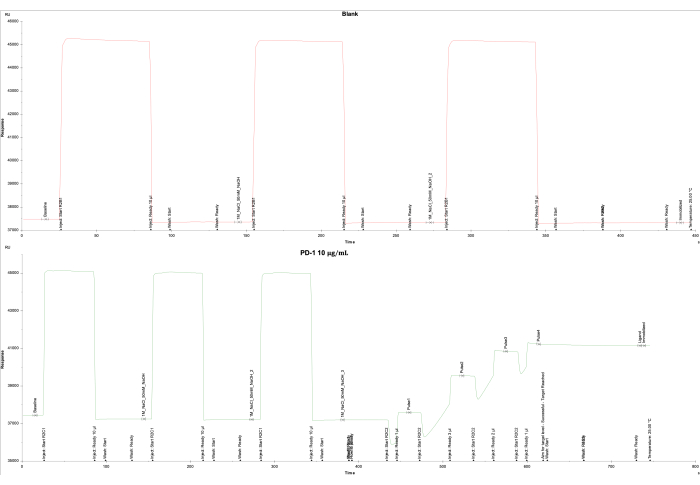
الشكل 2: تثبيت PD-1 على شريحة SA. يتم عرض منحنيات الشلل ل (A) خلية التدفق الفارغة 1 المغلفة ب SA فقط ، و (B) بروتين PD-1 على شريحة SA على خلية التدفق 2. بالنسبة للفراغ (خلية التدفق 1) ، تم حقن 1 م من كلوريد الصوديوم و 50 ملي مولار من هيدروكسيد الصوديوم ثلاث مرات ، تليها غسل بنسبة 50٪ إيزوبروبانول / 1 م من كلوريد الصوديوم / 50 ملي مولار من هيدروكسيد الصوديوم. بالنسبة لبروتين PD-1 (خلية التدفق 2) ، تم حقن 1 م من كلوريد الصوديوم و 50 ملي مولار من هيدروكسيد الصوديوم ثلاث مرات ، تليها خمس نبضات من بروتين PD-1 للوصول إلى المستوى المستهدف البالغ 4000 وحدة تغذية وغسل نهائي بنسبة 50٪ إيزوبروبانول / 1 م من كلوريد الصوديوم / 50 ملي مولار من هيدروكسيد الصوديوم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: استكشاف التجديد ل PD-1 و PD-L1. تم الحصول على خط الأساس واستجابة العينة لأربعة ظروف تجديد مع الجلايسين عند درجة الحموضة 1.5 و 2 و 2.5 و 3 لتحديد حل التجديد الأمثل قبل اختبار العينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحقق من صحة تفاعل PD-1 / PD-L1. حركية الربط بتركيزات مختلفة من PD-L1 (0.037 ميكرومتر ، 0.111 ميكرومتر ، و 0.333 ميكرومتر) إلى PD-1 على سطح الرقاقة المطلي بالستربتافيدين. يوضح PD-L1 ارتباطا متميزا (0-60 ثانية) ومراحل التفكك (61-120 ثانية) مع PD-1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
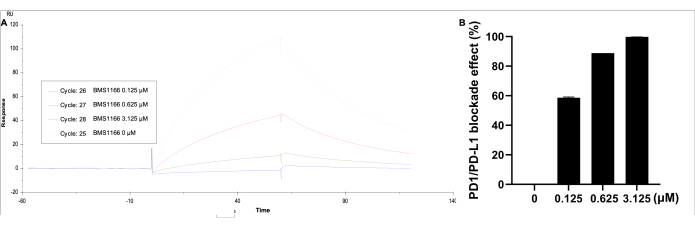
الشكل 5: تحليل SPR ل PD-1 المطلي على شريحة CM5 مشدودة SA ، مع PD-L1 (0.11 ميكرومتر) و BMS-1166 (0-3.125 ميكرومتر) في المحلول. (أ) استجابة SPR تمثيلية في الوقت الفعلي لتفاعلات الربط بين PD-1 / PD-L1 مع BMS-1166. (ب) تأثير الحصار بنسبة مئوية BMS-1166 على حركية ربط التفاعل PD-1 / PD-L1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: مقارنة بين استراتيجيات تثبيت البروتين PD-1. اقتران الأمين (A) مقابل اقتران الستربتافيدين والبيوتين ثنائي الخطوتين (ب). يمثل اقتران الأمين تحديات ، بما في ذلك التوافر المحدود لمواقع الربط التي يمكن الوصول إليها ، والعائق الفراغي للربط ، والتعديل المحتمل لمواقع ربط PD-1 أثناء الشلل. في المقابل ، يعزز نهج Streptavidin-biotin ثنائي الخطوة توافر مواقع الربط الحرة على PD-1 الثابت ، مما يسهل التفاعل المحسن مع PD-L1 في المحلول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
على مدى العقود القليلة الماضية ، أدت أساليب العلاج المناعي المختلفة - بما في ذلك لقاحات السرطان ، ومثبطات نقاط التفتيش المناعية ، وعلاجات الخلايا التائية CAR - إلى تطوير علاج السرطانبشكل كبير 21. تلعب نقاط التفتيش المناعية دورا مهما في منع الأضرار الجانبية التي تساطر فيها الخلايا المناعية أثناء الاستجابات المسببة للأمراض وفي قمع المناعة الذاتية. ومن الأمثلة الرئيسية على ذلك التفاعل بين PD-L1 و PD-1 ، والذي يشكل نقطة تفتيش مناعية رئيسية ، مما يسمح للخلايا السرطانية بالتهرب من المراقبة المناعية. حقق استهداف مسار PD-1 / PD-L1 بالأجسام المضادة وحيدة النسيلة نجاحا ملحوظا في علم الأورام السريري. ومع ذلك ، نظرا للقيود المرتبطة بعلاجات الأجسام المضادة وحيدة النسيلة وزيادة حدوث الأحداث الضائرة المرتبطة بالمناعة ، هناك اهتمام متزايد بتطوير مثبطات جزيئات صغيرة تستهدف PD-1 / PD-L19،22.
تركز استراتيجيات الفحص الحالية لمثبطات PD-1 / PD-L1 ذات الجزيئات الصغيرة بشكل أساسي على تقنيات المقايسة الحيوية مثل ELISA ، ومقايسات المراسل المستندة إلى الخلايا ، ومقايسات الخلايا التائية. تستخدم التقنيات الفيزيائية الحيوية ، بما في ذلك SPR وقياس تداخل الطبقة الحيوية (BLI) على نطاق واسع لتوصيف الصلات المرتبطة ، ولكن يتم التقليل من قدرتها على استخدامها كأدوات فحص23. طورت هذه الدراسة مقايسة حصار PD-1 / PD-L1 محسنة قائمة على SPR ، والتي توفر منصة عالية الإنتاجية مناسبة لاكتشاف مثبطات PD-1 / PD-L1 ذات الجزيئات الصغيرة. تم تثبيت SA إلى ~ 2000 RU ، متبوعا ب PD-1 البيوتينيل (~ 4000 RU) عبر تفاعل البيوتين والستربتافيدين. يضمن هذا الربط القوي طلاء PD-1 الآمن مع الاتجاه الأمثل ، مما يقلل من الارتباط غير المحدد ويقلل من استخدام البروتين (10 ميكروغرام / مل). أدى الشلل الموجه إلى الموقع إلى تحسين الكفاءة مقارنة بالطرق التقليدية. تم استخدام عازلة الجلايسين (درجة الحموضة 2.0) لتجديد سطح المستشعر بين الدورات ، والحفاظ على السلامة التجريبية ومنع الارتباط غير المحدد.
بالمقارنة مع الطرق المناعية القياسية و ELISA ، قدم نهج SPR هذا اكتشافا في الوقت الفعلي وخالي من الملصقات بحساسية وخصوصية عالية. علاوة على ذلك ، فإنه يتيح الفحص عالي الإنتاجية مع وقت تشغيل يبلغ 120 ثانية / عينة ويكمل المقايسات الحيوية في تقييم كفاءة الحصار للمركبات والأدوية البيولوجية التي تستهدف PD-1 / PD-L1. كان مستوى الشلل الذي تم تحقيقه مشابها للمنصة السابقة (3698.5 RU مقابل 3688.5 RU) ، مع تقارب تفاعل PD-1 / PD-L1 مماثل (KD = 6.536 × 10-7 M مقابل 1.295 × 10-7 M). أظهر مثبط BMS-1166 معدل تفكك أعلى بتركيز أقل ، مع تأثيرات حصار مماثلة للمنصة السابقة (99.8٪ مقابل 94.2٪ عند 3.125 ميكرومتر). أظهر BMS-1166 معدلات حصار PD-1 / PD-L1 مدعومة بقيم IC50 البالغة 1.4 نانومتر و 96 نانومتر في HTRF والمقايسات القائمة على الخلايا ، على التوالي24. بالإضافة إلى ذلك ، أبلغت دراسات أخرى عن قيم IC50 تبلغ 3.9 نانومتر و 1574 نانومتر باستخدام HTRF وطرق فحص الزراعة المشتركة لحصار نقاط التفتيش المناعية25. أظهرت نتائجنا السابقة أن قيم IC50 ل BMS-1166 كانت 85.4 نانومتر ، وهو ما يتوافق مع هذه النتائج السابقة18. ميزة أخرى لمنصة الفحص هذه هي متانتها وإنتاجيتها العالية. تم تطبيق هذه الطريقة على نطاق واسع في الفحص عالي الإنتاجية باستخدام تنسيق لوحة 384 بئرا ، مع تضمين BMS-1166 و BMS-202 كعناصر تحكم إيجابية لكل 10 عينات. كانت نطاقات معدل الحصار 29.8٪ -38.1٪ ل BMS-1166 و 6.0٪ -10.4٪ ل BMS-202 عند 10 نانومتر (ن = 11 لكل لوحة).
من المحتمل أن يكون ل DMSO تأثيرات متفاوتة على الأغشية البيولوجية غير المتجانسة ، اعتمادا على تكوينها المحلي وهيكلها ، مما قد يؤثر على الوظائف البيولوجية المرتبطة بالغشاء. بتركيزات منخفضة نسبيا ، يمكن ل DMSO تغيير خصائص البروتين في المحلول ، مما يؤدي إلى التمسخ أو التجميع أو التدهور. بالإضافة إلى ذلك ، قد يعدل DMSO خصائص الارتباط الظاهرة للبروتينات26،27. علاوة على ذلك ، لمعالجة المخاوف السابقة بشأن تداخل DMSO ، قمنا بتخفيض تركيز DMSO إلى 0.003٪ (تم استخدام 0.01٪ DMSO في النظام الأساسي السابق) في هذا البروتوكول.
في دراسة سابقة ، تم تثبيت بروتينات PD-1 على رقائق المستشعر باستخدام اقتران الأمين ، الذي يستخدم كيمياء EDC / NHS لتنشيط مجموعات الكربوكسي ميثيل على الرقاقة ، وتشكيل روابط تساهمية مع مجموعات الأمين على PD-1. نظرا لوجود مجموعات أمين متعددة عبر 288 من الأحماض الأمينية في PD-1 ، فإن هذه الطريقة تؤدي بطبيعتها إلى اتجاهات عشوائية. لتحقيق توجه أكثر تحديدا ، استخدمنا استراتيجية اقتران الالتقاط مع PD-1 البشري الحيوي (FC ، Avitag) في هذه الدراسة. يتم إيوتينيل بقايا اللايسين المفردة في Avitag إنزيميا في منطقة Fc من PD-1 ، مما يتيح الشلل الدقيق من خلال التفاعل عالي التقارب بين البيوتين والستربتافيدين (الشكل 6). من الناحية النظرية ، يضمن هذا النهج أن يظل المجال المتغير ل PD-1 مكشوفا ، مما يسهل التفاعل الأمثل مع PD-L1 في المخزن المؤقت. ومع ذلك ، يتطلب هذا الافتراض مزيدا من التحقق من الصحة باستخدام تقنيات مثل cryo-EM أو علم البلورات لتأكيد اتجاه البروتين.
تم استخدام الجلايسين 2.0 كمخزن مؤقت خفيف للتجديد ، مما أدى إلى إزالة PD-L1 بشكل فعال دون تقليل PD-1 الثابت ومع ذلك ، بالنسبة للمثبطات أو مجاميع البروتين المرتبطة بإحكام ، قد تكون هناك حاجة إلى مخازن تجديد أقوى ، مثل 0.5٪ SDS أو 50-100 ملي مولار من هيدروكسيد الصوديوم ، لمنع التداخل مع العينات اللاحقة.
هذه الدراسة لها العديد من القيود. أولا ، يمكن أن تحد التكلفة العالية لأجهزة SPR من إمكانية الوصول ، على الرغم من أنه يمكن في كثير من الأحيان تكييف البروتوكول لأنظمة SPR الأخرى ذات القدرات المماثلة. يمكن تعديل المعلمات مثل تركيز البروتين وأوقات الارتباط / التفكك لتناسب منصات SPR محددة. قيد آخر هو اعتماده على البروتينات المؤتلفة ، والتي قد لا تكرر تفاعلات البروتين الأصلية تماما. يجب مراعاة هذه العوامل عند تفسير بيانات SPR ومقارنة النتائج بالتقنيات التكميلية ، مثل المقايسات القائمة على الخلايا أو النماذج في الجسم الحي .
على الرغم من هذه القيود ، توفر طريقة SPR المحسنة نهجا سريعا في الوقت الفعلي وعالي الإنتاجية وخاليا من الملصقات لفحص مثبطات الجزيئات الصغيرة لتفاعل PD-1 / PD-L1. إنه يعزز بشكل كبير التقنيات الفيزيائية الحيوية لتوصيف الجزيئات الصغيرة والبيولوجيا التي تستهدف تفاعل PD-1 / PD-L1. بفضل حساسيتها العالية ، تعتبر المنصة ذات قيمة خاصة لدراسة تفاعلات نقاط التفتيش المناعية والتفاعلات الأوسع بين البروتين والبروتين (PPI) ، مما يجعلها أداة قوية لتعزيز اكتشاف أدوية PPI.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يقر المؤلفون بمرفق RI-INBRE الأساسي في جامعة رود آيلاند ، بدعم من Grant P20GM103430 من المركز الوطني لموارد البحث (NCRR) ، وهو أحد مكونات المعاهد الوطنية للصحة (NIH). تم دعم هذا البحث من خلال جائزة منحة تجريبية من كلية الصيدلة بجامعة رود آيلاند ، وجائزة منحة صغيرة من مركز رود آيلاند لعلوم الحياة (RILSH) ، ومنحة مؤسسة رود آيلاند ، وكلها منحت إلى تشانغ ليو ، دكتوراه.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mM NaOH | Cytiva Life Sciences | 100358 | |
| 50 mM NaOH | Fisher Scientific | 905376 | |
| 96-Well Polystyrene Microplates | Cytiva Life Sciences | BR100503 | |
| Amine Coupling Kit | Cytiva Life Sciences | 35120 | |
| Biacore T200 SPR System and Evaluation Software 3.2 | Cytiva Life Sciences | 28975001 | |
| Biotinylated Human PD-1 Fc, Avitag Protein | Acro Biosystems | PD1-H82F1 | |
| BMS1166 | MedChemExpress | HY-102011 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 276855 | |
| DNase Free Water | Fisher Scientific | 188506 | |
| Glycine 1.5 | Cytiva Life Sciences | BR100354 | |
| Glycine 2.0 | Cytiva Life Sciences | BR100355 | |
| Glycine 2.5 | Cytiva Life Sciences | BR100356 | |
| Glycine 3.0 | Cytiva Life Sciences | BR100357 | |
| HBS-EP+ Buffer | Cytiva Life Sciences | BR100669 | |
| Human PD-L1 Fc Tag Protein | Acro Biosystems | PD-1-H5258 | |
| Isopropanol | Fisher Scientific | BP2618-1 | |
| Microplate Foil, 96-Well | Cytiva Life Sciences | 28975816 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Plastic Vials 7 mm | Cytiva Life Sciences | BR100212 | |
| Rubber Caps, Type 3 | Cytiva Life Sciences | BR100502 | |
| Series S Sensor Chip CM5 | Cytiva Life Sciences | 29149603 | |
| Sodium Acetate 4.5 | Cytiva Life Sciences | 100350 | |
| Sodium Acetate 5.0 | Cytiva Life Sciences | 100351 | |
| Streptavidin | Sigma-Aldrich | S4762 |
References
- Ribas, A., Wolchok, J. D. Cancer immunotherapy using checkpoint blockade. Science. 359 (6382), 1350-1355 (2018).
- Zhang, X., et al. Structural and functional analysis of the costimulatory receptor programmed death-1. Immunity. 20 (3), 337-347 (2004).
- Freeman, G. J., et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 192 (7), 1027-1034 (2000).
- Han, Y., Liu, D., Li, L. PD-1/PD-L1 pathway: Current researches in cancer. Am J Cancer Res. 10 (3), 727-742 (2020).
- Lyu, N., et al. Recognition of PDL1/L2 by different induced-fit mechanisms of PD1: A comparative study of molecular dynamics simulations. Phys Chem Chem Phys. 22 (3), 1276-1287 (2020).
- Taube, J. M., et al. Colocalization of inflammatory response with B7-H1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Trans Med. 4 (127), 127ra37 (2012).
- Sun, X., et al. Immune-related adverse events associated with programmed cell death protein-1 and programmed cell death ligand 1 inhibitors for non-small cell lung cancer: A PRISMA systematic review and meta-analysis. BMC Cancer. 19 (1), 558 (2019).
- Alkholifi, F. K., Alsaffar, R. M. Dostarlimab an inhibitor of PD-1/PD-L1: A new paradigm for the treatment of cancer. Medicina. 58 (11), 1572 (2022).
- Uzar, W., et al. An updated patent review on PD-1/PD-L1 antagonists (2022-present). Expert Opin Ther Pat. 34 (8), 627-650 (2024).
- Ai, L., et al. Research status and outlook of PD-1/PD-L1 inhibitors for cancer therapy. Drug Des Devel Ther. 14, 3625-3649 (2020).
- Conroy, M., Naidoo, J. Immune-related adverse events and the balancing act of immunotherapy. Nat Commun. 13 (1), 392 (2022).
- Guzik, K., et al. Small-molecule inhibitors of the Programmed Cell Death-1/Programmed Death-Ligand 1 (PD-1/PD-L1) interaction via transiently induced protein states and dimerization of PD-L1. J Med Chem. 60 (13), 5857-5867 (2017).
- Sifniotis, V., Cruz, E., Eroglu, B., Kayser, V. Current advancements in addressing key challenges of therapeutic antibody design, manufacture, and formulation. Antibodies. 8 (2), 36 (2019).
- Beck, H., Härter, M., Haß, B., Schmeck, C., Baerfacker, L. Small molecules and their impact in drug discovery: A perspective on the occasion of the 125th anniversary of the Bayer Chemical Research Laboratory. Drug Discov Today. 27 (6), 1560-1574 (2022).
- Nguyen, H. H., Park, J., Kang, S., Kim, M. Surface plasmon resonance: A Versatile technique for biosensor applications. Sensors (Basel, Switzerland). 15 (5), 10481-10510 (2015).
- Liu, C., Seeram, N. P., Ma, H. Small molecule inhibitors against PD-1/PD-L1 immune checkpoints and current methodologies for their development: A review. Cancer Cell Int. 21 (1), 239 (2021).
- Hu, K., Li, X. -. J., Asmamaw, M. D., Shi, X. -. J., Liu, H. -. M. Establishment of high-throughput screening HTRF assay for identification small molecule inhibitors of Skp2-Cks1. Sci Rep. 11 (1), 21105 (2021).
- Puopolo, T., et al. Establishment of human PD-1/PD-L1 blockade assay based on surface plasmon resonance (SPR) biosensor. Bio-protoc. 13 (15), e4765 (2023).
- Ding, M., Chen, Y., Lang, Y., Cui, L. The role of cellular prion protein in cancer biology: A potential therapeutic target. Front Oncol. 11, 742949 (2021).
- Li, H., Seeram, N. P., Liu, C., Ma, H. Further investigation of blockade effects and binding affinities of selected natural compounds to immune checkpoint PD-1/PD-L1. Front Oncol. 12, 995461 (2022).
- Kamrani, A., et al. New immunotherapeutic approaches for cancer treatment. Pathol Res Pract. 248, 154632 (2023).
- Yan, Y., Zhang, L., Zuo, Y., Qian, H., Liu, C. Immune checkpoint blockade in cancer immunotherapy: mechanisms, clinical outcomes, and safety profiles of PD-1/PD-L1 inhibitors. Arch Immunol Ther Exp. 68 (6), 36 (2020).
- Chandrasekharan, G., Unnikrishnan, M. High throughput methods to study protein-protein interactions during host-pathogen interactions. Eur J Cell Biol. 103 (2), 151393 (2024).
- Zhang, Y., et al. BMS-202, a PD-1/PD-L1 inhibitor, decelerates the profibrotic effects of fibroblasts derived from scar tissues via ERK and TGFβ1/Smad signaling pathways. Immun Inflamm Dis. 10 (1), e591 (2022).
- Surmiak, E., et al. PD-L1 inhibitors: Different classes, activities, and mechanisms of action. Int J Mol Sci. 22 (21), 11797 (2021).
- Feoli, A., Sarno, G., Castellano, S., Sbardella, G. DMSO-Related effects on ligand-binding properties of lysine methyltransferases G9a and SETD8. ChemBioChem. 25 (4), e202300809 (2024).
- Tjernberg, A., Markova, N., Griffiths, W. J., HalléN, D. DMSO-Related effects in protein characterization. SLAS Discov. 11 (2), 131-137 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved