Method Article
Идентификация ингибиторов PD-1/PD-L1 с помощью технологии поверхностного плазмонного резонанса
В этой статье
Резюме
В данном протоколе описан анализ блокады ингибиторов PD-1/PD-L1 с использованием технологии поверхностного плазмонного резонанса. Он использует двухступенчатую стратегию иммобилизации и специализированную буферную систему для точного измерения единиц реагирования, облегчая оценку скорости блокады для соединений или биологических препаратов. Кроме того, он поддерживает высокопроизводительную идентификацию ингибиторов PD-1/PD-L1.
Аннотация
Нарушение взаимодействия PD-1/PD-L1 является перспективной стратегией иммунотерапии рака. Надежные платформы скрининга имеют важное значение для оценки эффективности ингибиторов PD-1/PD-L1. Ранее проведенный анализ блокады PD-1/PD-L1 человека с использованием технологии поверхностного плазмонного резонанса (SPR) (платформа для скрининга ингибитора PD-1/PD-L1 первого поколения) продемонстрировал результаты, сопоставимые с результатами, полученными с помощью гомогенной флуоресценции с временным разрешением (HTRF) и клеточных анализов, с потенциалом для крупномасштабного скрининга. В данной работе представлена оптимизированная версия этого анализа (платформа для скрининга SPR ингибитора PD-1/PD-L1 второго поколения), отличающаяся двухступенчатым процессом сопряжения, сочетающим связь амина и биострептавидина для улучшения контроля ориентации PD-1 на чипе и снижения потребления белка PD-1. Обновленная платформа была успешно валидирована с использованием ингибитора PD-1/PD-L1 BMS-1166, показав блокадные эффекты, сравнимые с предыдущим методом на основе SPR и другими известными методами, такими как ИФА. Эти результаты подтверждают надежность подхода. Эта оптимизированная платформа скрининга SPR предлагает высокопроизводительный и надежный инструмент для выявления новых ингибиторов PD-1/PD-L1, продвижения исследований в области иммунотерапии рака и выявления потенциала SPR в скрининге ингибиторов контрольных точек иммунного ответа.
Введение
Препараты блокады контрольных точек иммунного ответа, особенно те, которые нацелены на программируемую гибель клеток-1 (PD-1) и лиганд запрограммированной клеточной смерти 1 (PD-L1), находятся на переднем крае стратегий иммунотерапии рака. Анти-PD-1/PD-L1 терапия получила одобрение для использования при различных типах рака, таких как гематологический, кожный, легочный, печеночный, мочевого пузыря и почечный рак1. PD-1 представляет собой трансмембранный гликопротеин, принадлежащий к суперсемейству иммуноглобулинов, характеризующийся одним вариабельным (IgV) доменом на N-конце, примерно 20-аминокислотным стеблем, отделяющим домен IgV от плазматической мембраны, трансмембранным доменом и цитоплазматическим хвостом, содержащим сигнальные мотивы на основе тирозина2. PD-L1, идентифицированный как один из лигандов для PD-1, представляет собой трансмембранный белок I типа, обладающий трансмембранной областью, двумя внеклеточными доменами — иммуноглобулиновой константой (IgC) и IgV, а также относительно коротким цитоплазматическим доменом, который запускает внутриклеточные сигнальные пути3. Ингибирующий путь PD-1/PD-L1 служит важнейшей иммунной контрольной точкой, регулирующей активацию Т-клеток и аутоиммунитет4. PD-1 экспрессируется на Т-клетках, где он взаимодействует с PD-L1, ингибирует передачу сигналов рецепторов Т-клеток и блокирует стимуляцию молекул CD28 и CD80 на антигенпрезентирующих клетках и Т-клетках5. Раковые ткани используют этот физиологический механизм, сверхэкспрессируя PD-L1 во время фазы побега, тем самым создавая иммуносупрессивную среду, способствующую росту и прогрессированию опухоли6. Ингибиторы PD-1 и PD-L1 нарушают это взаимодействие, позволяя иммунной системе уклоняться от индуцированного опухолью подавления и повторно инициировать процесс опосредованной Т-клетками опухолевой гибели7.
Основываясь на фундаменте, заложенном выдающейся ролью терапии блокады иммунных контрольных точек, разработка ингибиторов PD-1/PD-L1 ознаменовала значительный прогресс в иммунотерапии рака. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило девять ингибиторов иммунных контрольных точек, которые специально нацелены на путь PD-1/PD-L1. К ним относятся шесть ингибиторов PD-1 - пембролизумаб, достарлимаб, ниволумаб, цемиплимаб, орипалимаб и тислелизумаб - и три ингибитора PD-L1 - атезолизумаб, авелумаб и дурвалумаб 8,9. Эти методы лечения эффективно используются для лечения различных видов рака, таких как меланома, рак легких, уротелиальный рак, рак шейки матки, рак желудка или желудочно-кишечного тракта и другиесолидные опухоли. Несмотря на свою эффективность, терапия на основе моноклональных антител сталкивается со значительными ограничениями, включая низкую частоту ответа, высокую стоимость, длительный период полувыведения, тяжелые побочные эффекты, связанные с иммунитетом, и ограничения на внутривенное или подкожное введение 11,12,13. Следовательно, исследования все больше сосредоточены на разработке низкомолекулярных ингибиторов, нацеленных на ось PD-1/PD-L1. Эти малые молекулы обладают явными преимуществами, такими как улучшенное проникновение в клетки, модуляция различных биологических мишеней, повышенная биодоступность при пероральном приеме и снижение затрат, с целью достижения сопоставимых терапевтических результатов с меньшим количествомпобочных эффектов. Тем не менее, разработка низкомолекулярных ингибиторов, нацеленных на взаимодействие PD-1/PD-L1, находится на ранних стадиях, в первую очередь из-за отсутствия надежной высокопроизводительной платформы скрининга. Такие платформы необходимы для быстрой оценки обширных библиотек малых молекул и идентификации ведущих соединений для дальнейшей проверки и оптимизации. Преодоление этой проблемы имеет решающее значение для развития иммунотерапии рака.
Технология поверхностного плазмонного резонанса (SPR) широко используется для обнаружения различных биомолекул, включая антигены антител, ферменты, нуклеиновые кислоты и лекарства, и особенно эффективна при скрининге низкомолекулярных лекарств15,16. В отличие от других биофизических методов, SPR обеспечивает безметочное обнаружение, кинетические данные в режиме реального времени и широкий диапазон обнаружения. В отличие от этого, изотермическая титрательная калориметрия не позволяет получать кинетическую информацию в реальном времени и требует больших объемов образцов, что ограничивает производительность. Микромасштабный термофорез подвержен буферной интерференции и не может предоставить кинетические данные, в то время как биослойная интерферометрия имеет ограничения, зависящие от размера и свойств молекул. Однородная флуоресценция с временным разрешением требует мечения и чувствительна к флуоресцентной интерференции. Мы признаем, что HTRF является еще одной подходящей технологией для изучения ингибиторов PD-1/PD-L1. Одним из неотъемлемых ограничений HTRF, по сравнению с SPR, является гашение флуоресценции, вызванное внешними взаимодействиями с процессом внутримолекулярного возбуждения (например, переносом электронов, FRET и отбеливанием), чувствительность в процессе скрининга лекарственного средства слишком низка из-за малого диапазона окна и интерференции от флуоресцентных библиотечных соединений или биологических белков. Эти особенности делают SPR превосходным инструментом для разработки лекарств. Наши предыдущие исследования показали, что SPR способен определять эффект блокады малых молекул против PD-1/PD-L1, что является преимуществом по сравнению с другими методами, требующими высоких требований к технологии мечения, многоступенчатости, низкой специфичности и высокойстоимости в процессе разработки лекарств.
В этом исследовании представлена оптимизированная платформа на основе SPR, объединяющая двухступенчатый процесс сопряжения, в котором используется связь амина и биострептавидина для улучшения ориентации PD-1 на чипе и минимизации использования белка. Этот обновленный подход был успешно валидирован с использованием ингибитора PD-1/PD-L1 BMS-1166 в качестве положительного контрольного связующего, продемонстрировав блокадные эффекты, сравнимые как с нашим предыдущим методом SPR, так и с другими известными методами, такими как ИФА19,20. Это не только подтверждает надежность и воспроизводимость нашего протокола, но и иллюстрирует эффективность нашей модифицированной платформы в облегчении высокопроизводительного скрининга ингибиторов PD-1/PD-L1. Включение этапа захвата био-стрептавидина обеспечивает ориентацию белка на сайт, а не случайно, что позволяет снизить концентрацию PD-1 (40 мкг/мл против 10 мкг/мл) и сэкономить средства, позволяя конечному пользователю иммобилизовать стрептавидин (SA) в чип CM5, что является менее дорогой альтернативой коммерчески выпущенным предварительно иммобилизованным чипам SA. Это делает его предпочтительным для крупномасштабного и экономически эффективного скрининга библиотек соединений/пептидов. Несмотря на то, что дополнительные методы характеризации, в том числе in silico, in vitro и in vivo, имеют важное значение для оценки клинического потенциала ингибиторов PD-1/PD-L1 против рака, наша усовершенствованная платформа скрининга на основе SPR выделяется как эффективный инструмент для широкомасштабного скрининга ингибиторов PD-1/PD-L1.
протокол
Реагенты и оборудование перечислены в Таблице материалов.
1. Иммобилизация белка стрептавидина (SA) на чипе CM5
- Настройте метод иммобилизации на приборе SPR: Открыть/создать шаблон мастера , выберите иммобилизацию, установите тип микросхемы CM5 и количество ячеек потока за цикл равным 1. Проверьте иммобилизованные проточные ячейки 1 и проточные ячейки 2.
- Установите Амин в качестве метода обездвиживания. Установите целевой уровень иммобилизованного, концентрацию лиганда: 40 мкг/мл стрептавидина, целевой уровень: 2000 РУ, раствор промывки: 50 мМ NaOH. Затем проверьте Prime перед запуском.
- Подготовьте следующие пробирки: R2 B1 и R2 C1 - 40 мкг/мл стрептавидина; R2 B2 и R2 C2: 50 мМ NaOH; R2 B3 и R2 C3: EDC; R2 B4 и R2 C4: NHS; R2 B5 и R2 C5: пустые; R2 B6 и R2 C6: Этаноламин.
ПРИМЕЧАНИЕ: EDC и NHS активируют карбоксильные группы на чипе CM5, обеспечивая ковалентную связь с аминами на лиганде. Этаноламин используется в качестве блокирующего буфера для предотвращения неспецифического связывания во время иммобилизации. - Разведите 20 мл буфера HBS-EP+ 10× в 180 мл деионизированной (DI) воды для приготовления 200 мл 1× проточного буферного раствора HBS-EP+.
- Добавьте 1 мл воды, не содержащей ДНКазы, к 1 мг стрептавидина и инкубируйте при комнатной температуре в течение 30 минут. Далее разведите раствор стрептавидина до 40 мкг/мл в ацетатном буфере (pH 4,5). Подготовьте набор реагентов Amine Coupling в соответствии с инструкциями производителя и разместите все соответствующие схемы расположения реагентов, как указано в шаге 1.2.
- Замените микросхему датчика технического обслуживания на микросхему CM5, затем поместите трубку A в подготовленный буфер 1× HBS-EP+, снова откройте метод иммобилизации и вставьте трубки в соответствии с схемой шага 1.2. Запустите метод и сохраните файл результатов.
- Техническое обслуживание после запуска: замените микросхему CM5 на микросхему датчика обслуживания, поместите трубку A в бутылку, наполненную деионизированной водой, и запустите праймер. После извлечения чипа CM5 промойте чип несколькими каплями воды DI и высушите на воздухе. Поместите чип в пробирку объемом 50 мл при температуре 4 °C.
ПРИМЕЧАНИЕ: Иммобилизованный SA позволяет чипу CM5 функционировать как чип SA.
2. Иммобилизация белка PD-1 на SA-чипе
- Задайте метод иммобилизации на приборе SPR: Открыть/новый шаблон мастера , выберите иммобилизацию, установите тип микросхемы SA и подайте ячейки за цикл равным 1. Проверьте иммобилизованную проточную ячейку 1 и ячейку 2.
- Установите SA-биотин в качестве метода. Для ячейки 1 установите холостую иммобилизацию, для ячейки 2 установите цель для иммобилизованного уровня, 10 мкг/мл PD-1 в качестве лиганда, целевой уровень: 4000 RU, затем проверьте прайм перед запуском.
ПРИМЕЧАНИЕ: Подготовьте следующие пробирки - R2 B1 и R2 C1: 1 М NaCl, 50 мМ NaOH; R2 B2 и R2 C2: 50% изопропанола/50 мМ NaOH/1 М NaCl; R2 C3: 10 мкг/мл PD-1.
- Установите SA-биотин в качестве метода. Для ячейки 1 установите холостую иммобилизацию, для ячейки 2 установите цель для иммобилизованного уровня, 10 мкг/мл PD-1 в качестве лиганда, целевой уровень: 4000 RU, затем проверьте прайм перед запуском.
- Растворите 58,44 мг NaCl в 1 мл 50 мМ раствора NaOH для приготовления 1 М раствора NaCl и 50 мМ раствора NaOH. Растворите 58,44 мг NaCl и 4,0 мг NaOH в 500 мкл воды, затем добавьте 500 мкл изопропанола для приготовления 50% раствора изопропанола/50 мМ NaOH/1 М NaCl.
- Приготовьте раствор PD-1: Добавьте 200 μл воды, не содержащей ДНКазы, к 100 μг биотинилированного человеческого PD-1 (Fc и Avitagged) и стабилизируйте при комнатной температуре в течение 30 минут, затем разбавьте до 10 μг/мл в ацетатном буфере (pH 5,0).
- Разместите все раскладки реагентов, как описано в шаге 2.1. Поместите пробирку A в 1× буферный раствор HBS-EP+, затем извлеките микросхему датчика обслуживания и вставьте микросхему SA (микросхему CM5, покрытую белком стрептавидина из этапа 1). Снова откройте метод иммобилизации, вставьте штатив для реагентов 2 и проверьте положение, затем запустите метод для расчетного времени выполнения.
- Повторите шаг 1.6.
3. Разведка регенерации для PD-1 и PD-L1
- Настройте метод скаутинга регенерации: Откройте/новый шаблон мастера , выберите Скаутинг регенерации, установите путь потока: 2-1, 4-3, тип чипа на SA, проверьте цикл кондиционирования запуска, запишите решение как HBS-EP+, время контакта как 30 с, количество впрысков как 3, раствор как PD-L1, время контакта: 30 с, расход: 30 мкл/мин.
- Для параметров регенерации расход составляет 30 мкл/мин, а период стабилизации – 300 с. В плане эксперимента установите количество условий равным 4, а количество циклов для каждого условия — 2. Установите условия 4, раствор для регенерации: Глицин 1,5, 2,0, 2,5, 3,0, время контакта: 30 с, затем проверьте прайм перед запуском.
- Установите концентрацию PD-L1 в виде отдельной лунки для образца в 96-луночной схеме микропланшетов: R1 A1 до R1 A9: 1 мкМ PD-L1; R1 A10 - R1 A12: буфер HBS-EP+; R1 B1: глицин 1,5; R1 B2: Глицин 2; R1 B3: Глицин 2,5; R1 B4: Глицин 3.
ПРИМЕЧАНИЕ: В качестве буфера для регенерации используется глициновый буфер с различным рН. - Приготовьте раствор PD-L1: Добавьте 200 мкл воды, не содержащей ДНКазы, к 100 мкг белка PD-L1 Fc Tag человека (9,42 мкМ), затем разбавьте до 1 мкМ в буфере HBS-EP+.
- Поместите все соответствующие реагенты в схему, как описано в шаге 3.2. Поместите трубку A в буфер 1× HBS-EP+, затем замените микросхему датчика обслуживания на микросхему SA. Снова откройте метод Regeneration Scouting , следуйте положению пробирки, указанному на шаге 3.2, вставьте штатив для реагентов, а затем запустите метод для расчетного времени выполнения.
- Повторите шаг 1.6.
4. Валидация взаимодействия PD-1/PD-L1
ПРИМЕЧАНИЕ: Для проверки достоверности ранее опубликованный отчет18 был дополнен незначительными корректировками.
- Используйте те же параметры, что и в опубликованном отчете, в разделах «Общие настройки», «Этапы анализа» и «Типы циклов», установите время контакта на 60 с, время диссоциации на 60 с и расход на 30 мкл/мин. В разделе Переменные метода, Переменные оценки и Команды используйте ту же настройку, за исключением использования Глицина 2.0 в качестве Регенерации, установите скорость потока до 30 мкл/мин, проходит через путь потока 1, 2, 3, 4.
- Затем настройте прогон и выберите путь потока: 2-1, 4-3. Введите PD-L1 с концентрациями от 0 мкМ, 0,037 мкМ, 0,111 мкМ, 0,333 мкМ и молекулярной массой 51 300 Да. Проверьте все этапы анализа для проверки и выберите простое число перед запуском.
- Затем установите концентрацию каждого PD-L1 в качестве отдельной пробоотборной лунки на схеме штатива для реагентов 2: R2 B1: PD-L1 0 μM; R2 B2: PD-L1 0,037 мкМ; R2 B3: PD-L1 0,111 мкМ; R2 B4: PD-L1 0,333 мкМ; R2 A1: Глицин 2.0 в качестве буфера для регенерации; R2 A2: HBS-EP+ в качестве буфера запуска.
- Приготовьте 200 мл 1× проточного буферного раствора HBS-EP+. Готовьте концентрации PD-L1: разбавляйте белок PD-L1 в концентрациях от 9,42 мкМ до 0,333 мкМ, 0,111 мкМ и 0,037 мкМ в HBS-EP+. Затем поместите все соответствующие реагенты в схему, как описано в шаге 4.1.2.
- Вставьте трубку A в буферный раствор 1× HBS-EP+, извлеките микросхему датчика технического обслуживания и вставьте микросхему SA. Снова откройте метод скаутинга регенерации , следуйте положению пробирки, описанному на шаге 4.1, вставьте штатив для реагентов 2 и запустите метод в течение расчетной продолжительности.
- Повторите шаг 1.6.
5. Анализ PD-1/PD-L1 блокады с низкомолекулярным ингибитором: BMS-1166
ПРИМЕЧАНИЕ: Для анализа блокады был составлен ранее опубликованный отчет18 с незначительными корректировками.
- Используйте те же параметры, что и в опубликованном отчете, в разделах «Общие настройки», «Этапы анализа» и «Типы циклов», установите время контакта на 60 с, время диссоциации на 60 с и расход на 30 мкл/мин. В переменных метода, переменных оценки и командах также используется одна и та же настройка, за исключением использования Глицина 2.0 в качестве регенерации, настройка расхода до 30 мкл/мин, проходит по пути потока 1, 2, 3, 4.
- Затем настройте запуск и выберите путь потока: 2-1, 4-3. Введите образец раствора: PD-L1 (0,111 мкМ, молекулярная масса 51 300 Да) с BMS-1166 в концентрации 0 мкМ, 0,125 мкМ, 0,625 мкМ, 3,125 мкМ. Проверьте все этапы анализа для проверки и выберите простое число перед запуском.
- Затем установите концентрацию каждого PD-L1 в виде отдельной пробоотборной лунки в макете штатива для реагентов 2: R2 B1: PD-L1 (0,111 μM) + BMS-1166 0 μM R2 B2: PD-L1 (0,111 μM) + BMS-1166 0,125 μM; R2 B3: PD-L1 (0,111 мкМ) + BMS-1166 0,625 мкМ; R2 B4: PD-L1 (0,111 μM) + BMS-1166 3,125 μM; R2 A1: Глицин 2.0 для регенерации.
- Приготовьте 200 мл 1× проточного буферного раствора HBS-EP+. Приготовьте смесь BMS-1166/PD-L1: Растворите 5 мг BMS-1166 в 77,99 мкл диметилсульфоксида (ДМСО) до получения 100 мМ исходного раствора. Разбавляют исходный раствор белком PD-L1 (0,11 мкМ) до целевых концентраций BMS-1166 при 0 мкМ, 0,125 мкМ, 0,625 мкМ и 3,125 мкМ в HBS-EP+. Разместите все соответствующие раскладки реагентов, как описано в шаге 5.1.2.
- Поместите трубку A в буферный раствор 1× HBS-EP+, затем извлеките микросхему датчика обслуживания и вставьте микросхему SA. Снова откройте метод скаутинга регенерации , следуйте положению пробирки из 5.1 и вставьте штатив для реагентов 2, затем запустите метод для расчетного времени работы.
- Повторите шаг 1.6.
Результаты
Иммобилизация SA на чипе CM5
Данные были проанализированы с помощью выходных данных прибора SPR и соответствующего аналитического программного обеспечения, указывающих на успешное достижение целевого значения RU (2000 RU) белка SA на проточной ячейке 1 и проточной ячейке 2. Проточные ячейки 1 и 2 иммобилизовали SA (40 мкг/мл) на поверхности чипа CM5 с итоговым откликом 1902,3 МКЗ на проточной ячейке 1 (рис. 1А) и 1900,7 мкР на проточной ячейке 2 (рис. 1В).
Иммобилизация PD-1 на чипе SA
Анализ данных, основанный на выходных данных прибора SPR и соответствующего программного обеспечения, показал низкий уровень отклика (RU) для пустой ячейки на проточной ячейке 1 и успешное достижение целевого значения RU (4000 RU) для лиганда PD-1 на проточной ячейке 2. Проточную ячейку 1 иммобилизовали в виде холостого материала, что дало итоговый отклик -161,0 RU (рисунок 2A), в то время как проточную ячейку 2 иммобилизовали биотинилированным белком PD-1 (10 мкг/мл), покрытым на чипе SA, в результате чего итоговый ответ составил 3698,5 RU (рисунок 2B).
Разведка регенерации для ПД-1 и ПД-Л1.
Анализ регенерации проводили с PD-1, иммобилизованным на проточной ячейке 2, и PD-L1 в растворе (0,1 мкМ) при различных уровнях pH глицина (1,5, 2, 2,5 и 3) для определения регенерационного раствора, что привело к стабильному исходному уровню и реакции образца. Данные были проанализированы с помощью выходных данных прибора SPR и аналитического программного обеспечения, в результате чего глицин (pH 2,0) является оптимальным условием регенерации из-за минимальных изменений в реакции как исходного уровня, так и реакции образца, что указывает на минимальную потерю белка PD-1 и успешное удаление белка PD-L1 с поверхности чипа. При pH глицина 2,0 исходный ответ оставался относительно постоянным, а ответ аналита был стабильным и близким к ответу в начале эксперимента, что указывает на наиболее оптимальный буфер регенерации среди четырех тестируемых условий pH глицина. Более высокий pH недостаточен, а более низкий pH слишком резок; pH 2,0 определен как наиболее подходящее условие регенерации (рис. 3).
Валидация взаимодействия PD-1/PD-L1
Данные были проанализированы с помощью соответствующего программного обеспечения для оценки. В разделе Kinetics/Affinity выберите "surface-bound", выберите кривую 2-1, установите модель кинетики на привязку 1:1 и настройте параметр RI до постоянной аппроксимации, чтобы определить скорость ассоциации (ka), скорость диссоциации (kd) и константу диссоциации равновесия (KD). Связывание PD-L1 в различных концентрациях с PD-1 было количественно определено, что дало измеримый ответ (рис. 4). Анализируемые параметры связывания включали скорость ассоциации (ka) 3,611 × 104 (1/мс), скорость диссоциации (kd) 0,0236 (1/с) и константу равновесной диссоциации (KD) 6,536 × 10-7 М.
Анализ блокады PD-1/PD-L1 с установленным низкомолекулярным ингибитором: BMS-1166
Данные были проанализированы с помощью соответствующего метода. В разделе Kinetics/Affinity выберите surface-bound, выберите кривую 2-1, затем получите визуализированную кривую результата и единицы отклика. Блокадный эффект связывающего взаимодействия PD-1/PD-L1 наблюдался при использовании BMS-1166 (0-3,125 мкМ) с 0,11 мкМ белка PD-L1 в буфере HBS EP+ (рис. 5). Самая высокая единица ответа идентифицируется только PD-L1, тогда как с увеличением концентрации BMS-1166 единица связывания пропорционально уменьшается.

Рисунок 1: Иммобилизация SA на чипе CM5. Показаны кривые иммобилизации белка стрептавидина на проточной ячейке 1 (А) и проточной ячейке 2 (В) чипа CM5. Сначала пять предварительных концентраций белка SA проходили через проточные ячейки 1 и 2, после чего проводилась промывка NaOH и установление стабильного исходного уровня. Затем были добавлены EDC и NHS, а затем была проведена промывка гидрохлоридом этаноламина. Затем было проведено пять импульсов PD-1 для достижения целевого уровня (2000 RU), за которыми последовала промывка этаноламина гидрохлоридом для удаления электростатически связанных лигандов и дезактивации NHS-эфиров, которые остаются нереактивными. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
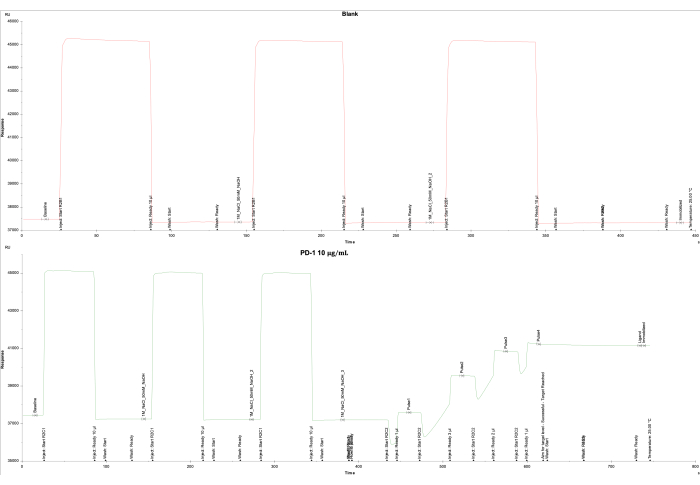
Рисунок 2: Иммобилизация PD-1 на микросхеме SA. Показаны кривые иммобилизации (A) бланковой проточной ячейки 1, покрытой только SA, и (B) белка PD-1 на чипе SA на проточной ячейке 2. Для бланка (проточная ячейка 1) вводили 1 М NaCl и 50 мМ NaOH три раза, после чего проводили промывку 50% изопропанолом/1 М NaCl/50 мМ NaOH. Для белка PD-1 (проточная ячейка 2) три раза вводили 1 М NaCl и 50 мМ NaOH, после чего следовали пять импульсов белка PD-1 для достижения целевого уровня 4000 ЕД и заключительная промывка 50% изопропанола/1 М NaCl/50 мМ NaOH. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Скаутинг регенерации для PD-1 и PD-L1. Исходный уровень и реакцию образца были получены для четырех условий регенерации глицином при pH 1,5, 2, 2,5 и 3 для определения оптимального решения для регенерации до тестирования образца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Валидация взаимодействия PD-1/PD-L1. Кинетика связывания различных концентраций PD-L1 (0,037 мкМ, 0,111 мкМ и 0,333 мкМ) с PD-1 на поверхности чипа, покрытого стрептавидином. PD-L1 демонстрирует отчетливую ассоциацию (0-60 с) и фазы диссоциации (61-120 с) с PD-1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
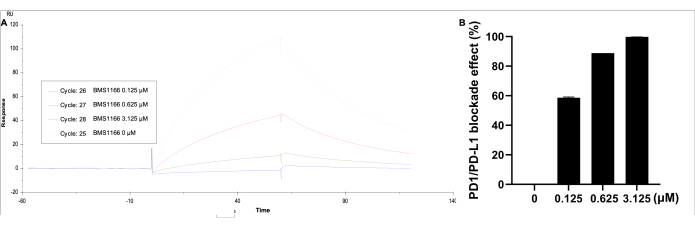
Рисунок 5: SPR-анализ PD-1, покрытого на иммобилизованном SA чипе CM5, с PD-L1 (0,11 мкМ) и BMS-1166 (0-3,125 мкМ) в растворе. (A) Репрезентативный ответ SPR в реальном времени на реакции связывания между PD-1/PD-L1 и BMS-1166. (B) Процентное влияние блокады BMS-1166 на кинетику связывания взаимодействия PD-1/PD-L1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Сравнение стратегий иммобилизации белка PD-1. Аминная связь (А) в сравнении с двухступенчатая связь стрептавидин-биотин (В). Аминное связывание сопряжено с проблемами, включая ограниченную доступность доступных сайтов связывания, стерические препятствия для связывания и потенциальную модификацию сайтов связывания PD-1 во время иммобилизации. Напротив, двухступенчатый подход стрептавидин-биотин повышает доступность свободных сайтов связывания на иммобилизованном PD-1, способствуя улучшению взаимодействия с PD-L1 в растворе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
За последние несколько десятилетий различные подходы к иммунотерапии, включая противораковые вакцины, ингибиторы контрольных точек иммунного ответа и терапию CAR T-клетками, значительно продвинуливперед лечение рака. Иммунные контрольные точки играют решающую роль в предотвращении коллатерального повреждения, опосредованного иммунными клетками, во время патогенных реакций и в подавлении аутоиммунитета. Ключевым примером является взаимодействие между PD-L1 и PD-1, которое образует основную иммунную контрольную точку, позволяющую раковым клеткам уклоняться от иммунного надзора. Нацеливание на путь PD-1/PD-L1 с помощью моноклональных антител достигло замечательных успехов в клинической онкологии. Тем не менее, из-за ограничений, связанных с терапией моноклональными антителами, и растущей частоты побочных эффектов, связанных с иммунитетом, растет интерес к разработке низкомолекулярных ингибиторов, нацеленных на PD-1/PD-L1 9,22.
Современные стратегии скрининга на низкомолекулярные ингибиторы PD-1/PD-L1 в первую очередь сосредоточены на методах биоанализа, таких как ИФА, клеточный репортерный анализ и Т-клеточный анализ. Биофизические методы, включая SPR и биослойную интерферометрию (BLI), широко используются для определения аффинностей связывания, но их потенциал для использования в качестве инструментов скрининга недооценивается23. В этом исследовании был разработан оптимизированный анализ блокады PD-1/PD-L1 на основе SPR, который предлагает высокопроизводительную платформу, подходящую для обнаружения низкомолекулярных ингибиторов PD-1/PD-L1. SA иммобилизовали до ~2000 RU с последующим биотинилированием PD-1 (~4000 RU) через биотин-стрептавидиновое взаимодействие. Это прочное связывание обеспечивает надежное покрытие PD-1 с оптимальной ориентацией, сводя к минимуму неспецифическое связывание и снижая потребление белка (10 мкг/мл). Местно-направленная иммобилизация повысила эффективность по сравнению с традиционными методами. Буфер глицина (pH 2,0) использовался для регенерации поверхности сенсора между циклами, поддерживая экспериментальную целостность и предотвращая неспецифическое связывание.
По сравнению со стандартными иммунологическими методами и ИФА, этот подход SPR обеспечивает обнаружение в режиме реального времени без меток с высокой чувствительностью и специфичностью. Кроме того, он обеспечивает высокопроизводительный скрининг со временем выполнения 120 с/образец и дополняет биоанализы для оценки эффективности блокады соединений, нацеленных на PD-1/PD-L1, и биологических препаратов. Достигнутый уровень иммобилизации был сопоставим с предыдущей платформой (3698,5 RU против 3688,5 RU), при аналогичной аффинности взаимодействия PD-1/PD-L1 (KD = 6,536 × 10-7 М против 1,295 × 10-7 М). Ингибитор BMS-1166 продемонстрировал более высокую скорость диссоциации при более низкой концентрации, с блокадными эффектами, сопоставимыми с более ранней платформой (99,8% против 94,2% при 3,125 мкМ). BMS-1166 продемонстрировал скорость блокады PD-1/PD-L1, поддерживаемую значениями IC50 1,4 нМ и 96 нМ в анализах HTRF и клеточных анализах, соответственно24. Кроме того, в других исследованиях сообщалось о значениях IC50 в 3,9 нМ и 1574 нМ с использованием методов HTRF и кокультурального анализа блокады иммунных контрольных точек25. Наши предыдущие результаты показали, что значения IC50 BMS-1166 составляли 85,4 нМ, что согласуется с этими более ранними выводами18. Еще одним преимуществом этой просеивающей платформы является ее надежность и высокая пропускная способность. Этот метод широко применялся при высокопроизводительном скрининге с использованием 384-луночного планшета, при этом BMS-1166 и BMS-202 включались в качестве положительного контроля для каждых 10 образцов. Диапазон интенсивности блокады составил 29,8%-38,1% для BMS-1166 и 6,0%-10,4% для BMS-202 при 10 нМ (n = 11 на пластину).
ДМСО, вероятно, будет оказывать различное воздействие на гетерогенные биологические мембраны, в зависимости от их локального состава и структуры, потенциально влияя на мембраноассоциированные биологические функции. При относительно низких концентрациях ДМСО может изменять свойства белка в растворе, что приводит к денатурации, агрегации или деградации. Кроме того, ДМСО может изменять кажущиеся связывающие свойства белков26,27. Кроме того, чтобы решить ранее возникшие опасения по поводу интерференции ДМСО, мы снизили концентрацию ДМСО до 0,003% (0,01% ДМСО использовалось на более ранней платформе) в этом протоколе.
В предыдущем исследовании белки PD-1 были иммобилизованы на сенсорных чипах с помощью аминной связи, которая использует химию EDC/NHS для активации карбоксиметиловых групп на чипе, образуя ковалентные связи с аминными группами на PD-1. Из-за наличия нескольких аминных групп в 288 аминокислотах PD-1, этот метод по своей сути приводит к случайным ориентациям. Чтобы достичь более конкретной ориентации, в этом исследовании мы использовали стратегию сопряжения захвата с биотинилированным человеческим PD-1 (Fc, Avitag). Одиночный остаток лизина в Avitag ферментативно биотинилирован на Fc-области PD-1, что обеспечивает точную иммобилизацию за счет высокоаффинного взаимодействия между биотином и стрептавидином (рис. 6). Теоретически такой подход гарантирует, что вариабельный домен PD-1 остается открытым, способствуя оптимальному взаимодействию с PD-L1 в буфере. Однако это предположение требует дальнейшей проверки с использованием таких методов, как крио-ЭМ или кристаллография для подтверждения ориентации белка.
Глицин 2.0 использовали в качестве мягкого буфера для регенерации, эффективно удаляя PD-L1 без уменьшения иммобилизованного PD-1. Однако для плотно связанных ингибиторов или белковых агрегатов могут потребоваться более сильные буферы регенерации, такие как 0,5% SDS или 50-100 мМ NaOH, чтобы предотвратить интерференцию с последующими образцами.
Это исследование имеет несколько ограничений. Во-первых, высокая стоимость контрольно-измерительных приборов SPR может ограничивать доступность, хотя протокол часто может быть адаптирован для других систем SPR с аналогичными возможностями. Такие параметры, как концентрация белка и время ассоциации/диссоциации, могут быть скорректированы в соответствии с конкретными платформами SPR. Еще одним ограничением является его зависимость от рекомбинантных белков, которые могут не полностью воспроизводить нативные белковые взаимодействия. Эти факторы следует учитывать при интерпретации данных SPR и сравнении результатов с дополнительными методами, такими как клеточные анализы или модели in vivo .
Несмотря на эти ограничения, оптимизированный метод SPR предлагает быстрый, работающий в режиме реального времени, с высокой пропускной способностью и без меток подход к скринингу низкомолекулярных ингибиторов взаимодействия PD-1/PD-L1. Он значительно расширяет биофизические методы для определения характеристик малых молекул и биологических препаратов, нацеленных на взаимодействие PD-1/PD-L1. Благодаря своей высокой чувствительности платформа особенно ценна для изучения взаимодействий иммунных контрольных точек и более широких белок-белковых взаимодействий (ИПП), что делает ее мощным инструментом для продвижения разработки лекарств от ИПП.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы отдают должное основному объекту RI-INBRE в Университете Род-Айленда, поддерживаемому грантом P20GM103430 от Национального центра исследовательских ресурсов (NCRR), входящего в состав Национальных институтов здравоохранения (NIH). Это исследование было поддержано премией пилотного гранта от Фармацевтического колледжа Университета Род-Айленда, премией за малый грант от Центра наук о жизни Род-Айленда (RILSH) и грантом Фонда Род-Айленда, все они были присуждены Чанг Лю, доктору философии.
Материалы
| Name | Company | Catalog Number | Comments |
| 50 mM NaOH | Cytiva Life Sciences | 100358 | |
| 50 mM NaOH | Fisher Scientific | 905376 | |
| 96-Well Polystyrene Microplates | Cytiva Life Sciences | BR100503 | |
| Amine Coupling Kit | Cytiva Life Sciences | 35120 | |
| Biacore T200 SPR System and Evaluation Software 3.2 | Cytiva Life Sciences | 28975001 | |
| Biotinylated Human PD-1 Fc, Avitag Protein | Acro Biosystems | PD1-H82F1 | |
| BMS1166 | MedChemExpress | HY-102011 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 276855 | |
| DNase Free Water | Fisher Scientific | 188506 | |
| Glycine 1.5 | Cytiva Life Sciences | BR100354 | |
| Glycine 2.0 | Cytiva Life Sciences | BR100355 | |
| Glycine 2.5 | Cytiva Life Sciences | BR100356 | |
| Glycine 3.0 | Cytiva Life Sciences | BR100357 | |
| HBS-EP+ Buffer | Cytiva Life Sciences | BR100669 | |
| Human PD-L1 Fc Tag Protein | Acro Biosystems | PD-1-H5258 | |
| Isopropanol | Fisher Scientific | BP2618-1 | |
| Microplate Foil, 96-Well | Cytiva Life Sciences | 28975816 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Plastic Vials 7 mm | Cytiva Life Sciences | BR100212 | |
| Rubber Caps, Type 3 | Cytiva Life Sciences | BR100502 | |
| Series S Sensor Chip CM5 | Cytiva Life Sciences | 29149603 | |
| Sodium Acetate 4.5 | Cytiva Life Sciences | 100350 | |
| Sodium Acetate 5.0 | Cytiva Life Sciences | 100351 | |
| Streptavidin | Sigma-Aldrich | S4762 |
Ссылки
- Ribas, A., Wolchok, J. D. Cancer immunotherapy using checkpoint blockade. Science. 359 (6382), 1350-1355 (2018).
- Zhang, X., et al. Structural and functional analysis of the costimulatory receptor programmed death-1. Immunity. 20 (3), 337-347 (2004).
- Freeman, G. J., et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 192 (7), 1027-1034 (2000).
- Han, Y., Liu, D., Li, L. PD-1/PD-L1 pathway: Current researches in cancer. Am J Cancer Res. 10 (3), 727-742 (2020).
- Lyu, N., et al. Recognition of PDL1/L2 by different induced-fit mechanisms of PD1: A comparative study of molecular dynamics simulations. Phys Chem Chem Phys. 22 (3), 1276-1287 (2020).
- Taube, J. M., et al. Colocalization of inflammatory response with B7-H1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Trans Med. 4 (127), 127ra37 (2012).
- Sun, X., et al. Immune-related adverse events associated with programmed cell death protein-1 and programmed cell death ligand 1 inhibitors for non-small cell lung cancer: A PRISMA systematic review and meta-analysis. BMC Cancer. 19 (1), 558 (2019).
- Alkholifi, F. K., Alsaffar, R. M. Dostarlimab an inhibitor of PD-1/PD-L1: A new paradigm for the treatment of cancer. Medicina. 58 (11), 1572 (2022).
- Uzar, W., et al. An updated patent review on PD-1/PD-L1 antagonists (2022-present). Expert Opin Ther Pat. 34 (8), 627-650 (2024).
- Ai, L., et al. Research status and outlook of PD-1/PD-L1 inhibitors for cancer therapy. Drug Des Devel Ther. 14, 3625-3649 (2020).
- Conroy, M., Naidoo, J. Immune-related adverse events and the balancing act of immunotherapy. Nat Commun. 13 (1), 392 (2022).
- Guzik, K., et al. Small-molecule inhibitors of the Programmed Cell Death-1/Programmed Death-Ligand 1 (PD-1/PD-L1) interaction via transiently induced protein states and dimerization of PD-L1. J Med Chem. 60 (13), 5857-5867 (2017).
- Sifniotis, V., Cruz, E., Eroglu, B., Kayser, V. Current advancements in addressing key challenges of therapeutic antibody design, manufacture, and formulation. Antibodies. 8 (2), 36 (2019).
- Beck, H., Härter, M., Haß, B., Schmeck, C., Baerfacker, L. Small molecules and their impact in drug discovery: A perspective on the occasion of the 125th anniversary of the Bayer Chemical Research Laboratory. Drug Discov Today. 27 (6), 1560-1574 (2022).
- Nguyen, H. H., Park, J., Kang, S., Kim, M. Surface plasmon resonance: A Versatile technique for biosensor applications. Sensors (Basel, Switzerland). 15 (5), 10481-10510 (2015).
- Liu, C., Seeram, N. P., Ma, H. Small molecule inhibitors against PD-1/PD-L1 immune checkpoints and current methodologies for their development: A review. Cancer Cell Int. 21 (1), 239 (2021).
- Hu, K., Li, X. -. J., Asmamaw, M. D., Shi, X. -. J., Liu, H. -. M. Establishment of high-throughput screening HTRF assay for identification small molecule inhibitors of Skp2-Cks1. Sci Rep. 11 (1), 21105 (2021).
- Puopolo, T., et al. Establishment of human PD-1/PD-L1 blockade assay based on surface plasmon resonance (SPR) biosensor. Bio-protoc. 13 (15), e4765 (2023).
- Ding, M., Chen, Y., Lang, Y., Cui, L. The role of cellular prion protein in cancer biology: A potential therapeutic target. Front Oncol. 11, 742949 (2021).
- Li, H., Seeram, N. P., Liu, C., Ma, H. Further investigation of blockade effects and binding affinities of selected natural compounds to immune checkpoint PD-1/PD-L1. Front Oncol. 12, 995461 (2022).
- Kamrani, A., et al. New immunotherapeutic approaches for cancer treatment. Pathol Res Pract. 248, 154632 (2023).
- Yan, Y., Zhang, L., Zuo, Y., Qian, H., Liu, C. Immune checkpoint blockade in cancer immunotherapy: mechanisms, clinical outcomes, and safety profiles of PD-1/PD-L1 inhibitors. Arch Immunol Ther Exp. 68 (6), 36 (2020).
- Chandrasekharan, G., Unnikrishnan, M. High throughput methods to study protein-protein interactions during host-pathogen interactions. Eur J Cell Biol. 103 (2), 151393 (2024).
- Zhang, Y., et al. BMS-202, a PD-1/PD-L1 inhibitor, decelerates the profibrotic effects of fibroblasts derived from scar tissues via ERK and TGFβ1/Smad signaling pathways. Immun Inflamm Dis. 10 (1), e591 (2022).
- Surmiak, E., et al. PD-L1 inhibitors: Different classes, activities, and mechanisms of action. Int J Mol Sci. 22 (21), 11797 (2021).
- Feoli, A., Sarno, G., Castellano, S., Sbardella, G. DMSO-Related effects on ligand-binding properties of lysine methyltransferases G9a and SETD8. ChemBioChem. 25 (4), e202300809 (2024).
- Tjernberg, A., Markova, N., Griffiths, W. J., HalléN, D. DMSO-Related effects in protein characterization. SLAS Discov. 11 (2), 131-137 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены