Method Article
זיהוי מעכבי PD-1/PD-L1 עם טכנולוגיית תהודה פלזמון פני השטח
In This Article
Summary
פרוטוקול זה מתאר בדיקת חסימה עבור מעכבי PD-1/PD-L1 באמצעות טכנולוגיית תהודה פלזמון פני השטח. היא משתמשת באסטרטגיית אימוביליזציה דו-שלבית ומערכת חיץ מותאמת למדידה מדויקת של יחידות תגובה, מה שמקל על הערכת שיעורי החסימה של תרכובות או תרופות ביולוגיות. בנוסף, הוא תומך בזיהוי תפוקה גבוהה של מעכבי PD-1/PD-L1.
Abstract
שיבוש האינטראקציה PD-1/PD-L1 הוא אסטרטגיה מבטיחה לאימונותרפיה של סרטן. פלטפורמות סינון אמינות חיוניות להערכת היעילות של מעכבי PD-1/PD-L1. בדיקת חסימת PD-1/PD-L1 אנושית שהוקמה בעבר תוך שימוש בטכנולוגיית תהודה פלזמון פני השטח (SPR) (פלטפורמת סינון SPR מעכב PD-1/PD-L1 מהדור הראשון) הדגימה תוצאות דומות לאלו שהושגו באמצעות פלואורסצנציה הומוגנית בפתרון זמן (HTRF) ומבחנים מבוססי תאים, עם פוטנציאל להקרנה בקנה מידה גדול. כאן, מוצגת גרסה אופטימלית של בדיקה זו (פלטפורמת סינון SPR מעכב PD-1/PD-L1 מהדור השני), הכוללת תהליך צימוד דו-שלבי המשלב צימוד אמין וביו-סטרפטווידין כדי לשפר את בקרת הכיוון PD-1 על השבב ולהפחית את צריכת החלבון PD-1. הפלטפורמה המעודכנת אומתה בהצלחה באמצעות מעכב PD-1/PD-L1 BMS-1166, והראה השפעות חסימה דומות לשיטה הקודמת המבוססת על SPR וטכניקות מבוססות אחרות כגון ELISA. תוצאות אלה מאשרות את מהימנות הגישה. פלטפורמת סינון SPR אופטימלית זו מציעה כלי בעל תפוקה גבוהה ואמין לזיהוי מעכבי PD-1/PD-L1 חדשים, קידום מחקר אימונותרפיה לסרטן והדגשת הפוטנציאל של SPR בבדיקת מעכבי מחסום חיסוני.
Introduction
טיפולי חסימת מחסום חיסוני, במיוחד אלה המכוונים למוות תאי מתוכנת-1 (PD-1) וליגנד מוות תאי מתוכנן 1 (PD-L1), עומדים בחזית האסטרטגיות האימונותרפיות לסרטן. טיפולים נגד PD-1/PD-L1 קיבלו אישור לשימוש בסוגי סרטן שונים, כגון סרטן המטולוגי, עור, ריאה, כבד, שלפוחית השתן וסרטן הכליות1. PD-1 הוא גליקופרוטאין טרנסממברני השייך למשפחת העל של האימונוגלובולין, המאופיין בתחום דמוי משתנה אימונוגלובולין יחיד (IgV) בטרמינל N, גבעול של כ-20 חומצות אמינו המפריד בין תחום ה-IgV לקרום הפלזמה, תחום טרנסממברני, וזנב ציטופלזמי המכיל מוטיבים של איתות מבוססי טירוזין2. PD-L1, המזוהה כאחד הליגנדים ל-PD-1, הוא חלבון טרנסממברני מסוג I הכולל אזור טרנסממברני, שני תחומים חוץ-תאיים - קבוע אימונוגלובולין (IgC) ו-IgV - ותחום ציטופלזמי קצר יחסית המפעיל מסלולי איתות תוך תאיים3. המסלול המעכב PD-1/PD-L1 משמש כמחסום חיסוני קריטי המווסת את הפעלת תאי T ואת האוטואימוניות4. PD-1 מתבטא בתאי T, שם הוא מקיים אינטראקציה עם PD-L1, מעכב איתות קולטני תאי T וחוסם את הגירוי של מולקולות CD28 ו-CD80 על תאים מציגי אנטיגן ותאי T5. רקמות סרטניות מנצלות את המנגנון הפיזיולוגי הזה על ידי ביטוי יתר של PD-L1 בשלב הבריחה, ובכך יוצרות סביבה מדכאת חיסון המקדמת צמיחה והתקדמות של הגידול6. מעכבי PD-1 ו-PD-L1 משבשים אינטראקציה זו, ומאפשרים למערכת החיסון להתחמק מדיכוי המושרה על ידי הגידול וליזום מחדשאת תהליך המוות של תאי הגידול בתיווך תאי T.
בהתבסס על היסודות שהונחו על ידי התפקיד הבולט של טיפולי חסימת מחסום חיסוני, הפיתוח של מעכבי PD-1/PD-L1 סימן התקדמות משמעותית באימונותרפיה לסרטן. מינהל המזון והתרופות האמריקני (FDA) אישר תשעה מעכבי נקודות ביקורת חיסוניות המכוונים באופן ספציפי למסלול PD-1/PD-L1. אלה כוללים שישה מעכבי PD-1 - פמברוליזומאב, דוסטרלימאב, ניבולומאב, סמיפלימאב, אוריפלימאב וטיסלליזומאב - ושלושה מעכבי PD-L1 - אטזוליזומאב, אבלומאב ודורבלומאב 8,9. טיפולים אלה נוצלו ביעילות לטיפול במגוון סוגי סרטן, כגון מלנומה, סרטן ריאות, סרטן דרכי השתן, סרטן צוואר הרחם, סרטן הקיבה או הוושט וגידולים מוצקים אחרים10. למרות יעילותם, טיפולים מבוססי נוגדנים חד-שבטיים מתמודדים עם מגבלות משמעותיות, כולל שיעורי תגובה נמוכים, עלויות גבוהות, מחצית חיים ממושכת, תופעות לוואי חמורות הקשורות למערכת החיסון והגבלות על מתן תוך ורידי או תת עורי 11,12,13. כתוצאה מכך, המחקר מתמקד יותר ויותר בפיתוח מעכבי מולקולות קטנות המכוונים לציר PD-1/PD-L1. מולקולות קטנות אלו מציעות יתרונות מובהקים, כגון חדירה תאית משופרת, אפנון של מטרות ביולוגיות מגוונות, זמינות ביולוגית משופרת דרך הפה והפחתת עלויות, במטרה להשיג תוצאות טיפוליות דומות עם פחות תופעות לוואי14. עם זאת, הפיתוח של מעכבי מולקולות קטנות המכוונים לאינטראקציה PD-1/PD-L1 נמצא בשלביו המוקדמים, בעיקר בשל היעדר פלטפורמת סינון אמינה בעלת תפוקה גבוהה. פלטפורמות כאלה חיוניות להערכה מהירה של ספריות עצומות של מולקולות קטנות ולזיהוי תרכובות עופרת לצורך אימות ואופטימיזציה נוספים. התגברות על אתגר זה היא קריטית לקידום אימונותרפיה לסרטן.
טכנולוגיית תהודה פלזמון פני השטח (SPR) משמשת באופן נרחב באיתור ביומולקולות שונות, כולל אנטיגנים של נוגדנים, אנזימים, חומצות גרעין ותרופות, והיא יעילה במיוחד בבדיקת תרופות של מולקולות קטנות15,16. בניגוד לטכניקות ביופיזיקליות אחרות, SPR מציעה גילוי ללא תוויות, נתונים קינטיים בזמן אמת וטווח זיהוי רחב. לעומת זאת, קלורימטריית טיטרציה איזותרמית חסרה תובנות קינטיות בזמן אמת ודורשת נפחי דגימה גדולים יותר, מה שמגביל את התפוקה. תרמופורזיס בקנה מידה מיקרו נוטה להפרעות חוצץ ואינו יכול לספק נתונים קינטיים, בעוד שלאינטרפרומטריית שכבה ביולוגית יש מגבלות ספציפיות ליישום המבוססות על גודל ותכונות מולקולריות. פלואורסצנציה הומוגנית שנפתרה בזמן דורשת תיוג ורגישה להפרעות פלואורסצנטיות. אנו מכירים בכך ש-HTRF היא טכנולוגיה מתאימה נוספת לחקר מעכבי PD-1/PD-L1. מגבלה אינהרנטית אחת של HTRF, בהשוואה ל-SPR, היא כיבוי פלואורסצנטי הנגרם על ידי אינטראקציות חיצוניות עם תהליך העירור התוך-מולקולרי (למשל, העברת אלקטרונים, FRET והלבנה), הרגישות נמוכה מדי בתהליך סינון התרופות בגלל טווח החלונות הקטן, והפרעות מתרכובות ספרייה פלואורסצנטיות או חלבונים ביולוגיים17. תכונות אלו ממקמות את SPR ככלי מעולה לגילוי תרופות. המחקרים הקודמים שלנו הראו כי SPR מסוגל לקבוע את אפקט החסימה של מולקולות קטנות כנגד PD-1/PD-L1, וזה יתרון על פני טכניקות אחרות הדורשות דרישות טכנולוגיות תיוג גבוהות, שלבים מרובים, ספציפיות ירודה ועלות גבוהה בתהליך גילוי התרופות18.
מחקר זה מציג פלטפורמה מבוססת SPR אופטימלית, המשלבת תהליך צימוד דו-שלבי המשתמש הן בצימוד אמין והן בצימוד ביו-סטרפטווידין כדי לשפר את כיוון PD-1 על השבב ולמזער את השימוש בחלבון. גישה מעודכנת זו אומתה בהצלחה באמצעות מעכב PD-1/PD-L1 BMS-1166 כקלסר בקרה חיובי, המדגים השפעות חסימה דומות הן לשיטת ה-SPR הקודמת שלנו והן לטכניקות מבוססות אחרות כגון ELISA19,20. זה לא רק מאשר את האמינות ויכולת השחזור של הפרוטוקול שלנו, אלא גם ממחיש את היעילות של הפלטפורמה המותאמת שלנו בהקלת סריקה בתפוקה גבוהה של מעכבי PD-1/PD-L1. השילוב של שלב לכידת הביו-סטרפטווידין מספק כיוון חלבון מכוון אתר ולא אקראי, ומאפשר ריכוז PD-1 מופחת (40 מיקרוגרם/מ"ל לעומת 10 מיקרוגרם/מ"ל) וחיסכון בעלויות על ידי מתן אפשרות למשתמש הקצה לשתק סטרפטווידין (SA) לשבב CM5, חלופה זולה יותר לשבבי SA משותקים. זה הופך אותו ליתרון עבור הקרנות בקנה מידה גדול וחסכוני של ספריות תרכובות/פפטידים. למרות ששיטות אפיון נוספות, כולל בדיקות in silico, in vitro ו-in vivo, חיוניות להערכת הפוטנציאל הקליני של מעכבי PD-1/PD-L1 נגד סרטן, פלטפורמת הסינון המשופרת מבוססת ה-SPR שלנו בולטת ככלי יעיל להקרנה בקנה מידה גדול של מעכבי PD-1/PD-L1.
Protocol
הריאגנטים והציוד מפורטים בטבלת החומרים.
1. קיבוע של חלבון הסטרפטווידין (SA) על שבב CM5
- הגדר את שיטת הקיבוע במכשיר SPR: תבנית אשף פתוחה/חדשה, בחר אימוביליזציה, הגדר את סוג השבב ל-CM5 ותאי זרימה למחזור ל-1. בדוק לשתק את תא הזרימה 1 ואת תא הזרימה 2.
- הגדר את אמין כשיטת הקיבוע. הגדר יעד לרמה משותקת, ריכוז ליגנד: 40 מיקרוגרם/מ"ל סטרפטווידין, רמת יעד: 2000 RU, תמיסת כביסה: 50 מ"מ NaOH. לאחר מכן, בדוק את הראשונים לפני ההפעלה.
- הכן את הצינורות הבאים: R2 B1 ו- R2 C1 - 40 מיקרוגרם/מ"ל סטרפטווידין; R2 B2 ו-R2 C2: 50 מ"מ של NaOH; R2 B3 ו-R2 C3: EDC; R2 B4 ו-R2 C4: NHS; R2 B5 ו- R2 C5: ריק; R2 B6 ו-R2 C6: אתנולמין.
הערה: EDC ו-NHS מפעילים את קבוצות הקרבוקסיל בשבב CM5, ומאפשרים צימוד קוולנטי עם אמינים על הליגנד. אתנולמין משמש כמאגר חוסם למניעת קשירה לא ספציפית במהלך קיבוע. - יש לדלל 20 מ"ל של מאגר HBS-EP+ 10× ב-180 מ"ל של מים נטולי יונים (DI) כדי להכין 200 מ"ל של 1× תמיסת חיץ ריצה HBS-EP+.
- הוסף 1 מ"ל מים ללא DNase ל -1 מ"ג סטרפטווידין ודגירה בטמפרטורת החדר למשך 30 דקות. לאחר מכן, יש לדלל את תמיסת הסטרפטווידין ל-40 מיקרוגרם/מ"ל במאגר אצטט (pH 4.5). הכן את ריאגנטים של ערכת ריאגנטים לצימוד אמין בהתאם להוראות היצרן והנח את כל פריסות המגיב הרלוונטיות כמצוין בשלב 1.2.
- החלף את שבב חיישן התחזוקה בשבב CM5, ולאחר מכן הנח את צינור A במאגר 1× HBS-EP+ המוכן, פתח מחדש את שיטת הקיבוע והכנס צינורות בהתאם לפריסת שלב 1.2. הפעל את השיטה ושמור את קובץ התוצאות.
- תחזוקה לאחר הפעלה: החלף את שבב ה-CM5 בשבב חיישן התחזוקה, הנח את צינור A לבקבוק מלא במים נטולי יונים והפעל את הפריים. לאחר הוצאת שבב ה-CM5, שטפו את השבב בכמה טיפות מי DI וייבשו באוויר. הנח את השבב בצינור של 50 מ"ל בטמפרטורה של 4 מעלות צלזיוס.
הערה: ה-SA המשותק מאפשר לשבב CM5 לתפקד כשבב SA.
2. קיבוע של חלבון PD-1 על שבב SA
- הגדר את שיטת הקיבוע במכשיר ה-SPR: תבנית אשף פתוחה/חדשה, בחר אימוביליזציה, הגדר את סוג השבב ל-SA ותאי זרימה לכל מחזור ל-1. בדוק לשתק את תא הזרימה 1 ותא 2.
- הגדר לכידת SA-ביוטין כשיטה. עבור תא 1 הגדר אימוביליזציה ריקה, עבור תא 2 הגדר מטרה לרמה משותקת, 10 מיקרוגרם/מ"ל PD-1 כליגנד, רמת יעד: 4000 RU, ולאחר מכן בדוק ראשוני לפני הריצה.
הערה: הכן את הצינורות הבאים - R2 B1 ו-R2 C1: 1 מ' של NaCl, 50 מ"מ של NaOH; R2 B2 ו-R2 C2: 50% איזופרופנול/50 מ"מ של NaOH/1 מ' של NaCl; R2 C3: 10 מיקרוגרם/מ"ל PD-1.
- הגדר לכידת SA-ביוטין כשיטה. עבור תא 1 הגדר אימוביליזציה ריקה, עבור תא 2 הגדר מטרה לרמה משותקת, 10 מיקרוגרם/מ"ל PD-1 כליגנד, רמת יעד: 4000 RU, ולאחר מכן בדוק ראשוני לפני הריצה.
- ממיסים 58.44 מ"ג של NaCl ב-1 מ"ל של 50 מ"מ NaOH כדי להכין את 1 מ' של NaCl ו-50 מ"מ של תמיסת NaOH. ממיסים 58.44 מ"ג NaCl ו-4.0 מ"ג NaOH ב-500 מיקרוליטר מים, ולאחר מכן מוסיפים 500 מיקרוליטר איזופרופנול להכנת תמיסת 50% איזופרופנול/50 מ"מ NaOH/1 M NaCl.
- הכן תמיסת PD-1: הוסף 200 מיקרוליטר של מים נטולי DNase ל-100 מיקרוגרם של PD-1 אנושי ביוטיניל (Fc ו-Avitagged) וייצב בטמפרטורת החדר למשך 30 דקות, ולאחר מכן לדלל ל-10 מיקרוגרם/מ"ל במאגר אצטט (pH 5.0).
- מקם את כל פריסות המגיב כמתואר בשלב 2.1. הנח את צינור A לתוך תמיסת המאגר הפועל 1× HBS-EP+, ולאחר מכן הוצא את שבב חיישן התחזוקה והכנס את שבב ה-SA (שבב CM5 מצופה בחלבון סטרפטווידין משלב 1). פתח מחדש את שיטת הקיבוע, הכנס את מתלה המגיב 2 ובדוק את המיקומים, ולאחר מכן הפעל את השיטה עבור זמן הריצה המשוער.
- חזור על שלב 1.6.
3. סקאוטינג התחדשות עבור PD-1 ו-PD-L1
- הגדר את שיטת סקאוטינג ההתחדשות: תבנית אשף פתוחה/חדשה , בחר Regeneration Scouting, הגדר נתיב זרימה: 2-1, 4-3, סוג שבב ל-SA , בדוק את מחזור מיזוג ההפעלה, הקלט את הפתרון כ-HBS-EP+, זמן מגע כ-30 שניות, מספר הזרקות כ-3, תמיסה כ-PD-L1, זמן מגע: 30 שניות, קצב זרימה: 30 מיקרוליטר לדקה.
- עבור פרמטרי התחדשות, קצב הזרימה הוא 30 מיקרוליטר לדקה, ותקופת הייצוב היא 300 שניות. בתכנון הניסוי, הגדר את מספר התנאים כ-4, ואת מספר המחזורים עבור כל תנאי כ-2. הגדר את התנאים כ-4, פתרון התחדשות: גליצין 1.5, 2.0, 2.5, 3.0, זמני מגע: 30 שניות, ולאחר מכן בדוק את הראשוני לפני ההפעלה.
- הגדר כל ריכוז PD-L1 כמיקום באר דגימה נפרד בפריסת מיקרו-פלטות של 96 בארות: R1 A1 עד R1 A9: 1 μM PD-L1; R1 A10 עד R1 A12: מאגר HBS-EP+ ; R1 B1: גליצין 1.5; R1 B2: גליצין 2; R1 B3: גליצין 2.5; R1 B4: גליצין 3.
הערה: מאגר גליצין עם pH שונה משמש כמאגר ההתחדשות. - הכן תמיסת PD-L1: הוסף 200 מיקרוליטר של מים ללא DNase ל-100 מיקרוגרם של חלבון PD-L1 Fc Tag אנושי (9.42 מיקרומטר), ולאחר מכן דלל ל-1 מיקרומטר במאגר HBS-EP+.
- הנח את כל הריאגנטים הרלוונטיים בפריסה כמתואר בשלב 3.2. הנח את צינור A במאגר 1× HBS-EP+ ולאחר מכן החלף את שבב חיישן התחזוקה בשבב SA. פתח מחדש את שיטת Regeneration Scouting , עקוב אחר מיקום הצינור משלב 3.2, הכנס את מתלה המגיב ולאחר מכן הפעל את השיטה למשך זמן הריצה המשוער.
- חזור על שלב 1.6.
4. אימות אינטראקציה PD-1/PD-L1
הערה: לצורך אימות, דוח18 שפורסם בעבר לווה בהתאמות קלות.
- השתמש באותם פרמטרים כמו הדוח שפורסם תחת הגדרות כלליות, שלבי בדיקה וסוגי מחזורים, הגדר את זמן המגע ל-60 שניות, זמן דיסוציאציה ל-60 שניות וקצב זרימה ל-30 מיקרוליטר לדקה. תחת משתני שיטה, משתני הערכה ופקודות, השתמש באותה הגדרה, למעט שימוש בגליצין 2.0 כהתחדשות, הגדר את קצב הזרימה ל-30 מיקרוליטר לדקה, עובר דרך נתיב הזרימה של 1, 2, 3, 4.
- לאחר מכן הגדר הפעלה ובחר את נתיב הזרימה: 2-1, 4-3. קלט PD-L1 עם ריכוזים מ- 0 μM, 0.037 μM, 0.111 μM, 0.333 μM ומשקל מולקולרי של 51,300 Da. בדוק את כל שלבי הבדיקה לאימות ובחר ראשוני לפני הריצה.
- לאחר מכן הגדר כל ריכוז PD-L1 כמיקום באר דגימה נפרד בפריסת Reagent Rack 2: R2 B1: PD-L1 0 מיקרומטר; R2 B2: PD-L1 0.037 מיקרומטר; R2 B3: PD-L1 0.111 מיקרומטר; R2 B4: PD-L1 0.333 מיקרומטר; R2 A1: גליצין 2.0 כמאגר התחדשות; R2 A2: HBS-EP+ כמאגר אתחול.
- הכן 200 מ"ל של 1× תמיסת מאגר ריצה HBS-EP+. הכן ריכוזי PD-L1: חלבון PD-L1 מדולל ב-9.42 מיקרומטר עד 0.333 מיקרומטר, 0.111 מיקרומטר ו-0.037 מיקרומטר ב-HBS-EP+. לאחר מכן מקם את כל הריאגנטים הרלוונטיים בפריסה כמתואר בשלב 4.1.2.
- הכנס את שפופרת A לתוך תמיסת חוצץ הריצה 1× HBS-EP+, הוצא את שבב חיישן התחזוקה והכנס את שבב ה-SA. פתח מחדש את שיטת סקאוטינג ההתחדשות , עקוב אחר מיקום הצינור משלב 4.1, הכנס מתלה מגיב 2 והפעל את השיטה למשך הזמן המשוער.
- חזור על שלב 1.6.
5. בדיקת חסימת PD-1/PD-L1 עם מעכב מולקולות קטנות: BMS-1166
הערה: עבור בדיקת המצור, דוח18 שפורסם בעבר לווה בהתאמות קלות.
- השתמש באותם פרמטרים כמו הדוח שפורסם תחת הגדרות כלליות, שלבי בדיקה וסוגי מחזורים, הגדר את זמן המגע ל-60 שניות, זמן דיסוציאציה ל-60 שניות וקצב זרימה ל-30 מיקרוליטר לדקה. תחת משתני שיטה, משתני הערכה ופקודות משתמשים גם הם באותה הגדרה, למעט שימוש בגליצין 2.0 כהתחדשות, הגדרת קצב זרימה ל-30 מיקרוליטר לדקה, עוברת דרך נתיב הזרימה של 1, 2, 3, 4.
- לאחר מכן הגדר הפעלה ובחר נתיב זרימה: 2-1, 4-3. הזן את פתרון המדגם: PD-L1 (0.111 μM, משקל מולקולרי של 51,300 Da) עם BMS-1166 ב-0 μM, 0.125 μM, 0.625 μM, 3.125 μM. בדוק את כל שלבי הבדיקה לאימות ובחר ראשוני לפני הריצה.
- לאחר מכן הגדר כל ריכוז PD-L1 כמיקום באר דגימה נפרד בפריסת Reagent Rack 2: R2 B1: PD-L1 (0.111 μM) + BMS-1166 0 μM R2 B2: PD-L1 (0.111 μM) + BMS-1166 0.125 μM; R2 B3: PD-L1 (0.111 מיקרומטר) + BMS-1166 0.625 מיקרומטר; R2 B4: PD-L1 (0.111 מיקרומטר) + BMS-1166 3.125 מיקרומטר; R2 A1: גליצין 2.0 להתחדשות.
- הכן 200 מ"ל של 1× תמיסת מאגר ריצה HBS-EP+. הכן תערובת BMS-1166/PD-L1: ממיסים 5 מ"ג של BMS-1166 ב-77.99 מיקרוליטר דימתיל סולפוקסיד (DMSO) להכנת תמיסת מלאי של 100 מ"מ. לדלל את תמיסת המלאי עם חלבון PD-L1 (0.11 μM) לריכוזי היעד של BMS-1166 ב-0 μM, 0.125 μM, 0.625 μM ו-3.125 μM ב-HBS-EP+. מקם את כל פריסת הריאגנטים הרלוונטית כמתואר בשלב 5.1.2.
- הנח את צינור A לתוך תמיסת המאגר הפועל 1× HBS-EP+, ולאחר מכן הוצא את שבב חיישן התחזוקה והכנס את שבב ה-SA. פתח מחדש את שיטת הסקאוטינג של ההתחדשות , עקוב אחר מיקום הצינור מ-5.1 והכנס את מתלה המגיב 2, ולאחר מכן הפעל את השיטה לזמן הריצה המשוער.
- חזור על שלב 1.6.
תוצאות
קיבוע של SA על שבב CM5
הנתונים נותחו באמצעות הפלט ממכשיר ה-SPR ותוכנת הניתוח הנלווית המצביעים על השגה מוצלחת של ה-RU היעד (2000 RU) של חלבון SA בתא זרימה 1 ותא זרימה 2. תאי זרימה 1 ו-2 היו משותקים עם SA (40 מיקרוגרם/מ"ל) על משטח שבב CM5 עם תגובה סופית של 1902.3 RU בתא זרימה 1 (איור 1A) ו-1900.7 RU בתא זרימה 2 (איור 1B).
קיבוע של PD-1 על שבב SA
ניתוח נתונים המבוסס על הפלט ממכשיר ה-SPR והתוכנה הנלווית הצביע על יחידת תגובה נמוכה (RU) עבור התא הריק בתא הזרימה 1 והשגה מוצלחת של RU היעד (4000 RU) עבור ליגנד PD-1 בתא זרימה 2. תא זרימה 1 היה משותק כריק, והניב תגובה סופית של -161.0 RU (איור 2A), בעוד שתא זרימה 2 היה משותק עם חלבון PD-1 ביוטיניליזציה (10 מיקרוגרם/מ"ל) מצופה על שבב SA, וכתוצאה מכך תגובה סופית של 3698.5 RU (איור 2B).
סקאוטינג התחדשות עבור PD-1 ו-PD-L1.
מעקב התחדשות נערך עם PD-1 משותק על תא זרימה 2, ו-PD-L1 בתמיסה (0.1 מיקרומטר) ברמות pH שונות של גליצין (1.5, 2, 2.5 ו-3) כדי לקבוע את תמיסת ההתחדשות וכתוצאה מכך קו בסיס יציב ותגובת דגימה. הנתונים נותחו באמצעות הפלט ממכשיר ה-SPR ותוכנת הניתוח, וכתוצאה מכך גליצין (pH 2.0) הוא מצב ההתחדשות האופטימלי עקב שינויים מינימליים בתגובה הן לתגובה הבסיסית והן לתגובת הדגימה, מה שמעיד על אובדן מינימלי של חלבון PD-1 והסרה מוצלחת של חלבון PD-L1 משטח השבב. ב-Glycine pH 2.0, התגובה הבסיסית נותרה קבועה יחסית, ותגובת האנליט הייתה יציבה וקרובה לתגובה בתחילת הניסוי, מה שמצביע על מאגר ההתחדשות האופטימלי ביותר מבין ארבעת תנאי ה-pH של הגליצין שנבדקו. pH גבוה יותר אינו מספיק, ו-pH נמוך יותר הוא קשה מדי; pH 2.0 מזוהה כמצב ההתחדשות המתאים ביותר (איור 3).
אימות אינטראקציה PD-1/PD-L1
הנתונים נותחו באמצעות תוכנת ההערכה המתאימה. תחת הקטע Kinetics/Affinity, בחר "Surface-bound", בחר עקומה 2-1, הגדר את מודל הקינטיקה לכריכה של 1:1, והתאם את פרמטר ה-RI להתאמה קבועה כדי לקבוע את קצב האסוציאציה (ka), קצב הדיסוציאציה (kd) וקבוע הדיסוציאציה של שיווי המשקל (KD). אינטראקציית הקישור של PD-L1 בריכוזים משתנים עם PD-1 כומתה, והניבה תגובה מדידה (איור 4). פרמטרי הקישור שנותחו כללו שיעור אסוציאציה (ka) של 3.611 × 104 (1/ms), קצב דיסוציאציה (kd) של 0.0236 (1/s) וקבוע דיסוציאציה של שיווימשקל (K D) של 6.536 ×-10-7 M.
בדיקת חסימת PD-1/PD-L1 עם מעכב מולקולות קטנות מבוססות: BMS-1166
הנתונים נותחו באמצעות ההתאמה. תחת Kinetics/Affinity, בחר Surface-bound, בחר את העקומה 2-1, ולאחר מכן קבל את העקומה החזותית של התוצאה ויחידת התגובה. אפקט החסימה של אינטראקציית הקישור PD-1/PD-L1 נצפתה עם BMS-1166 (0-3.125 מיקרומטר) עם חלבון PD-L1 של 0.11 מיקרומטר במאגר HBS EP+ (איור 5). יחידת התגובה הגבוהה ביותר מזוהה על ידי PD-L1 בלבד, בעוד שעם עלייה בריכוז BMS-1166, יחידת תגובת הקישור יורדת באופן יחסי.

איור 1: אימוביליזציה של SA על שבב CM5. עקומות אימוביליזציה של חלבון סטרפטווידין על תא זרימת שבב CM5 1 (A) ותא זרימה 2 (B) מוצגות. ראשית, חמישה ריכוזים מוקדמים של חלבון SA זרמו על תאי זרימה 1 ו-2, ואחריהם שטיפה של NaOH והקמת קו בסיס יציב. לאחר מכן, נוספו EDC ו-NHS, ולאחר מכן בוצעה שטיפת אתנולאמין הידרוכלוריד. לאחר מכן, בוצעו חמש פעימות של PD-1 כדי להגיע לרמת היעד (2000 RU), ולאחר מכן שטיפת אתנולאמין הידרוכלוריד להסרת ליגנדים קשורים אלקטרוסטטית וביטול אסטרי NHS שנותרו לא תגובתיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 2: אימוביליזציה של PD-1 על שבב SA. עקומות אימוביליזציה של (A) תא הזרימה הריק 1 המצופה ב-SA בלבד, ו-(B) חלבון PD-1 בשבב SA בתא זרימה 2 מוצגות. עבור הריק (תא זרימה 1), 1 M של NaCl ו-50 מ"מ של NaOH הוזרקו שלוש פעמים, ולאחר מכן שטיפה עם 50% איזופרופנול/1 M של NaCl/50 מ"מ של NaOH. עבור חלבון PD-1 (תא זרימה 2), 1 M של NaCl ו-50 מ"מ של NaOH הוזרקו שלוש פעמים, ולאחר מכן חמש פולסים של חלבון PD-1 כדי להגיע לרמת היעד של 4000 RU ושטיפה סופית של 50% איזופרופנול/1 M של NaCl/50 מ"מ של NaOH. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: סקאוטינג רגנרציה עבור PD-1 ו-PD-L1. תגובת הבסיס והדגימה התקבלו עבור ארבעה מצבי התחדשות עם גליצין ב-pH 1.5, 2, 2.5 ו-3 כדי לקבוע את פתרון ההתחדשות האופטימלי לפני בדיקת הדגימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: אימות של אינטראקציה PD-1/PD-L1. קינטיקה קשירה בריכוזים שונים של PD-L1 (0.037 מיקרומטר, 0.111 מיקרומטר ו-0.333 מיקרומטר) ל-PD-1 על פני השבב המצופה סטרפטווידין. PD-L1 מדגים קשר מובהק (0-60 שניות) ושלבי דיסוציאציה (61-120 שניות) עם PD-1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
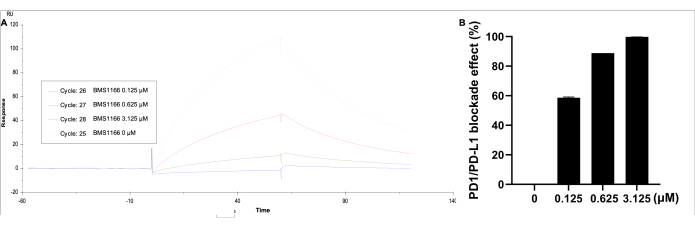
איור 5: ניתוח SPR של PD-1 מצופה על שבב CM5 משותק SA, עם PD-L1 (0.11 μM) ו-BMS-1166 (0-3.125 μM) בתמיסה. (A) תגובת SPR מייצגת בזמן אמת של תגובות הקישור בין PD-1/PD-L1 עם BMS-1166. (B) אחוז אפקט החסימה BMS-1166 על קינטיקה של קשירת אינטראקציה PD-1/PD-L1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: השוואה בין אסטרטגיות קיבוע חלבון PD-1. צימוד אמין (A) לעומת צימוד סטרפטווידין-ביוטין דו-שלבי (B). צימוד אמין מציב אתגרים, כולל זמינות מוגבלת של אתרי קשירה נגישים, עיכוב סטרי לקשירה ושינוי פוטנציאלי של אתרי קשירה PD-1 במהלך קיבוע. לעומת זאת, גישת סטרפטווידין-ביוטין הדו-שלבית משפרת את הזמינות של אתרי קשירה חופשיים על PD-1 משותק, ומאפשרת אינטראקציה משופרת עם PD-L1 בתמיסה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
במהלך העשורים האחרונים, גישות אימונותרפיות שונות - כולל חיסונים לסרטן, מעכבי נקודות ביקורת חיסוניות וטיפולים בתאי T CAR - קידמו משמעותית את הטיפול בסרטן21. נקודות ביקורת חיסוניות ממלאות תפקיד מכריע במניעת נזק אגבי בתיווך תאי חיסון במהלך תגובות פתוגניות ובדיכוי אוטואימוניות. דוגמה מרכזית היא האינטראקציה בין PD-L1 ל-PD-1, המהווה מחסום חיסוני מרכזי, המאפשר לתאי סרטן להתחמק ממעקב חיסוני. התמקדות במסלול PD-1/PD-L1 עם נוגדנים חד-שבטיים השיגה הצלחה יוצאת דופן באונקולוגיה קלינית. עם זאת, בשל מגבלות הקשורות לטיפולים בנוגדנים חד-שבטיים והשכיחות הגוברת של תופעות לוואי הקשורות למערכת החיסון, יש עניין גובר בפיתוח מעכבי מולקולות קטנות המכוונים ל-PD-1/PD-L1 9,22.
אסטרטגיות הסינון הנוכחיות למעכבי PD-1/PD-L1 של מולקולות קטנות מתמקדות בעיקר בטכניקות בדיקה ביולוגית כגון ELISA, מבחני דיווח מבוססי תאים ובדיקות תאי T. טכניקות ביופיזיקליות, כולל SPR ואינטרפרומטריית שכבה ביולוגית (BLI) נמצאות בשימוש נרחב לאפיון זיקות קשירה, אך הפוטנציאל שלהן לשמש ככלי סינון אינו מוערך23. מחקר זה פיתח בדיקת חסימת PD-1/PD-L1 מבוססת SPR, המציעה פלטפורמה בעלת תפוקה גבוהה המתאימה לגילוי מעכבי PD-1/PD-L1 במולקולות קטנות. SA היה משותק ל-~2000 RU, ואחריו PD-1 ביוטיניל (~4000 RU) באמצעות אינטראקציית ביוטין-סטרפטווידין. קשירה חזקה זו הבטיחה ציפוי PD-1 מאובטח עם אוריינטציה אופטימלית, מזעור קשירה לא ספציפית והפחתת השימוש בחלבון (10 מיקרוגרם/מ"ל). אימוביליזציה מכוונת אתר שיפרה את היעילות בהשוואה לשיטות קונבנציונליות. מאגר גליצין (pH 2.0) שימש לחידוש משטח החיישן בין מחזורים, שמירה על שלמות הניסוי ומניעת קשירה לא ספציפית.
בהשוואה לשיטות אימונולוגיות סטנדרטיות ו-ELISA, גישת SPR זו הציעה זיהוי בזמן אמת, ללא תוויות עם רגישות וסגוליות גבוהות. יתר על כן, הוא מאפשר סריקה בתפוקה גבוהה עם זמן ריצה של 120 שניות לדגימה ומשלים בדיקות ביולוגיות בהערכת יעילות החסימה של תרכובות וביולוגיות המכוונות ל-PD-1/PD-L1. רמת הקיבוע שהושגה הייתה דומה לפלטפורמה הקודמת (3698.5 RU לעומת 3688.5 RU), עם זיקה דומה לאינטראקציה PD-1/PD-L1 (KD = 6.536 × 10-7 M לעומת 1.295 × 10-7 M). מעכב BMS-1166 הראה שיעור דיסוציאציה גבוה יותר בריכוז נמוך יותר, עם השפעות חסימה דומות לפלטפורמה הקודמת (99.8% לעומת 94.2% ב-3.125 מיקרומטר). BMS-1166 הדגים שיעורי חסימה PD-1/PD-L1 הנתמכים על ידי ערכי IC50 של 1.4 ננומטר ו-96 ננומטר במבחנים מבוססי HTRF ותאים, בהתאמה24. בנוסף, מחקרים אחרים דיווחו על ערכי IC50 של 3.9 ננומטר ו-1574 ננומטר באמצעות HTRF ושיטות בדיקת תרבית משותפת של חסימת מחסום חיסוני25. התוצאות הקודמות שלנו הראו שערכי IC50 של BMS-1166 היו 85.4 ננומטר, מה שעולה בקנה אחד עם הממצאים הקודמים הללו18. יתרון נוסף של פלטפורמת סינון זו הוא החוסן והתפוקה הגבוהה שלה. שיטה זו יושמה באופן נרחב בהקרנה בתפוקה גבוהה באמצעות פורמט צלחת של 384 בארות, כאשר BMS-1166 ו-BMS-202 נכללו כבקרות חיוביות לכל 10 דגימות. טווחי שיעור החסימה היו 29.8%-38.1% עבור BMS-1166 ו-6.0%-10.4% עבור BMS-202 ב-10 ננומטר (n = 11 לצלחת).
ל-DMSO צפויות להיות השפעות שונות על ממברנות ביולוגיות הטרוגניות, בהתאם להרכבן ולמבנה המקומי שלהן, מה שעלול להשפיע על תפקודים ביולוגיים הקשורים לממברנה. בריכוזים נמוכים יחסית, DMSO יכול לשנות את תכונות החלבון בתמיסה, מה שמוביל לדנטורציה, צבירה או פירוק. בנוסף, DMSO עשוי לשנות את תכונות הקישור לכאורה של חלבונים26,27. יתר על כן, כדי לטפל בחששות קודמים לגבי הפרעות DMSO, הפחתנו את ריכוז ה-DMSO ל-0.003% (0.01% DMSO שימש בפלטפורמה הקודמת) בפרוטוקול זה.
במחקר קודם, חלבוני PD-1 קובעו על שבבי חיישנים באמצעות צימוד אמין, המשתמש בכימיה של EDC/NHS כדי להפעיל קבוצות קרבוקסימתיל על השבב, וליצור קשרים קוולנטיים עם קבוצות אמין ב-PD-1. בשל נוכחותן של קבוצות אמינים מרובות על פני 288 חומצות האמינו של PD-1, שיטה זו מביאה מטבעה לכיוונים אקראיים. כדי להשיג אוריינטציה ספציפית יותר, השתמשנו באסטרטגיית צימוד לכידה עם PD-1 אנושי ביוטיניל (Fc, Avitag) במחקר זה. שאריות הליזין הבודדות ב-Avitag עוברות ביוטינילציה אנזימטית באזור Fc של PD-1, מה שמאפשר קיבוע מדויק באמצעות אינטראקציה בעלת זיקה גבוהה בין ביוטין לסטרפטווידין (איור 6). תיאורטית, גישה זו מבטיחה שהתחום המשתנה של PD-1 יישאר חשוף, מה שמאפשר אינטראקציה אופטימלית עם PD-L1 במאגר. עם זאת, הנחה זו דורשת אימות נוסף באמצעות טכניקות כגון cryo-EM או קריסטלוגרפיה כדי לאשר את כיוון החלבון.
גליצין 2.0 שימש כחוצץ התחדשות קל, והסיר ביעילות את PD-L1 מבלי להפחית את ה-PD-1 המשותק. עם זאת, עבור מעכבים קשורים היטב או אגרגטים של חלבון, ייתכן שיידרשו מאגרי התחדשות חזקים יותר, כגון 0.5% SDS או 50-100 מ"מ של NaOH, כדי למנוע הפרעה לדגימות הבאות.
למחקר זה מספר מגבלות. ראשית, העלות הגבוהה של מכשור SPR יכולה להגביל את הנגישות, אם כי לעתים קרובות ניתן להתאים את הפרוטוקול למערכות SPR אחרות בעלות יכולות דומות. ניתן להתאים פרמטרים כגון ריכוז חלבון וזמני אסוציאציה/דיסוציאציה כך שיתאימו לפלטפורמות SPR ספציפיות. מגבלה נוספת היא ההסתמכות שלו על חלבונים רקומביננטיים, שאולי לא ישכפלו לחלוטין אינטראקציות חלבון מקומיות. יש לקחת בחשבון גורמים אלה בעת פירוש נתוני SPR והשוואת תוצאות עם טכניקות משלימות, כגון מבחנים מבוססי תאים או מודלים in vivo .
למרות מגבלות אלה, שיטת ה-SPR האופטימלית מציעה גישה מהירה, בזמן אמת, תפוקה גבוהה ונטולת תוויות לסינון מעכבי מולקולות קטנות של אינטראקציית PD-1/PD-L1. הוא משפר באופן משמעותי טכניקות ביופיזיקליות לאפיון מולקולות קטנות ותרופות ביולוגיות המכוונות לאינטראקציה PD-1/PD-L1. עם הרגישות הגבוהה שלה, הפלטפורמה חשובה במיוחד לחקר אינטראקציות מחסום חיסוני ואינטראקציות רחבות יותר בין חלבון לחלבון (PPI), מה שהופך אותה לכלי רב עוצמה לקידום גילוי תרופות PPI.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מכירים במתקן הליבה של RI-INBRE באוניברסיטת רוד איילנד, הנתמך על ידי מענק P20GM103430 מהמרכז הלאומי למשאבי מחקר (NCRR), מרכיב של המכונים הלאומיים לבריאות (NIH). מחקר זה נתמך על ידי פרס מענק פיילוט מהמכללה לרוקחות באוניברסיטת רוד איילנד, פרס מענק קטן ממרכז מדעי החיים של רוד איילנד (RILSH), ומענק קרן רוד איילנד, כולם הוענקו לצ'אנג ליו, Ph.D.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mM NaOH | Cytiva Life Sciences | 100358 | |
| 50 mM NaOH | Fisher Scientific | 905376 | |
| 96-Well Polystyrene Microplates | Cytiva Life Sciences | BR100503 | |
| Amine Coupling Kit | Cytiva Life Sciences | 35120 | |
| Biacore T200 SPR System and Evaluation Software 3.2 | Cytiva Life Sciences | 28975001 | |
| Biotinylated Human PD-1 Fc, Avitag Protein | Acro Biosystems | PD1-H82F1 | |
| BMS1166 | MedChemExpress | HY-102011 | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 276855 | |
| DNase Free Water | Fisher Scientific | 188506 | |
| Glycine 1.5 | Cytiva Life Sciences | BR100354 | |
| Glycine 2.0 | Cytiva Life Sciences | BR100355 | |
| Glycine 2.5 | Cytiva Life Sciences | BR100356 | |
| Glycine 3.0 | Cytiva Life Sciences | BR100357 | |
| HBS-EP+ Buffer | Cytiva Life Sciences | BR100669 | |
| Human PD-L1 Fc Tag Protein | Acro Biosystems | PD-1-H5258 | |
| Isopropanol | Fisher Scientific | BP2618-1 | |
| Microplate Foil, 96-Well | Cytiva Life Sciences | 28975816 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Plastic Vials 7 mm | Cytiva Life Sciences | BR100212 | |
| Rubber Caps, Type 3 | Cytiva Life Sciences | BR100502 | |
| Series S Sensor Chip CM5 | Cytiva Life Sciences | 29149603 | |
| Sodium Acetate 4.5 | Cytiva Life Sciences | 100350 | |
| Sodium Acetate 5.0 | Cytiva Life Sciences | 100351 | |
| Streptavidin | Sigma-Aldrich | S4762 |
References
- Ribas, A., Wolchok, J. D. Cancer immunotherapy using checkpoint blockade. Science. 359 (6382), 1350-1355 (2018).
- Zhang, X., et al. Structural and functional analysis of the costimulatory receptor programmed death-1. Immunity. 20 (3), 337-347 (2004).
- Freeman, G. J., et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 192 (7), 1027-1034 (2000).
- Han, Y., Liu, D., Li, L. PD-1/PD-L1 pathway: Current researches in cancer. Am J Cancer Res. 10 (3), 727-742 (2020).
- Lyu, N., et al. Recognition of PDL1/L2 by different induced-fit mechanisms of PD1: A comparative study of molecular dynamics simulations. Phys Chem Chem Phys. 22 (3), 1276-1287 (2020).
- Taube, J. M., et al. Colocalization of inflammatory response with B7-H1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape. Sci Trans Med. 4 (127), 127ra37 (2012).
- Sun, X., et al. Immune-related adverse events associated with programmed cell death protein-1 and programmed cell death ligand 1 inhibitors for non-small cell lung cancer: A PRISMA systematic review and meta-analysis. BMC Cancer. 19 (1), 558 (2019).
- Alkholifi, F. K., Alsaffar, R. M. Dostarlimab an inhibitor of PD-1/PD-L1: A new paradigm for the treatment of cancer. Medicina. 58 (11), 1572 (2022).
- Uzar, W., et al. An updated patent review on PD-1/PD-L1 antagonists (2022-present). Expert Opin Ther Pat. 34 (8), 627-650 (2024).
- Ai, L., et al. Research status and outlook of PD-1/PD-L1 inhibitors for cancer therapy. Drug Des Devel Ther. 14, 3625-3649 (2020).
- Conroy, M., Naidoo, J. Immune-related adverse events and the balancing act of immunotherapy. Nat Commun. 13 (1), 392 (2022).
- Guzik, K., et al. Small-molecule inhibitors of the Programmed Cell Death-1/Programmed Death-Ligand 1 (PD-1/PD-L1) interaction via transiently induced protein states and dimerization of PD-L1. J Med Chem. 60 (13), 5857-5867 (2017).
- Sifniotis, V., Cruz, E., Eroglu, B., Kayser, V. Current advancements in addressing key challenges of therapeutic antibody design, manufacture, and formulation. Antibodies. 8 (2), 36 (2019).
- Beck, H., Härter, M., Haß, B., Schmeck, C., Baerfacker, L. Small molecules and their impact in drug discovery: A perspective on the occasion of the 125th anniversary of the Bayer Chemical Research Laboratory. Drug Discov Today. 27 (6), 1560-1574 (2022).
- Nguyen, H. H., Park, J., Kang, S., Kim, M. Surface plasmon resonance: A Versatile technique for biosensor applications. Sensors (Basel, Switzerland). 15 (5), 10481-10510 (2015).
- Liu, C., Seeram, N. P., Ma, H. Small molecule inhibitors against PD-1/PD-L1 immune checkpoints and current methodologies for their development: A review. Cancer Cell Int. 21 (1), 239 (2021).
- Hu, K., Li, X. -. J., Asmamaw, M. D., Shi, X. -. J., Liu, H. -. M. Establishment of high-throughput screening HTRF assay for identification small molecule inhibitors of Skp2-Cks1. Sci Rep. 11 (1), 21105 (2021).
- Puopolo, T., et al. Establishment of human PD-1/PD-L1 blockade assay based on surface plasmon resonance (SPR) biosensor. Bio-protoc. 13 (15), e4765 (2023).
- Ding, M., Chen, Y., Lang, Y., Cui, L. The role of cellular prion protein in cancer biology: A potential therapeutic target. Front Oncol. 11, 742949 (2021).
- Li, H., Seeram, N. P., Liu, C., Ma, H. Further investigation of blockade effects and binding affinities of selected natural compounds to immune checkpoint PD-1/PD-L1. Front Oncol. 12, 995461 (2022).
- Kamrani, A., et al. New immunotherapeutic approaches for cancer treatment. Pathol Res Pract. 248, 154632 (2023).
- Yan, Y., Zhang, L., Zuo, Y., Qian, H., Liu, C. Immune checkpoint blockade in cancer immunotherapy: mechanisms, clinical outcomes, and safety profiles of PD-1/PD-L1 inhibitors. Arch Immunol Ther Exp. 68 (6), 36 (2020).
- Chandrasekharan, G., Unnikrishnan, M. High throughput methods to study protein-protein interactions during host-pathogen interactions. Eur J Cell Biol. 103 (2), 151393 (2024).
- Zhang, Y., et al. BMS-202, a PD-1/PD-L1 inhibitor, decelerates the profibrotic effects of fibroblasts derived from scar tissues via ERK and TGFβ1/Smad signaling pathways. Immun Inflamm Dis. 10 (1), e591 (2022).
- Surmiak, E., et al. PD-L1 inhibitors: Different classes, activities, and mechanisms of action. Int J Mol Sci. 22 (21), 11797 (2021).
- Feoli, A., Sarno, G., Castellano, S., Sbardella, G. DMSO-Related effects on ligand-binding properties of lysine methyltransferases G9a and SETD8. ChemBioChem. 25 (4), e202300809 (2024).
- Tjernberg, A., Markova, N., Griffiths, W. J., HalléN, D. DMSO-Related effects in protein characterization. SLAS Discov. 11 (2), 131-137 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved