Method Article
Doğal γH2A ile yaygın kırılgan bölge kırılmalarının yakalanması. X ChIP
Bu Makalede
Özet
Doğal γH2A.X kromatin immünopresipitasyonu (ChIP) yoluyla yaygın kırılgan bölge kırılmalarını tespit etmek için hızlı ve etkili bir yöntem sunuyoruz. Bu yaklaşım, geleneksel γH2A.X ChIP tahlilleriyle ilişkili hem zamanı hem de işçiliği önemli ölçüde azaltırken, sonuçların yüksek tekrarlanabilirliğini ve güvenilirliğini korur.
Özet
Ekstrinsik ajanlara maruz kalmanın neden olduğu replikasyon stresi, genomda yapısal dengesizliğe eğilimli olduğu bilinen bölgeler olan ortak kırılgan bölgelerde DNA kırılmalarına yol açabilir. γH2A.X kromatin immünopresipitasyon (ChIP) testi, genotoksisite çalışmalarında güçlü bir araç olarak hizmet eder, çünkü γH2A.X fosforilasyonu, DNA çift iplikli kırılmalar için iyi bilinen bir belirteçtir. Bununla birlikte, geleneksel γH2A.X ChIP tahlilleri genellikle emek yoğundur ve çoklu, zaman alıcı adımlar içerir. Bu çalışmada, γH2A.X ile ilişkili kompleksleri izole etmek için hücre altı fraksiyonlamayı doğal ChIP ile birleştiren basitleştirilmiş ancak etkili bir yöntem sunuyoruz. Bu yaklaşım, gelişmiş özgüllük ve verimlilik ile γH2A.X-kromatin etkileşimlerini analiz etmek için özellikle uygundur. Hücre altı fraksiyonlama kullanılarak, kromatine bağlı olmayan malzemeler etkili bir şekilde uzaklaştırılır ve saflaştırılmış bir kromatin fraksiyonu elde edilir. Hafif koşullar altında müteakip mikrokokal nükleaz (MNaz) sindirimi, γH2A.X ve ilişkili protein kompleksleri arasındaki fizyolojik etkileşimleri korurken kromatin parçalanmasına izin verir. Bu koruma, DNA hasar tepki yollarında yer alan doğal etkileşim ortaklarını incelemek için gereklidir. Bu optimize edilmiş yerel ChIP protokolü, geleneksel γH2A.X ChIP tahlilleriyle ilişkili zamanı ve işçiliği önemli ölçüde azaltır. Kolaylaştırılmış prosedür yalnızca iş akışını basitleştirmekle kalmaz, aynı zamanda yüksek oranda tekrarlanabilir sonuçlar verir, bu da onu birden fazla numunenin yüksek verimli işlenmesinin gerekli olduğu ortamlarda özellikle avantajlı hale getirir. Bu yöntem, DNA hasar bölgelerinin doğru ve verimli bir şekilde tespit edilmesinin kritik olduğu genom stabilitesi, DNA onarımı ve kromatin biyolojisine odaklanan çalışmalarda geniş bir uygulanabilirliğe sahiptir. Optimize edilmiş protokoller ve kolaylaştırılmış adımlar kullanan bu yöntem, gelişmiş hassasiyet ve minimum numune işleme ile hassas bölgelerde DNA hasarının tespit edilmesini sağlar ve bu da onu genom stabilitesi ve DNA hasar tepkisi üzerine çalışmalar için değerli bir araç haline getirir.
Giriş
Yaygın kırılgan bölgeler (CFS'ler), metafaz sırasında kırılmaya eğilimli her insan kromozomunda bulunan büyük kromozomal bölgelerdir. Replikasyon stresi altında, bu bölgelerdeki replikasyon önemli ölçüde gecikir ve mitotik giriş1'den önce bunların tamamen tekrarlanması önlenir ve bu da sonuçta sahaya özgü boşluklar ve kırılmalarla sonuçlanır. CFS'ler kromozomal instabilite için sıcak noktalardır ve erken kanser gelişimi sırasında kromozomal yeniden düzenlemelerin önemli bir nedenidir. Genellikle tümörjenik koşullar altında mevcut olan replikasyon stresi, tümör baskılayıcı genlerin kaybına ve topluca kopya sayısı varyasyonu (CNV) olarak adlandırılan onkogenlerin amplifikasyonuna yol açabilir - 2,3,4,5,6. Ek olarak, CFS'ler viral entegrasyona oldukça yatkındır ve kanser gelişimini daha da teşvik eder 7,8,9,10. Primer tümörlerin pan-kanser analizleri sırasında CFS bölgelerinde tümör baskılayıcı genlerin çoklu homozigot delesyonları tespit edilmiştir. Kanserde en sık etkilenen CFS'ler FRA2F, FRA3B, FRA4F, FRA5H ve FRA16D'dir11. CFS'ler, ekstrinsik kanserojen ajanların varlığında kırılmaya karşı özellikle hassastır12. Çevresel kirleticilerin zararlı kanserojen etkilerini değerlendirmek için, CFS kırılma oluşumunu ölçmek için hızlı ve güvenilir bir yönteme ihtiyaç vardır.
H2A'nın fosforilasyonu. Ataksi Telenjiektazi ve Rad3 ile İlgili Protein (ATR) veya Ataksi Telenjiektazi Mutasyona Uğramış (ATM) serin kalıntısı 139'daki (γH2A.X) X, sinyal replikasyon çatalının durmasında önemli bir olaydır13. γH2A.X, çift iplikli kopma (DSB) oluşumundan13 önce durmuş replikasyon çatallarının bir göstergesi olarak hizmet eder ve onarım proteinlerinin durmuş bölgelere verimli bir şekilde alınmasını kolaylaştırmak için uygun bir kromatin ortamı yaratır. Ek olarak, γH2A.X, DSB onarımındaki birincil rolüyle tutarlı olarak, çatal çökmesi 14,15'in ardından sahaları kırmak için işe alınabilir. Kronik Yorgunluk Sendromu kırılmaları, kanserin ilerlemesini sağlayan kromozomal anormalliklerle yakından ilişkili olduğundan, bu kırılmaların tespit edilmesi, tümör oluşumunun erken evrelerinin anlaşılmasında etkili olabilir. CFS'lerde γH2A.X'in varlığı, genomik instabilitenin erken olaylarını tespit etmek için bir biyobelirteç olarak kullanılabilir. Bu bilgi, potansiyel kanserojenlerin tanımlanmasına ve çeşitli dışsal ajanlara maruz kalmayla ilişkili riskin değerlendirilmesine yardımcı olabilir. γH2A.X kromatin IP (ChIP), ekstrinsik ajanlar tarafından indüklenen CFS'lerde DNA kırılmalarını ölçerek, bu tür ajanların tümörigenezin altında yatan mekanizmalara nasıl katkıda bulunduğuna dair fikir verebilir.
Konvansiyonel ChIP'de (yani, Çapraz bağlı ChIP, X-ChIP), γH2A.X'in hedef DNA dizileri ile ilişkisi, tersinir formaldehit çapraz bağlama ile stabilize edilir. Kromatin daha sonra sonikasyon yoluyla yaklaşık 500 baz çiftinin (bp) parçalarına kesilir ve elde edilen çözelti sedimantasyon 16,17,18 ile döküntülerden arındırılır. Daha sonra temizlenmiş kromatin fraksiyonuna bir ChIP dereceli γH2A.X antikoru eklenir, ardından γH2A.X'e bağlı kromatin bölgeleri 16,17,18 için zenginleştirmek üzere Protein A/G agaroz boncukları eklenir. Bağışıklık kompleksleri (yani, boncuk-antikor-γH2A.X-hedefli DNA kompleksi), spesifik olarak bağlı olmayan DNA parçalarını çıkarmak için sıkı yıkama tamponları ile birçok kez yıkanır 16,17,18. Yıkandıktan sonra, spesifik olarak bağlı DNA, bağışıklık komplekslerinden ayrıştırılır. Formaldehit çapraz bağları daha sonra tersine çevrilir, ardından proteinaz K kullanılarak protein sindirimi yapılır, ardından zenginleştirilmiş DNA saflaştırılır ve konsantreedilir 16,17,18. γH2A.X ile ilişkili bölgeleri değerlendirmek için PCR, kantitatif PCR (qPCR) veya doğrudan dizileme kullanılır 16,17,18. γH2A.X'in CFS gibi belirli bölgelerdeki doluluğu, o konuma bağlı γH2A.X miktarı ile orantılı olan PCR veya qPCR sinyalinin yoğunluğu ile belirlenir ve bölgeye özgü DNA hasarı ve onarım olayları hakkında bilgi sağlar 16,17,18.
Güçlü bir deneysel yaklaşım olmasına rağmen, X-ChIP'nin birkaç önemli sınırlaması vardır: (i) fiksasyonla ilişkili antikor çökelmesinin verimsizliği nedeniyle, tipik olarak 1 x 107 ila 5 x 107 aralığında çok sayıda hücre gerektirir, bu da deneyin toplam maliyetini artırır19; (ii) formaldehit çapraz bağlarının tersine çevrilmesi ve müteakip DNA saflaştırılması süreci zaman alıcı ve emek yoğundur, bu da sonuçlarda tutarlılığı ve güvenilirliği korumayı zorlaştırır; ve (iii) küçük işlevsel öneme sahip γH2A.X-DNA etkileşimleri, daha büyük öneme sahip olanlardan ayırt edilemeyebilir, çünkü çapraz bağlama adımı geçici etkileşimleri stabilize edebilir ve biyolojik olarak ilgili olmayabilecek etkileşimlerin saptanmasına yol açabilir19.
Doğal kromatin immünopresipitasyonu (Native ChIP veya N-ChIP), fizyolojik tuz koşulları altında doğal kromatin bağlamında protein-DNA etkileşimlerini incelemek için kullanılan temel bir biyokimyasal tekniktir. Kromatinin uzamsal ve zamansal organizasyonunu, transkripsiyon faktörü bağlanmasını ve histon modifikasyonlarını aydınlatmada etkili olmuştur. Native ChIP, daha geniş kromatin biyolojisi ve epigenetik alanında uzun süredir devam eden bir role sahiptir ve X-ChIP'ye kıyasla benzersiz avantajlar ve sınırlamalar sağlar. 1980'lerin sonlarındatanıtılan bu yöntem20, kromatinin mikrokokal nükleaz (MNase) 21 ile sindirim gibi doğal yapısını koruyan yöntemlerle hücrelerden izole edilmesini içerir. Bu, doğal protein-DNA ve histon-DNA temaslarını korur, bu da Native ChIP'yi doğal kromatin ayarlarında histon modifikasyonlarını ve nükleozom konumlandırmasını incelemek için özellikle uygun hale getirir22. Yüksek çözünürlüklü Yerel ChIP çalışmaları, kromatini tek tek nükleozomlara indirgemek için MNaz sindiriminin kullanıldığını göstermiştir, bu da histon modifikasyonlarının daha yüksek doğrulukla haritalanmasını kolaylaştırır23. Ayrıca, hiçbir kimyasal çapraz bağlanma söz konusu olmadığından, protein-DNA etkileşimlerini yanlış temsil edebilecek önyargılar veya artefaktlar ortaya çıkma riski en aza indirilir24.
Protein-DNA etkileşimlerini sabitlemek için formaldehit veya diğer çapraz bağlama ajanlarının kullanıldığı X-ChIP'nin aksine, Native ChIP, potansiyel çapraz bağlama artefaktlarından kaçınarak kromatinin daha gerçekçi bir görünümünü sağlar. Bununla birlikte, X-ChIP genellikle DNA ve düzenleyici proteinler25 arasındaki geçici veya dinamik etkileşimleri tespit etmek için daha uygun olsa da, Native ChIP, histonlar veya diğer kromatine bağlı proteinler26,27 gibi kararlı protein-DNA etkileşimleri için idealdir. Yerel ChIP için belirtilen sınırlamalardan biri, genellikle X-ChIP25'te çapraz bağlama yoluyla stabilize edilen düşük afiniteli veya geçici bağlanma olaylarını yakalayamamaktır.
Epigenetikte önemli bir çalışma grubu, çeşitli biyolojik ortamlarda histon modifikasyonlarını ortaya çıkarmak için Native ChIP'den yararlanmıştır28. Bu çabalar, gen ekspresyonunu ve kromatin dinamiklerini düzenleyen histon modifikasyonlarının modeli olan histon kodunu tanımlamada çok önemli olmuştur29. Her ne kadar H2A. X, daha az güçlü bir şekilde ilişkili bir bağlayıcı histon, yerel H2A'dır. X ChIP yöntemi embriyonik kök hücrelerde30 adet başarıyla uygulanmıştır. Bu çalışmada, insan 293T hücrelerinde γH2A.X'in Doğal ChIP'sini gerçekleştirmek için bir kromatin ekstraksiyon prosedürünü optimize ettik (Şekil 1). Hidroksiüre ve aphidikolin, DNA replikasyon stresi, hasarı ve genomik kararsızlığı araştırmak için araştırmalarda yaygın olarak kullanılmaktadır31. Bu çalışmada, bu ajanlar hücrelere replikasyon stresini indüklemek ve CFS'de DNA kırılmaları oluşturmak için uygulandı.
Yaklaşık 1 x 106 ila 5 x 106 hücreli başlangıç materyali kullanılarak, bu yöntem dört ana aşamaya ayrılabilir: (i) kromatini izole etmek için hücre altı fraksiyonlama, (ii) kromatini parçalamak için mikrokokal nükleaz (MNaz) sindirimi, (iii) immünopresipitasyon ve elüsyon ve (iv) kantitatif PCR (qPCR) ile DNA analizi. Hücre altı fraksiyonlamayı takiben ChIP'nin yürütülmesi çeşitli faydalar sağlar ve çok sayıda çalışmada iyi belgelenmiştir 32,33,34,35. Bu yaklaşım, kromatine bağlı olmayan proteinlerin ve diğer hücresel kalıntıların uzaklaştırılmasına izin vererek, yüksek oranda saflaştırılmış bir kromatin fraksiyonu ile sonuçlanır. İmmünopresipitasyondan önce kromatini izole ederek, hücre altı fraksiyonlama, doğal kromatin etkileşimlerinin korunmasına yardımcı olur ve kromatinle ilişkili olmayan proteinlerden gelen arka plan gürültüsünü azaltır, bu da analiz için yalnızca kromatine bağlı kompleksler tutulduğundan daha spesifik ve güvenilir sonuçlara yol açar. Ayrıca, hücre altı fraksiyonlama, kromatin sindirimi için daha hafif koşullar sağlar, böylece fizyolojik protein-DNA etkileşimlerini korur ve doğal hücresel ortamda kromatin dinamiklerinin daha doğru bir temsilini sunar.
Ekstrinsik ajanların yaygın kırılgan bölge kırılması üzerindeki etkisini ölçmek için γH2AX'in doğal ChIP'sini kullanmak, kanser araştırmaları için önemli bir potansiyele sahiptir. Bu teknik, çevresel kanserojenlere maruz kalmanın neden olduğu DNA hasarının tespit edilmesini sağlayarak, kirleticilerin genomik kararsızlığa ve kanser gelişimine katkıda bulunduğu moleküler mekanizmalar hakkında bilgi sağlar. Bu yöntem, doğal kromatin bağlamını koruyarak, kanserojen maruziyetle ilişkili DNA hasar modellerinin doğru bir şekilde değerlendirilmesini kolaylaştırır, çevresel risklerin değerlendirilmesine ve kirliliğe bağlı tümör oluşumunun incelenmesine yardımcı olur.
Protokol
1. Hücre toplama
- Her biri 4 mL tam DMEM ortamı içeren dört adet 6 cm'lik tabağın her birine yaklaşık 5 x 105 HEK 293T hücresi tohumlayın.
- 24 saat sonra, bir tabağa 2 μL 1 mM Aphidicolin ( Malzeme Tablosuna bakın) stok çözeltisi (0.5 μM'lik nihai konsantrasyon) ve başka bir tabağa 20 μL 1 M hidroksiüre ( Malzeme Tablosuna bakın) stok çözeltisi (5 mM'lik nihai konsantrasyon) ile muamele edin replikasyon stresini indüklemek için. Kontrol görevi görmesi için kalan iki yemeğe DMSO ekleyin.
- 24 saatlik tedaviden sonra kültür ortamını atın. 6 cm'lik bir plaka tipik olarak %60-70 birleşmede yaklaşık 2 x 106 hücre verir.
- Her tabağı 2 kez 5 mL buz gibi soğuk 1x PBS ile durulayın. Hücreleri ayırmak için hücre sıyırıcılar kullanın ve hücre süspansiyonunu dört ayrı 1.5 mL tüpe aktarın. Hücre kümelerini ayırmak için bir P1000 pipetle nazikçe yukarı ve aşağı pipetleyin.
- Hücreleri 500 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin, ardından süpernatanı atın. Hücreleri buzun üzerine yerleştirin.
2. Hücre altı fraksiyonasyon
- Hücre peletini 500 μL taze hazırlanmış soğuk Tampon A içinde yeniden süspanse edin ( Tablo 1'e bakın), nazik pipetleme ile hücre kümelerinin tamamen ayrışmasını sağlayın.
- Lizatları buz üzerinde 5-10 dakika inkübe edin. Hücre lizizinin tamamlandığından emin olmak için lizis ilerlemesini mikroskop altında kontrol edin.
- Lizattan küçük bir alikot alın (yaklaşık 5-10 μL) ve temiz bir mikroskop lamı üzerine yerleştirin. Kirlenmeyi önlemek için bir lamel ile örtün.
- Hücreleri veya kalıntıları görselleştirmek için uygun bir büyütme oranına (örn. 20x - 40x) sahip bir ışık mikroskobu kullanın. Sağlam hücreler ve parçalanmış materyal arasında ayrım yapmak için parçalanmamış bir kontrol numunesi ile karşılaştırın.
NOT: Düzgün bir şekilde parçalanmış bir numune, belirgin hücre ana hatlarına sahip olmayacaktır, yalnızca dağınık kromatin veya hücresel materyale sahip olacaktır. Lizatı net bir şekilde gözlemlemek için odağı ayarlayın. Gerekirse, belirli hücre tipleriyle çalışırken Dounce homojenizatör kullanmak gibi lizis adımı sırasında mekanik kuvvet uygulayın.
- Hücreler tamamen parçalandıktan sonra 4 ° C'de 5 dakika boyunca 500 x g'da santrifüjleyin. Süpernatanı dikkatlice atın. Geniş delikli pipet uçları kullanarak çekirdek peletini 500 μL soğuk Tampon A'da yeniden süspanse edin.
NOT: Geniş delikli uçlar, kesme kuvvetlerini en aza indirmeye ve kromatin gibi hassas numuneleri korumaya yardımcı olur. Standart uçların ucunu keskin bir bıçakla keserek geniş çaplı uçlar yapın. - 500 x g'da 4 °C'de 5 dakika santrifüjleyin. Süpernatanı dikkatlice atın.
- Bir inkübatörü önceden 37 °C'ye ısıtın ve bir durdurma tamponu hazırlayın (100 mM EDTA, pH 8.0; Tablo 1).
- Mikrokokal Nükleaz (MNase, Malzeme Tablosuna bakın) konsantrasyonlarını ve inkübasyon sürelerini önceden optimize edin.
- Farklı MNaz konsantrasyonlarını ve inkübasyon sürelerini test etmek için 40 μL test kromatin örneğini birkaç eşit alikota bölün.
- Bir dizi MNaz konsantrasyonu kullanın (ör., 0.0625 U, 0.125 U, 0.25 U, 0.5 U, 1 U, 2 U, 4 U, reaksiyon başına 8 U) ve çoklu inkübasyon sürelerini test edin (ör., 2, 5, 10 ve 15 dakika).
- Kromatin alikotlarına çeşitli konsantrasyonlarda MNaz içeren MNase Tamponu ( Tablo 1'e bakın) ekleyin ve numuneleri belirtilen süreler boyunca 37 ° C'de inkübe edin.
- İstenen inkübasyon süresinden hemen sonra 1/4 hacim durdurma tamponu (nihai konsantrasyon: 20 mM EDTA) ekleyerek reaksiyonu sonlandırın.
- Bir fenol / kloroform / izoamil alkol ekstraksiyon yöntemi kullanarak sindirilmiş kromatin örneklerinden DNA'yı izole edin.
- Sindirim modellerini görselleştirmek için ekstrakte edilen DNA'yı %1.5'lik bir agaroz jel üzerinde çalıştırın: Yetersiz sindirim, yüksek moleküler ağırlıklı bantlar gösterecektir (Şekil 2, şerit 1-4); aşırı sindirim, bir leke veya çok kısa fragmanlarla sonuçlanacaktır (Şekil 2, şerit 6-8) ve optimal sindirim, net bir nükleozomal merdiven modeli verecektir (Şekil 2, şerit 5, örneğin, mono-, di-, tri-nükleozomlar).
- Aşırı sindirim olmadan istenen nükleozomal çözünürlüğü üreten koşulları belirleyin.
NOT: CaCl2 , MNaz aktivitesi için bir kofaktör görevi görür. CaCl2 konsantrasyonunu 1 mM ile 5 mM arasında ayarlayarak sindirimi optimize edin.
- Geniş delikli uçlarla 5 - 10 kez pipetleyerek sağlam çekirdekleri 100 μL MNase Tamponu ile nazikçe yeniden süspanse edin. Hemen numunelere önceden belirlenmiş miktarda MNase ekleyin (1.25 U MNase / 100 μL MNase Tamponu).
NOT: Birden fazla numuneyle çalışırken, aşırı sindirimi önlemek için her birini ayrı ayrı sindirin. - Tüpleri bir döndürücüye yerleştirin ve 37 ° C'de 5 dakika inkübe edin. Tüpleri hemen buza geri döndürün ve 20 mM'lik bir nihai konsantrasyona EDTA ekleyerek MNase sindirimini sonlandırın ve girdaplama ile karıştırın.
- Her numuneye 500 μL Tampon B ( Tablo 1'e bakın) ekleyin ve 5x - 10x yukarı ve aşağı pipetleyerek iyice karıştırın. Proteinleri buz üzerinde 5 dakika inkübe ederek çözündürün.
NOT: Tampon B'deki tuz ve deterjan, zayıf kromatine bağlı proteinleri ayrıştırmaya ve immünopresipitasyon için epitopları açığa çıkarmaya yardımcı olur. - Çözünmeyen malzemeyi 4 °C'de 5 dakika boyunca maksimum hızda santrifüjleyerek peletleyin. Berrak süpernatanı, doğal kromatin fraksiyonu olarak etiketlenmiş yeni 1.5 mL tüplere aktarın. Numuneler -80 °C'de saklanabilir veya kromatin parçalanmasının verimliliğini doğrulamak için kullanılabilir.
NOT: İlgilenilen protein-DNA etkileşimlerini bozabileceğinden, sık sık donma-çözülme döngülerinden kaçının. Mümkün olduğunda donma-çözülme döngülerini en aza indirin.
3. Kromatin parçalanmasının doğrulanması
- Her numuneden 10 μL süpernatanı yeni bir 1.5 mL tüpe alın. 20 μL damıtılmış su ve 30 μL fenol/kloroform/izoamil alkol (25:24:1) ile karıştırın.
- Tüpleri sıkıca kapatın ve 15-30 saniye kuvvetlice girdaplayın. 20.000 x g'da (veya santrifüjün maksimum hızında) 4 °C'de 10 dakika santrifüjleyin. Santrifüjlemeden sonra, üç farklı katman gözlenecektir: şeffaf bir üst katman, beyaz bir orta katman ve sarı bir alt katman.
- 20 μL üst sulu fazı (DNA içeren) dikkatlice yeni bir tüpe aktarın. Saflaştırılmış DNA'yı 100 V'ta 30 dakika boyunca% 1.5 agaroz jel içinde ayırın ve sindirim modellerini görselleştirin. Kromatin fragmanlarının boyutunun esas olarak 200 ila 1000 baz çifti arasında olduğundan emin olun.
NOT: Uygun kromatin fragman boyutları, doğal ChIP'nin başarısı için çok önemlidir ve enzim birimleri, inkübasyon süresi ve CaCl2 konsantrasyonu dahil olmak üzere MNaz tedavi koşullarına bağlıdır. MNaz sindirim verimliliği ayrıca hücre tipine ve sayısına göre değişebilir. Şekil 2'de (şerit 5) gösterilen kromatin parçalanma modeli, bu ChIP testi için önerilir.
4. İmmünopresipitasyon
- Her numuneden 20 μL sindirilmiş kromatini 1.5 mL'lik taze bir tüpe alın ve 180 μL Elüsyon Tamponu ile karıştırın ( Tablo 1'e bakınız). Bu tüpleri Giriş numuneleri olarak etiketleyin ve -20 °C'de saklayın.
- 400 μL kromatin örneğini ChIP için başka bir 1.5 mL tüpe aktarın.
- Bir DMSO ile muamele edilmiş, bir Aphidicolin ile muamele edilmiş numuneye ve bir hidroksiüre ile muamele edilmiş numuneye γH2A.X antikoru ( Malzeme Tablosuna bakınız) ekleyin. ChIP testi için negatif bir kontrol olarak DMSO ile muamele edilmiş başka bir numuneye aynı miktarda normal IgG ekleyin ( Malzeme Tablosuna bakın).
NOT: Burada, 400 μL kromatin için tipik olarak 1 μg primer antikor kullanılır (yani, antikor nihai konsantrasyonu 2.5 μg/mL'dir). Bununla birlikte, farklı γH2A.X antikorları için optimal miktar ampirik olarak belirlenmelidir. - ChIP tüplerini 4 °C'de bir döndürücüye yerleştirin ve en az 5 saat veya tercihen gece boyunca inkübe edin.
- Bu arada, 100 μL ChIP dereceli manyetik Protein A / G boncuklarını ( Malzeme Tablosuna bakın) yeni bir 1.5 mL tüpe alın. Boncukların doğru ölçümünü sağlamak için geniş delikli uçlar kullanın ve yavaşça pipetleyin. Tüpü en az 1 dakika manyetik bir stand üzerine yerleştirin, ardından sıvıyı dikkatlice atın.
- Boncukları% 0.5 BSA içeren 1 mL 1x PBS'de yeniden süspanse edin. 4 °C'de yaklaşık 4 saat döndürün. Tüpü en az 1 dakika manyetik bir stand üzerine yerleştirin ve süpernatanı atın.
- Boncukları %0,5 BSA içeren 1 mL 1x PBS ile tekrar yıkayın. Manyetik boncukları peletlemek için tüpü 1 dakika manyetik standın üzerine yerleştirin, ardından süpernatanı atın.
NOT: Adım 4.5 ila 4.7, antikorların manyetik boncuklara spesifik olmayan bağlanmasını azaltmak için boncukların ön kaplamasıdır. - Önceden kaplanmış boncukları geniş delikli uçlar kullanarak 100 μL Tampon B'de yeniden süspanse edin. Her bir ChIP numune tüpüne 25 μL önceden kaplanmış manyetik boncuk süspansiyonu ekleyin. 4 °C'de 2 saat döndürün.
- ChIP tüplerini manyetik standın üzerine yerleştirin ve boncuklar tüpün yan tarafına tamamen takılana ve çözelti berraklaşana kadar bekleyin.
- Manyetik boncukları bozmadan şeffaf süpernatanı atın. Boncukları 1 mL Yıkama Tamponu ile tekrar süspanse edin ( Tablo 1'e bakın) ve 4 °C'de 10 dakika döndürün.
- Tüpleri manyetik standa geri yerleştirin ve çözelti berraklaşana kadar bekleyin. Yıkama tamponunu atın. Toplam dört yıkama için yıkamayı tekrarlayın.
- Son yıkamadan sonra yıkama tamponunu atın ve kalan sıvıyı sıkmak için tüpleri 4 °C'de 30 saniye boyunca 400 x g'da kısa bir süre santrifüjleyin. Tüpleri manyetik standa geri yerleştirin ve tüpün altında kalan sıvıyı dikkatlice çıkarın.
5. Elüsyon ve DNA çökelmesi
NOT: Antikor etkinliği farklı partiler arasında farklılık gösterebilir. Western blot analizi ile immünopresipite edilmiş örnekleri kontrol ederek yeni bir antikorun bağlanma afinitesini doğrulamak önemlidir.
- Aşağıda açıklandığı gibi Western blot (WB) kullanarak ChIP antikorunun aşağı çekme verimliliğini doğrulayın.
- Analiz için ChIP örneğinin küçük bir kopyasını alın (yani, genellikle ChIP örneğinin %10'u). Karşılaştırma için Giriş kromatini (ön immünopresipitasyon) ve negatif kontrolü (örneğin, IgG pull-down) dahil edin.
- Antikora bağlı boncuklardan proteinleri 20 μL 1x SDS-PAGE yükleme tamponunda ( Malzeme Tablosuna bakınız) 95 ° C'de 5 dakika ısıtarak elde edin.
- IP örneklerini, girişi ve kontrolleri %15'lik bir SDS-PAGE jele yükleyin. Jeli çalıştırın.
- Proteinleri ıslak veya yarı kuru bir transfer sistemi kullanarak 0.2 μm nitroselüloza ( Malzeme Tablosuna bakın) veya PVDF membranına aktarın.
- Spesifik olmayan bağlanmayı önlemek için membranı oda sıcaklığında 1 saat boyunca TBST'de %5 yağsız süt veya BSA ile ( Tablo 1'e bakın) bloke edin.
- Membranı, oda sıcaklığında 1-2 saat veya gece boyunca 4 ° C'de bloke edici tampon içinde seyreltilmiş γH2A.X'e ( Malzeme Tablosuna bakın) karşı birincil antikor ile inkübe edin.
- Bağlanmamış antikorları çıkarmak için zarı 3x TBST ile yıkayın. Membranı HRP ile konjuge edilmiş bir ikincil antikor ile ( Malzeme Tablosuna bakınız) oda sıcaklığında 1 saat inkübe edin. Fazla ikincil antikorları çıkarmak için zarı tekrar yıkayın.
- Kemilüminesan bir substrat kullanarak zarı geliştirin ve sinyali bir görüntüleyici ile görselleştirin. Aşağı çekmenin verimliliğini ve özgüllüğünü değerlendirmek için IP, giriş ve kontrol şeritleri arasındaki sinyal yoğunluğunu karşılaştırın.
NOT: IP şeridindeki hedef proteine karşılık gelen bir bant, başarılı antikor çekme işlemini doğrular. Bu yaklaşım, ChIP deneyi sırasında hedef proteini yakalamada antikorun etkinliğini değerlendirebilmenizi sağlar.
- Kalan ChIP numunelerinin her birine 50 μL Elüsyon Tamponu ( Tablo 1'e bakın) ekleyin. Tüpleri bir termomikser üzerine yerleştirin ve oda sıcaklığında 15 dakika çalkalayın.
- Tüpleri en az 1 dakika boyunca manyetik tutucuya yerleştirin. Elute'u yeni tüplere toplayın. 1x tekrarlayın ve elute'yi aynı tüplerde toplayın.
- Her ChIP elüsyon örneğine ek 100 μL Elüsyon Tamponu ve her Giriş örneğine 180 μL Elüsyon Tamponu ekleyin.
- Her numuneye 200 μL fenol/kloroform/izoamil alkol (25:24:1) ekleyin ve kuvvetlice girdap yapın. Numuneleri 20.000 x g'da (veya maksimum hızda) 4 °C'de 10 dakika santrifüjleyin.
- Her yeni 1,5 mL santrifüj tüpüne 19 μL 3M sodyum asetat (NaOAc, pH 5.2; Tablo 1'e bakın) ve 2 μL glikojen çözeltisi (20 mg/mL, Malzeme Tablosuna bakın) ekleyin.
- Santrifüjlemeden sonra, üst sulu tabakayı (yaklaşık 190 μL) NaOAc ve glikojen içeren tüplere dikkatlice aktarın ve girdaplama ile karıştırın.
- 500 μL% 100 etanol ve girdap ekleyin. Numuneleri -20 °C'de en az 2 saat veya gece boyunca inkübe ederek DNA'yı çökeltin.
- Tüpleri 20.000 x g'da (veya maksimum hızda) 4 °C'de 10 dakika santrifüjleyin. Beyaz peleti rahatsız etmemeye dikkat ederek süpernatanı atın. Peleti 1 mL% 70 etanol içinde yeniden süspanse edin ve iyice girdaplayın.
- Tüpleri 20.000 x g'da (veya maksimum hızda) 4 °C'de 5 dakika santrifüjleyin. Süpernatanı dikkatlice çıkarın. Kalan etanolü döndürmek için tüpleri kısaca tekrar santrifüjleyin. Bir P20 pipeti kullanarak etanolü dikkatlice çıkarın. DNA peletlerini 2-3 dakika havayla kurutun.
NOT: DNA'nın yeniden çözünmesini zorlaştırabileceğinden, peleti aşırı kurutmaktan kaçının. - ChIP örnekleri için, DNA'yı 400 μL TE tamponunda yeniden süspanse edin ( Tablo 1'e bakınız). Giriş DNA'sı için, 1000 μL TE tamponunda yeniden süspanse edin. Ayrıştırılan numuneler artık -20°C'de saklanabilir.
6. qPCR ölçümü
- Her numune için teknik üçlüler içeren ticari bir kit ( Malzeme Tablosuna bakın) kullanarak qPCR gerçekleştirin. Amplifikasyonun özgüllüğünü sağlamak için erime eğrisi analizi yaparak tek bir spesifik PCR ürününün varlığını doğrulayın36.
- Veri analizi
NOT: Bağıl miktar tayin analizinde, test numunesi, bir kontrol numunesine göre bir kat değişikliği olarak ifade edilir (normal saflaştırılmış IgG veya sahte IP kullanılarak immünopresipite edilir). İmmün presipite protein tarafından işgal edilmediği bilinen DNA lokusları (negatif lokus), bilinen, işgal edilmiş, pozitif kontrol DNA lokuslarına kıyasla bu şekilde bir referans gen olarak kullanılabilir36.- Aşağıdaki formülü kullanarak her ChIP için girdi yüzdesini hesaplayın
%Giriş = 2(-ΔCt [normalleştirilmiş ChIP]) - Aşağıdaki formülü kullanarak pozitif lokus için elde edilen ΔCt değerini negatif lokus için ΔCt değerinden çıkararak pozitif lokus ΔCt değerlerini negatif lokusa (ΔΔCt) normalleştirin
(ΔΔCt = ΔCtpositive - ΔCtnegatif) - Aşağıdaki formülü kullanarak ChIP DNA'daki pozitif lokus dizisinin negatif lokus üzerindeki kat zenginleştirmesini hesaplayın
Katlama zenginleştirme =2ΔΔCt
Analiz için kullanılan qPCR primerlerinin dizileri Tablo 2'de verilmiştir. FRA3B ve FRA16D37'ningenomik organizasyonu Şekil 3A,B'de gösterilmiştir.
- Aşağıdaki formülü kullanarak her ChIP için girdi yüzdesini hesaplayın
- İstatistiksel analiz
- Student'ın eşleştirilmiş t-testini kullanarak sonuçları istatistiksel olarak analiz edin. ≤0.05'lik bir p değeri istatistiksel olarak anlamlı kabul edilir, bu da gözlemlenen farklılıkların rastgele varyasyondan kaynaklanma olasılığının düşük olduğunu gösterir38.
Sonuçlar
Kromatin fragmanlarının boyutu, antikor bağlanması için DNA bölgelerinin erişilebilirliğini doğrudan etkilediği için Native ChIP'nin başarısı için çok önemlidir. Kromatin parçalanması için optimal MNaz konsantrasyonunu belirlemek için, değişen konsantrasyonlarda MNaz içeren bir dizi mikrosantrifüj tüpü hazırladık (ör., 0.0625 U, 0.125 U, 0.25 U, 0.5 U, 1 U, 2 U, 4 U, reaksiyon başına 8 U) ve 40 μL izole çekirdek. Her reaksiyon, bir dizi kromatin fragman boyutu elde etmek için 37 ° C'de 5 dakika inkübe edildi. MNase sindiriminin sonuçları Şekil 2'de sunulmuştur.
Şekil 2'de gösterildiği gibi, daha yüksek MNaz konsantrasyonları, kromatinin daha kapsamlı sindirimine yol açmış ve bu da mono-nükleozom fragmanlarının baskın olmasına neden olmuştur (Şekil 2, şerit 1, 2 ve 3). Buna karşılık, daha düşük MNaz konsantrasyonlarında, kromatin fragmanlarının çoğu daha büyüktü, genellikle 1 kb'yi aşıyordu (Şekil 2, şerit 6, 7 ve 8), bu da aşağı akış uygulamaları için yetersiz sindirimi gösteriyor. 1.6 birimlik bir MNaz konsantrasyonu ve 5 dakikalık bir sindirim süresi ile, esas olarak 200 ila 1000 baz çifti aralığında kromatin fragmanları elde ettik (Şekil 2, şerit 5). Bu fragman boyutu, belirli epitoplara erişilebilirliği korurken kromatinle ilişkili DNA'nın verimli bir şekilde zenginleştirilmesini sağladığı için Native ChIP için idealdir. Uygun fragman boyutu, kantitatif PCR veya dizileme gibi verimli immünopresipitasyon ve aşağı akış analizini kolaylaştırarak, protein-DNA etkileşimlerini yüksek çözünürlükte tespit etmek için uygun hale getirir.
Antikorun bağlanma afinitesi, Native ChIP'nin başarısı için kritik bir faktördür. Antikorun hedef epitopuna verimli ve spesifik bir şekilde bağlanmasını sağlamak, güvenilir sonuçlar elde etmek için çok önemlidir. Bu nedenle, antikorun bağlanma etkinliğini önceden doğrulamak çok önemlidir. γH2A.X immünopresipitasyonunun etkinliğini doğrulamak için bir western blot (WB) testi gerçekleştirdik.
DMSO ile tedavi edilen hücreler (kontrol), aphidikolin ile tedavi edilen ve hidroksiüre ile tedavi edilen hücreler (replikasyon stresli) arasındaki γH2A.X seviyelerini western blotlama kullanarak karşılaştırdık. Şekil 4A'da (Giriş) gösterildiği gibi, aphidikolin ile tedavi edilen hücrelerde γH2A.X seviyeleri, DMSO ile tedavi edilen hücrelere kıyasla önemli ölçüde daha yüksekti. γH2A.X'teki bu artış, aphidikolin tarafından replikasyon stresinin indüksiyonu ile tutarlıdır, bu da çift iplikli kırılma oluşumunun artmasına ve ardından γH2A.X fosforilasyonuna yol açar. ChIP yaptıktan sonra, IgG kontrolü ve γH2A.X IP örneklerinde γH2A.X zenginleştirmesini karşılaştırarak immünopresipitasyonun özgüllüğünü doğruladık. IgG kontrolü, minimum spesifik olmayan bağlanmayı gösteren herhangi bir saptanabilir γH2A.X'i aşağı çekmedi (Şekil 4B, N-ChIP ve X-ChIP). Buna karşılık, γH2A.X IP örneği, aphidikolin ile tedavi edilen hücrelerden γH2A.X'i başarılı bir şekilde zenginleştirdi ve antikorun γH2A.X'e verimli ve spesifik bağlandığını gösterdi (Şekil 4, N-ChIP ve X-ChIP). Bu sonuçlar, γH2A.X antikorunun, γH2A.X'e bağlı kromatin bölgelerinin güvenilir bir şekilde saptanmasını ve zenginleştirilmesini sağlayarak, Native ChIP deneylerinde kullanım için yeterli bağlanma afinitesine ve özgüllüğüne sahip olduğunu doğrulamaktadır. Bu doğrulama adımı, sonraki ChIP analizlerinin kalitesini ve doğruluğunu sağlamak için gereklidir.
Replikasyon stresine yanıt olarak γH2A.X'in DNA'ya bağlanmasının özgüllüğünü değerlendirmek için ortak kırılgan bölgeler (CFS'ler) FRA16D ve FRA3B'yi kullandık. FRA16D ve FRA3B, replikasyon stresi koşulları altında kararsızlığa eğilimli iyi bilinen CFS bölgeleridir ve bu da onları γH2A.X/DNA etkileşimlerini doğrulamak için ideal adaylar haline getirir. Şekil 3A,B, analiz için kullanılan spesifik qPCR primerleri ile birlikte bu iki CFS'nin genomik organizasyonunu göstermektedir.
γH2A.X'in replikasyon stresine yanıt olarak bu CFS bölgeleriyle ilişkili olup olmadığını belirlemek için, kontrol (DMSO ile tedavi edilmiş), aphidikolin ile tedavi edilmiş hücrelerde ve hidroksiüre ile tedavi edilmiş hücrelerde ChIP-qPCR analizi gerçekleştirdik. qPCR sonuçları, DMSO ile tedavi edilen kontrol hücrelerinde, γH2A.X'in FRA16D veya FRA3B lokuslarında zenginleştirilmediğini gösterdi, bu da bu bölgelerde önemli DNA hasarı veya replikasyon stresi olmadığını düşündürdü. Bununla birlikte, DNA polimerazı inhibe ederek replikasyon stresini indükleyen aphidicolin veya hidroksiüre ile muamele edilen hücrelerde, hem FRA16D hem de FRA3B'de γH2A.X'in önemli ölçüde zenginleştiğini gözlemledik (Şekil 3C). Bu, γH2A.X'in özellikle DNA replikasyon stresine yanıt olarak bu CFS bölgelerine alındığını gösterir. Bu bulgular, γH2A.X'in CFS'lerde doluluğunun, DNA hasar tepkisi ve replikasyon çatalı durmasının bir belirteci olarak rolünü destekleyen replikasyon stresi tarafından tetiklendiğini göstermektedir. Afidikolin tedavisi sırasında γH2A.X'in FRA16D ve FRA3B'ye spesifik olarak alınması, ChIP testimizin özgüllüğünü daha da doğrular ve γH2A.X'in kırılgan bölgelerde DNA hasarı ve replikasyon stresinin güvenilir bir göstergesi olduğunu doğrular.
Doğal ChIP'nin verimliliğini çapraz bağlı ChIP (X-ChIP) ile karşılaştırmak için, Lyu ve ark.39 tarafından açıklanan protokolü izleyerek aynı başlangıç hücre sayısını kullanarak γH2A.X X-ChIP gerçekleştirdik. FRA16D'ye γH2A.X alımı, Şekil 3D'de gösterildiği gibi aphidicolin ve hidroksiüre ile muamele edilerek arttırılmıştır. Bununla birlikte, X-ChIP'de FRA16D'de γH2A.X'in nispi zenginleşmesi, yerel ChIP ile gözlemlenenden belirgin şekilde daha düşüktü ve bu koşullar altında X-ChIP'nin verimliliğinin azaldığını gösterdi. Ayrıca, FRA3B'de, γH2A.X zenginleşmesindeki artış istatistiksel olarak önemsizdi ve X-ChIP'nin sınırlı sayıda hücre ile çalışırken daha az verimli olduğuna dair ek kanıtlar sağladı. Bu sonuçlar, yerel ChIP'nin, örneklem boyutu kısıtlı olduğunda kırılgan bölgelerde γH2A.X zenginleşmesini tespit etmek için daha uygun olabileceğini düşündürmektedir. Student'ın eşleştirilmiş t-testini kullanarak sonuçları istatistiksel olarak analiz edin. ≤ 0.05'lik bir p değeri istatistiksel olarak anlamlı kabul edilir.

Şekil 1:Doğal bir γH2A.X ChIP testi gerçekleştirmek için W orkflow. (i) Hücreler kültürlenir ve γH2A.X sinyalini indüklemek için spesifik işlemlere (örneğin, hidroksiüre gibi DNA'ya zarar veren ajanlar) tabi tutulur. (ii) İşlem görmüş hücreler işlenmek üzere toplanır. (iii) Hücreler, kromatine bağlı γH2A.X'i diğer hücresel bileşenlerden ayırarak izole etmek için fraksiyonlara ayrılır. (iv) Kromatini nükleozom büyüklüğünde parçalara ayırmak için mikrokokal nükleaz (MNaz) sindirimi yapılır. (v) Kromatin fragmanlarının boyutu, bir agaroz jel üzerinde bir numune çalıştırılarak doğrulanır ve fragmanların ChIP için uygun uzunlukta olduğundan emin olun. (vi) γH2A.X ile işaretlenmiş kromatin fragmanlarını immünopresipite etmek için γH2A.X için spesifik bir antikor kullanılır. (vii) Protein A/G boncukları, γH2A.X'e bağlı DNA için zenginleştirme yapan antikor-kromatin komplekslerini aşağı çekmek için kullanılır. (viii) γH2A.X işaretli DNA parçaları ayrıştırılır ve saflaştırılır, bu da onları sonraki analizler için hazırlar. (ix) Aşağı Akış Analizi: qPCR ve sıralama ve Veri Analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MNaz sindirim durumunu optimize etmek için tahlil. Kromatin fragmanları, değişen MNaz sindirim koşulları kullanılarak HEK 293T hücrelerinden hazırlandı. Parçalanmış kromatinden elde edilen saflaştırılmış DNA,% 2'lik bir agaroz jel üzerinde ayrıldı ve 30 dakika boyunca 100 V'ta çalıştırıldı. 1'den 8'e kadar olan şeritler, artan MNaz konsantrasyonları (yani, reaksiyon başına 0.0625 U, 0.125 U, 0.25 U, 0.5 U, 1 U, 2 U, 4 U, 8 U) ile muamele edilen numuneleri temsil eder ve bir kromatin sindirimi gradyanı gösterir. DNA merdiveni (M ile gösterilir) boyut referansı için dahil edildi. DNA fragmanları Midori Green Advance DNA boyama solüsyonu kullanılarak görüntülendi. Etiketli bant, mono-nükleozom boyutundaki DNA fragmanlarına karşılık gelir ve her MNaz konsantrasyonunda sindirim verimliliğini vurgular. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
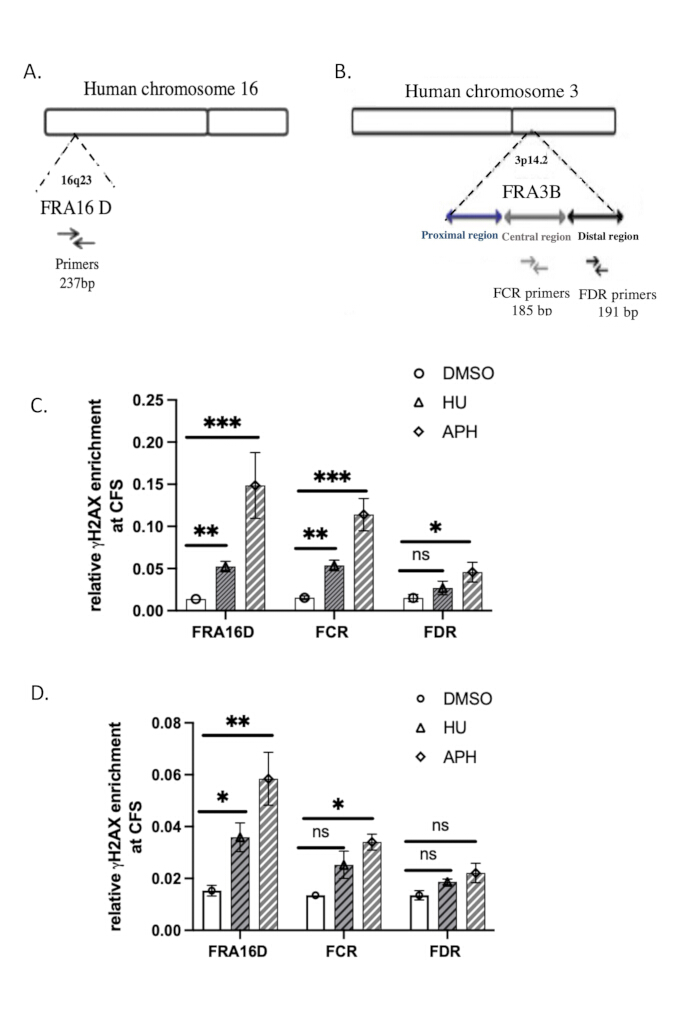
Şekil 3: γH2A.X ChIP'nin qPCR doğrulaması. (A) FRA16D'nin genomik organizasyonlarının diyagramı. (B) FRA3B bölgesinin genomik organizasyonlarının diyagramı. FRA3B lokusu içindeki FRA16D, distal (FDR) ve merkezi (FCR) bölgelerin qPCR analizleri için kullanılan primer setleri endikedir. (C) γH2A.X'in ortak kırılgan bölgelerde (CFS), özellikle FRA3B ve FRA16D'de nispi zenginleşmesi, doğal ChIP kullanılarak değerlendirildi ve ardından afidikolin ve hidroksiüre ile muameleden sonra qPCR analizi yapıldı. (D) γH2A.X'in ortak kırılgan bölgelerde (CFS), özellikle FRA3B ve FRA16D'de nispi zenginleşmesi, X-ChIP kullanılarak değerlendirildi ve ardından afidikolin ve hidroksiüre ile muameleden sonra qPCR analizi yapıldı. p < 0.001 ile istatistiksel olarak anlamlı bir sonucu gösterir; ** p < 0.01'i gösterir ve *, bir t-testi ile belirlenen p < 0.05'i gösterir; n = 3 olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
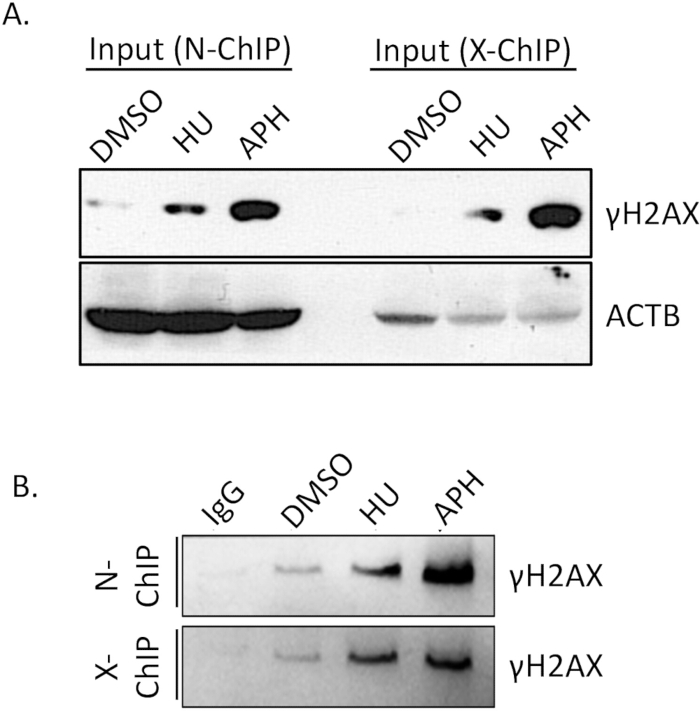
Şekil 4: Western blot kullanılarak ChIP antikor çekme etkinliğinin doğrulanması. Toplam numuneden, ChIP numunesinin% 10'u, giriş kontrolleri ile birlikte, polipeptitleri çözmek için% 15'lik bir SDS-PAGE jeli üzerinde ayrıldı. Elektroforezi takiben, ayrılan proteinler standart bir transfer protokolü kullanılarak 0.22 μm'lik bir PVDF membranına aktarıldı. Membran daha sonra γH2A.X ve ACTB'yi hedefleyen spesifik bir primer antikor ile sıralı olarak incelendi, ardından uygun bir HRP konjuge sekonder antikor izledi. Sinyal daha sonra kemilüminesans tespiti kullanılarak görselleştirildi ve ChIP testinde antikor özgüllüğünün ve aşağı çekme verimliliğinin değerlendirilmesine izin verildi. (A) DMSO ile muamele edilen hücreler (kontrol), aphidikolin ile muamele edilen ve hidroksiüre ile muamele edilen hücreler (replikasyon stresli) arasındaki γH2A.X seviyeleri yükleme kontrolü olarak ACTB ile. (B) IgG kontrol ve IP örneklerinde γH2A.X zenginleşmesi. Kısaltmalar: APH = afidikolin, HU = hidroksiüre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Tampon A (1X) | |
| Reaktif | Çalışma Konsantrasyonu |
| BORULAR pH 6.8 | 10 milyon |
| NaCl (Doğal) | 100 milyon |
| MgCl2 | 3 milyon |
| EGTA pH 7.6 | 1 milyon |
| -20 °C'de 1 yıla kadar saklayın | |
| MNase arabelleği (1X) | |
| Reaktif | Çalışma Konsantrasyonu |
| Tris-HCl, pH 7.5 | 50 milyon |
| CaCl2 | 1 milyon |
| MgCl2 | 4 milyon |
| -20 °C'de 1 yıla kadar saklayın | |
| Tampon B (1X) | |
| Reaktif | Çalışma Konsantrasyonu |
| Sodyum fosfat pH 7. 0 | 20 milyon |
| Sodyum pirofosfat10. H2O | 30 milyon |
| Kartal | 250 milyon |
| EDTA, pH 8.0 | 5 milyon |
| Gliserol | 10% |
| Triton X-100 | 0.10% |
| Proteaz İnhibitörü kokteyli | 1 katı |
| Fosfataz İnhibitörü kokteyli | 1 katı |
| DTT (DTT) | 0,5 milyon |
| -20 °C'de 1 yıla kadar saklayın | |
| Elüsyon Tamponu | |
| Reaktif | Çalışma Konsantrasyonu |
| NaHCO3 | 50 milyon |
| SDS (Demokratik Güç) | 1% |
| Taze hazırlanmış | |
| Yıkama Tamponu | |
| Reaktif | Çalışma Konsantrasyonu |
| MNase arabelleği | x 0,5 |
| Tampon B | x 0,5 |
| Taze hazırlanmış | |
| Arabelleği Durdur | |
| EDTA | 100 mM , pH 8.0 |
| 3 M Sodyum asetat, pH 5.2 | |
| 408.24 g Sodyum asetat | |
| asetik asit ile pH 5.2'ye kadar ajust pH | |
| Sesi 1 L'ye ayarlama | |
| Tamponu filtrasyon veya otoklavlama ile sterilize edin | |
| TBST tamponu | |
| Tris Bazı, pH 8.0 | 10 milyon |
| NaCl (Doğal) | 150 milyon |
| Ara 20 | %0,1 (h/h) |
| TE tamponu | |
| Tris-HCl, pH 8.0 | 10 milyon |
| EDTA, pH 8.0 | 1 milyon |
Tablo 1: Tampon bileşimi.
| Gen lokusları | İleri astar | Ters astar |
| FRA16D | TCCTGTGGAAGGGATATTTA | CCCCTCATATTGCTTCTA |
| FRA3B | TGTTGGAATGTTAACTCTATCCCAT | ATATCTCATCAAGACCGCTGCA |
| FCR (Mali İşler T | ||
| FRA3B | CAATGGCTTAAGCAGACATGGT | AGTGAATGGCATGGCTGGAATG |
| FDR | ||
| ACTB (negatif kontrol) | GACGCAGGATGGCATGGG | ACGCCTCTGGCCGTACCAC |
Tablo 2: Primer sırası.
| DNA'nın düşük geri kazanımı | Potansiyel sorun | Muhtemel çözüm |
| Kötü antikor kalitesi | ChIP dereceli antikor kullanın. | |
| Yetersiz antikor | 25 μg kromatin başına 1-10 μg ChIP antikoru kullanın. | |
| Yetersiz kuluçka süresi | İmmünopresipitasyon adımını gece boyunca 4 °C'de gerçekleştirin. | |
| Aşırı sıkı yıkamalar | Yıkama tamponunda 500 mM'den daha yüksek bir NaCl konsantrasyonu kullanmayın. | |
| Düşük kaliteli boncuklar | Protein A veya G'nin ChIP antikoru ile uyumlu olduğundan emin olun. | |
| Optimum boncuk hacmi / antikor oranı için boncuk ürün veri sayfasını takip edin. | ||
| Yetersiz başlangıç | Hücre sayısını doğru bir şekilde belirlemek için ayrı bir hücre plakası hazırlayın. | |
| Örnek | Hedef düşük bolluk ise kullanılan hücre sayısını artırın. | |
| Yetersiz hücre lizisi | Verimliliği artırmak için tampon bileşimini ve lizis süresini optimize edin. | |
| Belirli hücre tipleriyle çalışırken, Dounce homojenizatör kullanmak gibi parçalama adımı sırasında mekanik kuvvet uygulayın. | ||
| Çekirdeklerin bozulması meydana geldi | Kromatin bütünlüğünü ve erişilebilirliğini korumak için çekirdek izolasyonunun nazik olduğundan emin olun. | |
| Kullanım sırasında çekirdeklerin kesilmesini en aza indirmek için geniş delikli pipet uçları kullanın. | ||
| Numunede bozulma meydana geldi | Tüm adımları buz üzerinde veya 4 °C'de gerçekleştirin. | |
| Tüm tamponlara proteaz inhibitörleri ekleyin ve tüm tamponların taze hazırlandığından emin olun. | ||
| Yetersiz MNaz sindirimi | Belirli numune tipi için en uygun miktarı belirlemek için MNaz konsantrasyonunu (örn. 0,1-5 birim) titre edin; ve ideal sindirim koşullarını belirlemek için bir dizi konsantrasyonla başlayın. | |
| MNase aşırı sindirim | 37 ° C'de farklı inkübasyon süreleri (örneğin, 1-10 dakika) ile denemeler yapın ve aşırı sindirim olmadan yeterli sindirimi sağlamak için parçalanma modelini izleyin. | |
| Bozulmuş Fosforilasyon | Lizis tamponuna fosfataz inhibitör kokteyli ekleyin ve tüm tamponların taze hazırlandığından emin olun. | |
| Negatif kontrolde yüksek arka plan | Boncuklara spesifik olmayan bağlanma | İmmünopresipitasyon adımından önce bir ön temizleme adımı ekleyin ve genellikle azaltılmış spesifik olmayan bağlanma sergileyen manyetik ChIP dereceli boncuklar kullanın. |
| Yetersiz yıkama | Tuz ve deterjan konsantrasyonunu ayarlayarak yıkama sayısını veya sıkılığını artırın. | |
| Kromatinin yetersiz parçalanması | 200-750 bp'lik parçalar elde etmek için parçalanmayı optimize edin. | |
| Her hücre veya doku tipi için optimizasyon gereklidir | ||
| PCR sorun giderme | Giriş örneğinin amplifikasyonu yok | (1) Aşırı parçalanmış: kromatin mono-nükleozom uzunluğuna parçalanırsa, 150 bp'nin üzerindeki amplikonlar için sinyal azalır. |
| (2) PCR koşullarını optimize edin. | ||
| (3) Daha küçük (<150 bp) bir bölgeyi büyütmek için astarlar tasarlayın. | ||
| Düşük çözünürlük | DNA parçası boyutu çok büyük | 200-750 bp'lik parçalar elde etmek için parçalanmayı optimize edin. |
Tablo 3: Kromatin İmmünopresipitasyon Sorun Giderme.
Tartışmalar
Çevre kirliliği, insan kanserlerine önemli bir katkıda bulunur. Birçok kirletici kanserojendir, yani kanser gelişimine yol açan genetik hasara neden olabilirler40,41. Bununla birlikte, belirli bir maddenin tümörjenik olup olmadığını belirlemek zorlu bir iştir. Kanserojen potansiyeli belirlemek için hızlı, güvenilir ve uygun maliyetli bir yöntem, bilim adamlarının çevresel kirleticileri verimli bir şekilde taramasını ve genomik stabilite üzerindeki etkilerini değerlendirmesini sağlayacaktır. Bu çalışmada, DSB'ler için oldukça spesifik bir belirteç olarak yaygın olarak kabul edilen modifiye edilmiş bir histon varyantı olan γH2A.X'e odaklanıyoruz. γH2A.X, histon varyantı H2A olduğunda oluşur. X, DNA hasarına yanıt olarak serin 139'da fosforile edilir.
CFS'lerde Native ChIP ile γH2A.X'in varlığını tespit ederek, çevresel kirleticilerin neden olduğu DNA hasarının boyutunu etkili bir şekilde değerlendirebiliriz42. CFS'lerde γH2A.X'i kantitatif olarak ölçme yeteneği, çevresel kirleticilerin tümörjenik etkileri indükleme potansiyelini değerlendirmek için hızlı, hassas ve güvenilir bir yol sağlar. Genellikle DNA hasarının dolaylı belirteçlerini (mutasyonlar, mikronükleus oluşumu veya hücresel transformasyon gibi) ölçen geleneksel genotoksisite deneylerinin aksine, doğal γH2AX ChIP, belirli genomik lokuslarda kırılma olaylarının hassas bir şekilde haritalanmasına izin verir42. Bu, çevresel kirleticilere karşı en savunmasız bölgenin daha derin bir şekilde anlaşılmasını sağlar ve potansiyel kanserojen mekanizmaların tanımlanmasına yardımcı olur.
Başarılı Native ChIP, hedef bölgelerin etkili bir şekilde zenginleştirilmesini sağlamak için birkaç kritik adıma dikkat edilmesini gerektirir. Aşağıda, γH2AX'in yerel ChIP'sinde yer alan kritik adımlar verilmiştir. Hücre hazırlığı: Yeterli sayıda hücre ile başlayın. Hücreleri, pozitif bir kontrol olarak replikasyon stresini indüklemek için aphidikolin gibi DNA hasarına neden olan bir ajanla tedavi edin. Karşılaştırma için uygun işlenmemiş negatif kontrol örneklerini dahil edin. Kromatin izolasyonu: Sitoplazmik bileşenlerden kontaminasyonu en aza indirirken kromatine bağlı proteinleri izole etmek için hücre altı fraksiyonlama gerçekleştirin. MNaz optimizasyonu: Mikrokokal nükleaz (MNase) konsantrasyonunu ve inkübasyon süresini optimize etmek için pilot deneyler yapın. Amaç, 200-1000 baz çifti arasında kromatin fragmanları elde etmek ve nükleozom bütünlüğünü korurken ChIP için iyi bir çözünürlük sağlamaktır. İmmünopresipitasyon: Spesifik olmayan bağlanmayı en aza indirirken hedef kromatinin verimli bir şekilde aşağı çekilmesini sağlamak için Protein A/G agaroz ile birlikte yüksek kaliteli bir ChIP dereceli γH2AX antikoru kullanın. Yıkama: γH2AX'e bağlı kromatini korurken spesifik olmayan etkileşimleri gidermek için boncukları uygun konsantrasyonda tuz ve deterjan içeren bir tamponla yıkayın. Elüsyon ve DNA geri kazanımı: DNA'nın kapsamlı bir şekilde elüsyonu ve çökeltilmesi ile bağlı kromatini verimli bir şekilde geri kazanın ve zenginleştirilmiş hedef kromatinin minimum kaybını sağlayın. Geleneksel X-ChIP ile karşılaştırıldığında, yerel γH2AX ChIP'nin dört ana avantajı vardır. İlk olarak, hücre altı fraksiyonlamanın entegre edilmesi, yanlış pozitif etkileşimleri azaltır ve ChIP özgüllüğünü artırır. İkinci olarak, protein-DNA kompleksleri, çapraz bağlama ajanları ile meydana gelebilecek geçici γH2AX-kromatin etkileşimlerinin stabilizasyonunu en aza indirerek doğal hallerinde korunur. Üçüncüsü, sabitleme ve zaman alıcı ters çapraz bağlama adımlarını atlamak, genel iş akışını kolaylaştırır. Son olarak, daha az başlangıç malzemesi gereklidir ve kromatin kesme için su banyosu sonikatörü (örneğin, Bioruptor) veya odaklanmış ultrasonik sonikatör (örneğin, Covaris) gibi pahalı bir ekipmana gerek yoktur.
Native ChIP'nin avantajları olmasına rağmen, sınırlamaları da kabul edilmelidir. Bir sınırlama, kromatin hazırlama ve immünopresipitasyon sırasında proteinin yeniden düzenlenmesi potansiyelidir. Bu yeniden düzenleme, kromatine bağlı proteinlerin etkileşimlerini teorik olarak değiştirebilir ve sonuçlarda değişkenlik yaratabilir. Bu tür yeniden düzenlemelerin meydana gelmesini destekleyecek doğrudan kanıtlarımız olmasa da, bu potansiyel artefaktı hesaba katmak için uygun deneysel kontrolleri dahil etmek önemlidir. Yerel ChIP testinin bir başka sınırlaması, yanlış sonuçlara yol açabilen MNase'in bölünme yanlılığıdır. MNase tercihen genomun A-T açısından zengin bölgelerini böler, bu da bu bölgelerin ChIP işlemi sırasında parçalanma ve zenginleşme olasılığını artırır. Bu yanlılık, A-T açısından zengin dizilerin aşırı temsiline ve G-C açısından zengin bölgelerin yetersiz temsiline neden olabilir, bu da potansiyel olarak MNaz sindirimi için daha az erişilebilir olan genomik bölgeler için yanlış negatif sinyallere neden olabilir. İlgilenilen lokuslar GC açısından zenginse, MNaz sindirim koşullarının dikkatli bir şekilde optimizasyonu gereklidir. Alternatif olarak, sonikasyon ile kromatin parçalanması gibi ek kontrollerin dahil edilmesi, MNase önyargısının etkisini azaltmaya ve sonuçların güvenilirliğini artırmaya yardımcı olabilir.
Belirli sınırlamalarına rağmen, doğal γH2AX ChIP, belirli kirleticilerin DNA hasarına neden olduğu gen lokuslarını tanımlamak için özellikle yararlıdır. Araştırmacılar, γH2AX'e bağlı DNA parçalarını zenginleştirerek, genomun kırılgan bölgelerini, özellikle de kirleticilerin neden olduğu replikasyon stresi altında kırılmaya daha yatkın olan qPCR ile CFS'leri belirleyebilirler. Bu teknik aynı zamanda araştırmacıların belirli bir kanserojene maruz kalma ile belirli genomik bölgelerde DNA hasarının oluşumu arasında doğrudan bir ilişki kurmasını sağlayarak, kirleticilerin genotoksik profili ve bunların karsinogenezi başlatmadaki potansiyel rolleri hakkında fikir verir43,44.
Sorun giderme tablosu (Tablo 3), düşük DNA verimi, yetersiz kromatin parçalanması, yüksek arka plan gürültüsü veya zayıf antikor performansı gibi ChIP testi sırasında karşılaşılan yaygın sorunlar için ayrıntılı çözümler sunar. Her sorun, protokolün güvenilirliğini ve tekrarlanabilirliğini sağlamak için özel önerilerle eşleştirilir.
Doğal γH2AX ChIP, otomatik sıvı işleme sistemleri ve kantitatif PCR veya dizileme teknolojilerini kullanarak, DNA hasarına neden olan ajanları verimli bir şekilde tanımlayabilir, böylece toksikolojik çalışmalarda ve çevresel izlemede değerli bir araç olarak hizmet edebilir. Araştırmacılar, farklı seviyelerde çevresel kirleticilere maruz kalan popülasyonlardan elde edilen numuneler üzerinde doğal γH2AX ChIP kullanarak, belirli DNA hasar modellerini tanımlayabilir ve belirli ajanlara maruz kalmayla ilişkili risk seviyesini belirleyebilir. Sonuç olarak, doğal γH2AX ChIP, çevresel kirleticilerin kanserojen potansiyelini değerlendirmek için önemli avantajlar sunar ve belirli genomik lokuslarda DNA hasarını tespit etmek için hızlı, uygun maliyetli ve yüksek özgüllüklü bir yaklaşım sağlar. Yüksek verimli tarama, kişiselleştirilmiş risk değerlendirmesi ve biyobelirteç geliştirmedeki gelecekteki uygulamaları, onu çevresel karsinogenez anlayışımızı ilerletmek ve kanser önleme ve müdahalesi için stratejiler geliştirmek için değerli bir araç haline getirmektedir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Güney Çin Üniversitesi'nin başlangıç fonu tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 µm nitrocellulose membrane | Amersham | 10600011 | |
| Actin B | proteintech | 20536-1-AP | |
| Aphidicolin | MedChemExpress | HY-N6733 | |
| ChIP-grade magnetic Protein A/G beads | ThermoFisher | 26162 | |
| Clarity Western ECL Substrate | Bio-Rad | #1705061 | |
| Glycogen, molecular biology grade | ThermoFisher | Cat. No. R0561 | |
| HRP-conjugated secondary antibody | proteintech | SA00001-2 | |
| hydroxyurea | MedChemExpress | HY-B0313 | |
| Micrococcal Nuclease | NEB | M0247S | |
| normal IgG | Santa Cruz | sc-2025 | |
| Taq Universal SYBR Green Supermix | BioRad | 1725120 | |
| γH2A.X antibody (for ChIP) | Sigma-Aldrich | 05-636 | |
| γH2A.X antibody (for WB) | Cell Signaling | #25955 |
Referanslar
- Glover, T. W., Berger, C., Coyle, J., Echo, B. DNA polymerase alpha inhibition by aphidicolin induces gaps and breaks at common fragile sites in human chromosomes. Hum Genet. 67 (2), 136-142 (1984).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Hellman, A., et al. A role for common fragile site induction in amplification of human oncogenes. Cancer Cell. 1 (1), 89-97 (2002).
- Kotzot, D., et al. Parental origin and mechanisms of formation of cytogenetically recognisable de novo direct and inverted duplications. J Med Genet. 37 (4), 281-286 (2000).
- Miller, C. T., et al. Genomic amplification of MET with boundaries within fragile site FRA7G and upregulation of MET pathways in esophageal adenocarcinoma. Oncogene. 25 (3), 409-418 (2006).
- Zack, T. I., et al. Pan-cancer patterns of somatic copy number alteration. Nat Genet. 45 (10), 1134-1140 (2013).
- Gao, G., et al. Common fragile sites (CFS) and extremely large CFS genes are targets for human papillomavirus integrations and chromosome rearrangements in oropharyngeal squamous cell carcinoma. Genes Chromosomes Cancer. 56 (1), 59-74 (2017).
- Thorland, E. C., Myers, S. L., Gostout, B. S., Smith, D. I. Common fragile sites are preferential targets for HPV16 integrations in cervical tumors. Oncogene. 22 (8), 1225-1377 (2003).
- Matovina, M., Sabol, I., Grubisić, G., Gasperov, N. M., Grce, M. Identification of human papillomavirus type 16 integration sites in high-grade precancerous cervical lesions. Gynecol Oncol. 113 (1), 120-127 (2009).
- Yu, T., et al. The role of viral integration in the development of cervical cancer. Cancer Genet Cytogenet. 158 (1), 27-34 (2005).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Thavathiru, E., Ludes-Meyers, J. H., MacLeod, M. C., Aldaz, C. M. Expression of common chromosomal fragile site genes, WWOX/FRA16D and FHIT/FRA3B is downregulated by exposure to environmental carcinogens, UV, and BPDE but not by IR. Mol Carcinog. 44 (3), 174-182 (2005).
- Sirbu, B. M., et al. Analysis of protein dynamics at active, stalled, and collapsed replication forks. Genes Dev. 25 (12), 1320-1327 (2011).
- Barlow, J. H., et al. Identification of early replicating fragile sites that contribute to genome instability. Cell. 152 (3), 620-632 (2013).
- Petermann, E., Orta, M. L., Issaeva, N., Schultz, N., Helleday, T. Hydroxyurea-stalled replication forks become progressively inactivated and require two different RAD51-mediated pathways for restart and repair. Mol Cell. 37 (4), 492-502 (2010).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Shanbhag, N. M., Rafalska-Metcalf, I. U., Balane-Bolivar, C., Janicki, S. M., Greenberg, R. A. ATM-dependent chromatin changes silence transcription in cis to DNA double-strand breaks. Cell. 141 (6), 970-981 (2010).
- Stiff, T., et al. ATR-dependent phosphorylation and activation of ATM in response to UV treatment or replication fork stalling. EMBO J. 25 (24), 5775-5782 (2006).
- Nelson, J. D., Denisenko, O., Bomsztyk, K. Fast chromatin immunoprecipitation assay. Nuc Acids Res. 34 (5), e2 (2006).
- Dorbic, T., Wittig, B. Isolation of oligonucleosomes from active chromatin using HMG17-specific monoclonal antibodies. Nuc Acids Res. 14 (8), 3363-3376 (1986).
- Dorbic, T., Wittig, B. Chromatin from transcribed genes contains HMG17 only downstream from the starting point of transcription. EMBO J. 6 (8), 2393-2399 (1987).
- Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. A direct link between core histone acetylation and transcriptionally active chromatin. EMBO J. 7 (5), 1395-1402 (1988).
- Hebbes, T. R., Thorne, A. W., Clayton, A. L., Crane-Robinson, C. Histone acetylation and globin gene switching. Nuc Acids Res. 20 (5), 1017-1022 (1992).
- Hebbes, T. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Core histone hyperacetylation co-maps with generalized DNase I sensitivity in the chicken beta-globin chromosomal domain. EMBO J. 13 (8), 1823-1830 (1994).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trend Biochem, Sci. 25 (3), 99-104 (2000).
- Myers, F. A., Evans, D. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Targeted and extended acetylation of histones H4 and H3 at active and inactive genes in chicken embryo erythrocytes. J Biol Chem. 276 (23), 20197-20205 (2001).
- Litt, M. D., Simpson, M., Recillas-Targa, F., Prioleau, M. N., Felsenfeld, G. Transitions in histone acetylation reveal boundaries of three separately regulated neighboring loci. EMBO J. 20 (9), 2224-2235 (2001).
- Madisen, L., Krumm, A., Hebbes, T. R., Groudine, M. The immunoglobulin heavy chain locus control region increases histone acetylation along linked c-myc genes. Mol Cell Biol. 18 (11), 6281-6292 (1998).
- Clayton, A. L., Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. Histone acetylation and gene induction in human cells. FEBS Lett. 336 (1), 23-26 (1993).
- Tseng, Z., Wu, T., Liu, Y., Zhong, M., Xiao, A. Using native chromatin immunoprecipitation to interrogate histone variant protein deposition in embryonic stem cells. Methods Mol Biol. 1176, 11-22 (2014).
- Durkin, S. G., Glover, T. W. Chromosome fragile sites. Ann Rev Genetics. 41, 169-192 (2007).
- Lee, J. B., Keung, A. J. Chromatin immunoprecipitation in human and yeast cells. Methods Mol Biol. 1767, 257-269 (2018).
- Miyamoto, R., Yokoyama, A. Protocol for fractionation-assisted native ChIP (fanChIP) to capture protein-protein/DNA interactions on chromatin. STAR Protoc. 2 (2), 100404 (2021).
- Mendez, J., Stillman, B. Chromatin association of human origin recognition complex, cdc6, and minichromosome maintenance proteins during the cell cycle: Assembly of prereplication complexes in late mitosis. Mol Cell Biol. 20 (22), 8602-8612 (2000).
- Nowak, D. E., Tian, B., Brasier, A. R. Two-step cross-linking method for identification of NF-κB gene network by chromatin immunoprecipitation. BioTechniques. 39 (5), 715-725 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Lu, X., Parvathaneni, S., Hara, T., Lal, A., Sharma, S. Replication stress induces specific enrichment of RECQ1 at common fragile sites FRA3B and FRA16D. Mol Cancer. 12, 29 (2013).
- Ruijter, J. M., et al. Amplification efficiency: linking baseline and bias in the analysis of quantitative PCR data. Nucl Acids Res. 37 (6), e45 (2009).
- Lyu, X., Chastain, M., Chai, W. Genome-wide mapping and profiling of γH2AX binding hotspots in response to different replication stress inducers. BMC Genomics. 20, 579 (2019).
- Farmer, P. B., et al. Molecular epidemiology studies of carcinogenic environmental pollutants. Effects of polycyclic aromatic hydrocarbons (PAHs) in environmental pollution on exogenous and oxidative DNA damage. Mutat Res. 544 (2-3), 397-402 (2003).
- Phillips, D. H., Arlt, V. M. Genotoxicity: damage to DNA and its consequences. EXS. 99, 87-110 (2009).
- Nitsch, S., Schneider, R. Native ChIP: Studying the genome-wide distribution of histone modifications in cells and tissue. Meth Mol Biol. 2846, (2024).
- Nikitina, T., Wang, D., Gomberg, M., Grigoryev, S. A., Zhurkin, V. B. Combined micrococcal nuclease and exonuclease III digestion reveals precise positions of the nucleosome core/linker junctions: implications for high-resolution nucleosome mapping. J Mol Biol. 425 (11), 1946-1960 (2013).
- Teves, S. S., Henikoff, S. Salt fractionation of nucleosomes for genome-wide profiling. Methods Mol Biol. 833, 421-432 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır