Method Article
Захват распространенных хрупких участковых разрывов с помощью нативного γH2A. Х Чип
В этой статье
Резюме
Мы представляем быстрый и эффективный метод обнаружения прорывов распространенных хрупких участков с помощью нативной иммунопреципитации γH2A.X хроматина (ChIP). Такой подход значительно сокращает время и трудозатраты, связанные с традиционными анализами γH2A.X ChIP, сохраняя при этом высокую воспроизводимость и надежность результатов.
Аннотация
Репликационный стресс, вызванный воздействием внешних агентов, может привести к разрывам ДНК в общих хрупких участках, которые представляют собой области генома, которые, как известно, склонны к структурной нестабильности. Иммунопреципитация хроматина γH2A.X (ChIP) служит мощным инструментом в исследованиях генотоксичности, поскольку фосфорилирование γH2A.X является хорошо известным маркером двухцепочечных разрывов ДНК. Однако традиционные анализы γH2A.X ChIP часто являются трудоемкими и включают в себя несколько трудоемких этапов. В этом исследовании мы представляем упрощенный, но эффективный метод, который сочетает субклеточное фракционирование с нативным ChIP для выделения комплексов, связанных с γH2A.X. Этот подход особенно подходит для анализа взаимодействий γH2A.X-хроматина с повышенной специфичностью и эффективностью. Используя субклеточное фракционирование, несвязанные с хроматином материалы эффективно удаляются, в результате чего получается очищенная хроматиновая фракция. Последующее расщепление микрококковой нуклеазы (MNase) в мягких условиях позволяет фрагментировать хроматин, сохраняя при этом физиологические взаимодействия между γH2A.X и связанными с ним белковыми комплексами. Эта сохранность имеет важное значение для изучения нативных партнеров по взаимодействию, участвующих в путях реакции на повреждение ДНК. Этот оптимизированный собственный протокол ChIP значительно сокращает время и трудозатраты, связанные с традиционными анализами γH2A.X ChIP. Оптимизированная процедура не только упрощает рабочий процесс, но и дает высоковоспроизводимые результаты, что делает ее особенно выгодной в условиях, где требуется высокая производительность обработки нескольких образцов. Этот метод широко применим в исследованиях, посвященных стабильности генома, репарации ДНК и биологии хроматина, где точное и эффективное обнаружение участков повреждения ДНК имеет решающее значение. Используя оптимизированные протоколы и оптимизированные шаги, этот метод позволяет обнаруживать повреждения ДНК в хрупких участках с повышенной чувствительностью и минимальной обработкой образцов, что делает его ценным инструментом для исследований стабильности генома и реакции на повреждение ДНК.
Введение
Общие хрупкие участки (СХУ) — это большие хромосомные участки, обнаруженные на каждой хромосоме человека, склонные к разрыву во время метафазы. Под действием репликационного стресса репликация в этих областях значительно задерживается, предотвращая их полное дублирование до митотического входа1, что в конечном итоге приводит к образованию специфических для сайта разрывов и разрывов. СХУ являются горячими точками хромосомной нестабильности и основной причиной хромосомных перестроек на ранних стадиях развития рака. Репликационный стресс, который часто присутствует в опухолевых условиях, может привести к потере генов-супрессоров опухоли и амплификации онкогенов, что в совокупности называется вариацией числа копий (CNV)2,3,4,5,6. Кроме того, СХУ очень склонны к вирусной интеграции, что еще больше способствует развитию рака 7,8,9,10. Множественные гомозиготные делеции генов-супрессоров опухолей были обнаружены в областях СХУ во время панракового анализа первичных опухолей. К наиболее часто поражаемым СХУ при раке относятся FRA2F, FRA3B, FRA4F, FRA5H и FRA16D11. СХУ особенно уязвимы к разрыву в присутствии внешних канцерогенных агентов12. Для оценки пагубного канцерогенного воздействия загрязнителей окружающей среды необходим быстрый и надежный метод количественной оценки возникновения разрыва СХУ.
Фосфорилирование H2A. X в сериновом остатке 139 (γH2A.X) при атаксии, телеангиэктазии и Rad3-родственном белке (ATR) или мутированной атаксии, телеангиэктазии (ATM), является ключевым событием в остановке репликационной вилки13. γH2A.X служит индикатором остановки репликационных вилок до образования двухцепочечного разрыва (DSB)13, создавая благоприятную среду хроматина, способствующую эффективному привлечению репарирующих белков к остановленным сайтам. Кроме того, γH2A.X может быть задействован для разрушения участков после обрушения вилки14,15, что согласуется с его основной ролью в восстановлении DSB. Поскольку разрывы СХУ тесно связаны с хромосомными аберрациями, которые приводят к прогрессированию рака, обнаружение этих разрывов может сыграть важную роль в понимании ранних стадий онкогенеза. Присутствие γH2A.X в СХУ может быть использовано в качестве биомаркера для выявления ранних событий геномной нестабильности. Эта информация может помочь выявить потенциальные канцерогены и оценить риск, связанный с воздействием различных внешних агентов. Измеряя разрывы ДНК в СХУ, индуцированные внешними агентами, γH2A.X хроматин IP (ChIP) может дать представление о том, как такие агенты влияют на механизмы, лежащие в основе онкогенеза.
В обычном ChIP (т.е. Cross-linked ChIP, X-ChIP) ассоциация γH2A.X с его целевыми последовательностями ДНК стабилизируется путем обратимого сшивания формальдегида. Затем хроматин разрезают на фрагменты примерно 500 пар оснований (.н.) с помощью ультразвука, и полученный раствор очищают от мусора путем осаждения 16,17,18. Затем к очищенной фракции хроматина добавляют антитело γH2A.X класса ChIP, после чего добавляют гранулы агарозы белка A/G для обогащения областей хроматина, связанных с γH2A.X, 16,17,18. Иммунные комплексы (т.е. комплекс ДНК, нацеленный на гранулы-антитело-γH2A.X) многократно промывают строгими промывочными буферами для удаления неспецифически связанных фрагментов ДНК 16,17,18. После промывки специфически связанная ДНК вымывается из иммунных комплексов. Затем формальдегидные поперечные сшивания переворачивают с последующим расщеплением белка с использованием протеиназы К, после чего обогащенную ДНК очищают и концентрируют 16,17,18. Для оценки областей, ассоциированных с γH2A.X, используется ПЦР, количественная ПЦР (кПЦР) или прямое секвенирование 16,17,18. Занятость γH2A.X в конкретных областях, таких как СХУ, определяется интенсивностью сигнала ПЦР или количественной ПЦР, которая пропорциональна количеству связанного γH2A.X в этом месте, что позволяет получить представление о повреждениях и событиях репарации ДНК, специфичных для конкретного сайта 16,17,18.
Несмотря на то, что X-ChIP является мощным экспериментальным подходом, он имеет несколько существенных ограничений: (i) он требует большого количества клеток, обычно в диапазоне от 1 x 107 до 5 x 107, из-за неэффективности осаждения антител, связанного с фиксацией, что увеличивает общую стоимость эксперимента19; (ii) процесс восстановления формальдегидных поперечных связей и последующей очистки ДНК является трудоемким и трудоемким, что затрудняет поддержание согласованности и надежности результатов; и (iii) взаимодействия γH2A.X-ДНК с незначительной функциональной значимостью могут быть неотличимы от взаимодействий с большей значимостью, поскольку стадия сшивки может стабилизировать переходные взаимодействия, приводя к выявлению взаимодействий, которые могут быть биологически незначимыми.
Нативная иммунопреципитация хроматина (Native ChIP или N-ChIP) является важным биохимическим методом, используемым для изучения взаимодействий белков и ДНК в их нативном хроматиновом контексте в физиологических солевых условиях. Он сыграл важную роль в выяснении пространственной и временной организации хроматина, связывания транскрипционного фактора и модификаций гистонов. Нативный ChIP играет давнюю роль в более широкой области биологии и эпигенетики хроматина, обеспечивая уникальные преимущества и ограничения по сравнению с X-ChIP. Этот метод, внедренный в конце 1980-хгодов20, включает выделение хроматина из клеток методами, сохраняющими его нативную структуру, такими как расщепление микрококковой нуклеазой (МНаза)21. Это позволяет сохранить присущие ему контакты белок-ДНК и гистон-ДНК, что делает нативный ChIP особенно подходящим для изучения модификаций гистонов и позиционирования нуклеосом в их естественной настройкехроматина 22. Исследования Native ChIP с высоким разрешением продемонстрировали использование расщепления MNазы для восстановления хроматина до отдельных нуклеосом, что облегчает картирование модификаций гистонов сбольшей точностью. Кроме того, поскольку в нем не задействованы химические сшивки, риск внесения погрешностей или артефактов, которые могут исказить взаимодействие белка и ДНК, сведен кминимуму24.
В отличие от X-ChIP, где формальдегид или другие сшивающие агенты используются для фиксации взаимодействий белка и ДНК, Native ChIP обеспечивает более реалистичное представление о хроматине, избегая потенциальных артефактов сшивания. Однако, в то время как X-ChIP, как правило, лучше подходит для обнаружения переходных или динамических взаимодействий между ДНК и регуляторными белками25, нативный ChIP идеально подходит для стабильных белок-ДНК-взаимодействий, таких как гистоны или другие белки, связанные с хроматином 26,27. Одним из ограничений, отмеченных для нативного ChIP, является невозможность захвата событий низкоаффинного или переходного связывания, которые часто стабилизируются за счет сшивки в X-ChIP25.
Значительный объем работ в области эпигенетики был использован с помощью нативного ChIP для выявления модификаций гистонов в различныхбиологических условиях. Эти усилия сыграли решающую роль в определении кода гистонов - структуры модификаций гистонов, которые регулируют экспрессию генов и динамику хроматина. Хотя H2A. X является менее тесно связанным линкерным гистоном, нативным H2A. Метод X ChIP был успешно применен в эмбриональных стволовых клетках30. В этом исследовании мы оптимизировали процедуру экстракции хроматина для выполнения Native ChIP γH2A.X в клетках человека 293T (Рисунок 1). Гидроксимочевина и афидиколин широко используются в исследованиях для изучения стресса репликации ДНК, повреждений и геномной нестабильности31. В этом исследовании эти агенты применялись к клеткам для индуцирования репликационного стресса и генерации разрывов ДНК при СХУ.
Используя исходный материал примерно от 1 x 106 до 5 x 106 клеток, этот метод можно разделить на четыре основных этапа: (i) субклеточное фракционирование для выделения хроматина, (ii) расщепление микрококковой нуклеазы (MNase) до фрагмента хроматина, (iii) иммунопреципитация и элюирование, и (iv) анализ ДНК с помощью количественной ПЦР (кПЦР). Проведение ChIP после субклеточного фракционирования имеет ряд преимуществ и было хорошо задокументировано в многочисленных исследованиях 32,33,34,35. Такой подход позволяет удалять несвязанные с хроматином белки и другой клеточный мусор, в результате чего получается высокоочищенная хроматиновая фракция. Выделяя хроматин перед иммунопреципитацией, субклеточное фракционирование помогает поддерживать нативные взаимодействия хроматина и снижает фоновый шум от белков, не связанных с хроматином, что приводит к более специфичным и надежным результатам, поскольку для анализа сохраняются только хроматин-связанные комплексы. Кроме того, субклеточное фракционирование обеспечивает более мягкие условия для расщепления хроматина, тем самым сохраняя физиологические взаимодействия белка и ДНК и обеспечивая более точное представление динамики хроматина в нативной клеточной среде.
Использование нативного ChIP γH2AX для измерения влияния внешних агентов на разрушение общего хрупкого участка имеет значительный потенциал для исследований рака. Этот метод позволяет обнаруживать повреждения ДНК, вызванные воздействием канцерогенов из окружающей среды, что дает представление о молекулярных механизмах, с помощью которых загрязняющие вещества способствуют нестабильности генома и развитию рака. Сохраняя нативный контекст хроматина, этот метод способствует точной оценке характера повреждений ДНК, связанных с канцерогенным воздействием, помогая в оценке экологических рисков и изучении онкогенеза, вызванного загрязнением.
протокол
1. Забор клеток
- Посадите примерно 5 x 105 HEK 293T клеток в каждую из четырех 6-сантиметровых чашек, каждая из которых содержит 4 мл полной среды DMEM.
- Через 24 ч обработайте одну чашку 2 мкл 1 мМ афидиколина (см. Таблицу материалов) стоковым раствором (конечная концентрация 0,5 мкМ), а другую чашку 20 мкл 1 М гидроксимочевины (см. Таблицу материалов) стоковым раствором (конечная концентрация 5 мМ) для индуцирования репликационного стресса. Добавьте ДМСО в оставшиеся две тарелки, чтобы они служили контрольными.
- Через 24 ч после обработки выбросьте питательные среды. Из одной 6-сантиметровой пластины обычно получается примерно 2 x 106 клеток при 60%-70% слиянии.
- Промойте каждую посуду 2 раза 5 мл ледяного 1x PBS. С помощью скребков для клеток отделите клетки и перенесите клеточную суспензию в четыре отдельные пробирки объемом 1,5 мл. Осторожно проводите пипеткой вверх и вниз с помощью пипетки P1000, чтобы диссоциировать любые скопления клеток.
- Центрифугируйте клетки при 500 x g в течение 5 минут при 4 °C, затем выбросьте надосадочную жидкость. Поместите клетки на лед.
2. Субклеточное фракционирование
- Ресуспендируйте клеточную гранулу в 500 мкл свежеприготовленного холодного буфера А (см. таблицу 1), обеспечивая полную диссоциацию клеточных комков путем щадящего пипетирования.
- Инкубируйте лизаты на льду в течение 5-10 минут. Проверьте ход лизиса под микроскопом, чтобы убедиться в полном лизисе клеток.
- Возьмите небольшую аликвоту лизата (около 5 - 10 мкл) и поместите ее на чистое предметное стекло микроскопа. Накройте его защитным стеклом, чтобы избежать загрязнения.
- Используйте световой микроскоп с соответствующим увеличением (например, 20x - 40x) для визуализации клеток или мусора. Сравните с нелизированным контрольным образцом, чтобы дифференцировать интактные клетки и лизированный материал.
Примечание: Правильно лизированный образец не будет иметь четких клеточных контуров, только диффузный хроматин или клеточный материал. Отрегулируйте фокус так, чтобы четко наблюдать за лизатом. При необходимости приложите механическую силу на этапе лизиса, например, с помощью гомогенизатора Dounce, при работе с определенными типами клеток.
- Центрифугируйте при давлении 500 x g в течение 5 минут при 4 °C, после того как клетки будут полностью лизированы. Аккуратно выбросьте надосадочную жидкость. Ресуспендируйте гранулы ядер в 500 мкл холодного буфера А с помощью наконечников для пипеток с широкими отверстиями.
ПРИМЕЧАНИЕ: Наконечники с широкими отверстиями помогают свести к минимуму усилия сдвига и защитить хрупкие образцы, такие как хроматин. Делайте ширококалиберные наконечники, срезая острым лезвием концы стандартных наконечников. - Центрифугируйте при 500 x g в течение 5 мин при 4 °C. Аккуратно выбросьте надосадочную жидкость.
- Разогрейте инкубатор до 37 °C и приготовьте буфер для остановки (100 мМ ЭДТА, pH 8,0; Таблица 1).
- Заранее оптимизируйте концентрацию микрококковой нуклеазы (MNase, см. Таблицу материалов) и время инкубации.
- Разделите 40 мкл образца исследуемого хроматина на несколько равных аликвот, чтобы проверить различные концентрации МНазы и время инкубации.
- Используйте диапазон концентраций МНазы (например, 0,0625 ЕД, 0,125 ЕД, 0,25 ЕД, 0,5 ЕД, 1 ЕД, 2 ЕД, 4 ЕД, 8 ЕД на реакцию) и тестируйте многократное время инкубации (например, 2, 5, 10 и 15 минут).
- Добавьте MNase Buffer (см. таблицу 1), содержащий различные концентрации MNase, в аликвоты хроматина и инкубируйте образцы при 37 °C в течение указанного времени.
- Завершите реакцию, добавив 1/4 объема буфера для остановки (конечная концентрация: 20 мМ ЭДТА) сразу после желаемого времени инкубации.
- Выделите ДНК из переваренных образцов хроматина с помощью метода экстракции фенолом/хлороформом/изоамиловым спиртом.
- Запустите извлеченную ДНК на 1,5% агарозном геле, чтобы визуализировать паттерны пищеварения: при недостаточном переваривании будут видны полосы с высокой молекулярной массой (рис. 2, дорожка 1-4); чрезмерное переваривание приведет к мазку или очень коротким фрагментам (Рисунок 2, дорожка 6-8), а оптимальное переваривание приведет к четкому нуклеосомному рисунку лестницы (Рисунок 2, дорожка 5, например, моно-, ди-, трехнуклеосомы).
- Определите условия, которые обеспечивают желаемое нуклеосомное разрешение без чрезмерного переваривания.
Примечание: CaCl2 действует как кофактор активности MNase. Оптимизируйте разложение, регулируя концентрацию CaCl2 в диапазоне от 1 мМ до 5 мМ.
- Аккуратно ресуспендируйте интактные ядра 100 мкл буфера MNазы путем пипетирования 5–10 раз с широкими наконечниками. Немедленно добавьте в образцы заранее определенное количество MNазы (1,25 U MNase/100 μL MNase Buffer).
ПРИМЕЧАНИЕ: При работе с несколькими образцами переваривайте каждый из них по отдельности, чтобы избежать переваривания. - Поместите пробирки на вращатель и инкубируйте в течение 5 минут при 37 °C. Немедленно верните пробирки в лед и завершите расщепление MNase, добавив ЭДТА до конечной концентрации 20 мМ, и перемешайте путем вортексирования.
- Добавьте 500 мкл буфера B (см. Таблицу 1) в каждый образец и тщательно перемешайте, пипетируя вверх и вниз 5-10 раз. Растворяют белки путем инкубации на льду в течение 5 минут.
ПРИМЕЧАНИЕ: Соль и детергент в буфере B помогают диссоциировать слабые белки, связанные с хроматином, и подвергают эпитопы воздействию иммунопреципитации. - Гранулируйте нерастворимый материал центрифугированием на максимальной скорости в течение 5 минут при 4 °C. Перенесите прозрачный надосадочный жидкость в новые пробирки объемом 1,5 мл, помеченные как нативная фракция хроматина. Образцы могут храниться при температуре -80 °C или использоваться для проверки эффективности фрагментации хроматина.
Примечание: Избегайте частых циклов замораживания-оттаивания, так как они могут нарушить интересующие интерес взаимодействия белка и ДНК. По возможности сведите к минимуму циклы замораживания-оттаивания.
3. Проверка фрагментации хроматина
- Аликвотировать 10 мкл надосадочной жидкости из каждого образца в новую пробирку объемом 1,5 мл. Смешайте с 20 μL дистиллированной воды и 30 μL фенола/хлороформа/изоамилового спирта (25:24:1).
- Плотно закройте трубки и энергично делайте вихри в течение 15-30 с. Центрифугируйте при давлении 20 000 x g (или максимальной скорости центрифуги) в течение 10 мин при 4 °C. После центрифугирования будут наблюдаться три отдельных слоя: прозрачный верхний слой, белый средний слой и желтый нижний слой.
- Осторожно перенесите 20 мкл верхней водной фазы (содержащей ДНК) в свежую пробирку. Отделите очищенную ДНК в 1,5% агарозном геле в течение 30 минут при 100 В и визуализируйте схемы пищеварения. Убедитесь, что размер фрагментов хроматина в основном составляет от 200 до 1000 пар оснований.
Правильный размер фрагментов хроматина имеет решающее значение для успеха нативного ChIP и зависит от условий обработки MNase, включая ферментные единицы, время инкубации и концентрацию CaCl2. Эффективность переваривания MNазы также может варьироваться в зависимости от типа и количества клеток. Картина фрагментации хроматина, показанная на рисунке 2 (дорожка 5), рекомендуется для данного анализа ChIP.
4. Иммунопреципитация
- Добавьте 20 мкл расщепленного хроматина из каждого образца в свежую пробирку объемом 1,5 мл и смешайте со 180 мкл элюирующего буфера (см. таблицу 1). Пометьте эти пробирки как входные образцы и храните при температуре -20 °C.
- Перелейте 400 мкл образца хроматина в другую пробирку объемом 1,5 мл для ChIP.
- Добавьте антитело γH2A.X (см. Таблицу материалов) в один образец, обработанный ДМСО, один образец, обработанный афидиколином, и один образец, обработанный гидроксимочевиной. Добавьте такое же количество нормального IgG (см. Таблицу материалов) в другой образец, обработанный ДМСО, в качестве отрицательного контроля для анализа ChIP.
Примечание: Здесь обычно используется 1 г первичного антитела для 400 μл хроматина (т.е. конечная концентрация антитела составляет 2,5 μг/мл). Тем не менее, оптимальное количество должно быть определено эмпирически для различных антител к γH2A.X. - Поместите трубки ChIP на вращатель при температуре 4 °C и инкубируйте не менее 5 часов, а лучше в течение ночи.
- Между тем, аликвотируйте 100 мкл магнитных гранул белка A/G класса ChIP (см. Таблицу материалов) в новую пробирку объемом 1,5 мл. Используйте наконечники с широкими отверстиями и медленно нажимайте на пипетку, чтобы обеспечить точное измерение шариков. Поместите трубку на магнитную подставку не менее чем на 1 минуту, затем осторожно слейте жидкость.
- Суспендируйте гранулы в 1 мл 1x PBS, содержащего 0,5% BSA. Вращайте при температуре 4 °C в течение примерно 4 часов. Поместите трубку на магнитную подставку не менее чем на 1 минуту и выбросьте надосадочную жидкость.
- Снова промойте шарики 1 мл 1x PBS, содержащего 0,5% BSA. Поместите трубку на магнитную подставку на 1 минуту, чтобы гранулировать магнитные шарики, затем выбросьте надосадочную жидкость.
Примечание: Этапы с 4.5 по 4.7 представляют собой предварительное покрытие гранул для уменьшения неспецифического связывания антител с магнитными гранулами. - Суспендируйте предварительно покрытые шарики в 100 мкл буфера B с помощью наконечников с широкими отверстиями. Добавьте 25 мкл предварительно покрытой магнитной суспензии в каждую пробирку с образцом ChIP. Вращайте при температуре 4 °C в течение 2 часов.
- Поместите трубки ChIP на магнитную подставку и подождите, пока шарики полностью прикрепятся к боковой стороне трубки и раствор станет прозрачным.
- Выбросьте прозрачную надосадочную жидкость, не повреждая магнитные шарики. Восстановите гранулы с помощью 1 мл буфера для стирки (см. Таблицу 1) и вращайте при температуре 4 °C в течение 10 минут.
- Поместите трубки обратно на магнитную подставку и подождите, пока раствор не станет прозрачным. Выбросьте буфер для стирки. Повторите стирку в общей сложности четыре стирки.
- Выбросьте промывочный буфер после окончательной промывки и кратковременно центрифугируйте пробирки при давлении 400 x g в течение 30 с при 4 °C, чтобы удалить остатки жидкости. Поместите пробирки обратно на магнитную подставку и осторожно удалите остатки жидкости со дна пробирки.
5. Элюирование и осаждение ДНК
ПРИМЕЧАНИЕ: Эффективность антител может варьироваться в зависимости от партии. Важно подтвердить аффинность связывания нового антитела путем проверки иммунопреципитированных образцов с помощью вестерн-блоттинга.
- Проверьте эффективность извлечения антител ChIP с помощью вестерн-блоттинга (WB), как описано ниже.
- Возьмите небольшую аликвоту образца ChIP для анализа (т.е. обычно 10% от образца ChIP). Включите входной хроматин (предиммунопреципитация) и отрицательный контроль (например, снижение уровня IgG) для сравнения.
- Элюирование белков из связанных с антителами гранул путем нагревания в 20 мкл 1x загрузочного буфера SDS-PAGE (см. таблицу материалов) при 95 °C в течение 5 мин.
- Загрузите образцы IP, входные данные и элементы управления в 15% гель SDS-PAGE. Запустите гель.
- Перенесите белки на мембрану из нитроцеллюлозы размером 0,2 мкм (см. Таблицу материалов) или ПВДФ с помощью системы влажного или полусухого переноса.
- Закройте мембрану 5% обезжиренным молоком или BSA в TBST (см. Таблицу 1) на 1 ч при комнатной температуре, чтобы предотвратить неспецифическое связывание.
- Инкубируйте мембрану с первичным антителом против γH2A.X (см. Таблицу материалов), разведенным в блокирующем буфере в течение 1-2 часов при комнатной температуре или в течение ночи при 4 °C.
- Промойте мембрану 3 раза с TBST, чтобы удалить несвязанные антитела. Инкубируйте мембрану с HRP-конъюгированным вторичным антителом (см. Таблицу материалов) в течение 1 ч при комнатной температуре. Еще раз промойте мембрану, чтобы удалить излишки вторичных антител.
- Разработайте мембрану с помощью хемилюминесцентной подложки и визуализируйте сигнал с помощью тепловизора. Сравните интенсивность сигнала между линиями IP, входом и управлением, чтобы оценить эффективность и специфичность понижающего сигнала.
Примечание: Полоса, соответствующая белку-мишени на линии IP, подтверждает успешное вытягивание антител. Такой подход позволяет оценить эффективность антитела в захвате целевого белка во время эксперимента ChIP.
- Добавьте 50 μL элюирующего буфера (см. Таблицу 1) к каждому из оставшихся образцов ChIP. Поместите трубки на термомиксер и встряхивайте в течение 15 минут при комнатной температуре.
- Поместите трубки на магнитный держатель не менее чем на 1 минуту. Соберите элюй в новые трубочки. Повторите 1 раз и соберите элют в те же пробирки.
- Добавьте дополнительно 100 мкл элюирующего буфера в каждый образец элюирования ChIP и 180 мкл элюирующего буфера в каждый входной образец.
- Добавьте 200 мкл фенола/хлороформа/изоамилового спирта (25:24:1) в каждый образец и энергично перемешайте. Центрифугируйте образцы при давлении 20 000 x g (или максимальной скорости) в течение 10 минут при 4 °C.
- Добавьте 19 мкл 3М ацетата натрия (NaOAc, pH 5,2; см. Таблицу 1) и 2 мкл раствора гликогена (20 мг/мл, см. Таблицу материалов) в каждую новую центрифужную пробирку объемом 1,5 мл.
- После центрифугирования осторожно перенесите верхний водный слой (примерно 190 мкл) в пробирки, содержащие NaOAc и гликоген, и перемешайте с помощью вортексирования.
- Добавьте 500 μL 100% этанола и вортекс. Осаждайте ДНК путем инкубации образцов при -20 °C в течение не менее 2 часов или в течение ночи.
- Центрифугируйте пробирки при давлении 20 000 x g (или максимальной скорости) в течение 10 минут при 4 °C. Выбросьте надосадочную жидкость, стараясь не потревожить белую гранулу. Повторно суспендируйте гранулу в 1 мл 70% этанола и тщательно перемешайте.
- Центрифугируйте пробирки при давлении 20 000 x g (или максимальной скорости) в течение 5 минут при 4 °C. Осторожно удалите надосадочную жидкость. На короткое время снова центрифугируйте пробирки, чтобы раскрутить остаточный этанол. Осторожно удалите этанол с помощью пипетки P20. Гранулы ДНК высушиваются на воздухе в течение 2-3 минут.
ПРИМЕЧАНИЕ: Избегайте чрезмерной сушки гранулы, так как это может затруднить повторное растворение ДНК. - Для образцов ChIP ресуспендировать ДНК в 400 мкл TE-буфера (см. Таблицу 1). Для входной ДНК ресуспендировать в 1000 мкл TE-буфера. Элюированные образцы теперь можно хранить при температуре -20°C.
6. Количественное определение количественной оценки ПЦР
- Проведите количественную ПЦР с использованием коммерческого набора (см. Таблицу материалов) с техническими тройками для каждого образца. Подтвердить наличие одного конкретного продукта ПЦР путем проведения анализа кривой плавления для обеспечения специфичности амплификации36.
- Анализ данных
ПРИМЕЧАНИЕ: При сравнительном количественном анализе тестовый образец выражается в виде кратного изменения по отношению к контрольному образцу (иммунопреципитированный с использованием нормального очищенного IgG или имитации IP). Локусы ДНК, о которых известно, что они не заняты иммунопреципитированным белком (отрицательный локус), могут быть использованы таким образом в качестве референсного гена по сравнению с известными, занятыми, положительными контрольными локусамиДНК 36.- Рассчитайте процент ввода для каждого CHIP, используя формулу ниже
%input = 2(-ΔCt [нормализованный ChIP]) - Нормализуем значения положительного локуса ΔCt к отрицательному локусу (ΔΔCt) путем вычитания значения ΔCt, полученного для положительного локуса, из значения ΔCt для отрицательного локуса по формуле ниже
(ΔΔCt = ΔCtpositive - ΔCtnegative) - Рассчитайте кратное обогащение последовательности положительного локуса в ДНК ChIP по сравнению с отрицательным локусом по формуле ниже
Кратное обогащение = 2ΔΔCt
Последовательности праймеров для количественной ПЦР, использованных для анализа, приведены в таблице 2. Геномная организация FRA3B и FRA16D37изображена на рисунках 3A, B.
- Рассчитайте процент ввода для каждого CHIP, используя формулу ниже
- Статистический анализ
- Проанализируйте результаты статистически с помощью парного t-критерия Стьюдента. p-значение ≤0,05 считается статистически значимым, что указывает на то, что наблюдаемые различия вряд ли обусловленыслучайными вариациями.
Результаты
Размер фрагментов хроматина имеет решающее значение для успеха нативного ChIP, поскольку он напрямую влияет на доступность участков ДНК для связывания антител. Для определения оптимальной концентрации МНазы для фрагментации хроматина мы подготовили серию микроцентрифужных пробирок, содержащих различные концентрации МНазы (т.е. 0,0625 ЕД, 0,125 ЕД, 0,25 ЕД, 0,5 ЕД, 1 ЕД, 2 ЕД, 4 ЕД, 8 ЕД на реакцию) и 40 мкл выделенных ядер. Каждую реакцию инкубировали при 37 °C в течение 5 мин для достижения диапазона размеров фрагментов хроматина. Результаты расщепления MNазы представлены на рисунке 2.
Как показано на рисунке 2, более высокие концентрации MNазы приводили к более обширному расщеплению хроматина, что приводило к преобладанию фрагментов мононуклеосом (рисунок 2, дорожки 1, 2 и 3). Напротив, при более низких концентрациях МНазы большинство фрагментов хроматина были больше, часто превышая 1.н. (рис. 2, дорожки 6, 7 и 8), что указывает на недостаточное расщепление для последующего применения. При концентрации МНазы 1,6 единицы и времени расщепления 5 минут мы получили фрагменты хроматина преимущественно в диапазоне от 200 до 1000 пар оснований (рис. 2, дорожка 5). Такой размер фрагмента идеально подходит для нативного ChIP, так как обеспечивает эффективное обогащение хроматин-ассоциированной ДНК при сохранении доступности к конкретным эпитопам. Соответствующий размер фрагмента способствует эффективному иммунопреципитации и последующему анализу, такому как количественная ПЦР или секвенирование, что делает его пригодным для обнаружения взаимодействий белка и ДНК с высоким разрешением.
Аффинность связывания антитела является критическим фактором для успеха нативного ChIP. Обеспечение эффективного и специфического связывания антитела со своим эпитопом-мишенью имеет важное значение для достижения надежных результатов. Поэтому крайне важно заранее проверить эффективность связывания антитела. Для подтверждения эффективности иммунопреципитации γH2A.X мы провели вестерн-блоттинг (WB).
Мы сравнили уровни γH2A.X между клетками, обработанными ДМСО (контроль), клетками, обработанными афидиколином и гидроксимочевиной (подверженными репликационному стрессу) с использованием вестерн-блоттинга. Как показано на рисунке 4A (входные данные), уровни γH2A.X были значительно выше в клетках, обработанных афидиколином, по сравнению с клетками, обработанными ДМСО. Это увеличение γH2A.X согласуется с индукцией репликационного напряжения афидиколином, что приводит к увеличению образования двухцепочечного разрыва и последующему фосфорилированию γH2A.X. После проведения ChIP мы верифицировали специфичность иммунопреципитации путем сравнения обогащения γH2A.X в контрольных образцах IgG и γH2A.X IP. Контроль IgG не снижал обнаруживаемый γH2A.X, что указывает на минимальное неспецифическое связывание (рис. 4B, N-ChIP и X-ChIP). Напротив, образец γH2A.X IP успешно обогатил γH2A.X из клеток, обработанных афидиколином, продемонстрировав эффективное и специфическое связывание антитела с γH2A.X (рис. 4, N-ChIP и X-ChIP). Эти результаты подтверждают, что антитело γH2A.X обладает достаточным аффинностью связывания и специфичностью для использования в экспериментах с нативным ChIP, что позволяет надежно обнаруживать и обогащать области хроматина, связанные с γH2A.X. Этот этап валидации имеет важное значение для обеспечения качества и точности последующих анализов ChIP.
Мы использовали общие хрупкие сайты (СХУ) FRA16D и FRA3B для оценки специфичности связывания γH2A.X с ДНК в ответ на репликационный стресс. FRA16D и FRA3B являются хорошо известными областями СХУ, склонными к нестабильности в условиях репликационного напряжения, что делает их идеальными кандидатами для валидации взаимодействий γH2A.X/ДНК. Рисунки 3A,B иллюстрируют геномную организацию этих двух СХУ, а также специфические праймеры для количественной ПЦР, используемые для анализа.
Чтобы определить, связывается ли γH2A.X с этими областями СХУ в ответ на репликационный стресс, мы провели анализ ChIP-qPCR в контрольных клетках (обработанных ДМСО), обработанных афидиколином и гидроксимочевиной. Результаты количественной ПЦР показали, что в контрольных клетках, обработанных ДМСО, γH2A.X не был обогащен ни в локусах FRA16D, ни в FRA3B, что свидетельствует об отсутствии значительного повреждения ДНК или репликационного стресса в этих областях (рис. 3C). Однако в клетках, обработанных афидиколином или гидроксимочевиной, которые индуцируют репликационный стресс путем ингибирования ДНК-полимеразы, мы наблюдали значительное обогащение γH2A.X как в FRA16D, так и в FRA3B (рис. 3C). Это указывает на то, что γH2A.X был рекрутирован в эти области СХУ именно в ответ на стресс репликации ДНК. Эти результаты показывают, что занятость γH2A.X в СХУ вызвана репликационным стрессом, что подтверждает его роль в качестве маркера реакции на повреждение ДНК и остановки репликационной вилки. Специфическое рекрутирование γH2A.X в FRA16D и FRA3B во время лечения афидиколином еще больше подтверждает специфичность нашего анализа ChIP и подтверждает, что γH2A.X является надежным индикатором повреждения ДНК и репликационного стресса в хрупких участках.
Чтобы сравнить эффективность нативного ChIP с сшитым ChIP (X-ChIP), мы провели γH2A.X X-ChIP, используя то же начальное количество ячеек, следуя протоколу, описанному Lyu et al.39. Рекрутирование γH2A.X к FRA16D увеличивалось при лечении афидиколином и гидроксимочевиной, как показано на рисунке 3D. Тем не менее, относительное обогащение γH2A.X на FRA16D в X-ChIP было заметно ниже, чем при использовании нативного ChIP, что указывает на снижение эффективности X-ChIP в этих условиях. Кроме того, в FRA3B увеличение обогащения γH2A.X было статистически незначимым, что является дополнительным доказательством того, что X-ChIP менее эффективен при работе с ограниченным числом клеток. Эти результаты свидетельствуют о том, что нативный ChIP может быть более подходящим для обнаружения обогащения γH2A.X в хрупких участках при ограниченном размере выборки. Проанализируйте результаты статистически с помощью парного t-критерия Стьюдента. p-значение ≤ 0,05 считается статистически значимым.

Рисунок 1: Workflow для проведения нативного анализа γH2A.X ChIP. (i) Клетки культивируют и подвергают специфической обработке (например, повреждающими ДНК агентами, такими как гидроксимочевина) для индуцирования передачи сигналов γH2A.X. (ii) Обработанные клетки собираются для обработки. (iii) Клетки фракционируют для выделения связанного с хроматином γH2A.X, отделяя его от других клеточных компонентов. (iv) Расщепление микрококковой нуклеазы (MNase) выполняется для фрагментации хроматина на кусочки размером с нуклеосому. (v) Размер фрагментов хроматина проверяется путем прогона образца на агарозном геле, что обеспечивает достаточную длину фрагментов для ChIP. (vi) Антитело, специфичное к γH2A.X, используют для иммунопреципитации фрагментов хроматина, помеченных γH2A.X. (vii) Гранулы белка A/G используются для снижения комплексов антитело-хроматин, обогащая γH2A.X-связанную ДНК. (viii) Фрагменты ДНК, маркированные γH2A.X, элюируются и очищаются, подготавливая их к последующему анализу. (ix) Анализ на последующих этапах: количественная ПЦР и секвенирование, а также анализ данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Анализ для оптимизации состояния переваривания MNазы. Фрагменты хроматина получали из клеток HEK 293T с использованием различных условий расщепления MNase. Полученную очищенную ДНК из фрагментированного хроматина отделяли на 2% агарозном геле и прогоняли при напряжении 100 В в течение 30 минут. Полосы с 1 по 8 представляют образцы, обработанные возрастающими концентрациями МНазы (т.е. 0,0625 ЕД, 0,125 ЕД, 0,25 ЕД, 0,5 ЕД, 1 ЕД, 2 ЕД, 4 ЕД, 8 ЕД на реакцию), демонстрирующие градиент расщепления хроматина. Лестница ДНК (обозначена буквой М) была включена для определения размера. Фрагменты ДНК визуализировали с помощью окрашивающего раствора ДНК Midori Green Advance. Помеченная полоса соответствует фрагментам ДНК размером с мононуклеосому, подчеркивая эффективность пищеварения при каждой концентрации МНазы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
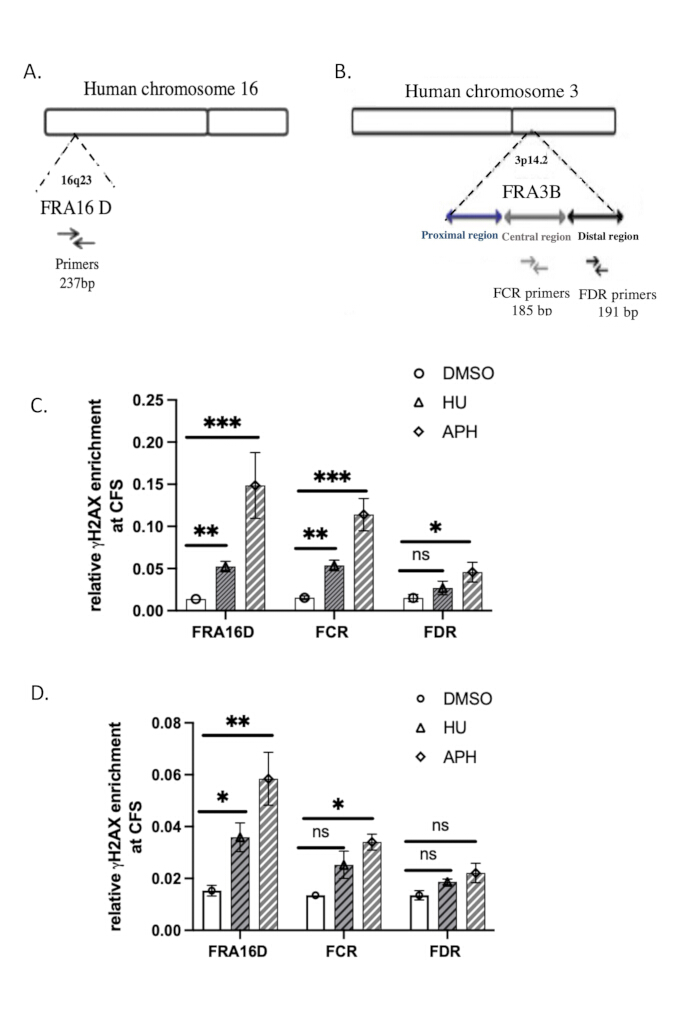
Рисунок 3:Проверка методом количественной ПЦР γH2A.X ChIP. (A) Диаграмма геномных организаций FRA16D. (B) Диаграмма геномных организаций региона FRA3B. Показаны наборы праймеров, используемые для количественного ПЦР-анализа FRA16D, дистальной (FDR) и центральной (FCR) областей в пределах локуса FRA3B. (C) Относительное обогащение γH2A.X в общих хрупких участках (СХУ), в частности FRA3B и FRA16D, оценивали с помощью нативного ChIP с последующим анализом количественной ПЦР после обработки афидиколином и гидроксимочевиной. (D) Относительное обогащение γH2A.X в общих хрупких участках (СХУ), в частности FRA3B и FRA16D, оценивали с помощью X-ChIP с последующим анализом количественной ПЦР после обработки афидиколином и гидроксимочевиной. указывает на статистически значимый результат с p < 0,001; ** обозначает p < 0,01, а * обозначает p < 0,05, определенный t-критерием; n = 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
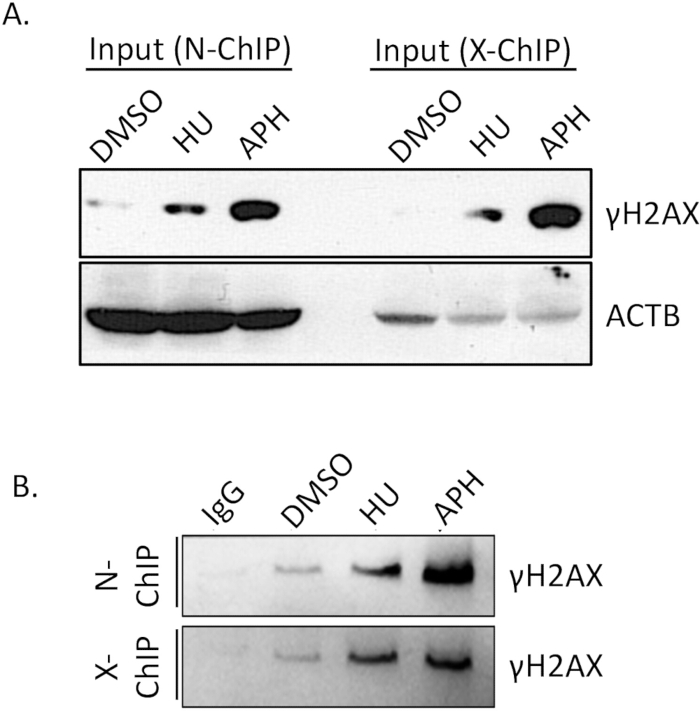
Рисунок 4: Проверка эффективности извлечения антител ChIP с помощью вестерн-блоттинга. Из общего образца 10% образца ChIP, вместе с входным контролем, было отделено на 15% геле SDS-PAGE для растворения полипептидов. После электрофореза разделенные белки переносили на мембрану PVDF размером 0,22 мкм с использованием стандартного протокола переноса. Затем мембрану последовательно зондировали специфическим первичным антителом, нацеленным на γH2A.X и ACTB, за которым следовали соответствующее HRP-конъюгированное вторичное антитело. Впоследствии сигнал был визуализирован с помощью хемилюминесцентного детектирования, что позволило оценить специфичность антител и эффективность снижения в анализе ChIP. (A) уровни γH2A.X между клетками, обработанными ДМСО (контроль), клетками, обработанными афидиколином и гидроксимочевиной (стресс-репликацией) с ACTB в качестве контроля нагрузки. (B) обогащение γH2A.X в контрольных образцах IgG и образцах IP. Сокращения: APH = афидиколин, HU = гидроксимочевина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Буфер А (1 шт.) | |
| Реагент | Рабочая концентрация |
| ТРУБКИ pH 6,8 | 10 мМ |
| NaCl | 100 мМ |
| MgCl2 | 3 мМ |
| pH EGTA 7,6 | 1 мМ |
| Хранить при температуре -20 °C до 1 года | |
| Буфер MNase (1X) | |
| Реагент | Рабочая концентрация |
| Tris-HCl, pH 7,5 | 50 мМ |
| CaCl2 | 1 мМ |
| MgCl2 | 4 мМ |
| Хранить при температуре -20 °C до 1 года | |
| Буфер B (1X) | |
| Реагент | Рабочая концентрация |
| Фосфат натрия pH 7. 0 | 20 мМ |
| Пирофосфат натрия10. Н2О | 30 мМ |
| KCl | 250 мМ |
| ЭДТА, pH 8,0 | 5 мМ |
| Глицерин | 10% |
| Тритон Х-100 | 0.10% |
| Коктейль ингибиторов протеазы | 1x |
| Коктейль ингибиторов фосфатазы | 1x |
| ДТТ | 0,5 мМ |
| Хранить при температуре -20 °C до 1 года | |
| Элюирующий буфер | |
| Реагент | Рабочая концентрация |
| НаОГС3 | 50 мМ |
| Паспорт безопасности | 1% |
| Свежеприготовленный | |
| Буфер для стирки | |
| Реагент | Рабочая концентрация |
| Буфер MNase | х 0,5 |
| Буфер B | х 0,5 |
| Свежеприготовленные | |
| Буфер остановки | |
| ЭДТА | 100 мМ , pH8.0 |
| 3 М Ацетат натрия, pH 5,2 | |
| 408,24 г Ацетата натрия | |
| ajust pH с уксусной кислотой до pH 5,2 | |
| разведение объема до 1 л | |
| Стерилизуйте буфер с помощью фильтрации или автоклавирования | |
| Буфер TBST | |
| Трис Базис, pH 8,0 | 10 мМ |
| NaCl | 150 мМ |
| Подросток 20 | 0,1% (v/v) |
| TE буфер | |
| Tris-HCl, pH 8,0 | 10 мМ |
| ЭДТА, pH 8,0 | 1 мМ |
Таблица 1: Состав буфера.
| Локусы генов | Передний праймер | Обратный праймер |
| ФРА16Д | TCCTGTGGAAGGGATATTTA | CCCCTCATATTCTGCTTCTA |
| FRA3B | TGTTGGAATGTTAACTCTATCCCAT | ATATCTCATCAAGACCGCTGCA |
| ПКР | ||
| FRA3B | CAATGGCTTAAGCAGACATGGT | AGTGAATGGCATGGCTGGAATG |
| ФДР | ||
| ACTB (отрицательный контроль) | GACGCAGGATGGCATGGG | ACGCCTCTGGCCGTACCAC |
Таблица 2: Последовательность праймеров.
| Низкое восстановление ДНК | Потенциальная проблема | Возможное решение |
| Низкое качество антител | Используйте антитела класса ChIP. | |
| Недостаточное количество антител | Используйте 1-10 мкг антитела ChIP на 25 мкг хроматина. | |
| Недостаточное время инкубации | Выполните этап иммунопреципитации в течение ночи при температуре 4 °C. | |
| Чрезмерно строгие стирки | Не используйте концентрацию NaCl выше 500 мМ в буфере для промывки. | |
| Низкое качество бусин | Убедитесь, что белок A или G совместим с антителом ChIP. | |
| Следуйте техническому описанию гранул для оптимального соотношения объема гранул и антител. | ||
| Недостаточный запуск | Подготовьте отдельную пластину с клетками, чтобы точно определить номер клетки. | |
| Образец | Увеличьте количество используемых ячеек, если целью является низкая численность. | |
| Недостаточный лизис клеток | Оптимизируйте состав буфера и время лизиса для повышения эффективности. | |
| Применяйте механическую силу на этапе лизиса, например, с помощью гомогенизатора Dounce, при работе с определенными типами клеток. | ||
| Произошла деградация ядер | Обеспечьте щадящую изоляцию ядер, чтобы сохранить целостность хроматина и доступность. | |
| Используйте наконечники для пипеток с широким отверстием, чтобы свести к минимуму сдвиг ядер во время работы. | ||
| Произошла деградация образца | Выполняйте все действия на льду или при температуре 4 °C. | |
| Включите ингибиторы протеазы во все буферы и убедитесь, что все буферы свежеприготовлены. | ||
| Недостаточное переваривание МНазы | титровать концентрацию MNазы (например, 0,1–5 единиц) для определения оптимального количества для конкретного типа образца; И начните с диапазона концентраций, чтобы определить идеальные условия пищеварения. | |
| Чрезмерное переваривание | Экспериментируйте с различным временем инкубации (например, 1–10 минут) при 37 °C и контролируйте характер фрагментации, чтобы обеспечить достаточное переваривание без переваривания. | |
| Нарушенное фосфорилирование | Добавьте коктейль ингибиторов фосфатазы в буфер для лизиса и убедитесь, что все буферы свежеприготовлены. | |
| Высокий фон в негативном контроле | Неспецифическое связывание с бусинами | Включите этап предварительного очищения перед этапом иммунопреципитации и используйте магнитные гранулы класса ChIP, которые обычно демонстрируют сниженное неспецифическое связывание. |
| Недостаточная стирка | Увеличьте количество или строгость стирок, регулируя концентрацию соли и моющего средства. | |
| Недостаточная фрагментация хроматина | Оптимизируйте фрагментацию для достижения фрагментов в 200-750.о. | |
| Оптимизация необходима для каждого типа клеток или тканей | ||
| Устранение неполадок с ПЦР | Нет усиления входной выборки | (1) Чрезмерная фрагментация: сигнал уменьшается для ампликонов более 150.о., если хроматин фрагментирован до длины мононуклеосомы. |
| (2) Оптимизируйте условия ПЦР. | ||
| (3) Разрабатывайте грунтовки для усиления меньшей (<150.н.) области. | ||
| Низкое разрешение | Слишком большой размер фрагмента ДНК | Оптимизируйте фрагментацию для достижения фрагментов в 200-750.о. |
Таблица 3: Устранение неполадок с иммунопреципитацией хроматина.
Обсуждение
Загрязнение окружающей среды является значительным фактором развития рака у человека. Многие загрязняющие вещества являются канцерогенными, то есть они могут вызывать генетические повреждения, которые приводят к развитию рака40,41. Тем не менее, определить, является ли то или иное вещество опухолевым, является сложной задачей. Быстрый, надежный и экономически эффективный метод определения канцерогенного потенциала позволил бы ученым эффективно проводить скрининг загрязнителей окружающей среды и оценивать их влияние на стабильность генома. В этом исследовании мы сосредоточимся на модифицированном варианте гистона, γH2A.X, который широко признан в качестве высокоспецифичного маркера для DSBs. γH2A.X образуется при возникновении гистонового варианта H2A. X фосфорилируется в серине 139 в ответ на повреждение ДНК.
Обнаруживая присутствие γH2A.X нативным ChIP в СХУ, мы можем эффективно оценить степень повреждения ДНК, вызванногозагрязнителями окружающей среды. Возможность количественного измерения γH2A.X в СХУ обеспечивает быстрый, чувствительный и надежный способ оценки способности загрязнителей окружающей среды вызывать опухолевые эффекты. В отличие от традиционных анализов генотоксичности, которые часто измеряют косвенные маркеры повреждения ДНК (такие как мутации, образование микроядер или клеточная трансформация), нативный γH2AX ChIP позволяет точно картировать события разрушения в конкретных геномных локусах42. Это обеспечивает более глубокое понимание региона, наиболее уязвимого к загрязнителям окружающей среды, и помогает в выявлении потенциальных канцерогенных механизмов.
Успешный Native ChIP требует пристального внимания к нескольким критическим шагам для обеспечения эффективного обогащения целевых регионов. Ниже приведены важнейшие шаги, связанные с нативным ChIP γH2AX. Подготовка клеток: Начните с достаточного количества клеток. Обработайте клетки агентом, вызывающим повреждение ДНК, таким как афидиколин, чтобы вызвать репликационный стресс в качестве положительного контроля. Приложите для сравнения соответствующие необработанные отрицательные контрольные пробы. Выделение хроматина: выполнение субклеточного фракционирования для выделения связанных с хроматином белков при минимизации загрязнения цитоплазматическими компонентами. Оптимизация MNase: Проведение пилотных экспериментов по оптимизации концентрации микрококковой нуклеазы (MNase) и времени инкубации. Цель состоит в том, чтобы получить фрагменты хроматина между 200-1000 парами оснований, обеспечивая хорошее разрешение для ChIP при сохранении целостности нуклеосом. Иммунопреципитация: Используйте высококачественное антитело γH2AX класса ChIP вместе с агарозой белка A/G для обеспечения эффективного вытягивания целевого хроматина при минимизации неспецифического связывания. Стирка: Промойте шарики буфером, содержащим соответствующую концентрацию соли и моющего средства, чтобы устранить неспецифические взаимодействия с сохранением связанного с γH2AX хроматина. Элюирование и восстановление ДНК: Эффективное восстановление связанного хроматина путем тщательного элюирования и осаждения ДНК, обеспечивая минимальную потерю обогащенного целевого хроматина. По сравнению с обычным X-ChIP, у нативного γH2AX ChIP есть четыре основных преимущества. Во-первых, интеграция субклеточного фракционирования снижает количество ложноположительных взаимодействий и повышает специфичность ChIP. Во-вторых, комплексы белок-ДНК сохраняются в нативном состоянии, сводя к минимуму стабилизацию транзиторных взаимодействий γH2AX-хроматин, которые могут происходить с сшивающими агентами. В-третьих, исключение фиксации и трудоемких этапов обратного сшивания оптимизирует общий рабочий процесс. Наконец, требуется меньше исходного материала, а для резки хроматина не требуется дорогостоящее оборудование, такое как ультразвуковой аппарат на водяной бане (например, Bioruptor) или сфокусированный ультразвуковой ультразвуковой аппарат (например, Covaris).
Хотя Native ChIP имеет свои преимущества, следует также признать его ограничения. Одним из ограничений является возможность перегруппировки белка во время получения хроматина и иммунопреципитации. Эта перегруппировка теоретически может изменить взаимодействия хроматин-связанных белков и внести вариабельность в результаты. Хотя у нас нет прямых доказательств в поддержку возникновения таких перестроек, важно включить соответствующие экспериментальные контрольные данные, чтобы учесть этот потенциальный артефакт. Еще одним ограничением нативного анализа ChIP является смещение расщепления MNase, что может привести к неточным результатам. MNase преимущественно расщепляет A-T-богатые участки генома, что делает эти области более склонными к фрагментации и обогащению в процессе ChIP. Это смещение может привести к чрезмерной представленности последовательностей, богатых A-T, и недостаточной представленности областей, богатых G-C, что потенциально может привести к ложноотрицательным сигналам для областей генома, которые менее доступны для переваривания MNase. Если интересующие нас локусы богаты G-C, необходима тщательная оптимизация условий расщепления MNазы. В качестве альтернативы, включение дополнительных средств контроля, таких как фрагментация хроматина методом ультразвуковой обработки, может помочь смягчить влияние смещения МНазы и повысить надежность результатов.
Несмотря на свои определенные ограничения, нативный γH2AX ChIP особенно полезен для идентификации генлокусов, в которых определенные загрязнители вызывают повреждение ДНК. Обогащая фрагменты ДНК, связанные с γH2AX, исследователи могут идентифицировать хрупкие участки генома, особенно СХУ, с помощью количественной ПЦР, которые более склонны к разрушению под действием репликационного стресса, вызванного загрязняющими веществами. Этот метод также позволяет исследователям установить прямую связь между воздействием конкретного канцерогена и формированием повреждений ДНК в определенных областях генома, обеспечивая понимание генотоксического профиля загрязнителей и их потенциальной роли в инициировании канцерогенеза43,44.
В таблице поиска и устранения неисправностей (Таблица 3) представлены подробные решения распространенных проблем, возникающих во время анализа ChIP, таких как низкий выход ДНК, недостаточная фрагментация хроматина, высокий уровень фонового шума или плохая производительность антител. Каждый вопрос сопровождается конкретными рекомендациями по обеспечению надежности и воспроизводимости протокола.
Используя автоматизированные системы обработки жидкостей и технологии количественной ПЦР или секвенирования, нативный γH2AX ChIP может эффективно идентифицировать агенты, вызывающие повреждение ДНК, тем самым выступая в качестве ценного инструмента в токсикологических исследованиях и мониторинге окружающей среды. Используя нативный γH2AX ChIP в образцах, полученных от популяций, подвергшихся воздействию различных уровней загрязнителей окружающей среды, исследователи могут идентифицировать конкретные модели повреждения ДНК и определить уровень риска, связанного с воздействием конкретных агентов. В заключение следует отметить, что нативный γH2AX ChIP обладает значительными преимуществами для оценки канцерогенного потенциала загрязнителей окружающей среды, обеспечивая быстрый, экономически эффективный и высокоспецифичный подход к обнаружению повреждений ДНК в конкретных геномных локусах. Его будущее применение в высокопроизводительном скрининге, персонализированной оценке рисков и разработке биомаркеров делает его ценным инструментом для углубления нашего понимания канцерогенеза окружающей среды и разработки стратегий профилактики и вмешательства в рак.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана финансированием стартапа Университета Южного Китая.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 µm nitrocellulose membrane | Amersham | 10600011 | |
| Actin B | proteintech | 20536-1-AP | |
| Aphidicolin | MedChemExpress | HY-N6733 | |
| ChIP-grade magnetic Protein A/G beads | ThermoFisher | 26162 | |
| Clarity Western ECL Substrate | Bio-Rad | #1705061 | |
| Glycogen, molecular biology grade | ThermoFisher | Cat. No. R0561 | |
| HRP-conjugated secondary antibody | proteintech | SA00001-2 | |
| hydroxyurea | MedChemExpress | HY-B0313 | |
| Micrococcal Nuclease | NEB | M0247S | |
| normal IgG | Santa Cruz | sc-2025 | |
| Taq Universal SYBR Green Supermix | BioRad | 1725120 | |
| γH2A.X antibody (for ChIP) | Sigma-Aldrich | 05-636 | |
| γH2A.X antibody (for WB) | Cell Signaling | #25955 |
Ссылки
- Glover, T. W., Berger, C., Coyle, J., Echo, B. DNA polymerase alpha inhibition by aphidicolin induces gaps and breaks at common fragile sites in human chromosomes. Hum Genet. 67 (2), 136-142 (1984).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Hellman, A., et al. A role for common fragile site induction in amplification of human oncogenes. Cancer Cell. 1 (1), 89-97 (2002).
- Kotzot, D., et al. Parental origin and mechanisms of formation of cytogenetically recognisable de novo direct and inverted duplications. J Med Genet. 37 (4), 281-286 (2000).
- Miller, C. T., et al. Genomic amplification of MET with boundaries within fragile site FRA7G and upregulation of MET pathways in esophageal adenocarcinoma. Oncogene. 25 (3), 409-418 (2006).
- Zack, T. I., et al. Pan-cancer patterns of somatic copy number alteration. Nat Genet. 45 (10), 1134-1140 (2013).
- Gao, G., et al. Common fragile sites (CFS) and extremely large CFS genes are targets for human papillomavirus integrations and chromosome rearrangements in oropharyngeal squamous cell carcinoma. Genes Chromosomes Cancer. 56 (1), 59-74 (2017).
- Thorland, E. C., Myers, S. L., Gostout, B. S., Smith, D. I. Common fragile sites are preferential targets for HPV16 integrations in cervical tumors. Oncogene. 22 (8), 1225-1377 (2003).
- Matovina, M., Sabol, I., Grubisić, G., Gasperov, N. M., Grce, M. Identification of human papillomavirus type 16 integration sites in high-grade precancerous cervical lesions. Gynecol Oncol. 113 (1), 120-127 (2009).
- Yu, T., et al. The role of viral integration in the development of cervical cancer. Cancer Genet Cytogenet. 158 (1), 27-34 (2005).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Thavathiru, E., Ludes-Meyers, J. H., MacLeod, M. C., Aldaz, C. M. Expression of common chromosomal fragile site genes, WWOX/FRA16D and FHIT/FRA3B is downregulated by exposure to environmental carcinogens, UV, and BPDE but not by IR. Mol Carcinog. 44 (3), 174-182 (2005).
- Sirbu, B. M., et al. Analysis of protein dynamics at active, stalled, and collapsed replication forks. Genes Dev. 25 (12), 1320-1327 (2011).
- Barlow, J. H., et al. Identification of early replicating fragile sites that contribute to genome instability. Cell. 152 (3), 620-632 (2013).
- Petermann, E., Orta, M. L., Issaeva, N., Schultz, N., Helleday, T. Hydroxyurea-stalled replication forks become progressively inactivated and require two different RAD51-mediated pathways for restart and repair. Mol Cell. 37 (4), 492-502 (2010).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Shanbhag, N. M., Rafalska-Metcalf, I. U., Balane-Bolivar, C., Janicki, S. M., Greenberg, R. A. ATM-dependent chromatin changes silence transcription in cis to DNA double-strand breaks. Cell. 141 (6), 970-981 (2010).
- Stiff, T., et al. ATR-dependent phosphorylation and activation of ATM in response to UV treatment or replication fork stalling. EMBO J. 25 (24), 5775-5782 (2006).
- Nelson, J. D., Denisenko, O., Bomsztyk, K. Fast chromatin immunoprecipitation assay. Nuc Acids Res. 34 (5), e2 (2006).
- Dorbic, T., Wittig, B. Isolation of oligonucleosomes from active chromatin using HMG17-specific monoclonal antibodies. Nuc Acids Res. 14 (8), 3363-3376 (1986).
- Dorbic, T., Wittig, B. Chromatin from transcribed genes contains HMG17 only downstream from the starting point of transcription. EMBO J. 6 (8), 2393-2399 (1987).
- Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. A direct link between core histone acetylation and transcriptionally active chromatin. EMBO J. 7 (5), 1395-1402 (1988).
- Hebbes, T. R., Thorne, A. W., Clayton, A. L., Crane-Robinson, C. Histone acetylation and globin gene switching. Nuc Acids Res. 20 (5), 1017-1022 (1992).
- Hebbes, T. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Core histone hyperacetylation co-maps with generalized DNase I sensitivity in the chicken beta-globin chromosomal domain. EMBO J. 13 (8), 1823-1830 (1994).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trend Biochem, Sci. 25 (3), 99-104 (2000).
- Myers, F. A., Evans, D. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Targeted and extended acetylation of histones H4 and H3 at active and inactive genes in chicken embryo erythrocytes. J Biol Chem. 276 (23), 20197-20205 (2001).
- Litt, M. D., Simpson, M., Recillas-Targa, F., Prioleau, M. N., Felsenfeld, G. Transitions in histone acetylation reveal boundaries of three separately regulated neighboring loci. EMBO J. 20 (9), 2224-2235 (2001).
- Madisen, L., Krumm, A., Hebbes, T. R., Groudine, M. The immunoglobulin heavy chain locus control region increases histone acetylation along linked c-myc genes. Mol Cell Biol. 18 (11), 6281-6292 (1998).
- Clayton, A. L., Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. Histone acetylation and gene induction in human cells. FEBS Lett. 336 (1), 23-26 (1993).
- Tseng, Z., Wu, T., Liu, Y., Zhong, M., Xiao, A. Using native chromatin immunoprecipitation to interrogate histone variant protein deposition in embryonic stem cells. Methods Mol Biol. 1176, 11-22 (2014).
- Durkin, S. G., Glover, T. W. Chromosome fragile sites. Ann Rev Genetics. 41, 169-192 (2007).
- Lee, J. B., Keung, A. J. Chromatin immunoprecipitation in human and yeast cells. Methods Mol Biol. 1767, 257-269 (2018).
- Miyamoto, R., Yokoyama, A. Protocol for fractionation-assisted native ChIP (fanChIP) to capture protein-protein/DNA interactions on chromatin. STAR Protoc. 2 (2), 100404 (2021).
- Mendez, J., Stillman, B. Chromatin association of human origin recognition complex, cdc6, and minichromosome maintenance proteins during the cell cycle: Assembly of prereplication complexes in late mitosis. Mol Cell Biol. 20 (22), 8602-8612 (2000).
- Nowak, D. E., Tian, B., Brasier, A. R. Two-step cross-linking method for identification of NF-κB gene network by chromatin immunoprecipitation. BioTechniques. 39 (5), 715-725 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Lu, X., Parvathaneni, S., Hara, T., Lal, A., Sharma, S. Replication stress induces specific enrichment of RECQ1 at common fragile sites FRA3B and FRA16D. Mol Cancer. 12, 29 (2013).
- Ruijter, J. M., et al. Amplification efficiency: linking baseline and bias in the analysis of quantitative PCR data. Nucl Acids Res. 37 (6), e45 (2009).
- Lyu, X., Chastain, M., Chai, W. Genome-wide mapping and profiling of γH2AX binding hotspots in response to different replication stress inducers. BMC Genomics. 20, 579 (2019).
- Farmer, P. B., et al. Molecular epidemiology studies of carcinogenic environmental pollutants. Effects of polycyclic aromatic hydrocarbons (PAHs) in environmental pollution on exogenous and oxidative DNA damage. Mutat Res. 544 (2-3), 397-402 (2003).
- Phillips, D. H., Arlt, V. M. Genotoxicity: damage to DNA and its consequences. EXS. 99, 87-110 (2009).
- Nitsch, S., Schneider, R. Native ChIP: Studying the genome-wide distribution of histone modifications in cells and tissue. Meth Mol Biol. 2846, (2024).
- Nikitina, T., Wang, D., Gomberg, M., Grigoryev, S. A., Zhurkin, V. B. Combined micrococcal nuclease and exonuclease III digestion reveals precise positions of the nucleosome core/linker junctions: implications for high-resolution nucleosome mapping. J Mol Biol. 425 (11), 1946-1960 (2013).
- Teves, S. S., Henikoff, S. Salt fractionation of nucleosomes for genome-wide profiling. Methods Mol Biol. 833, 421-432 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены