Method Article
לכידת שברי אתרים שבירים נפוצים על ידי γH2A מקורי. X ChIP
In This Article
Summary
אנו מציגים שיטה מהירה ויעילה לאיתור פריצת אתרים שבירים נפוצים באמצעות γH2A.X כרומטין אימונו-משקעים (ChIP). גישה זו מפחיתה משמעותית הן את הזמן והן את העבודה הקשורים למבחני γH2A.X ChIP מסורתיים תוך שמירה על יכולת שחזור ואמינות גבוהה של התוצאות.
Abstract
מתח שכפול הנגרם על ידי חשיפה לגורמים חיצוניים יכול להוביל לשבירות DNA באתרים שבירים נפוצים, שהם אזורים בגנום הידועים כמועדים לחוסר יציבות מבנית. בדיקת γH2A.X כרומטין אימונו-משקעים (ChIP) משמשת ככלי רב עוצמה במחקרי גנוטוקסיות, שכן זרחון γH2A.X הוא סמן מבוסס היטב לשבירות דו-גדיליות של DNA. עם זאת, מבחני γH2A.X ChIP מסורתיים הם לרוב עתירי עבודה וכוללים שלבים מרובים וגוזלי זמן. במחקר זה, אנו מציגים שיטה פשוטה אך יעילה המשלבת פיצול תת-תאי עם ChIP מקורי כדי לבודד קומפלקסים הקשורים ל-γH2A.X. גישה זו מתאימה במיוחד לניתוח אינטראקציות γH2A.X-כרומטין עם ספציפיות ויעילות משופרות. באמצעות פיצול תת-תאי, חומרים לא קשורים לכרומטין מוסרים ביעילות, וכתוצאה מכך חלק כרומטין מטוהר. עיכול מיקרוקוקלי נוקלאז (MNase) לאחר מכן בתנאים מתונים מאפשר פיצול כרומטין תוך שמירה על אינטראקציות פיזיולוגיות בין γH2A.X וקומפלקסי החלבון הקשורים אליו. שימור זה חיוני לחקר שותפי אינטראקציה ילידיים המעורבים במסלולי תגובה לנזק ל-DNA. פרוטוקול ChIP מקורי אופטימלי זה מפחית באופן משמעותי את הזמן והעבודה הקשורים למבחני γH2A.X ChIP קונבנציונליים. ההליך היעיל לא רק מפשט את זרימת העבודה אלא גם מניב תוצאות הניתנות לשחזור גבוה, מה שהופך אותו ליתרון במיוחד בהגדרות שבהן נדרש עיבוד תפוקה גבוהה של מספר דגימות. לשיטה זו יש ישימות רחבה במחקרים המתמקדים ביציבות הגנום, תיקון DNA וביולוגיה של כרומטין, כאשר זיהוי מדויק ויעיל של אתרי נזק ל-DNA הוא קריטי. על ידי שימוש בפרוטוקולים אופטימליים ושלבים יעילים, שיטה זו מאפשרת זיהוי נזק ל-DNA באתרים שבירים עם רגישות משופרת וטיפול מינימלי בדגימה, מה שהופך אותה לכלי רב ערך למחקרים על יציבות הגנום ותגובת נזק ל-DNA.
Introduction
אתרים שבירים נפוצים (CFS) הם אזורים כרומוזומליים גדולים הנמצאים בכל כרומוזום אנושי הנוטים להישבר במהלך המטאפאזה. תחת לחץ שכפול, השכפול באזורים אלה מתעכב משמעותית, ומונע את השכפול המוחלט שלהם לפני כניסה מיטוטית1, מה שמביא בסופו של דבר לפערים ושברים ספציפיים לאתר. CFS הם נקודות חמות לחוסר יציבות כרומוזומלית ומהווים גורם עיקרי לסידור מחדש של כרומוזומים במהלך התפתחות סרטן מוקדמת. מתח שכפול, הקיים לעתים קרובות בתנאים גידוליים, יכול להוביל לאובדן גנים מדכאי גידול ולהגברה של אונקוגנים - המכונים באופן קולקטיבי וריאציה של מספר עותקים (CNV)2,3,4,5,6. בנוסף, CFS נוטים מאוד לאינטגרציה ויראלית, מה שמקדם עוד יותר את התפתחות הסרטן 7,8,9,10. מחיקות הומוזיגוטיות מרובות של גנים מדכאי גידול התגלו באזורי CFS במהלך ניתוחים פאן-סרטניים של גידולים ראשוניים. ה-CFS הנפגעים ביותר בסרטן כוללים FRA2F, FRA3B, FRA4F, FRA5H ו-FRA16D11. CFS פגיעים במיוחד לשבירה בנוכחות גורמים מסרטנים חיצוניים12. כדי להעריך את ההשפעות המסרטנות המזיקות של מזהמים סביבתיים, יש צורך בשיטה מהירה ואמינה לכימות התרחשות שבירת CFS.
זרחון של H2A. X בשאריות סרין 139 (γH2A.X) על ידי Ataxia Telangiectasia and Rad3-Related Protein (ATR) או Ataxia Telangiectasia Mutated (ATM) הוא אירוע מפתח בעצירת מזלג שכפול איתות13. γH2A.X משמש כאינדיקטור למזלגות שכפול תקועים לפני היווצרות שבירה כפולה (DSB)13, ויוצר סביבת כרומטין חיובית כדי להקל על גיוס יעיל של חלבוני תיקון לאתרים תקועים. בנוסף, ניתן לגייס את γH2A.X לאתרי שבירה לאחר קריסת מזלג14,15, בהתאם לתפקידו העיקרי בתיקון DSB. מכיוון שהפסקות CFS קשורות קשר הדוק לסטיות כרומוזומליות המניעות את התקדמות הסרטן, זיהוי שברים אלה יכול להיות חיוני בהבנת השלבים המוקדמים של הגידול. הנוכחות של γH2A.X ב-CFS יכולה לשמש כסמן ביולוגי לאיתור אירועים מוקדמים של חוסר יציבות גנומית. מידע זה יכול לסייע בזיהוי חומרים מסרטנים פוטנציאליים ולהעריך את הסיכון הכרוך בחשיפה לגורמים חיצוניים שונים. על ידי מדידת שבירות DNA ב-CFS הנגרמות על ידי גורמים חיצוניים, כרומטין IP γH2A.X (ChIP) יכול לספק תובנה כיצד חומרים כאלה תורמים למנגנונים העומדים בבסיס הגידול.
ב-ChIP הקונבנציונלי (כלומר, ChIP, X-ChIP), הקשר של γH2A.X עם רצפי ה-DNA היעד שלו מיוצב על ידי קישור צולב פורמלדהיד הפיך. כרומטין נחתך לאחר מכן לשברים של כ-500 זוגות בסיסים (bp) באמצעות סוניקציה, והתמיסה המתקבלת מנוקה מפסולת על ידי שקיעה 16,17,18. לאחר מכן מתווסף נוגדן γH2A.X בדרגת ChIP לחלק הכרומטין המנוקה, ואחריו מוסיפים חרוזי אגרוז של חלבון A/G להעשרה לאזורי כרומטין הקשורים ל-γH2A.X 16,17,18. הקומפלקסים החיסוניים (כלומר, קומפלקס DNA ממוקד חרוזים-נוגדנים-γH2A.X) נשטפים מספר פעמים עם מאגרי כביסה מחמירים כדי להסיר שברי DNA לא קשורים ספציפית 16,17,18. לאחר הכביסה, ה-DNA הקשור במיוחד נפלט מהקומפלקסים החיסוניים. לאחר מכן מתהפכים קישורי הפורמלדהיד, ואחריהם עיכול חלבון באמצעות פרוטאינאז K, ולאחר מכן ה-DNA המועשר מטוהר ומרוכז 16,17,18. כדי להעריך את האזורים הקשורים ל-γH2A.X, נעשה שימוש ב-PCR, PCR כמותי (qPCR) או ריצוף ישיר 16,17,18. התפוסה של γH2A.X באזורים ספציפיים, כגון CFS, נקבעת על ידי עוצמת אות ה-PCR או ה-qPCR, שהיא פרופורציונלית לכמות ה-γH2A.X הקשור באותו מיקום, ומספקת תובנות לגבי נזק ל-DNA ספציפי לאתר ואירועי תיקון 16,17,18.
למרות היותו גישה ניסויית רבת עוצמה, ל-X-ChIP יש מספר מגבלות משמעותיות: (i) הוא דורש מספר רב של תאים, בדרך כלל בטווח של 1 x 107 עד 5 x 107, בשל חוסר היעילות של משקעי הנוגדנים הקשורים לקיבוע, מה שמגדיל את העלות הכוללת של הניסוי19; (ii) תהליך היפוך קישורים צולבים של פורמלדהיד וטיהור ה-DNA שלאחר מכן הוא גוזל זמן ועתיר עבודה, מה שמקשה על שמירה על עקביות ואמינות בתוצאות; ו-(iii) לא ניתן להבחין בין אינטראקציות γH2A.X-DNA בעלות משמעות תפקודית מינורית לבין אלו בעלות משמעות גדולה יותר מכיוון ששלב הקישור הצולב יכול לייצב אינטראקציות חולפות, מה שמוביל לזיהוי אינטראקציות שעשויות להיות לא רלוונטיות מבחינה ביולוגית19.
משקעים חיסוניים של כרומטין מקורי (Native ChIP או N-ChIP) היא טכניקה ביוכימית חיונית המשמשת לחקר אינטראקציות חלבון-DNA בהקשר הכרומטין המקורי שלהם בתנאי מלח פיזיולוגיים. זה היה חיוני בהבהרת הארגון המרחבי והטמפורלי של כרומטין, קשירת גורמי שעתוק ושינויים בהיסטון. ל-ChIP מקורי יש תפקיד ארוך שנים בתחום הרחב יותר של ביולוגיה ואפיגנטיקה של כרומטין, ומספק יתרונות ומגבלות ייחודיים בהשוואה ל-X-ChIP. שיטה זו, שהוצגה בסוף שנות ה-8020, כוללת בידוד של כרומטין מהתאים בשיטות המשמרות את המבנה המקורי שלו, כגון עיכול עם נוקלאז מיקרוקוקלי (MNase)21. זה משמר את המגעים הטבועים בחלבון-DNA והיסטון-DNA, מה שהופך את Native ChIP למתאים במיוחד לחקר שינויים בהיסטון ומיקום נוקלאוזומים בהגדרת הכרומטין הטבעית שלהם22. מחקרי Native ChIP ברזולוציה גבוהה הדגימו את השימוש בעיכול MNase כדי להפחית את הכרומטין לנוקלאוזומים בודדים, מה שמקל על מיפוי שינויים בהיסטון בדיוק רב יותר23. יתר על כן, מכיוון שלא מעורב קישור צולב כימי, הסיכון להכנסת הטיות או חפצים שעלולים לייצג באופן שגוי את אינטראקציות החלבון-DNA ממוזער24.
בניגוד ל-X-ChIP, שבו פורמלדהיד או חומרים צולבים אחרים משמשים לתיקון אינטראקציות חלבון-DNA, Native ChIP מספק תצוגה מציאותית יותר של כרומטין על ידי הימנעות מחפצים צולבים פוטנציאליים. עם זאת, בעוד ש-X-ChIP מתאים יותר בדרך כלל לזיהוי אינטראקציות חולפות או דינמיות בין DNA לחלבונים רגולטוריים25, Native ChIP אידיאלי לאינטראקציות יציבות בין חלבון ל-DNA, כגון היסטונים או חלבונים אחרים הקשורים לכרומטין 26,27. אחת המגבלות שצוינו עבור Native ChIP היא חוסר היכולת ללכוד אירועי קשירה בעלי זיקה נמוכה או חולפת, אשר לעתים קרובות מיוצבים באמצעות קישור צולב ב-X-ChIP25.
גוף עבודה משמעותי באפיגנטיקה מינף את Native ChIP כדי לחשוף שינויים בהיסטונים במסגרות ביולוגיות מגוונות28. מאמצים אלה היו מכריעים בהגדרת קוד ההיסטון - דפוס השינויים בהיסטון המווסתים את ביטוי הגנים ודינמיקת הכרומטין29. למרות ש-H2A. X הוא היסטון מקשר פחות חזק, ה-H2A המקורי. שיטת X ChIP יושמה בהצלחה בתאי גזע עובריים30. במחקר זה, ביצענו אופטימיזציה של הליך מיצוי כרומטין לביצוע ChIP מקורי של γH2A.X בתאי 293T אנושיים (איור 1). הידרוקסיאוריאה ואפידיקולין נמצאים בשימוש נרחב במחקר לחקירת מתח שכפול DNA, נזק וחוסר יציבות גנומית31. במחקר זה, חומרים אלה יושמו על תאים כדי לגרום למתח שכפול וליצור שברי DNA ב-CFS.
באמצעות חומר מוצא של כ-1 x 106 עד 5 x 106 תאים, ניתן לחלק שיטה זו לארבעה שלבים עיקריים: (i) פיצול תת-תאי לבידוד כרומטין, (ii) עיכול מיקרוקוקלי נוקלאז (MNase) לפיצול כרומטין, (iii) משקעים חיסוניים ופליטה, ו-(iv) ניתוח DNA על ידי PCR כמותי (qPCR). ביצוע ChIP לאחר פיצול תת-תאי מספק מספר יתרונות ותועד היטב במחקרים רבים 32,33,34,35. גישה זו מאפשרת הסרה של חלבונים לא קשורים לכרומטין ופסולת תאית אחרת, וכתוצאה מכך חלק כרומטין מטוהר מאוד. על ידי בידוד כרומטין לפני משקעים חיסוניים, פיצול תת-תאי מסייע בשמירה על אינטראקציות כרומטין מקוריות ומפחית רעשי רקע מחלבונים שאינם קשורים לכרומטין, מה שמוביל לתוצאות ספציפיות ואמינות יותר, שכן רק קומפלקסים הקשורים לכרומטין נשמרים לניתוח. יתר על כן, פיצול תת-תאי מאפשר תנאים מתונים יותר לעיכול כרומטין, ובכך משמר אינטראקציות פיזיולוגיות בין חלבון ל-DNA ומציע ייצוג מדויק יותר של דינמיקת הכרומטין בסביבה התאית הטבעית.
שימוש ב-ChIP מקורי של γH2AX למדידת ההשפעה של גורמים חיצוניים על שבירת אתרים שבירים נפוצים טומן בחובו פוטנציאל משמעותי לחקר הסרטן. טכניקה זו מאפשרת לזהות נזק ל-DNA הנגרם מחשיפה לחומרים מסרטנים סביבתיים, ומספקת תובנות לגבי המנגנונים המולקולריים שבאמצעותם מזהמים תורמים לחוסר יציבות גנומית ולהתפתחות סרטן. על ידי שימור הקשר הכרומטין המקורי, שיטה זו מאפשרת הערכה מדויקת של דפוסי נזק ל-DNA הקשורים לחשיפה מסרטנת, ומסייעת בהערכת סיכונים סביבתיים ובחקר גידולים מונעי זיהום.
Protocol
1. קצירת תאים
- זרע כ -5 x 105 תאי HEK 293T לכל אחת מארבע הצלחות בגודל 6 ס"מ, כל אחת מכילה 4 מ"ל של מדיום DMEM שלם.
- לאחר 24 שעות, טפל במנה אחת עם 2 מיקרוליטר של 1 מ"מ אפידיקולין (עיין בטבלת החומרים) תמיסת מלאי (ריכוז סופי של 0.5 מיקרומטר) ומנה נוספת עם 20 מיקרוליטר של 1 מ"מ הידרוקסיאוריאה (עיין בטבלת החומרים) תמיסת מלאי (ריכוז סופי של 5 מ"מ) כדי לגרום למתח שכפול. הוסף DMSO לשתי המנות הנותרות כדי לשמש כבקרות.
- לאחר 24 שעות של טיפול, השליכו את אמצעי התרבית. צלחת אחת של 6 ס"מ מניבה בדרך כלל כ-2 x 106 תאים במפגש של 60%-70%.
- שוטפים כל צלחת פעמיים עם 5 מ"ל קר כקרח 1x PBS. השתמש במגרדי תאים כדי לנתק את התאים ולהעביר את תרחיף התאים לארבעה צינורות בודדים של 1.5 מ"ל. פיפטה בעדינות למעלה ולמטה עם פיפטה P1000 כדי לנתק את כל גושי התאים.
- צנטריפוגה את התאים ב-500 x g למשך 5 דקות ב-4 מעלות צלזיוס, ואז השליכו את הסופרנטנט. הניחו את התאים על קרח.
2. פיצול תת תאי
- השעו מחדש את גלולת התא ב-500 מיקרוליטר של מאגר קר A שהוכן לאחרונה (עיין בטבלה 1), והבטיחו דיסוציאציה מוחלטת של גושי התאים על ידי פיפטינג עדין.
- דגרו את הליזטים על קרח למשך 5-10 דקות. בדוק את התקדמות הליזיס במיקרוסקופ כדי לוודא ליזה תאית מלאה.
- קח מנה קטנה של הליזאט (בסביבות 5 - 10 מיקרוליטר) והנח אותה על שקופית מיקרוסקופ נקייה. מכסים אותו בכיסוי כדי למנוע זיהום.
- השתמש במיקרוסקופ אור עם הגדלה מתאימה (למשל, 20x - 40x) כדי לדמיין תאים או פסולת. השווה עם דגימת בקרה ללא ליזה כדי להבדיל בין תאים שלמים לחומר ליזה.
הערה: לדגימה שעברה ליזה כהלכה לא יהיו קווי מתאר תאים מובחנים, רק כרומטין מפוזר או חומר סלולרי. כוונן את המיקוד כדי להתבונן בבירור בליזאט. במידת הצורך, הפעל כוח מכני במהלך שלב הליזה, כגון שימוש בהומוגנייזר Dounce, בעת עבודה עם סוגי תאים מסוימים.
- צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס, לאחר שהתאים עוברים ליזה מלאה. השליכו בזהירות את הסופרנטנט. השעו מחדש את גלולת הגרעינים ב-500 מיקרוליטר של מאגר קר A באמצעות קצות פיפטה רחבים.
הערה: טיפים רחבים עוזרים למזער את כוחות הגזירה ולהגן על דגימות עדינות כמו כרומטין. צור טיפים רחבים על ידי חיתוך קצה הקצוות הסטנדרטיים עם להב חד. - צנטריפוגה ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. השליכו בזהירות את הסופרנטנט.
- מחממים אינקובטור ל-37 מעלות צלזיוס ומכינים מאגר עצירה (100 מ"מ EDTA, pH 8.0; טבלה 1).
- בצע אופטימיזציה מראש של ריכוזי Micrococcal Nuclease (MNase, עיין בטבלת החומרים) וזמני הדגירה.
- חלקו 40 מיקרוליטר של בדיקת דגימת כרומטין למספר נקודות שוות כדי לבדוק ריכוזי MNase שונים וזמני דגירה.
- השתמש בטווח של ריכוזי MNase (למשל, 0.0625 U, 0.125 U, 0.25 U, 0.5 U, 1 U, 2 U, 4 U, 8 U לכל תגובה) ובדוק זמני דגירה מרובים (למשל, 2, 5, 10 ו-15 דקות).
- הוסף MNase Buffer (עיין בטבלה 1) המכיל ריכוזים שונים של MNase למחירי הכרומטין ודגירה של דגימות ב-37 מעלות צלזיוס בזמנים שצוינו.
- סיים את התגובה על ידי הוספת 1/4 נפח של מאגר עצירה (ריכוז סופי: 20 מ"מ EDTA) מיד לאחר זמן הדגירה הרצוי.
- בודד DNA מדגימות הכרומטין המעוכלות בשיטת מיצוי אלכוהול פנול/כלורופורם/איזואמיל.
- הפעל את הדנ"א המופק על ג'ל אגרוז 1.5% כדי לדמיין דפוסי עיכול: תת-עיכול יראה רצועות משקל מולקולרי גבוהות (איור 2, נתיב 1-4); עיכול יתר יגרום למריחה או לשברים קצרים מאוד (איור 2, נתיב 6-8), ועיכול אופטימלי יניב דפוס סולם נוקלאוזומי ברור (איור 2, נתיב 5, למשל, מונו-, די-, טרי-נוקלאוזומים).
- זהה את התנאים המייצרים את הרזולוציה הנוקלאוזומלית הרצויה ללא עיכול יתר מוגזם.
הערה: CaCl2 פועל כקופקטור לפעילות MNase. ייעל את העיכול על ידי התאמת ריכוז CaCl2 בין 1 מ"מ ל-5 מ"מ.
- השעו בעדינות את הגרעינים השלמים עם 100 מיקרוליטר של MNase Buffer על ידי פיפטינג 5 - 10 פעמים עם קצות פתחים רחבים. הוסף מיד את הכמות שנקבעה מראש של MNase לדגימות (1.25 U MNase / 100 μL MNase Buffer).
הערה: בעת עבודה עם מספר דגימות, עכל כל אחת בנפרד כדי למנוע עיכול יתר. - הנח את הצינורות על מסובב ודגר למשך 5 דקות בחום של 37 מעלות צלזיוס. החזירו מיד את הצינורות לקרח וסיימו את עיכול ה-MNase על ידי הוספת EDTA לריכוז סופי של 20 מ"מ וערבבו על ידי מערבולת.
- הוסף 500 מיקרוליטר של מאגר B (עיין בטבלה 1) לכל דגימה וערבב היטב על ידי פיפטינג למעלה ולמטה פי 5 - פי 10. מסיסים חלבונים על ידי דגירה על קרח למשך 5 דקות.
הערה: המלח וחומר הניקוי ב-Buffer B עוזרים לנתק חלבונים חלשים הקשורים לכרומטין ולחשוף את האפיטופים למשקעים חיסוניים. - גלולה את החומר הבלתי מסיס על ידי צנטריפוגה במהירות מקסימלית למשך 5 דקות ב-4 מעלות צלזיוס. העבירו את הסופרנטנט השקוף לצינורות חדשים של 1.5 מ"ל המסומנים כחלק הכרומטין המקורי. ניתן לאחסן את הדגימות בטמפרטורה של -80 מעלות צלזיוס או להשתמש בהן כדי לאמת את היעילות של פיצול כרומטין.
הערה: הימנע ממחזורי הקפאה-הפשרה תכופים, מכיוון שהם עלולים לשבש אינטראקציות חלבון-DNA מעניינות. צמצם את מחזורי ההקפאה-הפשרה במידת האפשר.
3. אימות פיצול כרומטין
- יש להוציא 10 מיקרוליטר של הסופרנטנט מכל דגימה לתוך שפופרת חדשה של 1.5 מ"ל. יש לערבב עם 20 מיקרוליטר מים מזוקקים ו-30 מיקרוליטר אלכוהול פנול/כלורופורם/איזואמיל (25:24:1).
- סוגרים היטב את הצינורות ומערבולת במרץ למשך 15-30 שניות. צנטריפוגה ב-20,000 x גרם (או המהירות המרבית של הצנטריפוגה) למשך 10 דקות ב-4 מעלות צלזיוס. לאחר הצנטריפוגה נצפו שלוש שכבות נפרדות: שכבה עליונה שקופה, שכבה אמצעית לבנה ושכבה תחתונה צהובה.
- העבירו בזהירות 20 מיקרוליטר מהשלב המימי העליון (המכיל DNA) לצינור טרי. הפרד את ה-DNA המטוהר בג'ל אגרוז 1.5% למשך 30 דקות ב-100 וולט ודמיין את דפוסי העיכול. ודא שגודל שברי הכרומטין הוא בעיקר בין 200 ל-1000 זוגות בסיסים.
הערה: גדלים נכונים של שברי כרומטין הם חיוניים להצלחת ChIP מקורי ותלויים בתנאי הטיפול ב-MNase, כולל יחידות אנזים, זמן הדגירה וריכוז CaCl2. יעילות העיכול של MNase יכולה להשתנות גם בהתאם לסוג התא ומספרו. דפוס פיצול הכרומטין המוצג באיור 2 (נתיב 5) מומלץ עבור בדיקת ChIP זו.
4. משקעים חיסוניים
- יש להוציא 20 מיקרוליטר של כרומטין מעוכל מכל דגימה לתוך צינור טרי של 1.5 מ"ל ולערבב עם 180 מיקרוליטר של מאגר אלוטיון (עיין בטבלה 1). סמן את הצינורות הללו כדגימות קלט ואחסן בטמפרטורה של -20 מעלות צלזיוס.
- העבר 400 מיקרוליטר של דגימת כרומטין לצינור נוסף של 1.5 מ"ל עבור ChIP.
- הוסף נוגדן γH2A.X (עיין בטבלת החומרים) לדגימה אחת שטופלה ב-DMSO, לדגימה אחת שטופלה באפידיקולין ולדגימה אחת שטופלה בהידרוקסיאוריאה. הוסף את אותה כמות של IgG רגיל (עיין בטבלת החומרים) לדגימה אחרת שטופלה ב-DMSO כבקרה שלילית לבדיקת ChIP.
הערה: כאן, 1 מיקרוגרם של נוגדן ראשוני משמש בדרך כלל ל-400 מיקרוליטר של כרומטין (כלומר, הריכוז הסופי של הנוגדן הוא 2.5 מיקרוגרם/מ"ל). עם זאת, יש לקבוע את הכמות האופטימלית באופן אמפירי עבור נוגדנים שונים של γH2A.X. - הנח את צינורות ה-ChIP על מסובב בטמפרטורה של 4 מעלות צלזיוס ודגר למשך 5 שעות לפחות, או רצוי למשך הלילה.
- בינתיים, הכניסו 100 מיקרוליטר של חרוזי חלבון מגנטי A/G בדרגת ChIP (עיין בטבלת החומר) לתוך שפופרת חדשה של 1.5 מ"ל. השתמש בקצות פתחים רחבים ובפיפטה לאט כדי להבטיח מדידה מדויקת של החרוזים. הנח את הצינור על מעמד מגנטי למשך דקה אחת לפחות, ולאחר מכן השליך בזהירות את הנוזל.
- השעו מחדש את החרוזים ב-1 מ"ל של 1x PBS המכיל 0.5% BSA. סובב ב-4 מעלות צלזיוס למשך כ-4 שעות. הנח את הצינור על מעמד מגנטי למשך דקה אחת לפחות והשליך את הסופרנטנט.
- שטפו את החרוזים שוב עם 1 מ"ל של 1x PBS המכיל 0.5% BSA. הנח את הצינור על המעמד המגנטי למשך דקה אחת כדי לגלול את החרוזים המגנטיים, ולאחר מכן השליך את הסופרנטנט.
הערה: שלבים 4.5 עד 4.7 הם ציפוי מקדים של חרוזים כדי להפחית קשירה לא ספציפית של נוגדנים לחרוזים מגנטיים. - השעו מחדש את החרוזים המצופים מראש ב-100 מיקרוליטר של מאגר B באמצעות קצות פתחים רחבים. הוסף 25 מיקרוליטר של מתלה החרוזים המגנטי המצופה מראש לכל צינור דגימת ChIP. סובב בטמפרטורה של 4 מעלות צלזיוס למשך שעתיים.
- הנח את צינורות ה-ChIP על המעמד המגנטי והמתן עד שהחרוזים מחוברים לחלוטין לצד הצינור והתמיסה תתבהר.
- השליכו את הסופרנטנט השקוף מבלי להפריע לחרוזים המגנטיים. השעו מחדש את החרוזים עם 1 מ"ל של מאגר כביסה (עיין בטבלה 1) וסובבו בטמפרטורה של 4 מעלות צלזיוס למשך 10 דקות.
- הנח את הצינורות בחזרה על המעמד המגנטי והמתן עד שהתמיסה תתבהר. השלך את מאגר הכביסה. חזור על הכביסה בסך הכל ארבע כביסות.
- השלך את מאגר הכביסה לאחר הכביסה הסופית וצנטריפוגה קצרה את הצינורות ב-400 x גרם למשך 30 שניות ב-4 מעלות צלזיוס כדי לסובב כל נוזל שנותר. הנח את הצינורות בחזרה על המעמד המגנטי והסר בזהירות את כל הנוזלים שנותרו מתחתית הצינור.
5. סילוק ומשקעי DNA
הערה: יעילות הנוגדנים עשויה להשתנות בין קבוצות שונות. חשוב לאשר את זיקת הקישור של נוגדן חדש על ידי בדיקת הדגימות המשקעות את מערכת החיסון באמצעות ניתוח כתמים מערביים.
- ודא את יעילות המשיכה של נוגדני ChIP באמצעות כתם מערבי (WB) כמתואר להלן.
- קח מנה קטנה של דגימת ChIP לניתוח (כלומר, בדרך כלל 10% מדגימת ה-ChIP). כלול כרומטין קלט (טרום משקעים חיסוניים) ובקרה שלילית (למשל, משיכת IgG) להשוואה.
- יש לסלק חלבונים מהחרוזים הקשורים לנוגדנים על ידי חימום ב-20 מיקרוליטר של מאגר טעינה 1x SDS-PAGE (עיין בטבלת החומרים) ב-95 מעלות צלזיוס למשך 5 דקות.
- טען את דגימות ה-IP, הקלט והבקרות על ג'ל SDS-PAGE של 15%. הפעל את הג'ל.
- העבירו את החלבונים לניטרוצלולוז של 0.2 מיקרומטר (עיין בטבלת החומר) או לממברנת PVDF באמצעות מערכת העברה רטובה או יבשה למחצה.
- חסום את הממברנה עם חלב דל שומן 5% או BSA ב-TBST (עיין בטבלה 1) למשך שעה בטמפרטורת החדר כדי למנוע קשירה לא ספציפית.
- דגרו את הממברנה עם הנוגדן העיקרי כנגד γH2A.X (עיין בטבלת החומרים) מדולל במאגר חוסם למשך 1-2 שעות בטמפרטורת החדר או לילה ב-4 מעלות צלזיוס.
- שטפו את הממברנה פי 3 עם TBST כדי להסיר נוגדנים לא קשורים. דגרו את הממברנה עם נוגדן משני מצומד HRP (עיין בטבלת החומרים) למשך שעה אחת בטמפרטורת החדר. שטפו שוב את הממברנה כדי להסיר עודפי נוגדנים משניים.
- פתח את הממברנה באמצעות מצע כימילומינסנט ודמיין את האות באמצעות הדמיה. השווה את עוצמת האות בין נתיבי ה-IP, הקלט והבקרה כדי להעריך את היעילות והספציפיות של המשיכה.
הערה: רצועה המתאימה לחלבון המטרה בנתיב ה-IP מאשרת משיכה מוצלחת של נוגדנים. גישה זו מבטיחה שתוכל להעריך את יעילות הנוגדן בלכידת חלבון המטרה במהלך ניסוי ה-ChIP.
- הוסף 50 מיקרוליטר של מאגר סילוק (עיין בטבלה 1) לכל אחת מדגימות ה-ChIP הנותרות. מניחים את הצינורות על תרמו-מערבל ומנערים במשך 15 דקות בטמפרטורת החדר.
- הנח את הצינורות על המחזיק המגנטי למשך דקה אחת לפחות. אסוף את האלוט לצינורות חדשים. חזור על הפעולה פי 1 ואסוף את האלוט באותם צינורות.
- הוסף עוד 100 מיקרוליטר של מאגר אלוטיון לכל דגימת פליטה של ChIP ו-180 מיקרוליטר של מאגר פליטה לכל דגימת קלט.
- הוסף 200 מיקרוליטר של אלכוהול פנול/כלורופורם/איזואמיל (25:24:1) לכל דגימה ומערבולת במרץ. צנטריפוגה את הדגימות ב-20,000 x g (או מהירות מקסימלית) למשך 10 דקות ב-4 מעלות צלזיוס.
- הוסף 19 מיקרוליטר של נתרן אצטט 3M (NaOAc, pH 5.2; עיין בטבלה 1) ו-2 מיקרוליטר של תמיסת גליקוגן (20 מ"ג/מ"ל, עיין בטבלת החומר) לכל צינור צנטריפוגה חדש של 1.5 מ"ל.
- לאחר הצנטריפוגה, העבירו בזהירות את השכבה המימית העליונה (כ-190 מיקרוליטר) לצינורות המכילים NaOAc וגליקוגן וערבבו על ידי מערבולת.
- הוסף 500 מיקרוליטר של 100% אתנול ומערבולת. זרז את ה-DNA על ידי דגירה של הדגימות ב-20 מעלות צלזיוס למשך שעתיים לפחות או לילה.
- צנטריפוגה את הצינורות ב-20,000 x g (או מהירות מקסימלית) למשך 10 דקות ב-4 מעלות צלזיוס. השליכו את הסופרנטנט, והקפידו לא להפריע לכדור הלבן. השעו מחדש את הגלולה ב-1 מ"ל של 70% אתנול ומערבולת ביסודיות.
- צנטריפוגה את הצינורות ב-20,000 x g (או מהירות מקסימלית) למשך 5 דקות ב-4 מעלות צלזיוס. הסר בזהירות את הסופרנטנט. צנטריפוגה קצרה את הצינורות שוב כדי לסובב כל אתנול שנותר. הסר בזהירות את האתנול באמצעות פיפטה P20. יבש את כדורי ה- DNA באוויר למשך 2-3 דקות.
הערה: הימנע מייבוש יתר של הגלולה, מכיוון שהדבר עלול להקשות על המסת ה-DNA מחדש. - עבור דגימות ChIP, השעו מחדש את ה-DNA ב-400 מיקרוליטר של מאגר TE (עיין בטבלה 1). עבור קלט DNA, השעו מחדש ב-1000 מיקרוליטר של מאגר TE. כעת ניתן לאחסן את הדגימות המנומקות בטמפרטורה של -20 מעלות צלזיוס.
6. כימות qPCR
- בצע qPCR באמצעות ערכה מסחרית (עיין בטבלת החומרים) עם משולשים טכניים עבור כל דגימה. אשר את נוכחותו של מוצר PCR ספציפי יחיד על ידי ביצוע ניתוח עקומת התכה כדי להבטיח את הספציפיות של הגברה36.
- ניתוח נתונים
הערה: בניתוח כימות יחסי, דגימת הבדיקה מתבטאת כשינוי קיפול ביחס לדגימת בקרה (משקעים חיסוניים באמצעות IgG מטוהר רגיל או IP מדומה). מיקומי DNA הידועים כלא מאוכלסים על ידי החלבון המשקע החיסוני (לוקוס שלילי) יכולים לשמש באופן זה כגן ייחוס בהשוואה למיקומי DNA ידועים, תפוסים וחיוביים36.- חשב את אחוז הקלט עבור כל ChIP באמצעות הנוסחה שלהלן
%קלט = 2(-ΔCt [ChIP מנורמל]) - נרמל את ערכי ΔCt של הלוקוס החיובי למיקום שלילי (ΔΔCt) על ידי הפחתת ערך ה-ΔCt שהתקבל עבור הלוקוס החיובי מערך ΔCt עבור הלוקוס השלילי באמצעות הנוסחה שלהלן
(ΔΔCt = ΔCtpositive - ΔCtnegative) - חשב את העשרת הקיפול של רצף הלוקוס החיובי ב-ChIP DNA על פני הלוקוס השלילי באמצעות הנוסחה שלהלן
העשרת קיפול = 2ΔΔCt
הרצפים של פריימרים qPCR המשמשים לניתוח מסופקים בטבלה 2. הארגון הגנומי של FRA3B ו-FRA16D37מתואר באיור 3A,B.
- חשב את אחוז הקלט עבור כל ChIP באמצעות הנוסחה שלהלן
- ניתוח סטטיסטי
- נתח את התוצאות באופן סטטיסטי באמצעות מבחן t הזוגי של הסטודנט. ערך p של ≤0.05 נחשב למובהק סטטיסטית, מה שמצביע על כך שההבדלים שנצפו לא סבירים לנבוע משונות אקראית38.
תוצאות
גודלם של שברי הכרומטין הוא קריטי להצלחת Native ChIP, מכיוון שהוא משפיע ישירות על הנגישות של אזורי DNA לקשירת נוגדנים. כדי לקבוע את ריכוז ה-MNase האופטימלי לפיצול כרומטין, הכנו סדרה של צינורות מיקרו-צנטריפוגה המכילים ריכוזים משתנים של MNase (כלומר, 0.0625 U, 0.125 U, 0.25 U, 0.5 U, 1 U, 2 U, 4 U, 8 U לכל תגובה) ו-40 מיקרוליטר של גרעינים מבודדים. כל תגובה הודגרה ב-37 מעלות צלזיוס למשך 5 דקות כדי להשיג טווח של גדלי שברי כרומטין. תוצאות עיכול ה-MNase מוצגות באיור 2.
כפי שמוצג באיור 2, ריכוזים גבוהים יותר של MNase הובילו לעיכול נרחב יותר של כרומטין, וכתוצאה מכך דומיננטיות של שברי מונו-נוקלאוזום (איור 2, נתיבים 1, 2 ו-3). לעומת זאת, בריכוזי MNase נמוכים יותר, רוב שברי הכרומטין היו גדולים יותר, לעתים קרובות יותר מ-1 קילו-בייט (איור 2, נתיבים 6, 7 ו-8), מה שמעיד על עיכול לא מספיק ליישומים במורד הזרם. עם ריכוז MNase של 1.6 יחידות וזמן עיכול של 5 דקות, השגנו שברי כרומטין בעיקר בטווח של 200 עד 1000 זוגות בסיסים (איור 2, נתיב 5). גודל שבר זה אידיאלי עבור ChIP מקורי, מכיוון שהוא מבטיח העשרה יעילה של DNA הקשור לכרומטין תוך שמירה על נגישות לאפיטופים ספציפיים. גודל השבר המתאים מאפשר משקעים חיסוניים יעילים וניתוח במורד הזרם, כגון PCR כמותי או ריצוף, מה שהופך אותו למתאים לזיהוי אינטראקציות חלבון-DNA ברזולוציה גבוהה.
זיקת הקישור של הנוגדן היא גורם קריטי להצלחת Native ChIP. הבטחת הנוגדן נקשר ביעילות ובאופן ספציפי לאפיטופ המטרה שלו חיונית להשגת תוצאות אמינות. לכן, חשוב לוודא מראש את יעילות הקישור של הנוגדן. כדי לאשר את היעילות של γH2A.X, ערכנו בדיקת כתם מערבי (WB).
השווינו את רמות γH2A.X בין תאים שטופלו ב-DMSO (ביקורת), תאים שטופלו באפידיקולין ותאים שטופלו בהידרוקסיאוריאה (סטרוקסיאוריאה) באמצעות Western Blotting. כפי שמוצג באיור 4A (קלט), רמות γH2A.X היו גבוהות משמעותית בתאים שטופלו באפידיקולין בהשוואה לתאים שטופלו ב-DMSO. עלייה זו ב-γH2A.X עולה בקנה אחד עם השראת מתח השכפול על ידי אפידיקולין, מה שמוביל להיווצרות שבירה מוגברת של גדיל כפול ולזרחון γH2A.X לאחר מכן. לאחר ביצוע ChIP, אימתנו את הספציפיות של המשקעים החיסוניים על ידי השוואת העשרת γH2A.X בבקרת IgG ודגימות γH2A.X IP. בקרת ה-IgG לא משכה כלפי מטה שום γH2A.X הניתן לזיהוי, מה שמצביע על קישור מינימלי לא-ספציפי (איור 4B, N-ChIP ו-X-ChIP). לעומת זאת, דגימת γH2A.X IP העשירה בהצלחה γH2A.X מהתאים שטופלו באפידיקולין, והדגימה קשירה יעילה וספציפית של הנוגדן ל-γH2A.X (איור 4, N-ChIP ו-X-ChIP). תוצאות אלו מאשרות כי לנוגדני γH2A.X יש זיקה וספציפיות מספקות לשימוש בניסויי ChIP מקוריים, מה שמאפשר זיהוי והעשרה אמינים של אזורי כרומטין הקשורים ל-γH2A.X. שלב אימות זה חיוני כדי להבטיח את האיכות והדיוק של ניתוחי ChIP הבאים.
השתמשנו באתרים השבריריים הנפוצים (CFS) FRA16D ו-FRA3B כדי להעריך את הספציפיות של קשירת γH2A.X ל-DNA בתגובה ללחץ שכפול. FRA16D ו-FRA3B הם אזורי CFS ידועים המועדים לאי-יציבות בתנאים של מתח שכפול, מה שהופך אותם למועמדים אידיאליים לאימות אינטראקציות γH2A.X/DNA. איור 3A,B ממחיש את הארגון הגנומי של שני CFS אלה, יחד עם פריימרים qPCR ספציפיים המשמשים לניתוח.
כדי לקבוע אם γH2A.X מתקשר לאזורי CFS אלה בתגובה ללחץ שכפול, ביצענו ניתוח ChIP-qPCR בביקורת (מטופל ב-DMSO), תאים שטופלו באפידיקולין ותאים שטופלו בהידרוקסיאוריאה. תוצאות ה-qPCR הראו כי בתאי הבקרה שטופלו ב-DMSO, γH2A.X לא הועשר במיקומי FRA16D או FRA3B, מה שמרמז על היעדר נזק משמעותי ל-DNA או מתח שכפול באזורים אלה (איור 3C). עם זאת, בתאים שטופלו באפידיקולין או הידרוקסיאוריאה, הגורמים למתח שכפול על ידי עיכוב DNA פולימראז, ראינו העשרה משמעותית של γH2A.X הן ב-FRA16D והן ב-FRA3B (איור 3C). זה מצביע על כך ש-γH2A.X גויס לאזורי CFS אלה במיוחד בתגובה ללחץ שכפול DNA. ממצאים אלה מדגימים כי התפוסה של γH2A.X ב-CFS מופעלת על ידי מתח שכפול, התומך בתפקידו כסמן של תגובת נזק ל-DNA ועצירת מזלג השכפול. הגיוס הספציפי של γH2A.X ל-FRA16D ו-FRA3B במהלך הטיפול באפידיקולין מאמת עוד יותר את הספציפיות של בדיקת ה-ChIP שלנו ומאשר ש-γH2A.X הוא אינדיקטור אמין לנזק ל-DNA ומתח שכפול באתרים שבירים.
כדי להשוות את היעילות של ChIP מקורי עם ChIP מקושר (X-ChIP), ביצענו γH2A.X X-ChIP תוך שימוש באותו מספר התחלתי של תאים, בהתאם לפרוטוקול שתואר על ידי Lyu et al.39. גיוס γH2A.X ל-FRA16D גדל על ידי טיפול באפידיקולין והידרוקסיאוריאה, כפי שמוצג באיור 3D. עם זאת, ההעשרה היחסית של γH2A.X ב-FRA16D ב-X-ChIP הייתה נמוכה באופן ניכר מזו שנצפתה עם ChIP מקורי, מה שמעיד על יעילות מופחתת של X-ChIP בתנאים אלה. יתר על כן, ב-FRA3B, העלייה בהעשרת γH2A.X הייתה חסרת משמעות סטטיסטית, מה שמספק ראיות נוספות לכך ש-X-ChIP פחות יעיל בעבודה עם מספר מוגבל של תאים. תוצאות אלו מצביעות על כך ש-ChIP מקורי עשוי להתאים יותר לזיהוי העשרת γH2A.X באתרים שבירים כאשר גודל המדגם מוגבל. נתח את התוצאות באופן סטטיסטי באמצעות מבחן t הזוגי של הסטודנט. ערך p של ≤ 0.05 נחשב למובהק סטטיסטית.

איור 1:זרם W עבור ביצוע בדיקת ChIP מקורית γH2A.X. (i) תאים עוברים תרבית ונתונים לטיפולים ספציפיים (למשל, חומרים מזיקים ל-DNA כמו הידרוקסיאוריאה) כדי לגרום לאיתות γH2A.X. (ii) תאים מטופלים נאספים לעיבוד. (iii) התאים מחולקים כדי לבודד את γH2A.X הקשור לכרומטין, ולהפריד אותו מרכיבים תאיים אחרים. (iv) עיכול נוקלאז מיקרוקוקלי (MNase) מתבצע כדי לפצל את הכרומטין לחתיכות בגודל נוקלאוזום. (v) גודל שברי הכרומטין מאומת על ידי הפעלת דגימה על ג'ל אגרוז, מה שמבטיח שהשברים יהיו באורך המתאים ל-ChIP. (vi) נוגדן ספציפי ל-γH2A.X משמש לזריזות חיסונית של שברי כרומטין המסומנים על ידי γH2A.X. (vii) חרוזי חלבון A/G משמשים למשיכת קומפלקסים של נוגדנים-כרומטין, ומעשירים את ה-DNA הקשור ל-γH2A.X. (viii) שברי ה-DNA המסומנים ב-γH2A.X נפלטים ומטוהרים, ומכינים אותם לניתוחים במורד הזרם. (ix) ניתוח במורד הזרם: qPCR וריצוף וניתוח נתונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: בדיקה לאופטימיזציה של מצב העיכול של MNase. שברי כרומטין הוכנו מתאי HEK 293T תוך שימוש בתנאי עיכול משתנים של MNase. ה-DNA המטוהר שהתקבל מהכרומטין המקוטע הופרד על ג'ל אגרוז 2% והופעל ב-100 וולט למשך 30 דקות. נתיבים 1 עד 8 מייצגים דגימות שטופלו בריכוזים הולכים וגדלים של MNase (כלומר, 0.0625 U, 0.125 U, 0.25 U, 0.5 U, 1 U, 2 U, 4 U, 8 U לכל תגובה), המדגימים שיפוע של עיכול כרומטין. סולם ה-DNA (המסומן על ידי M) נכלל לצורך התייחסות לגודל. שברי DNA הודגמו באמצעות תמיסת צביעת DNA של Midori Green Advance. הרצועה המסומנת תואמת לשברי DNA בגודל מונו-נוקלאוזום, מה שמדגיש את יעילות העיכול בכל ריכוז MNase. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
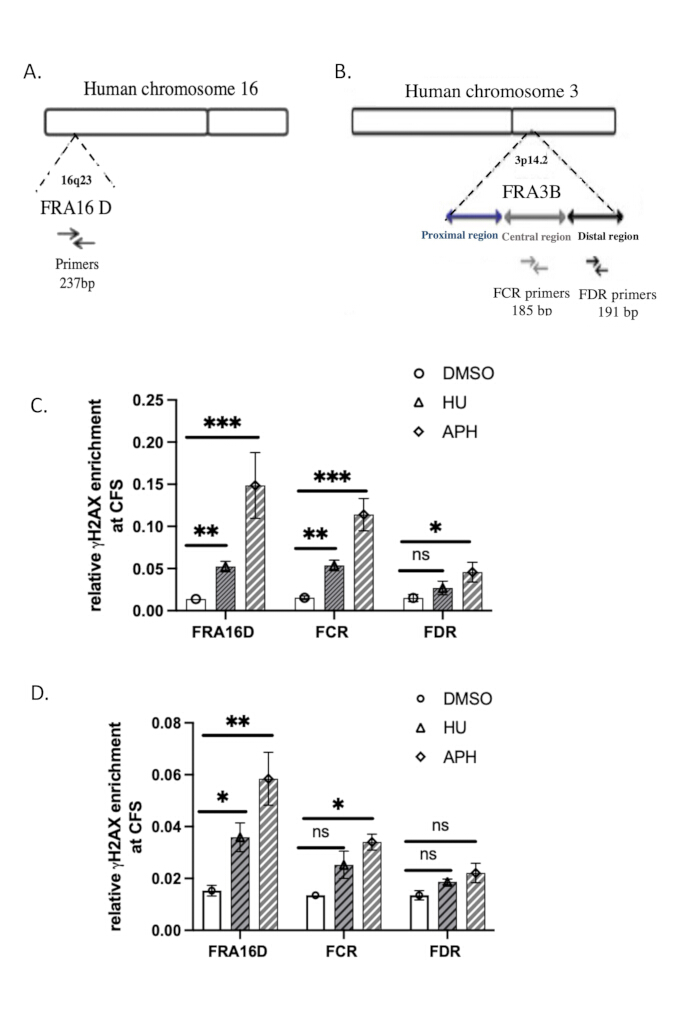
איור 3: אימות qPCR של γH2A.X ChIP. (A) תרשים של ארגונים גנומיים של FRA16D. (B) דיאגרמה של ארגונים גנומיים של אזור FRA3B. ערכות פריימר המשמשות לניתוחי qPCR של אזורים FRA16D, דיסטליים (FDR) ומרכזיים (FCR) בתוך לוקוס FRA3B. (C) ההעשרה היחסית של γH2A.X באתרים שבירים נפוצים (CFS), במיוחד FRA3B ו-FRA16D, הוערכה באמצעות ChIP מקורי ואחריו ניתוח qPCR לאחר טיפול באפידיקולין והידרוקסיאוריאה. (D) ההעשרה היחסית של γH2A.X באתרים שבירים נפוצים (CFS), במיוחד FRA3B ו-FRA16D, הוערכה באמצעות X-ChIP ואחריו ניתוח qPCR לאחר טיפול באפידיקולין והידרוקסיאוריאה. מציין תוצאה מובהקת סטטיסטית עם P < 0.001; ** מציין p < 0.01 ו- * מציין p < 0.05, שנקבע על ידי מבחן t; n = 3. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
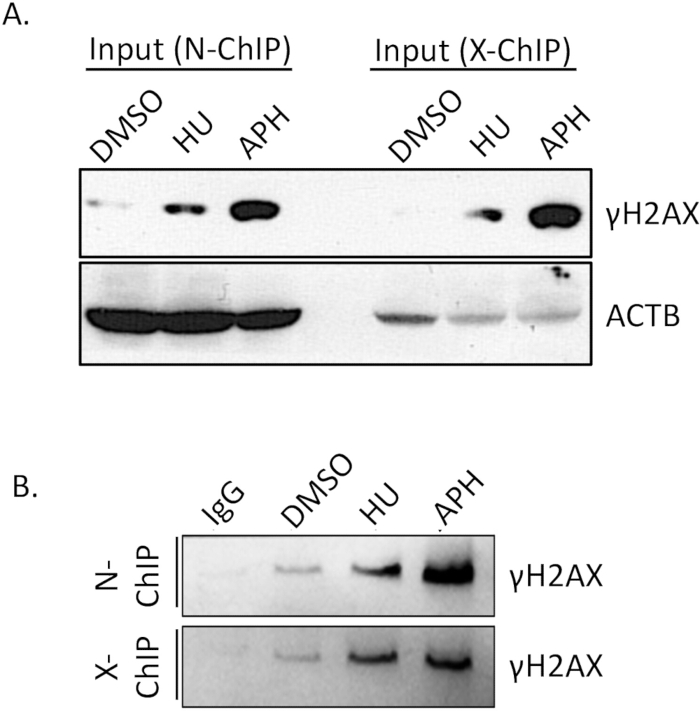
איור 4: אימות יעילות המשיכה של נוגדני ChIP באמצעות Western Blot. מתוך הדגימה הכוללת, 10% מדגימת ה-ChIP, יחד עם בקרות קלט, הופרדו על ג'ל SDS-PAGE של 15% כדי לפתור את הפוליפפטידים. לאחר האלקטרופורזה, החלבונים המופרדים הועברו לקרום PVDF של 0.22 מיקרומטר באמצעות פרוטוקול העברה סטנדרטי. לאחר מכן הממברנה נבדקה ברצף עם נוגדן ראשוני ספציפי המכוון ל-γH2A.X ו-ACTB, ואחריו נוגדן משני מצומד HRP מתאים. האות הוצג לאחר מכן באמצעות זיהוי כימילומינסנציה, מה שמאפשר להעריך את ספציפיות הנוגדנים ויעילות המשיכה בבדיקת ה-ChIP. (A) רמות γH2A.X בין תאים שטופלו ב-DMSO (בקרה), תאים שטופלו באפידיקולין ותאים שטופלו בהידרוקסיאוריאה (בלחץ שכפול) עם ACTB כבקרת הטעינה. (B) העשרת γH2A.X בבקרת IgG ובדגימות IP. קיצורים: APH = אפידיקולין, HU = הידרוקסיאוריאה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מאגר A (1X) | |
| מגיב | ריכוז עבודה |
| צינורות pH 6.8 | 10 מ"מ |
| NaCl | 100 מ"מ |
| MgCl2 | 3 מ"מ |
| EGTA pH 7.6 | 1 מ"מ |
| יש לאחסן בטמפרטורה של -20 מעלות צלזיוס למשך עד שנה | |
| מאגר MNase (1X) | |
| מגיב | ריכוז עבודה |
| Tris-HCl, pH 7.5 | 50 מ"מ |
| CaCl2 | 1 מ"מ |
| MgCl2 | 4 מ"מ |
| יש לאחסן בטמפרטורה של -20 מעלות צלזיוס למשך עד שנה | |
| בופר B (1X) | |
| מגיב | ריכוז עבודה |
| נתרן פוספט pH 7. 0 | 20 מ"מ |
| נתרן פירופוספט10. ח2א | 30 מ"מ |
| KCl | 250 מ"מ |
| EDTA, pH 8.0 | 5 מ"מ |
| גליצרול | 10% |
| טריטון X-100 | 0.10% |
| קוקטייל מעכב פרוטאז | 1x |
| קוקטייל מעכב פוספטאז | 1x |
| DTT | 0.5 מ"מ |
| יש לאחסן בטמפרטורה של -20 מעלות צלזיוס למשך עד שנה | |
| מאגר סילוק | |
| מגיב | ריכוז עבודה |
| נהקו3 | 50 מ"מ |
| SDS | 1% |
| מוכן טרי | |
| מאגר כביסה | |
| מגיב | ריכוז עבודה |
| מאגר MNase | פי 0.5 |
| מאגר B | פי 0.5 |
| טרי מוכן | |
| עצור מאגר | |
| EDTA | 100 מ"מ , pH8.0 |
| 3 M נתרן אצטט , pH 5.2 | |
| 408.24 גרם נתרן אצטט | |
| pH עם חומצה אצטית ל-pH 5.2 | |
| כוונון עוצמת הקול ל- 1 ליטר | |
| עיקור המאגר על ידי סינון או חיטוי | |
| מאגר TBST | |
| בסיס טריס, pH 8.0 | 10 מ"מ |
| NaCl | 150 מ"מ |
| טווין 20 | 0.1% (אנכי/אנכי) |
| חוצץ TE | |
| Tris-HCl, pH 8.0 | 10 מ"מ |
| EDTA, pH 8.0 | 1 מ"מ |
טבלה 1: הרכב המאגר.
| מיקומי גנים | פריימר קדימה | פריימר הפוך |
| FRA16D | TCCTGTGGAAGGGATATTTA | CCCCTCATATTCTGCTTCTA |
| FRA3B | TGTTGGAATGTTAACTCTATCCCAT | ATATCTCATCAAGACCGCTGCA |
| FCR | ||
| FRA3B | CAATGGCTTAAGCAGACATGGT | AGTGAATGGCATGGCTGGAATG |
| רוזוולט | ||
| ACTB (שליטה שלילית) | GACGCAGGATGGCATGGG | ACGCCTCTGGCCGTACCAC |
טבלה 2: רצף פריימר.
| התאוששות נמוכה של DNA | בעיה פוטנציאלית | פתרון אפשרי |
| איכות ירודה של נוגדנים | השתמש בנוגדנים בדרגת ChIP. | |
| נוגדן לא מספיק | השתמש ב-1-10 מיקרוגרם של נוגדן ChIP לכל 25 מיקרוגרם כרומטין. | |
| זמן דגירה לא מספיק | בצע את שלב המשקעים החיסוני למשך הלילה בטמפרטורה של 4 מעלות צלזיוס. | |
| שטיפות מחמירות מדי | אין להשתמש בריכוז של NaCl הגבוה מ-500 מ"מ במאגר הכביסה. | |
| חרוזים באיכות נמוכה | ודא שחלבון A או G תואם לנוגדני ChIP. | |
| עקוב אחר גיליון הנתונים של מוצר החרוזים לנפח אופטימלי של יחס חרוזים לנוגדנים. | ||
| התחלה לא מספקת | הכן לוח תאים נפרד כדי לקבוע במדויק את מספר התא. | |
| לדוגמה | הגדל את מספר התאים בשימוש אם היעד הוא שפע נמוך. | |
| ליזה תאית לא מספקת | בצע אופטימיזציה של הרכב המאגר וזמן הליזיס כדי לשפר את היעילות. | |
| הפעל כוח מכני במהלך שלב הליזיס, כגון שימוש בהומוגנייזר Dounce, בעת עבודה עם סוגי תאים מסוימים. | ||
| התרחשה השפלה של גרעינים | ודא שבידוד הגרעינים עדין כדי לשמור על שלמות הכרומטין ונגישותו. | |
| השתמש בקצות פיפטות רחבות כדי למזער את גזירת הגרעינים במהלך הטיפול. | ||
| התרחשה השפלה של הדגימה | בצע את כל השלבים על קרח או בטמפרטורה של 4 מעלות צלזיוס. | |
| כלול מעכבי פרוטאז בכל המאגרים וודא שכל המאגרים מוכנים טריים. | ||
| עיכול MNase לא מספיק | טיטרט את ריכוז ה-MNase (למשל, 0.1-5 יחידות) כדי לקבוע את הכמות האופטימלית לסוג דגימה ספציפי; ולהתחיל עם טווח ריכוזים כדי לזהות את תנאי העיכול האידיאליים. | |
| MNase עיכול יתר | התנסה בזמני דגירה שונים (למשל, 1-10 דקות) ב-37 מעלות צלזיוס ועקוב אחר דפוס הפיצול כדי להבטיח עיכול מספיק ללא עיכול יתר. | |
| זרחון משובש | הוסף קוקטייל מעכב פוספטאז למאגר הליזיס, וודא שכל המאגרים מוכנים טריים. | |
| רקע גבוה בשליטה שלילית | כריכה לא ספציפית לחרוזים | כלול שלב ניקוי מקדים לפני שלב המשקעים החיסוניים, והשתמש בחרוזים מגנטיים בדרגת ChIP, שבדרך כלל מציגים קשירה לא ספציפית מופחתת. |
| כביסה לא מספקת | הגדל את מספר הכביסה או את חומרת הכביסה על ידי התאמת ריכוז המלח וחומרי הניקוי. | |
| פיצול לא מספיק של כרומטין | בצע אופטימיזציה של פיצול כדי להשיג שברים של 200-750 bp. | |
| אופטימיזציה נחוצה לכל סוג תא או רקמה | ||
| פתרון בעיות PCR | אין הגברה של דגימת קלט | (1) מקוטע יתר על המידה: האות מצטמצם עבור אמפליקונים של מעל 150 bp אם הכרומטין מפוצל לאורך מונו-נוקלאוזום. |
| (2) אופטימיזציה של תנאי PCR. | ||
| (3) תכנן פריימרים כדי להגביר אזור קטן יותר (<150 bp). | ||
| רזולוציה נמוכה | גודל שבר הדנ"א גדול מדי | בצע אופטימיזציה של פיצול כדי להשיג שברים של 200-750 bp. |
טבלה 3: פתרון בעיות של כרומטין.
Discussion
זיהום סביבתי הוא תורם משמעותי לסרטן בבני אדם. מזהמים רבים הם מסרטנים, כלומר הם עלולים לגרום לנזק גנטי שמוביל להתפתחות סרטן 40,41. עם זאת, קביעה אם חומר מסוים הוא גידולי היא משימה מאתגרת. שיטה מהירה, אמינה וחסכונית לזיהוי פוטנציאל מסרטן תאפשר למדענים לסנן ביעילות מזהמים סביבתיים ולהעריך את השפעתם על היציבות הגנומית. במחקר זה, אנו מתמקדים בווריאנט היסטון שונה, γH2A.X, המוכר באופן נרחב כסמן ספציפי ביותר ל-DSBs. γH2A.X נוצר כאשר וריאנט ההיסטון H2A. X עובר זרחן בסרין 139 בתגובה לנזק ל-DNA.
על ידי זיהוי נוכחות של γH2A.X על ידי ChIP מקורי ב-CFS, אנו יכולים להעריך ביעילות את היקף הנזק ל-DNA שנגרם על ידי מזהמים סביבתיים42. היכולת למדוד כמותית γH2A.X ב-CFS מספקת דרך מהירה, רגישה ואמינה להעריך את הפוטנציאל של מזהמים סביבתיים לגרום להשפעות גידוליות. בניגוד למבחני גנוטוקסיות מסורתיים, המודדים לעתים קרובות סמנים עקיפים של נזק ל-DNA (כגון מוטציות, היווצרות מיקרו-גרעין או טרנספורמציה תאית), γH2AX ChIP מקורי מאפשר מיפוי מדויק של אירועי שבירה באתרים גנומיים ספציפיים42. זה מספק הבנה מעמיקה יותר של האזור הפגיע ביותר למזהמים סביבתיים ומסייע בזיהוי מנגנונים מסרטנים פוטנציאליים.
ChIP מקורי מוצלח דורש תשומת לב קפדנית למספר שלבים קריטיים כדי להבטיח העשרה יעילה של אזורי יעד. להלן השלבים הקריטיים הכרוכים ב-ChIP המקורי של γH2AX. הכנת תאים: התחל עם מספר מתאים של תאים. טפל בתאים עם חומר הגורם לנזק ל-DNA, כגון אפידיקולין, כדי לגרום למתח שכפול כבקרה חיובית. כלול דגימות בקרה שליליות מתאימות שלא טופלו להשוואה. בידוד כרומטין: בצע פיצול תת-תאי כדי לבודד חלבונים הקשורים לכרומטין תוך מזעור זיהום מרכיבים ציטופלזמיים. אופטימיזציה של MNase: ערכו ניסויי פיילוט כדי לייעל את ריכוז המיקרוקוק נוקלאז (MNase) וזמן הדגירה. המטרה היא להשיג שברי כרומטין בין 200-1000 זוגות בסיסים, מה שמבטיח רזולוציה טובה ל-ChIP תוך שמירה על שלמות הנוקלאוזום. משקעים חיסוניים: השתמש בנוגדני γH2AX באיכות גבוהה בדרגת ChIP יחד עם חלבון A/G אגרוז כדי להבטיח משיכה יעילה של כרומטין המטרה תוך מזעור קשירה לא ספציפית. כביסה: שטפו את החרוזים עם מאגר המכיל את הריכוז המתאים של מלח וחומר ניקוי כדי להסיר אינטראקציות לא ספציפיות תוך שמירה על הכרומטין הקשור ל-γH2AX. סילוק ושחזור DNA: שחזור יעיל של הכרומטין הקשור על ידי פליטה ומשקעים יסודיים של DNA, מה שמבטיח אובדן מינימלי של כרומטין המטרה המועשר. בהשוואה ל-X-ChIP קונבנציונלי, ישנם ארבעה יתרונות עיקריים של γH2AX ChIP מקורי. ראשית, שילוב פיצול תת-תאי מפחית אינטראקציות חיוביות כוזבות ומשפר את הספציפיות של ChIP. שנית, קומפלקסי החלבון-DNA נשמרים במצבם המקורי, וממזערים את הייצוב של אינטראקציות חולפות γH2AX-כרומטין שעלולות להתרחש עם סוכנים צולבים. שלישית, השמטת שלבי הקיבוע והקישור ההפוך, הגוזלים זמן, מייעלים את זרימת העבודה הכוללת. לבסוף, נדרש פחות חומר התחלתי, ואין צורך בציוד יקר לגזירת כרומטין, כגון סוניקטור אמבט מים (למשל, Bioruptor) או סוניקטור קולי ממוקד (למשל, Covaris).
למרות של-Native ChIP יש את היתרונות שלו, יש להכיר גם במגבלות שלו. מגבלה אחת היא הפוטנציאל לסידור מחדש של חלבון במהלך הכנת כרומטין ומשקעים חיסוניים. סידור מחדש זה יכול באופן תיאורטי לשנות את האינטראקציות של חלבונים הקשורים לכרומטין ולהכניס שונות בתוצאות. למרות שאין לנו ראיות ישירות התומכות בהתרחשותם של סידורים מחדש כאלה, חשוב לכלול בקרות ניסיוניות מתאימות כדי להסביר את החפץ הפוטנציאלי הזה. מגבלה נוספת של בדיקת ה-ChIP המקורית היא הטיית המחשוף של MNase, שעלולה להוביל לתוצאות לא מדויקות. MNase מבקע באופן מועדף אזורים עשירים ב-A-T בגנום, מה שמגדיל את הסיכוי שאזורים אלה יהיו מקוטעים ומועשרים במהלך תהליך ה-ChIP. הטיה זו עלולה לגרום לייצוג יתר של רצפים עשירים ב-A-T ולתת-ייצוג של אזורים עשירים ב-G-C, מה שעלול לגרום לאותות שליליים כוזבים עבור אזורים גנומיים פחות נגישים לעיכול MNase. אם מוקדי העניין עשירים ב-G-C, יש צורך באופטימיזציה זהירה של תנאי העיכול של MNase. לחלופין, שילוב בקרות נוספות, כגון פיצול כרומטין על ידי סוניקציה, יכול לעזור להפחית את ההשפעה של הטיית MNase ולשפר את אמינות התוצאות.
למרות מגבלותיו המסוימות, γH2AX ChIP מקורי שימושי במיוחד לזיהוי מיקומי הדור שבהם מזהמים ספציפיים גורמים לנזק ל-DNA. על ידי העשרת מקטעי DNA הקשורים ל-γH2AX, חוקרים יכולים לזהות אזורים שבירים בגנום, במיוחד CFS על ידי qPCR, המועדים יותר לשבירה תחת לחץ שכפול הנגרם על ידי מזהמים. טכניקה זו גם מאפשרת לחוקרים לבסס קשר ישיר בין חשיפה לחומר מסרטן ספציפי לבין היווצרות נזק ל-DNA באזורים גנומיים מסוימים, ומספקת תובנה לגבי הפרופיל הגנוטוקסי של מזהמים ותפקידם הפוטנציאלי בהתחלת סרטן43,44.
טבלת פתרון הבעיות (טבלה 3) מספקת פתרונות מפורטים לבעיות נפוצות שנתקלים בהן במהלך בדיקת ChIP, כגון תפוקת DNA נמוכה, פיצול כרומטין לא מספיק, רעש רקע גבוה או ביצועי נוגדנים גרועים. כל נושא משויך להמלצות ספציפיות כדי להבטיח את אמינות הפרוטוקול ויכולת השחזור.
על ידי שימוש במערכות אוטומטיות לטיפול בנוזלים וטכנולוגיות PCR או ריצוף כמותיות, γH2AX ChIP מקורי יכול לזהות ביעילות חומרים הגורמים לנזק ל-DNA, ובכך לשמש כלי רב ערך במחקרים טוקסיקולוגיים וניטור סביבתי. על ידי שימוש ב-γH2AX ChIP מקורי על דגימות שמקורן באוכלוסיות שנחשפו לרמות שונות של מזהמים סביבתיים, חוקרים יכולים לזהות דפוסי נזק ספציפיים ל-DNA ולקבוע את רמת הסיכון הכרוכה בחשיפה לחומרים מסוימים. לסיכום, γH2AX ChIP מקורי מציע יתרונות משמעותיים להערכת הפוטנציאל המסרטן של מזהמים סביבתיים, ומספק גישה מהירה, חסכונית וספציפית גבוהה לאיתור נזק ל-DNA במיקומים גנומיים ספציפיים. היישומים העתידיים שלו בבדיקות סקר בתפוקה גבוהה, הערכת סיכונים מותאמת אישית ופיתוח סמנים ביולוגיים הופכים אותו לכלי רב ערך לקידום ההבנה שלנו לגבי סרטן סביבתי ופיתוח אסטרטגיות למניעה והתערבות בסרטן.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מימון הסטארט-אפים של אוניברסיטת דרום סין.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm nitrocellulose membrane | Amersham | 10600011 | |
| Actin B | proteintech | 20536-1-AP | |
| Aphidicolin | MedChemExpress | HY-N6733 | |
| ChIP-grade magnetic Protein A/G beads | ThermoFisher | 26162 | |
| Clarity Western ECL Substrate | Bio-Rad | #1705061 | |
| Glycogen, molecular biology grade | ThermoFisher | Cat. No. R0561 | |
| HRP-conjugated secondary antibody | proteintech | SA00001-2 | |
| hydroxyurea | MedChemExpress | HY-B0313 | |
| Micrococcal Nuclease | NEB | M0247S | |
| normal IgG | Santa Cruz | sc-2025 | |
| Taq Universal SYBR Green Supermix | BioRad | 1725120 | |
| γH2A.X antibody (for ChIP) | Sigma-Aldrich | 05-636 | |
| γH2A.X antibody (for WB) | Cell Signaling | #25955 |
References
- Glover, T. W., Berger, C., Coyle, J., Echo, B. DNA polymerase alpha inhibition by aphidicolin induces gaps and breaks at common fragile sites in human chromosomes. Hum Genet. 67 (2), 136-142 (1984).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Hellman, A., et al. A role for common fragile site induction in amplification of human oncogenes. Cancer Cell. 1 (1), 89-97 (2002).
- Kotzot, D., et al. Parental origin and mechanisms of formation of cytogenetically recognisable de novo direct and inverted duplications. J Med Genet. 37 (4), 281-286 (2000).
- Miller, C. T., et al. Genomic amplification of MET with boundaries within fragile site FRA7G and upregulation of MET pathways in esophageal adenocarcinoma. Oncogene. 25 (3), 409-418 (2006).
- Zack, T. I., et al. Pan-cancer patterns of somatic copy number alteration. Nat Genet. 45 (10), 1134-1140 (2013).
- Gao, G., et al. Common fragile sites (CFS) and extremely large CFS genes are targets for human papillomavirus integrations and chromosome rearrangements in oropharyngeal squamous cell carcinoma. Genes Chromosomes Cancer. 56 (1), 59-74 (2017).
- Thorland, E. C., Myers, S. L., Gostout, B. S., Smith, D. I. Common fragile sites are preferential targets for HPV16 integrations in cervical tumors. Oncogene. 22 (8), 1225-1377 (2003).
- Matovina, M., Sabol, I., Grubisić, G., Gasperov, N. M., Grce, M. Identification of human papillomavirus type 16 integration sites in high-grade precancerous cervical lesions. Gynecol Oncol. 113 (1), 120-127 (2009).
- Yu, T., et al. The role of viral integration in the development of cervical cancer. Cancer Genet Cytogenet. 158 (1), 27-34 (2005).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Thavathiru, E., Ludes-Meyers, J. H., MacLeod, M. C., Aldaz, C. M. Expression of common chromosomal fragile site genes, WWOX/FRA16D and FHIT/FRA3B is downregulated by exposure to environmental carcinogens, UV, and BPDE but not by IR. Mol Carcinog. 44 (3), 174-182 (2005).
- Sirbu, B. M., et al. Analysis of protein dynamics at active, stalled, and collapsed replication forks. Genes Dev. 25 (12), 1320-1327 (2011).
- Barlow, J. H., et al. Identification of early replicating fragile sites that contribute to genome instability. Cell. 152 (3), 620-632 (2013).
- Petermann, E., Orta, M. L., Issaeva, N., Schultz, N., Helleday, T. Hydroxyurea-stalled replication forks become progressively inactivated and require two different RAD51-mediated pathways for restart and repair. Mol Cell. 37 (4), 492-502 (2010).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Shanbhag, N. M., Rafalska-Metcalf, I. U., Balane-Bolivar, C., Janicki, S. M., Greenberg, R. A. ATM-dependent chromatin changes silence transcription in cis to DNA double-strand breaks. Cell. 141 (6), 970-981 (2010).
- Stiff, T., et al. ATR-dependent phosphorylation and activation of ATM in response to UV treatment or replication fork stalling. EMBO J. 25 (24), 5775-5782 (2006).
- Nelson, J. D., Denisenko, O., Bomsztyk, K. Fast chromatin immunoprecipitation assay. Nuc Acids Res. 34 (5), e2(2006).
- Dorbic, T., Wittig, B. Isolation of oligonucleosomes from active chromatin using HMG17-specific monoclonal antibodies. Nuc Acids Res. 14 (8), 3363-3376 (1986).
- Dorbic, T., Wittig, B. Chromatin from transcribed genes contains HMG17 only downstream from the starting point of transcription. EMBO J. 6 (8), 2393-2399 (1987).
- Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. A direct link between core histone acetylation and transcriptionally active chromatin. EMBO J. 7 (5), 1395-1402 (1988).
- Hebbes, T. R., Thorne, A. W., Clayton, A. L., Crane-Robinson, C. Histone acetylation and globin gene switching. Nuc Acids Res. 20 (5), 1017-1022 (1992).
- Hebbes, T. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Core histone hyperacetylation co-maps with generalized DNase I sensitivity in the chicken beta-globin chromosomal domain. EMBO J. 13 (8), 1823-1830 (1994).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trend Biochem, Sci. 25 (3), 99-104 (2000).
- Myers, F. A., Evans, D. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Targeted and extended acetylation of histones H4 and H3 at active and inactive genes in chicken embryo erythrocytes. J Biol Chem. 276 (23), 20197-20205 (2001).
- Litt, M. D., Simpson, M., Recillas-Targa, F., Prioleau, M. N., Felsenfeld, G. Transitions in histone acetylation reveal boundaries of three separately regulated neighboring loci. EMBO J. 20 (9), 2224-2235 (2001).
- Madisen, L., Krumm, A., Hebbes, T. R., Groudine, M. The immunoglobulin heavy chain locus control region increases histone acetylation along linked c-myc genes. Mol Cell Biol. 18 (11), 6281-6292 (1998).
- Clayton, A. L., Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. Histone acetylation and gene induction in human cells. FEBS Lett. 336 (1), 23-26 (1993).
- Tseng, Z., Wu, T., Liu, Y., Zhong, M., Xiao, A. Using native chromatin immunoprecipitation to interrogate histone variant protein deposition in embryonic stem cells. Methods Mol Biol. 1176, 11-22 (2014).
- Durkin, S. G., Glover, T. W. Chromosome fragile sites. Ann Rev Genetics. 41, 169-192 (2007).
- Lee, J. B., Keung, A. J. Chromatin immunoprecipitation in human and yeast cells. Methods Mol Biol. 1767, 257-269 (2018).
- Miyamoto, R., Yokoyama, A. Protocol for fractionation-assisted native ChIP (fanChIP) to capture protein-protein/DNA interactions on chromatin. STAR Protoc. 2 (2), 100404(2021).
- Mendez, J., Stillman, B. Chromatin association of human origin recognition complex, cdc6, and minichromosome maintenance proteins during the cell cycle: Assembly of prereplication complexes in late mitosis. Mol Cell Biol. 20 (22), 8602-8612 (2000).
- Nowak, D. E., Tian, B., Brasier, A. R. Two-step cross-linking method for identification of NF-κB gene network by chromatin immunoprecipitation. BioTechniques. 39 (5), 715-725 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Lu, X., Parvathaneni, S., Hara, T., Lal, A., Sharma, S. Replication stress induces specific enrichment of RECQ1 at common fragile sites FRA3B and FRA16D. Mol Cancer. 12, 29(2013).
- Ruijter, J. M., et al. Amplification efficiency: linking baseline and bias in the analysis of quantitative PCR data. Nucl Acids Res. 37 (6), e45(2009).
- Lyu, X., Chastain, M., Chai, W. Genome-wide mapping and profiling of γH2AX binding hotspots in response to different replication stress inducers. BMC Genomics. 20, 579(2019).
- Farmer, P. B., et al. Molecular epidemiology studies of carcinogenic environmental pollutants. Effects of polycyclic aromatic hydrocarbons (PAHs) in environmental pollution on exogenous and oxidative DNA damage. Mutat Res. 544 (2-3), 397-402 (2003).
- Phillips, D. H., Arlt, V. M. Genotoxicity: damage to DNA and its consequences. EXS. 99, 87-110 (2009).
- Nitsch, S., Schneider, R. Native ChIP: Studying the genome-wide distribution of histone modifications in cells and tissue. Meth Mol Biol. 2846, (2024).
- Nikitina, T., Wang, D., Gomberg, M., Grigoryev, S. A., Zhurkin, V. B. Combined micrococcal nuclease and exonuclease III digestion reveals precise positions of the nucleosome core/linker junctions: implications for high-resolution nucleosome mapping. J Mol Biol. 425 (11), 1946-1960 (2013).
- Teves, S. S., Henikoff, S. Salt fractionation of nucleosomes for genome-wide profiling. Methods Mol Biol. 833, 421-432 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ISSN 2578-2037
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.