Method Article
التقاط فواصل الموقع الهشة الشائعة بواسطة γH2A الأصلي. X تشيب
In This Article
Summary
نقدم طريقة سريعة وفعالة للكشف عن فواصل الموقع الهشة الشائعة من خلال الترسيب المناعي للكروماتين γH2A.X الأصلي (ChIP). يقلل هذا النهج بشكل كبير من الوقت والعمل المرتبطين بمقايسات γH2A.X ChIP التقليدية مع الحفاظ على قابلية عالية للتكرار وموثوقية النتائج.
Abstract
يمكن أن يؤدي إجهاد النسخ المتماثل الناجم عن التعرض للعوامل الخارجية إلى انقطاع الحمض النووي في المواقع الهشة الشائعة ، وهي مناطق في الجينوم معروفة بأنها عرضة لعدم الاستقرار الهيكلي. يعمل مقايسة الترسيب المناعي للكروماتين γH2A.X (ChIP) كأداة قوية في دراسات السمية الجينية ، حيث أن فسفرة γH2A.X هي علامة راسخة لفواصل الحمض النووي المزدوج. ومع ذلك ، غالبا ما تكون فحوصات γH2A.X ChIP التقليدية كثيفة العمالة وتتضمن خطوات متعددة تستغرق وقتا طويلا. في هذه الدراسة ، نقدم طريقة مبسطة ولكنها فعالة تجمع بين التجزئة تحت الخلوية و ChIP الأصلي لعزل المجمعات المرتبطة ب γH2A.X. هذا النهج مناسب بشكل خاص لتحليل تفاعلات γH2A.X-chromatin مع تحسين الخصوصية والكفاءة. باستخدام التجزئة تحت الخلوية ، تتم إزالة المواد غير المرتبطة بالكروماتين بشكل فعال ، مما ينتج عنه جزء كروماتين منقى. يسمح هضم نوكلياز المكورات الدقيقة اللاحق (MNase) في ظل ظروف معتدلة بتجزئة الكروماتين مع الحفاظ على التفاعلات الفسيولوجية بين γH2A.X ومجمعات البروتين المرتبطة به. يعد هذا الحفظ ضروريا لدراسة شركاء التفاعل الأصليين المشاركين في مسارات الاستجابة لتلف الحمض النووي. يقلل بروتوكول ChIP الأصلي المحسن هذا بشكل كبير من الوقت والعمل المرتبطين بمقايسات γH2A.X ChIP التقليدية. لا يعمل الإجراء المبسط على تبسيط سير العمل فحسب ، بل يؤدي أيضا إلى نتائج قابلة للتكرار بدرجة كبيرة ، مما يجعله مفيدا بشكل خاص في الإعدادات التي تتطلب معالجة عالية الإنتاجية لعينات متعددة. هذه الطريقة لها قابلية تطبيق واسعة في الدراسات التي تركز على استقرار الجينوم وإصلاح الحمض النووي وبيولوجيا الكروماتين ، حيث يعد الكشف الدقيق والفعال عن مواقع تلف الحمض النووي أمرا بالغ الأهمية. من خلال استخدام البروتوكولات المحسنة والخطوات المبسطة ، تتيح هذه الطريقة اكتشاف تلف الحمض النووي في المواقع الهشة مع حساسية محسنة والحد الأدنى من التعامل مع العينات ، مما يجعلها أداة قيمة للدراسات حول استقرار الجينوم والاستجابة لتلف الحمض النووي.
Introduction
المواقع الهشة الشائعة (CFSs) هي مناطق كروموسومية كبيرة موجودة في كل كروموسوم بشري عرضة للكسر أثناء الطور. تحت إجهاد النسخ المتماثل ، يتأخر النسخ المتماثل في هذه المناطق بشكل كبير ، مما يمنع تكرارها الكامل قبل الدخول الانقسامي1 ، مما يؤدي في النهاية إلى فجوات وفواصل خاصة بالموقع. CFSs هي نقاط ساخنة لعدم استقرار الكروموسومات وهي سبب رئيسي لإعادة ترتيب الكروموسومات أثناء تطور السرطان المبكر. يمكن أن يؤدي إجهاد النسخ المتماثل ، الذي غالبا ما يكون موجودا في ظل ظروف الأورام ، إلى فقدان الجينات الكابتة للورم وتضخيم الجينات المسرطنة - يشار إليها مجتمعة باسم تباين رقم النسخ (CNV) 2،3،4،5،6. بالإضافة إلى ذلك ، فإن متلازمة التعب المزمن معرضة بشدة للتكامل الفيروسي ، مما يعزز تطور السرطان7،8،9،10. تم الكشف عن عمليات حذف متعددة متماثلة اللواقح للجينات مثبطة للورم في مناطق متلازمة التعب المزمن أثناء تحليلات السرطان للأورام الأولية. تشمل متلازمة التعب المزمن الأكثر شيوعا في السرطان FRA2F و FRA3B و FRA4F و FRA5H و FRA16D11. متلازمة التعب المزمن معرضة بشكل خاص للكسر في وجود عوامل خارجية مسرطنة12. ولتقييم الآثار الضارة المسببة للسرطان للملوثات البيئية، هناك حاجة إلى طريقة سريعة وموثوقة لقياس حدوث كسر متلازمة التعب المزمن.
فسفرة H2A. X في بقايا السيرين 139 (γH2A.X) بواسطة رنح توسع التلانجي والبروتين المرتبط ب Rad3 (ATR) أو الرنح توسع التلانجي المتحور (ATM) هو حدث رئيسي في توقف شوكة النسخ المتماثلللإشارة 13. يعمل γH2A.X كمؤشر على شوكات النسخ المتماثل المتوقفة قبل تكوين كسر الخيط المزدوج (DSB)13 ، مما يخلق بيئة كروماتين مواتية لتسهيل التوظيف الفعال لبروتينات الإصلاح في المواقع المتوقفة. بالإضافة إلى ذلك ، يمكن تجنيد γH2A.X لكسر المواقع بعد انهيار الشوكة14،15 ، بما يتفق مع دورها الأساسي في إصلاح DSB. نظرا لأن فواصل متلازمة التعب المزمن ترتبط ارتباطا وثيقا بالانحرافات الكروموسومية التي تدفع تطور السرطان ، فإن اكتشاف هذه الفواصل يمكن أن يكون مفيدا في فهم المراحل المبكرة من تكوين الأورام. يمكن استخدام وجود γH2A.X في CFSs كمؤشر حيوي للكشف عن الأحداث المبكرة لعدم الاستقرار الجيني. يمكن أن تساعد هذه المعلومات في تحديد المواد المسرطنة المحتملة وتقييم المخاطر المرتبطة بالتعرض لعوامل خارجية مختلفة. من خلال قياس فواصل الحمض النووي في متلازمة التعب المزمن الناجمة عن العوامل الخارجية ، يمكن أن يوفر γH2A.X chromatin IP (ChIP) نظرة ثاقبة حول كيفية مساهمة هذه العوامل في الآليات الكامنة وراء تكوين الأورام.
في ChIP التقليدي (أي ChIP المتشابك ، X-ChIP) ، يتم تثبيت ارتباط γH2A.X بتسلسلات الحمض النووي المستهدفة عن طريق التشابك القابل للانعكاس. يتم قص الكروماتين لاحقا إلى شظايا من حوالي 500 زوج أساسي (bp) من خلال صوتنة ، ويتم تطهير المحلول الناتج من الحطام عن طريق الترسيب16،17،18. ثم يضاف جسم مضاد من الدرجة ChIP γH2A.X إلى جزء الكروماتين الذي تم تطهيره ، متبوعا بإضافة حبات الاغاروز البروتين A / G لإثراء مناطق الكروماتين المرتبطة ب γH2A.X16،17،18. يتم غسل المجمعات المناعية (أي مركب الحمض النووي المستهدف بالخرز والأجسام المضادة γH2A.X) عدة مرات باستخدام مخازن غسيل صارمة لإزالة شظايا الحمض النووي غير المرتبطة على وجه التحديد16،17،18. بعد الغسيل ، يتم مسح الحمض النووي المرتبط على وجه التحديد من المجمعات المناعية. ثم يتم عكس الروابط المتقاطعة للفورمالديهايد ، متبوعا بهضم البروتين باستخدام البروتيناز K ، وبعد ذلك يتم تنقية الحمض النووي المخصبوتركيزه 16،17،18. لتقييم المناطق المرتبطة ب γH2A.X ، يتم استخدام تفاعل البوليميراز المتسلسل أو تفاعل البوليميراز المتسلسل الكمي (qPCR) أو التسلسل المباشر16،17،18. يتم تحديد إشغال γH2A.X في مناطق محددة ، مثل CFS ، من خلال شدة إشارة PCR أو qPCR ، والتي تتناسب مع كمية γH2A.X المرتبطة في هذا الموقع ، مما يوفر رؤى حول تلف الحمض النووي الخاص بالموقع وأحداثالإصلاح 16،17،18.
على الرغم من كونه نهجا تجريبيا قويا ، إلا أن X-ChIP له العديد من القيود المهمة: (أنا) يتطلب عددا كبيرا من الخلايا ، عادة في حدود 1 × 107 إلى 5 × 107 ، بسبب عدم كفاءة ترسيب الأجسام المضادة المرتبطة بالتثبيت ، مما يزيد من التكلفة الإجمالية للتجربة19 ؛ (2) إن عملية عكس الروابط المتقاطعة للفورمالديهايد وتنقية الحمض النووي اللاحقة تستغرق وقتا طويلا وتتطلب عمالة مكثفة ، مما يجعل من الصعب الحفاظ على الاتساق والموثوقية في النتائج ؛ و (ثالثا) قد لا يتم تمييز تفاعلات γH2A.X-DNA ذات الأهمية الوظيفية الثانوية عن تلك ذات الأهمية الأكبر لأن خطوة الربط المتقاطع يمكن أن تعمل على استقرار التفاعلات العابرة ، مما يؤدي إلى اكتشاف التفاعلات التي قد لا تكون ذات صلة بيولوجيا19.
الترسيب المناعي للكروماتين الأصلي (Native ChIP أو N-ChIP) هو تقنية كيميائية حيوية أساسية تستخدم لدراسة تفاعلات البروتين والحمض النووي في سياق الكروماتين الأصلي في ظل ظروف الملح الفسيولوجية. لقد كان له دور فعال في توضيح التنظيم المكاني والزماني للكروماتين ، وربط عامل النسخ ، وتعديلات الهيستون. يلعب Native ChIP دورا طويل الأمد في المجال الأوسع لبيولوجيا الكروماتين وعلم التخلق ، مما يوفر مزايا وقيودا فريدة مقارنة ب X-ChIP. تتضمن هذه الطريقة ، التي تم تقديمها في أواخر الثمانينيات20 ، عزل الكروماتين عن الخلايا بطرق تحافظ على بنيته الأصلية ، مثل الهضم باستخدام نوكلياز المكورات الدقيقة (MNase) 21. هذا يحافظ على اتصالات البروتين والحمض النووي والهيستون والحمض النووي المتأصل ، مما يجعل Native ChIP مناسبا بشكل خاص لدراسة تعديلات الهيستون ووضع النيوكليوسوم في إعداد الكروماتين الطبيعي22. أظهرت دراسات ChIP الأصلية عالية الدقة استخدام هضم MNase لتقليل الكروماتين إلى النيوكليوسومات الفردية ، مما يسهل رسم خرائط تعديلات الهيستون بدقة أكبر23. علاوة على ذلك ، نظرا لعدم وجود ارتباط كيميائي متقاطع ، يتم تقليل خطر إدخال التحيزات أو القطع الأثرية التي قد تشوه تمثيل تفاعلات البروتين والحمضالنووي 24.
على عكس X-ChIP ، حيث يتم استخدام الفورمالديهايد أو عوامل الربط المتقاطع الأخرى لإصلاح تفاعلات البروتين والحمض النووي ، يوفر Native ChIP رؤية أكثر واقعية للكروماتين من خلال تجنب القطع الأثرية المحتملة للربط المتبادل. ومع ذلك ، في حين أن X-ChIP مناسب بشكل عام للكشف عن التفاعلات العابرة أو الديناميكية بين الحمض النووي والبروتينات التنظيمية25 ، فإن Native ChIP مثالي للتفاعلات المستقرة بين البروتين والحمض النووي ، مثل الهستونات أو البروتينات الأخرى المرتبطة بالكروماتين26،27. أحد القيود المشار إليها في Native ChIP هو عدم القدرة على التقاط أحداث الربط ذات التقارب المنخفض أو العابر ، والتي غالبا ما يتم تثبيتها من خلال الربط المتقاطع في X-ChIP25.
استفادت مجموعة كبيرة من الأعمال في علم التخلق من Native ChIP للكشف عن تعديلات هيستون في بيئات بيولوجية متنوعة28. كانت هذه الجهود حاسمة في تحديد شفرة هيستون - نمط تعديلات الهيستون التي تنظم التعبير الجيني وديناميكيات الكروماتين29. على الرغم من H2A. X هو هيستون رابط أقل ارتباطا ، H2A الأصلي. تم تطبيق طريقة X ChIP بنجاح في الخلايا الجذعية الجنينية30. في هذه الدراسة ، قمنا بتحسين إجراء استخراج الكروماتين لإجراء ChIP الأصلي ل γH2A.X في خلايا 293T البشرية (الشكل 1). يستخدم هيدروكسي يوريا وأفيديكولين على نطاق واسع في الأبحاث للتحقيق في إجهاد تكرار الحمض النووي والتلف وعدم الاستقرار الجيني31. في هذه الدراسة ، تم تطبيق هذه العوامل على الخلايا للحث على إجهاد النسخ المتماثل وتوليد فواصل الحمض النووي في CFS.
باستخدام مادة أولية من حوالي 1 × 106 إلى 5 × 106 خلايا ، يمكن تقسيم هذه الطريقة إلى أربع مراحل رئيسية: (أنا) التجزئة تحت الخلوية لعزل الكروماتين ، (ثانيا) هضم نوكلياز المكورات الدقيقة (MNase) لتفتيت الكروماتين ، (ثالثا) الترسيب المناعي والشطف ، و (رابعا) تحليل الحمض النووي بواسطة تفاعل البوليميراز المتسلسل الكمي (qPCR). يوفر إجراء ChIP بعد التجزئة الفرعية للخلايا العديد من الفوائد وقد تم توثيقه جيدا في العديد من الدراسات32،33،34،35. يسمح هذا النهج بإزالة البروتينات غير المرتبطة بالكروماتين وغيرها من الحطام الخلوي ، مما ينتج عنه جزء كروماتين عالي النقاء. من خلال عزل الكروماتين قبل الترسيب المناعي ، يساعد التجزئة تحت الخلوية في الحفاظ على تفاعلات الكروماتين الأصلية ويقلل من ضوضاء الخلفية من البروتينات غير المرتبطة بالكروماتين ، مما يؤدي إلى نتائج أكثر تحديدا وموثوقية ، حيث يتم الاحتفاظ فقط بالمجمعات المرتبطة بالكروماتين للتحليل. علاوة على ذلك ، يتيح التجزئة تحت الخلوية ظروفا أكثر اعتدالا لهضم الكروماتين ، وبالتالي الحفاظ على التفاعلات الفسيولوجية بين البروتين والحمض النووي وتقديم تمثيل أكثر دقة لديناميكيات الكروماتين داخل البيئة الخلوية الأصلية.
إن استخدام ChIP الأصلي ل γH2AX لقياس تأثير العوامل الخارجية على كسر الموقع الهش الشائع يحمل إمكانات كبيرة لأبحاث السرطان. تتيح هذه التقنية الكشف عن تلف الحمض النووي الناجم عن التعرض للمواد المسرطنة البيئية ، مما يوفر نظرة ثاقبة للآليات الجزيئية التي تساهم بها الملوثات في عدم الاستقرار الجيني وتطور السرطان. من خلال الحفاظ على سياق الكروماتين الأصلي ، تسهل هذه الطريقة التقييم الدقيق لأنماط تلف الحمض النووي المرتبطة بالتعرض للسرطان ، مما يساعد في تقييم المخاطر البيئية ودراسة تكوين الأورام الناجمة عن التلوث.
Protocol
1. حصاد الخلايا
- ضع حوالي 5 × 105 خلايا HEK 293T في كل من الأطباق الأربعة مقاس 6 سم ، كل منها يحتوي على 4 مل من وسط DMEM الكامل.
- بعد 24 ساعة ، عالج طبقا واحدا ب 2 ميكرولتر من محلول مخزون أفيديكولين 1 ملي مولار (راجع جدول المواد) (التركيز النهائي 0.5 ميكرومتر) وطبق آخر يحتوي على 20 ميكرولتر من محلول مخزون 1 م هيدروكسي يوريا (راجع جدول المواد) (التركيز النهائي 5 ملليمتر) للحث على إجهاد النسخ المتماثل. أضف DMSO إلى الطبقين المتبقيين ليكون بمثابة عناصر تحكم.
- بعد 24 ساعة من العلاج ، تخلص من وسائط الاستزراع. عادة ما تنتج لوحة واحدة مقاس 6 سم ما يقرب من 2 × 106 خلايا عند التقاء 60٪ -70٪.
- اشطف كل طبق 2x مع 5 مل من الثلج البارد 1x PBS. استخدم كاشطات الخلايا لفصل الخلايا ونقل تعليق الخلية إلى أربعة أنابيب فردية سعة 1.5 مل. قم بتدوير الماصة برفق لأعلى ولأسفل باستخدام ماصة P1000 لفصل أي كتل خلايا.
- قم بالطرد المركزي للخلايا عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية ، ثم تخلص من المادة الطافية. ضع الخلايا على الجليد.
2. التجزئة تحت الخلوية
- أعد تعليق حبيبات الخلية في 500 ميكرولتر من المخزن المؤقت البارد المحضر حديثا A (راجع الجدول 1) ، مما يضمن التفكك الكامل لكتل الخلايا عن طريق سحب العينة اللطيف.
- احتضان المحللات على الثلج لمدة 5-10 دقائق. تحقق من تقدم التحلل تحت المجهر للتأكد من تحلل الخلايا بالكامل.
- خذ كمية صغيرة من المحللة (حوالي 5-10 ميكرولتر) وضعها على شريحة مجهرية نظيفة. قم بتغطيته بغطاء لتجنب التلوث.
- استخدم مجهرا ضوئيا مع تكبير مناسب (على سبيل المثال ، 20x - 40x) لتصور الخلايا أو الحطام. قارن مع عينة تحكم غير محللة للتمييز بين الخلايا السليمة والمواد المحللة.
ملاحظة: لن تحتوي العينة المحللة بشكل صحيح على مخططات خلوية مميزة ، فقط الكروماتين المنتشر أو المواد الخلوية. اضبط التركيز لمراقبة المحللة بوضوح. إذا لزم الأمر ، استخدم القوة الميكانيكية أثناء خطوة التحلل ، مثل استخدام الخالط Dounce ، عند العمل مع أنواع معينة من الخلايا.
- جهاز طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية ، بمجرد تحلل الخلايا بالكامل. تخلص بعناية من المادة الطافية أعد تعليق حبيبات النوى في 500 ميكرولتر من المخزن المؤقت البارد A باستخدام أطراف ماصة ذات فتحة واسعة.
ملاحظة: تساعد أطراف الفتحة العريضة على تقليل قوى القص وحماية العينات الحساسة مثل الكروماتين. اصنع أطراف واسعة التجويف عن طريق قطع نهاية الأطراف القياسية بشفرة حادة. - جهاز طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص بعناية من المادة الطافية
- قم بتسخين الحاضنة مسبقا إلى 37 درجة مئوية وقم بإعداد مخزن مؤقت للتوقف (100 ملي مولار EDTA ، درجة الحموضة 8.0 ؛ الجدول 1).
- تحسين تركيزات نوكليز المكورات الدقيقة (MNase ، راجع جدول المواد) وأوقات الحضانة مسبقا.
- قسم 40 ميكرولتر من عينة الكروماتين الاختبارية إلى عدة حصص متساوية لاختبار تركيزات MNase المختلفة وأوقات الحضانة.
- استخدم مجموعة من تركيزات MNase (على سبيل المثال ، 0.0625 U ، 0.125 U ، 0.25 U ، 0.5 U ، 1 U ، 2 U ، 4 U ، 8 U لكل تفاعل) واختبر أوقات حضانة متعددة (على سبيل المثال ، 2 و 5 و 10 و 15 دقيقة).
- أضف MNase Buffer (راجع الجدول 1) الذي يحتوي على تركيزات مختلفة من MNase إلى حصص الكروماتين واحتضان العينات عند 37 درجة مئوية للأوقات المحددة.
- قم بإنهاء التفاعل بإضافة 1/4 حجم من المخزن المؤقت للتوقف (التركيز النهائي: 20 ملي مولار EDTA) مباشرة بعد وقت الحضانة المطلوب.
- عزل الحمض النووي من عينات الكروماتين المهضومة باستخدام طريقة استخراج كحول الفينول / الكلوروفورم / الأيزواميل
- قم بتشغيل الحمض النووي المستخرج على هلام الاغاروز بنسبة 1.5٪ لتصور أنماط الهضم: سيظهر نقص الهضم نطاقات عالية الوزن الجزيئي (الشكل 2 ، حارة 1-4) ؛ سيؤدي الإفراط في الهضم إلى تشويه أو شظايا قصيرة جدا (الشكل 2 ، الممر 6-8) ، وسينتج عن الهضم الأمثل نمط سلم نواة واضح (الشكل 2 ، حارة 5 ، على سبيل المثال ، أحادي ، ثنائي ، ثلاثي النيوكليوسومات).
- تحديد الظروف التي تنتج الحل النووي المطلوب دون الإفراط في الهضم.
ملاحظة: يعمل CaCl2 كعامل مساعد لنشاط MNase. قم بتحسين عملية الهضم عن طريق ضبط تركيز CaCl2 بين 1 ملي مولار و 5 ملليمتر.
- أعد تعليق النوى السليمة برفق باستخدام 100 ميكرولتر من MNase Buffer عن طريق سحب العينات من 5 إلى 10 مرات بأطراف فتحة واسعة. أضف على الفور الكمية المحددة مسبقا من MNase إلى العينات (1.25 U MNase / 100 ميكرولتر MNase Buffer).
ملاحظة: عند العمل مع عينات متعددة ، هضم كل واحدة على حدة لتجنب الإفراط في الهضم. - ضع الأنابيب على دوار واحتضانها لمدة 5 دقائق عند 37 درجة مئوية. أعد الأنابيب على الفور إلى الجليد وقم بإنهاء هضم MNase عن طريق إضافة EDTA إلى تركيز نهائي يبلغ 20 ملي مولار وتخلط عن طريق الدوامة.
- أضف 500 ميكرولتر من المخزن المؤقت B (راجع الجدول 1) إلى كل عينة واخلطه جيدا عن طريق سحب العينات لأعلى ولأسفل 5x - 10x. قم بإذابة البروتينات عن طريق الحضانة على الثلج لمدة 5 دقائق.
ملاحظة: يساعد الملح والمنظف الموجود في Buffer B على فصل البروتينات الضعيفة المرتبطة بالكروماتين وتعريض الحواتم للترسيب المناعي. - بيليه المادة غير القابلة للذوبان عن طريق الطرد المركزي بأقصى سرعة لمدة 5 دقائق عند 4 درجات مئوية. انقل المادة الطافية الصافية إلى أنابيب جديدة سعة 1.5 مل تحمل علامة جزء الكروماتين الأصلي. يمكن تخزين العينات إما عند -80 درجة مئوية أو استخدامها للتحقق من كفاءة تجزئة الكروماتين.
ملاحظة: تجنب دورات التجميد والذوبان المتكررة ، لأنها قد تعطل تفاعلات البروتين والحمض النووي ذات الأهمية. قلل من دورات التجميد والذوبان كلما أمكن ذلك.
3. التحقق من تجزئة الكروماتين
- Aliquot 10 ميكرولتر من المادة الطافية من كل عينة في أنبوب جديد سعة 1.5 مل. تخلط مع 20 ميكرولتر من الماء المقطر و 30 ميكرولتر من الفينول / الكلوروفورم / كحول الأيزواميل (25:24:1).
- أغلق الأنابيب بإحكام ودوامة بقوة لمدة 15-30 ثانية. جهاز طرد مركزي عند 20,000 × جم (أو السرعة القصوى لجهاز الطرد المركزي) لمدة 10 دقائق عند 4 درجات مئوية. بعد الطرد المركزي ، سيتم ملاحظة ثلاث طبقات متميزة: طبقة علوية شفافة ، وطبقة وسطى بيضاء ، وطبقة سفلية صفراء.
- انقل بعناية 20 ميكرولتر من المرحلة المائية العلوية (التي تحتوي على الحمض النووي) إلى أنبوب جديد. افصل الحمض النووي المنقى في هلام الاغاروز بنسبة 1.5٪ لمدة 30 دقيقة عند 100 فولت وتصور أنماط الهضم. تأكد من أن حجم شظايا الكروماتين يتراوح بشكل أساسي بين 200 و 1000 زوج أساسي.
ملاحظة: تعد أحجام شظايا الكروماتين المناسبة أمرا بالغ الأهمية لنجاح ChIP الأصلي وتعتمد على ظروف معالجة MNase ، بما في ذلك وحدات الإنزيم ووقت الحضانة وتركيز CaCl2. يمكن أن تختلف كفاءة هضم MNase أيضا بناء على نوع الخلية وعددها. يوصى باستخدام نمط تجزئة الكروماتين الموضح في الشكل 2 (الممر 5) لمقايسة ChIP هذه.
4. الترسيب المناعي
- Aliquot 20 ميكرولتر من الكروماتين المهضوم من كل عينة في أنبوب جديد 1.5 مل وتخلط مع 180 ميكرولتر من Elution Buffer (راجع الجدول 1). قم بتسمية هذه الأنابيب على أنها عينات إدخال وتخزينها عند -20 درجة مئوية.
- انقل 400 ميكرولتر من عينة الكروماتين إلى أنبوب آخر سعة 1.5 مل ل ChIP.
- أضف الجسم المضاد γH2A.X (راجع جدول المواد) إلى عينة واحدة معالجة ب DMSO ، وعينة واحدة معالجة بالأفيديكولين ، وعينة واحدة معالجة بالهيدروكسي يوريا. أضف نفس الكمية من IgG العادي (راجع جدول المواد) إلى عينة أخرى معالجة ب DMSO كعنصر تحكم سلبي لمقايسة ChIP.
ملاحظة: هنا ، يتم استخدام 1 ميكروغرام من الجسم المضاد الأولي عادة ل 400 ميكرولتر من الكروماتين (أي أن التركيز النهائي للجسم المضاد هو 2.5 ميكروغرام / مل). ومع ذلك ، يجب تحديد الكمية المثلى تجريبيا للأجسام المضادة المختلفة γH2A.X. - ضع أنابيب ChIP على دوار عند 4 درجات مئوية واحتضانها لمدة 5 ساعات على الأقل ، أو يفضل بين عشية وضحاها.
- وفي الوقت نفسه ، قم بنقل 100 ميكرولتر من حبات البروتين المغناطيسية A / G من درجة ChIP (راجع جدول المواد) في أنبوب جديد سعة 1.5 مل. استخدم أطراف الفتحة العريضة والماصة ببطء لضمان القياس الدقيق للخرز. ضع الأنبوب على حامل مغناطيسي لمدة 1 دقيقة على الأقل ، ثم تخلص من السائل بعناية.
- أعد تعليق الخرزات في 1 مل من 1x PBS تحتوي على 0.5٪ BSA. قم بالتدوير عند 4 درجات مئوية لمدة 4 ساعات تقريبا. ضع الأنبوب على حامل مغناطيسي لمدة 1 دقيقة على الأقل وتخلص من المادة الطافية.
- اغسل الخرزات مرة أخرى ب 1 مل من 1x PBS تحتوي على 0.5٪ BSA. ضع الأنبوب على الحامل المغناطيسي لمدة 1 دقيقة لتكسير الخرز المغناطيسي ، ثم تخلص من المادة الطافية.
ملاحظة: الخطوات من 4.5 إلى 4.7 هي الطلاء المسبق للخرز لتقليل الارتباط غير المحدد للأجسام المضادة بالخرز المغناطيسي. - أعد تعليق الخرزات المطلية مسبقا في 100 ميكرولتر من العازلة B باستخدام أطراف فتحة واسعة. أضف 25 ميكرولتر من تعليق الخرزة المغناطيسية المطلية مسبقا إلى كل أنبوب عينة من ChIP. قم بالتدوير عند 4 درجات مئوية لمدة 2 ساعة.
- ضع أنابيب ChIP على الحامل المغناطيسي وانتظر حتى يتم توصيل الخرزات بالكامل بجانب الأنبوب ويصبح المحلول واضحا.
- تخلص من المادة الطافية الصافية دون إزعاج الخرز المغناطيسي. أعد تعليق الخرزات بسعة 1 مل من Wash Buffer (راجع الجدول 1) وقم بتدويرها عند 4 درجات مئوية لمدة 10 دقائق.
- ضع الأنابيب مرة أخرى على الحامل المغناطيسي وانتظر حتى يصبح المحلول واضحا. تخلص من مخزن الغسيل. كرر الغسيل لأربع غسلات.
- تخلص من المخزن المؤقت للغسيل بعد الغسيل النهائي وقم بالطرد المركزي للأنابيب لفترة وجيزة عند 400 × جم لمدة 30 ثانية عند 4 درجات مئوية لتدوير أي سائل متبقي. ضع الأنابيب مرة أخرى على الحامل المغناطيسي وقم بإزالة أي سائل متبقي بعناية من قاع الأنبوب.
5. الشطف وترسيب الحمض النووي
ملاحظة: قد تختلف كفاءة الأجسام المضادة بين الدفعات المختلفة. من المهم تأكيد تقارب الارتباط لجسم مضاد جديد عن طريق فحص العينات المترسبة المناعية من خلال تحليل اللطخة الغربية.
- تحقق من كفاءة سحب الجسم المضاد ChIP باستخدام اللطخة الغربية (WB) كما هو موضح أدناه.
- خذ حصة صغيرة من عينة ChIP للتحليل (أي عادة 10٪ من عينة ChIP). قم بتضمين الكروماتين المدخل (ما قبل الترسيب المناعي) والتحكم السلبي (على سبيل المثال ، منسدل IgG) للمقارنة.
- البروتينات المضغوطة من الخرزات المرتبطة بالأجسام المضادة عن طريق التسخين في 20 ميكرولتر من 1x SDS-PAGE المخزن المؤقت للتحميل (راجع جدول المواد) عند 95 درجة مئوية لمدة 5 دقائق.
- قم بتحميل عينات IP والإدخالات وعناصر التحكم على هلام SDS-PAGE بنسبة 15٪. قم بتشغيل الجل.
- انقل البروتينات إلى 0.2 ميكرومتر من النيتروسليلوز (راجع جدول المواد) أو غشاء PVDF باستخدام نظام نقل رطب أو شبه جاف.
- سد الغشاء بحليب خالي الدسم بنسبة 5٪ أو BSA في TBST (راجع الجدول 1) لمدة ساعة واحدة في درجة حرارة الغرفة لمنع الارتباط غير المحدد.
- احتضان الغشاء بالجسم المضاد الأساسي ضد γH2A.X (راجع جدول المواد) المخفف في مانع المخزن المؤقت لمدة 1-2 ساعة في درجة حرارة الغرفة أو بين عشية وضحاها عند 4 درجات مئوية.
- اغسل الغشاء 3 مرات باستخدام TBST لإزالة الأجسام المضادة غير المرتبطة. احتضان الغشاء بجسم مضاد ثانوي مترافق ب HRP (راجع جدول المواد) لمدة ساعة واحدة في درجة حرارة الغرفة. اغسل الغشاء مرة أخرى لإزالة الأجسام المضادة الثانوية الزائدة.
- قم بتطوير الغشاء باستخدام ركيزة كيميائية وتصور الإشارة باستخدام جهاز تصوير. قارن شدة الإشارة بين ممرات IP والإدخال والتحكم لتقييم كفاءة وخصوصية المنسدل.
ملاحظة: يؤكد النطاق المقابل للبروتين المستهدف في ممر IP سحب الأجسام المضادة الناجح. يضمن هذا النهج أنه يمكنك تقييم فعالية الجسم المضاد في التقاط البروتين المستهدف أثناء تجربة ChIP.
- أضف 50 ميكرولتر من المخزن المؤقت Elution (راجع الجدول 1) إلى كل عينة من عينات ChIP المتبقية. ضع الأنابيب على خلاط حراري ورجيها لمدة 15 دقيقة في درجة حرارة الغرفة.
- ضع الأنابيب على الحامل المغناطيسي لمدة 1 دقيقة على الأقل. اجمع العجينة في أنابيب جديدة. كرر 1x واجمع المحلول في نفس الأنابيب.
- أضف 100 ميكرولتر إضافيا من المخزن المؤقت للشطف إلى كل عينة شطف ChIP و 180 ميكرولتر من المخزن المؤقت للشطف لكل عينة إدخال.
- أضف 200 ميكرولتر من كحول الفينول / الكلوروفورم / الأيزواميل (25:24: 1) إلى كل عينة والدوامة بقوة. الطرد المركزي للعينات عند 20,000 × جم (أو السرعة القصوى) لمدة 10 دقائق عند 4 درجات مئوية.
- أضف 19 ميكرولتر من أسيتات الصوديوم 3M (NaOAc ، درجة الحموضة 5.2 ؛ راجع الجدول 1) و 2 ميكرولتر من محلول الجليكوجين (20 مجم / مل ، راجع جدول المواد) لكل أنبوب طرد مركزي جديد سعة 1.5 مل.
- بعد الطرد المركزي ، انقل الطبقة المائية العليا بعناية (حوالي 190 ميكرولتر) إلى الأنابيب التي تحتوي على NaOAc والجليكوجين واخلطها عن طريق الدوامة.
- أضف 500 ميكرولتر من الإيثانول والدوامة بنسبة 100٪. ترسيب الحمض النووي عن طريق احتضان العينات عند -20 درجة مئوية لمدة ساعتين على الأقل أو بين عشية وضحاها.
- قم بالطرد المركزي للأنابيب عند 20,000 × جم (أو السرعة القصوى) لمدة 10 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية ، مع الحرص على عدم إزعاج الحبيبات البيضاء. أعد تعليق الحبيبات في 1 مل من 70٪ من الإيثانول والدوامة جيدا.
- الطرد المركزي الأنابيب عند 20,000 × جم (أو السرعة القصوى) لمدة 5 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية بعناية. لفترة وجيزة ، قم بالطرد المركزي للأنابيب مرة أخرى لتدوير أي إيثانول متبقي. قم بإزالة الإيثانول بعناية باستخدام ماصة P20. جفف كريات الحمض النووي في الهواء لمدة 2-3 دقائق.
ملاحظة: تجنب الإفراط في تجفيف الحبيبات ، لأن ذلك قد يجعل من الصعب إعادة إذابة الحمض النووي. - بالنسبة لعينات ChIP ، أعد تعليق الحمض النووي في 400 ميكرولتر من المخزن المؤقت TE (راجع الجدول 1). بالنسبة للحمض النووي للإدخال ، أعد التعليق في 1000 ميكرولتر من المخزن المؤقت TE. يمكن الآن تخزين العينات المخففة عند -20 درجة مئوية.
6. القياس الكمي qPCR
- قم بإجراء qPCR باستخدام مجموعة تجارية (راجع جدول المواد) مع ثلاث نسخ فنية لكل عينة. تأكد من وجود منتج PCR واحد محدد عن طريق إجراء تحليل منحنى الانصهار لضمان خصوصية التضخيم36.
- تحليل البيانات
ملاحظة: في تحليل القياس الكمي النسبي ، يتم التعبير عن عينة الاختبار كتغيير أضعاف بالنسبة لعينة التحكم (مترسبة مناعية باستخدام IgG المنقى العادي أو IP الوهمية). يمكن استخدام مواقع الحمض النووي المعروفة بأنها غير مشغولة بالبروتين المناعي (الموضع السالب) بهذه الطريقة كجين مرجعي مقارنة بمواقع الحمض النووي المعروفة والمشغولة والإيجابية36.- احسب النسبة المئوية للإدخال لكل ChIP باستخدام الصيغة أدناه
٪ المدخلات = 2 (-ΔCt [ChIP العادي]) - قم بتطبيع قيم الموضع الموجب ΔCt إلى الموضع السالب (ΔΔCt) عن طريق طرح قيمة ΔCt التي تم الحصول عليها للموضع الموجب من قيمة ΔCt للموضع السالب باستخدام الصيغة أدناه
(ΔΔCt = ΔCإيجابي - ΔCسلبي) - احسب إثراء أضعاف تسلسل الموضع الموجب في ChIP DNA على الموضع السالب باستخدام الصيغة أدناه
إثراء الطية = 2ΔΔCt
يتم توفير تسلسل بادئات qPCR المستخدمة للتحليل في الجدول 2. تم تصوير التنظيم الجينومي ل FRA3B و FRA16D37في الشكل 3 أ ، ب.
- احسب النسبة المئوية للإدخال لكل ChIP باستخدام الصيغة أدناه
- التحليل الإحصائي
- تحليل النتائج إحصائيا باستخدام اختبار t المقترن للطالب. تعتبر قيمة p البالغة ≤0.05 ذات دلالة إحصائية ، مما يشير إلى أنه من غير المرجح أن تكون الاختلافات الملحوظة ناتجة عن التباين العشوائي38.
النتائج
يعد حجم شظايا الكروماتين أمرا بالغ الأهمية لنجاح Native ChIP ، لأنه يؤثر بشكل مباشر على إمكانية الوصول إلى مناطق الحمض النووي لربط الأجسام المضادة. لتحديد التركيز الأمثل ل MNase لتجزئة الكروماتين ، قمنا بإعداد سلسلة من أنابيب الطرد المركزي الدقيقة التي تحتوي على تركيزات متفاوتة من MNase (على سبيل المثال ، 0.0625 U ، 0.125 U ، 0.25 U ، 0.5 U ، 1 U ، 2 U ، 4 U ، 8 U لكل تفاعل) و 40 ميكرولتر من النوى المعزولة. تم احتضان كل تفاعل عند 37 درجة مئوية لمدة 5 دقائق لتحقيق مجموعة من أحجام شظايا الكروماتين. يتم عرض نتائج هضم MNase في الشكل 2.
كما هو موضح في الشكل 2 ، أدت التركيزات العالية من MNase إلى هضم أكثر شمولا للكروماتين ، مما أدى إلى غلبة شظايا أحادية النيوكليوسوم (الشكل 2 ، الممرات 1 و 2 و 3). في المقابل ، عند تركيزات MNase المنخفضة ، كانت غالبية شظايا الكروماتين أكبر ، وغالبا ما تتجاوز 1 كيلو بايت (الشكل 2 ، الممرات 6 و 7 و 8) ، مما يشير إلى عدم كفاية الهضم للتطبيقات النهائية. بتركيز MNase يبلغ 1.6 وحدة ووقت هضم يبلغ 5 دقائق ، حصلنا على شظايا كروماتين بشكل أساسي في حدود 200 إلى 1000 زوج أساسي (الشكل 2 ، حارة 5). يعد حجم الجزء هذا مثاليا ل ChIP الأصلي ، لأنه يضمن إثراء فعال للحمض النووي المرتبط بالكروماتين مع الحفاظ على إمكانية الوصول إلى حواتم معينة. يسهل حجم الجزء المناسب الترسيب المناعي الفعال والتحليل النهائي ، مثل تفاعل البوليميراز المتسلسل الكمي أو التسلسل ، مما يجعله مناسبا للكشف عن تفاعلات البروتين والحمض النووي بدقة عالية.
يعد تقارب الارتباط للجسم المضاد عاملا حاسما لنجاح Native ChIP. يعد التأكد من ارتباط الجسم المضاد بكفاءة وتحديدا بالحاتمة المستهدفة أمرا ضروريا لتحقيق نتائج موثوقة. لذلك ، من الضروري التحقق من كفاءة ارتباط الجسم المضاد مسبقا. لتأكيد كفاءة الترسيب المناعي γH2A.X ، أجرينا اختبار اللطخة الغربية (WB).
قارنا مستويات γH2A.X بين الخلايا المعالجة ب DMSO (التحكم) والمعالجة بالأفيديكولين والخلايا المعالجة بالهيدروكسي يوريا (المجهدة بالنسخ المتماثل) باستخدام النشاف الغربي. كما هو موضح في الشكل 4 أ (الإدخال) ، كانت مستويات γH2A.X أعلى بكثير في الخلايا المعالجة بالأفيديكولين مقارنة بالخلايا المعالجة ب DMSO. هذه الزيادة في γH2A.X تتوافق مع تحريض إجهاد النسخ المتماثل بواسطة الأفيديكولين ، مما يؤدي إلى زيادة تكوين كسر الخيط المزدوج والفسفرة اللاحقة γH2A.X. بعد إجراء ChIP ، تحققنا من خصوصية الترسيب المناعي من خلال مقارنة تخصيب γH2A.X في التحكم IgG وعينات γH2A.X IP. لم يقم عنصر التحكم IgG بسحب أي γH2A.X يمكن اكتشافه ، مما يشير إلى الحد الأدنى من الارتباط غير المحدد (الشكل 4B و N-ChIP و X-ChIP). في المقابل ، نجحت عينة γH2A.X IP في إثراء γH2A.X من الخلايا المعالجة بالأفيديكولين ، مما يدل على ارتباط فعال ومحدد: الجسم المضاد ب γH2A.X (الشكل 4 ، N-ChIP و X-ChIP). تؤكد هذه النتائج أن الجسم المضاد γH2A.X لديه تقارب وخصوصية كافية لاستخدامه في تجارب Native ChIP ، مما يتيح الكشف الموثوق به وإثراء مناطق الكروماتين المرتبطة ب γH2A.X. خطوة التحقق هذه ضرورية لضمان جودة ودقة تحليلات ChIP اللاحقة.
استخدمنا المواقع الهشة الشائعة (CFSs) FRA16D و FRA3B لتقييم خصوصية ارتباط γH2A.X بالحمض النووي استجابة لإجهاد النسخ المتماثل. FRA16D و FRA3B هي مناطق CFS معروفة معرضة لعدم الاستقرار في ظل ظروف إجهاد النسخ المتماثل ، مما يجعلها مرشحين مثاليين للتحقق من صحة تفاعلات γH2A.X / DNA. يوضح الشكل 3 أ ، ب التنظيم الجيني لهذين المتلازمين التعبيين المزمنين ، جنبا إلى جنب مع بادئات qPCR المحددة المستخدمة في التحليل.
لتحديد ما إذا كان γH2A.X يرتبط بمناطق CFS هذه استجابة لإجهاد النسخ المتماثل ، أجرينا تحليل ChIP-qPCR في الخلايا الضابطة (المعالجة ب DMSO) ، والخلايا المعالجة بالأفيديكولين ، والخلايا المعالجة بالهيدروكسي يوريا. أظهرت نتائج qPCR أنه في خلايا التحكم المعالجة ب DMSO ، لم يتم إثراء γH2A.X في مواقع FRA16D أو FRA3B ، مما يشير إلى عدم وجود تلف كبير في الحمض النووي أو إجهاد النسخ المتماثل في هذه المناطق (الشكل 3C). ومع ذلك ، في الخلايا المعالجة بالأفيديكولين أو الهيدروكسي يوريا ، مما يؤدي إلى إجهاد النسخ المتماثل عن طريق تثبيط بوليميراز الحمض النووي ، لاحظنا تخصيبا كبيرا ل γH2A.X في كل من FRA16D و FRA3B (الشكل 3 ج). يشير هذا إلى أن γH2A.X تم تجنيدها في مناطق CFS هذه على وجه التحديد استجابة لإجهاد تكرار الحمض النووي. توضح هذه النتائج أن إشغال γH2A.X في CFSs ناتج عن إجهاد النسخ المتماثل ، مما يدعم دوره كعلامة على استجابة تلف الحمض النووي وتوقف شوكة النسخ المتماثل. إن التوظيف المحدد ل γH2A.X إلى FRA16D و FRA3B أثناء علاج الأفيديكولين يتحقق من خصوصية اختبار ChIP الخاص بنا ويؤكد أن γH2A.X هو مؤشر موثوق به لتلف الحمض النووي وإجهاد النسخ المتماثل في المواقع الهشة.
لمقارنة كفاءة ChIP الأصلي مع ChIP المتشابك (X-ChIP) ، أجرينا γH2A.X X-ChIP باستخدام نفس العدد الأولي من الخلايا ، باتباع البروتوكول الموصوف بواسطة Lyu et al.39. تمت زيادة تجنيد γH2A.X في FRA16D عن طريق العلاج بالأفيديكولين والهيدروكسي يوريا ، كما هو موضح في الشكل 3D. ومع ذلك ، فإن التخصيب النسبي ل γH2A.X في FRA16D في X-ChIP كان أقل بشكل ملحوظ من ذلك الذي لوحظ مع ChIP الأصلي ، مما يشير إلى انخفاض كفاءة X-ChIP في ظل هذه الظروف. علاوة على ذلك ، في FRA3B ، كانت الزيادة في تخصيب γH2A.X ضئيلة إحصائيا ، مما يوفر دليلا إضافيا على أن X-ChIP أقل كفاءة عند العمل مع عدد محدود من الخلايا. تشير هذه النتائج إلى أن ChIP الأصلي قد يكون أكثر ملاءمة للكشف عن تخصيب γH2A.X في المواقع الهشة عندما يكون حجم العينة مقيدا. تحليل النتائج إحصائيا باستخدام اختبار t المقترن للطالب. تعتبر قيمة p البالغة ≤ 0.05 ذات دلالة إحصائية.

الشكل 1: Workflow لإجراء اختبار γH2A.X ChIP الأصلي. (ط) يتم زراعة الخلايا وإخضاعها لعلاجات محددة (على سبيل المثال ، العوامل الضارة بالحمض النووي مثل هيدروكسي يوريا) للحث على إشارات γH2A.X. (ثانيا) يتم جمع الخلايا المعالجة للمعالجة. (ثالثا) يتم تجزئة الخلايا لعزل γH2A.X المرتبط بالكروماتين ، وفصله عن المكونات الخلوية الأخرى. (رابعا) يتم إجراء هضم نوكلياز المكورات الدقيقة (MNase) لتفتيت الكروماتين إلى قطع بحجم النيوكليوزوم. (ت) يتم التحقق من صحة حجم شظايا الكروماتين عن طريق تشغيل عينة على هلام الاغاروز ، مما يضمن أن تكون الشظايا بالطول المناسب ل ChIP. (vi) يستخدم جسم مضاد خاص ل γH2A.X لترسيب شظايا الكروماتين المناعية التي تتميز ب γH2A.X. (vii) تستخدم حبات البروتين A / G لسحب مجمعات الأجسام المضادة والكروماتين ، مما يثري الحمض النووي المرتبط ب γH2A.X. (ثامنا) يتم تنقية شظايا الحمض النووي التي تحمل علامة γH2A.X وتنقيتها ، مما يهيئها لتحليلات المصب. (9) التحليل النهائي: qPCR والتسلسل وتحليل البيانات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: فحص لتحسين حالة هضم MNase. تم تحضير شظايا الكروماتين من خلايا HEK 293T باستخدام ظروف هضم MNase مختلفة. تم فصل الحمض النووي المنقى الناتج من الكروماتين المجزأ على هلام الاغاروز بنسبة 2٪ وتشغيله عند 100 فولت لمدة 30 دقيقة. تمثل الممرات من 1 إلى 8 عينات تمت معالجتها بتركيزات متزايدة من MNase (أي 0.0625 وحدة ، 0.125 وحدة ، 0.25 وحدة ، 0.5 وحدة ، 1 U ، 2 U ، 4 U ، 8 U لكل تفاعل) ، مما يدل على تدرج هضم الكروماتين. تم تضمين سلم الحمض النووي (المشار إليه بواسطة M) للإشارة إلى الحجم. تم تصور شظايا الحمض النووي باستخدام محلول تلطيخ الحمض النووي Midori Green Advance. يتوافق النطاق المسمى مع شظايا الحمض النووي أحادي الحجم ، مما يسلط الضوء على كفاءة الهضم عند كل تركيز MNase. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
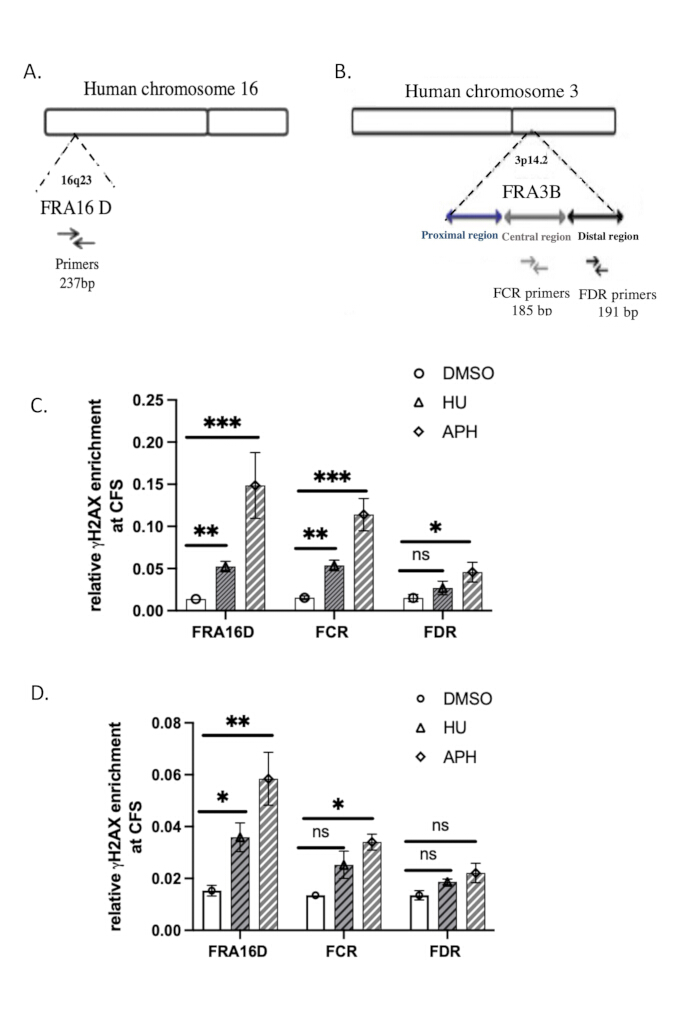
الشكل 3: التحقق من qPCR ل γH2A.X ChIP. (أ) رسم تخطيطي للمنظمات الجينومية ل FRA16D. (ب) رسم تخطيطي للمنظمات الجينومية لمنطقة FRA3B. يشار إلى مجموعات التمهيدي المستخدمة في تحليلات qPCR للمناطق FRA16D والبعيدة (FDR) والوسطى (FCR) داخل موضع FRA3B. (ج) تم تقييم التخصيب النسبي ل γH2A.X في المواقع الهشة الشائعة (CFS) ، وتحديدا FRA3B و FRA16D ، باستخدام ChIP الأصلي متبوعا بتحليل qPCR بعد المعالجة بالأفيديكولين والهيدروكسي يوريا. (د) تم تقييم التخصيب النسبي ل γH2A.X في المواقع الهشة الشائعة (CFS) ، وتحديدا FRA3B و FRA16D ، باستخدام X-ChIP متبوعا بتحليل qPCR بعد المعالجة بالأفيديكولين والهيدروكسي يوريا. يشير إلى نتيجة ذات دلالة إحصائية مع p < 0.001 ؛ ** يشير إلى p < 0.01 و * يشير إلى p < 0.05 ، يحدده اختبار t ؛ ن = 3. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
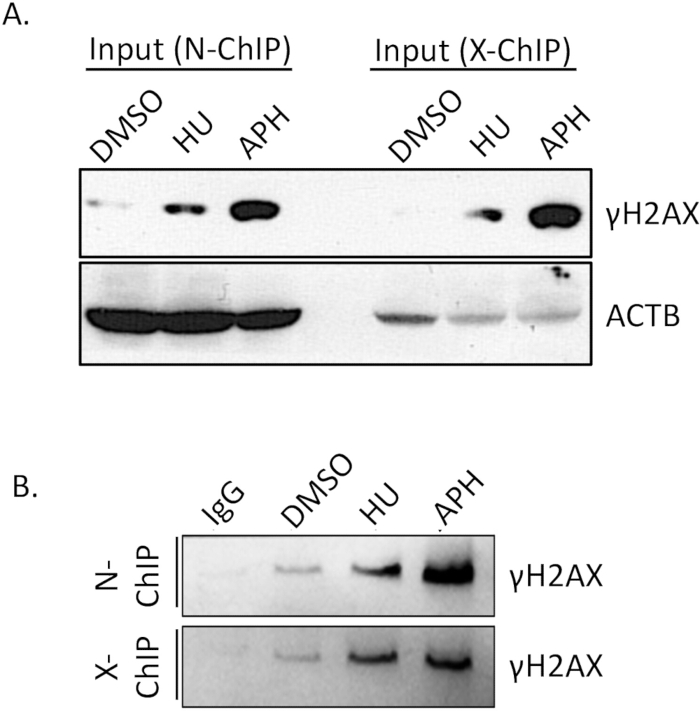
الشكل 4: التحقق من كفاءة سحب الأجسام المضادة ChIP باستخدام اللطخة الغربية. من العينة الإجمالية ، تم فصل 10٪ من عينة ChIP ، جنبا إلى جنب مع عناصر التحكم في الإدخال ، على هلام SDS-PAGE بنسبة 15٪ لحل عديد الببتيدات. بعد الرحلان الكهربائي ، تم نقل البروتينات المنفصلة إلى غشاء PVDF 0.22 ميكرومتر باستخدام بروتوكول نقل قياسي. ثم تم فحص الغشاء بالتتابع بجسم مضاد أولي محدد يستهدف γH2A.X و ACTB ، متبوعا بجسم مضاد ثانوي مناسب مترافق ب HRP. تم تصور الإشارة لاحقا باستخدام الكشف عن التلألؤ الكيميائي ، مما يسمح بتقييم خصوصية الجسم المضاد وكفاءة السحب في مقايسة ChIP. (أ) مستويات γH2A.X بين الخلايا المعالجة ب DMSO (التحكم) ، والخلايا المعالجة بالأفيديكولين والمعالجة بالهيدروكسي يوريا (المجهدة بالنسخ المتماثل) مع ACTB كعنصر تحكم في التحميل. (B) تخصيب γH2A.X في عينات التحكم IgG وعينات IP. الاختصارات: APH = أفيديكولين ، HU = هيدروكسي يوريا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المخزن المؤقت أ (1X) | |
| الكاشف | تركيز العمل |
| الأنابيب الرقم الهيدروجيني 6.8 | 10 ملم |
| كلوريد الصوديوم | 100 ملم |
| مغنكلوريد2 | 3 مللي متر |
| درجة الحموضة EGTA 7.6 | 1 ملي متر |
| يحفظ في درجة حرارة -20 درجة مئوية لمدة تصل إلى 1 سنة | |
| المخزن المؤقت MNase (1X) | |
| الكاشف | تركيز العمل |
| تريس حمض الهيدروكلوريك ، درجة الحموضة 7.5 | 50 ملم |
| كلوريدالهواء 2 | 1 ملي متر |
| مغنكلوريد2 | 4 مللي |
| يحفظ في درجة حرارة -20 درجة مئوية لمدة تصل إلى 1 سنة | |
| المخزن المؤقت ب (1X) | |
| الكاشف | تركيز العمل |
| فوسفات الصوديوم الرقم الهيدروجيني 7. 0 | 20 ملم |
| بيروفوسفات الصوديوم10. ح2س | 30 ملم |
| كيه سي إل | 250 ملم |
| EDTA ، درجة الحموضة 8.0 | 5 مللي متر |
| الجلسرين | 10% |
| تريتون X-100 | 0.10% |
| كوكتيل مثبط البروتياز | 1x |
| كوكتيل مثبط الفوسفاتيز | 1x |
| DTT | 0.5 ملي |
| يحفظ في درجة حرارة -20 درجة مئوية لمدة تصل إلى 1 سنة | |
| المخزن المؤقت للشطف | |
| الكاشف | تركيز العمل |
| NaHCO3 | 50 ملم |
| الحزب الديمقراطي الصربي | 1% |
| طازج | |
| عازلة الغسيل | |
| الكاشف | تركيز العمل |
| المخزن المؤقت MNase | س 0.5 |
| العازلة ب | س 0.5 |
| طازج محضر | |
| إيقاف المخزن المؤقت | |
| EDTA | 100 ملي ، درجة الحموضة 8.0 |
| 3 م أسيتات الصوديوم ، درجة الحموضة 5.2 | |
| 408.24 غ أسيتات الصوديوم | |
| aفقط الرقم الهيدروجيني مع حمض الخليك إلى درجة الحموضة 5.2 | |
| ضبط مستوى الصوت إلى 1 لتر | |
| تعقيم المخزن المؤقت عن طريق الترشيح أو التعقيم | |
| المخزن المؤقت TBST | |
| قاعدة تريس ، درجة الحموضة 8.0 | 10 ملم |
| كلوريد الصوديوم | 150 ملم |
| توين 20 | 0.1٪ (حجم الحجم/الحجم) |
| المخزن المؤقت TE | |
| تريس حمض الهيدروكلوريك ، درجة الحموضة 8.0 | 10 ملم |
| EDTA ، درجة الحموضة 8.0 | 1 مللي متر |
الجدول 1: تكوين العازلة.
| مواقع الجينات | التمهيدي الأمامي | التمهيدي العكسي |
| FRA16D | TCCTGTGGAAGGGATATTTA | CCCCTCATATTCTGCTTCTA |
| FRA3B | TGTTGGAATGTTAACTCTATCCCAT | ATATCTCATCAAGACCGCTGCA |
| FCR | ||
| FRA3B | CAATGGCTTAAGCAGACATGGT | AGTGAATGGCATGGCTGGAATG |
| روزفلت | ||
| ACTB (التحكم السلبي) | GACGCAGGATGGGGGGG | ACGCCTCTGGCCGTACCAC |
الجدول 2: تسلسل التمهيدي.
| انخفاض استعادة الحمض النووي | مشكلة محتملة | الحل الممكن |
| رداءة جودة الأجسام المضادة | استخدم الجسم المضاد من الدرجة ChIP. | |
| عدم كفاية الجسم المضاد | استخدم 1-10 ميكروغرام من الأجسام المضادة ChIP لكل 25 ميكروغرام من الكروماتين. | |
| وقت حضانة غير كاف | قم بإجراء خطوة الترسيب المناعي طوال الليل عند 4 درجات مئوية. | |
| غسلات صارمة للغاية | لا تستخدم تركيز كلوريد الصوديوم أعلى من 500 ملي مولار في محلول الغسيل. | |
| حبات منخفضة الجودة | تأكد من أن البروتين A أو G متوافق مع الجسم المضاد ChIP. | |
| اتبع ورقة بيانات منتج الخرزة للحصول على الحجم الأمثل للحبات إلى نسبة الجسم المضاد. | ||
| بدء التشغيل غير كاف | قم بإعداد لوحة منفصلة من الخلايا لتحديد رقم الخلية بدقة. | |
| عينة | زيادة عدد الخلايا المستخدمة إذا كان الهدف منخفضا الوفرة. | |
| تحلل الخلايا غير الكافي | تحسين تكوين المخزن المؤقت ووقت التحلل لتحسين الكفاءة. | |
| استخدم القوة الميكانيكية أثناء خطوة التحلل ، مثل استخدام الخالط Dounce ، عند العمل مع أنواع معينة من الخلايا. | ||
| حدث تدهور النوى | تأكد من أن عزل النوى لطيف للحفاظ على سلامة الكروماتين وإمكانية الوصول إليه. | |
| استخدم أطراف الماصة ذات التجويف العريض لتقليل قص النوى أثناء المناولة. | ||
| حدث تدهور العينة | قم بتنفيذ جميع الخطوات على الجليد أو عند 4 درجات مئوية. | |
| قم بتضمين مثبطات الإنزيم البروتيني في جميع المخازن المؤقتة وتأكد من أن جميع المخازن المؤقتة جاهزة حديثا. | ||
| عدم كفاية هضم MNase | معايرة تركيز MNase (على سبيل المثال ، 0.1-5 وحدات) لتحديد الكمية المثلى لنوع عينة معين ؛ وابدأ بمجموعة من التركيزات لتحديد ظروف الهضم المثالية. | |
| فرط الهضم MNase | جرب أوقات حضانة مختلفة (على سبيل المثال ، 1-10 دقائق) عند 37 درجة مئوية وراقب نمط التجزئة لضمان الهضم الكافي دون الإفراط في الهضم. | |
| الفسفرة المتقطعة | أضف كوكتيل مثبط الفوسفاتيز إلى مخزن التحلل ، وتأكد من تحضير جميع المخازن المؤقتة حديثا. | |
| خلفية عالية في التحكم السلبي | ربط غير محدد للخرز | قم بتضمين خطوة ما قبل المقاصة قبل خطوة الترسيب المناعي ، واستخدم حبات مغناطيسية من درجة ChIP ، والتي تظهر بشكل عام ارتباطا غير محدد أقل. |
| غسيل غير كاف | قم بزيادة عدد أو صرامة عمليات الغسيل عن طريق ضبط تركيز الملح والمنظفات. | |
| تجزئة غير كافية للكروماتين | تحسين التجزئة لتحقيق أجزاء من 200-750 نقطة أساس. | |
| التحسين ضروري لكل نوع خلية أو أنسجة | ||
| استكشاف أخطاء PCR وإصلاحها | لا يوجد تضخيم لعينة الإدخال | (1) مفرط في التجزئة: تتضاءل الإشارة للأمبليكونات التي تزيد عن 150 نقطة أساس إذا تم تجزئة الكروماتين إلى طول أحادي النواة. |
| (2) تحسين ظروف PCR. | ||
| (3) تصميم بادئات لتضخيم منطقة أصغر (<150 نقطة أساس). | ||
| دقة منخفضة | حجم جزء الحمض النووي كبير جدا | تحسين التجزئة لتحقيق أجزاء من 200-750 نقطة أساس. |
الجدول 3: استكشاف أخطاء الكروماتين المناعية وإصلاحها.
Discussion
التلوث البيئي مساهم كبير في السرطانات البشرية. العديد من الملوثات مسببة للسرطان ، مما يعني أنها يمكن أن تسبب ضررا وراثيا يؤدي إلى تطور السرطان40،41. ومع ذلك ، فإن تحديد ما إذا كانت مادة معينة مسببة للأورام هو مهمة صعبة. من شأن الطريقة السريعة والموثوقة والفعالة من حيث التكلفة لتحديد الإمكانات المسببة للسرطان أن تمكن العلماء من فحص الملوثات البيئية بكفاءة وتقييم تأثيرها على الاستقرار الجيني. في هذه الدراسة ، نركز على متغير هيستون معدل ، γH2A.X ، والذي يعرف على نطاق واسع بأنه علامة محددة للغاية ل DSBs. γH2A.X يتشكل عندما يكون متغير هيستون H2A. يتم فسفرة X عند سيرين 139 استجابة لتلف الحمض النووي.
من خلال الكشف عن وجود γH2A.X بواسطة Native ChIP في CFSs ، يمكننا تقييم مدى تلف الحمض النووي الناجم عن الملوثات البيئيةبشكل فعال 42. توفر القدرة على القياس الكمي γH2A.X في CFSs طريقة سريعة وحساسة وموثوقة لتقييم إمكانات الملوثات البيئية للحث على تأثيرات الأورام. على عكس فحوصات السمية الجينية التقليدية ، والتي غالبا ما تقيس العلامات غير المباشرة لتلف الحمض النووي (مثل الطفرات أو تكوين النواة الدقيقة أو التحول الخلوي) ، فإن γH2AX ChIP الأصلي يسمح برسم خرائط دقيقة لأحداث الكسر في مواقع جينوميةمحددة 42. يوفر هذا فهما أعمق للمنطقة الأكثر عرضة للملوثات البيئية ويساعد في تحديد الآليات المسببة للسرطان المحتملة.
يتطلب نجاح ChIP الأصلي اهتماما دقيقا بالعديد من الخطوات الحاسمة لضمان الإثراء الفعال للمناطق المستهدفة. فيما يلي الخطوات الحاسمة المتضمنة في ChIP الأصلي ل γH2AX. تحضير الخلية: ابدأ بعدد كاف من الخلايا. عالج الخلايا بعامل يسبب تلف الحمض النووي ، مثل الأفيديكولين ، للحث على إجهاد النسخ المتماثل كعنصر تحكم إيجابي. قم بتضمين عينات المراقبة السلبية المناسبة غير المعالجة للمقارنة. عزل الكروماتين: قم بإجراء تجزئة تحت الخلايا لعزل البروتينات المرتبطة بالكروماتين مع تقليل التلوث من المكونات السيتوبلازمية. تحسين MNase: إجراء تجارب تجريبية لتحسين تركيز نوكلياز المكورات الدقيقة (MNase) ووقت الحضانة. الهدف هو الحصول على شظايا الكروماتين بين 200-1000 زوج أساسي ، مما يضمن دقة جيدة ل ChIP مع الحفاظ على سلامة النواة. الترسيب المناعي: استخدم جسما مضادا عالي الجودة من الدرجة ChIP γH2AX جنبا إلى جنب مع بروتين A / G agarose لضمان السحب الفعال للكروماتين المستهدف مع تقليل الارتباط غير المحدد. الغسيل: اغسل الخرزات بمحلول يحتوي على التركيز المناسب من الملح والمنظفات لإزالة التفاعلات غير المحددة مع الاحتفاظ بالكروماتين المرتبط ب γH2AX. الحذف واستعادة الحمض النووي: استعادة الكروماتين المرتبط بكفاءة عن طريق الشطف الشامل وترسيب الحمض النووي ، مما يضمن الحد الأدنى من فقدان الكروماتين المستهدف المخصب بالمقارنة مع X-ChIP التقليدي ، هناك أربع مزايا رئيسية ل γH2AX ChIP الأصلي. أولا ، يقلل دمج التجزئة تحت الخلوية من التفاعلات الإيجابية الكاذبة ويعزز خصوصية ChIP. ثانيا ، يتم الحفاظ على مجمعات البروتين والحمض النووي في حالتها الأصلية ، مما يقلل من استقرار تفاعلات γH2AX-chromatin العابرة التي قد تحدث مع عوامل الربط المتقاطع. ثالثا ، يؤدي حذف خطوات التثبيت والربط المتقاطع العكسي التي تستغرق وقتا طويلا إلى تبسيط سير العمل العام. أخيرا ، هناك حاجة إلى مواد أولية أقل ، ولا حاجة إلى معدات باهظة الثمن لقص الكروماتين ، مثل سونيكاتير حمام مائي (على سبيل المثال ، Bioruptor) أو سونيكاتير الموجات فوق الصوتية المركزة (على سبيل المثال ، Covaris).
على الرغم من أن Native ChIP لها مزاياها ، إلا أنه يجب أيضا الاعتراف بحدودها. أحد القيود هو إمكانية إعادة ترتيب البروتين أثناء تحضير الكروماتين والترسيب المناعي. يمكن أن تؤدي إعادة الترتيب هذه نظريا إلى تغيير تفاعلات البروتينات المرتبطة بالكروماتين وإدخال تباين في النتائج. على الرغم من أنه ليس لدينا دليل مباشر يدعم حدوث عمليات إعادة الترتيب هذه ، فمن المهم تضمين الضوابط التجريبية المناسبة لحساب هذه القطعة الأثرية المحتملة. هناك قيد آخر لمقايسة ChIP الأصلية وهو تحيز الانقسام ل MNase ، والذي يمكن أن يؤدي إلى نتائج غير دقيقة. يشق MNase بشكل تفضيلي المناطق الغنية ب A-T من الجينوم ، مما يجعل هذه المناطق أكثر عرضة للتجزئة والإثراء أثناء عملية ChIP. يمكن أن يتسبب هذا التحيز في الإفراط في تمثيل التسلسلات الغنية ب A-T وتمثيل ناقص للمناطق الغنية ب G-C ، مما قد يؤدي إلى إشارات سلبية كاذبة للمناطق الجينومية التي يصعب الوصول إليها من قبل هضم MNase. إذا كانت المواقع ذات الأهمية غنية ب GC ، فمن الضروري تحسين ظروف هضم MNase بعناية. بدلا من ذلك ، يمكن أن يساعد دمج عناصر تحكم إضافية ، مثل تجزئة الكروماتين عن طريق الصوتنة ، في التخفيف من تأثير تحيز MNase وتحسين موثوقية النتائج.
على الرغم من قيوده المعينة ، فإن γH2AX ChIP الأصلي مفيد بشكل خاص لتحديد المواقع العامة حيث تؤدي ملوثات معينة إلى تلف الحمض النووي. من خلال إثراء شظايا الحمض النووي المرتبطة ب γH2AX ، يمكن للباحثين تحديد المناطق الهشة من الجينوم ، وخاصة CFSs بواسطة qPCR ، والتي تكون أكثر عرضة للكسر تحت إجهاد النسخ المتماثل الناجم عن الملوثات. تمكن هذه التقنية الباحثين أيضا من إقامة علاقة مباشرة بين التعرض لمادة مسرطنة معينة وتكوين تلف الحمض النووي في مناطق جينومية معينة ، مما يوفر نظرة ثاقبة على الملف الملامح السامة للوراثي للملوثات ودورها المحتمل في بدء التسرطن43،44.
يوفر جدول استكشاف الأخطاء وإصلاحها (الجدول 3) حلولا مفصلة للمشكلات الشائعة التي تمت مواجهتها أثناء اختبار ChIP ، مثل انخفاض إنتاجية الحمض النووي ، أو عدم كفاية تجزئة الكروماتين ، أو ضوضاء الخلفية العالية ، أو ضعف أداء الأجسام المضادة. يتم إقران كل مشكلة بتوصيات محددة لضمان موثوقية البروتوكول وقابليته للتكرار.
باستخدام أنظمة معالجة السوائل الآلية وتقنيات تفاعل البوليميراز المتسلسل الكمي أو التسلسل ، يمكن ل γH2AX ChIP الأصلي تحديد العوامل التي تسبب تلف الحمض النووي بكفاءة ، وبالتالي يكون بمثابة أداة قيمة في دراسات السموم والمراقبة البيئية. من خلال استخدام γH2AX ChIP الأصلي على عينات مشتقة من السكان المعرضين لمستويات مختلفة من الملوثات البيئية ، يمكن للباحثين تحديد أنماط تلف الحمض النووي المحددة وتحديد مستوى المخاطر المرتبطة بالتعرض لعوامل معينة. في الختام ، يوفر γH2AX ChIP الأصلي مزايا كبيرة لتقييم الإمكانات المسببة للسرطان للملوثات البيئية ، مما يوفر نهجا سريعا وفعالا من حيث التكلفة وعالي الخصوصية للكشف عن تلف الحمض النووي في مواقع جينومية محددة. إن تطبيقاتها المستقبلية في الفحص عالي الإنتاجية ، وتقييم المخاطر الشخصية ، وتطوير المؤشرات الحيوية تجعلها أداة قيمة لتعزيز فهمنا للتسرطن البيئي وتطوير استراتيجيات للوقاية من السرطان والتدخل.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من خلال تمويل الشركات الناشئة من جامعة جنوب الصين.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm nitrocellulose membrane | Amersham | 10600011 | |
| Actin B | proteintech | 20536-1-AP | |
| Aphidicolin | MedChemExpress | HY-N6733 | |
| ChIP-grade magnetic Protein A/G beads | ThermoFisher | 26162 | |
| Clarity Western ECL Substrate | Bio-Rad | #1705061 | |
| Glycogen, molecular biology grade | ThermoFisher | Cat. No. R0561 | |
| HRP-conjugated secondary antibody | proteintech | SA00001-2 | |
| hydroxyurea | MedChemExpress | HY-B0313 | |
| Micrococcal Nuclease | NEB | M0247S | |
| normal IgG | Santa Cruz | sc-2025 | |
| Taq Universal SYBR Green Supermix | BioRad | 1725120 | |
| γH2A.X antibody (for ChIP) | Sigma-Aldrich | 05-636 | |
| γH2A.X antibody (for WB) | Cell Signaling | #25955 |
References
- Glover, T. W., Berger, C., Coyle, J., Echo, B. DNA polymerase alpha inhibition by aphidicolin induces gaps and breaks at common fragile sites in human chromosomes. Hum Genet. 67 (2), 136-142 (1984).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Hellman, A., et al. A role for common fragile site induction in amplification of human oncogenes. Cancer Cell. 1 (1), 89-97 (2002).
- Kotzot, D., et al. Parental origin and mechanisms of formation of cytogenetically recognisable de novo direct and inverted duplications. J Med Genet. 37 (4), 281-286 (2000).
- Miller, C. T., et al. Genomic amplification of MET with boundaries within fragile site FRA7G and upregulation of MET pathways in esophageal adenocarcinoma. Oncogene. 25 (3), 409-418 (2006).
- Zack, T. I., et al. Pan-cancer patterns of somatic copy number alteration. Nat Genet. 45 (10), 1134-1140 (2013).
- Gao, G., et al. Common fragile sites (CFS) and extremely large CFS genes are targets for human papillomavirus integrations and chromosome rearrangements in oropharyngeal squamous cell carcinoma. Genes Chromosomes Cancer. 56 (1), 59-74 (2017).
- Thorland, E. C., Myers, S. L., Gostout, B. S., Smith, D. I. Common fragile sites are preferential targets for HPV16 integrations in cervical tumors. Oncogene. 22 (8), 1225-1377 (2003).
- Matovina, M., Sabol, I., Grubisić, G., Gasperov, N. M., Grce, M. Identification of human papillomavirus type 16 integration sites in high-grade precancerous cervical lesions. Gynecol Oncol. 113 (1), 120-127 (2009).
- Yu, T., et al. The role of viral integration in the development of cervical cancer. Cancer Genet Cytogenet. 158 (1), 27-34 (2005).
- Bignell, G. R., et al. Signatures of mutation and selection in the cancer genome. Nature. 463 (7283), 893-898 (2010).
- Thavathiru, E., Ludes-Meyers, J. H., MacLeod, M. C., Aldaz, C. M. Expression of common chromosomal fragile site genes, WWOX/FRA16D and FHIT/FRA3B is downregulated by exposure to environmental carcinogens, UV, and BPDE but not by IR. Mol Carcinog. 44 (3), 174-182 (2005).
- Sirbu, B. M., et al. Analysis of protein dynamics at active, stalled, and collapsed replication forks. Genes Dev. 25 (12), 1320-1327 (2011).
- Barlow, J. H., et al. Identification of early replicating fragile sites that contribute to genome instability. Cell. 152 (3), 620-632 (2013).
- Petermann, E., Orta, M. L., Issaeva, N., Schultz, N., Helleday, T. Hydroxyurea-stalled replication forks become progressively inactivated and require two different RAD51-mediated pathways for restart and repair. Mol Cell. 37 (4), 492-502 (2010).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Shanbhag, N. M., Rafalska-Metcalf, I. U., Balane-Bolivar, C., Janicki, S. M., Greenberg, R. A. ATM-dependent chromatin changes silence transcription in cis to DNA double-strand breaks. Cell. 141 (6), 970-981 (2010).
- Stiff, T., et al. ATR-dependent phosphorylation and activation of ATM in response to UV treatment or replication fork stalling. EMBO J. 25 (24), 5775-5782 (2006).
- Nelson, J. D., Denisenko, O., Bomsztyk, K. Fast chromatin immunoprecipitation assay. Nuc Acids Res. 34 (5), e2 (2006).
- Dorbic, T., Wittig, B. Isolation of oligonucleosomes from active chromatin using HMG17-specific monoclonal antibodies. Nuc Acids Res. 14 (8), 3363-3376 (1986).
- Dorbic, T., Wittig, B. Chromatin from transcribed genes contains HMG17 only downstream from the starting point of transcription. EMBO J. 6 (8), 2393-2399 (1987).
- Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. A direct link between core histone acetylation and transcriptionally active chromatin. EMBO J. 7 (5), 1395-1402 (1988).
- Hebbes, T. R., Thorne, A. W., Clayton, A. L., Crane-Robinson, C. Histone acetylation and globin gene switching. Nuc Acids Res. 20 (5), 1017-1022 (1992).
- Hebbes, T. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Core histone hyperacetylation co-maps with generalized DNase I sensitivity in the chicken beta-globin chromosomal domain. EMBO J. 13 (8), 1823-1830 (1994).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation. Trend Biochem, Sci. 25 (3), 99-104 (2000).
- Myers, F. A., Evans, D. R., Clayton, A. L., Thorne, A. W., Crane-Robinson, C. Targeted and extended acetylation of histones H4 and H3 at active and inactive genes in chicken embryo erythrocytes. J Biol Chem. 276 (23), 20197-20205 (2001).
- Litt, M. D., Simpson, M., Recillas-Targa, F., Prioleau, M. N., Felsenfeld, G. Transitions in histone acetylation reveal boundaries of three separately regulated neighboring loci. EMBO J. 20 (9), 2224-2235 (2001).
- Madisen, L., Krumm, A., Hebbes, T. R., Groudine, M. The immunoglobulin heavy chain locus control region increases histone acetylation along linked c-myc genes. Mol Cell Biol. 18 (11), 6281-6292 (1998).
- Clayton, A. L., Hebbes, T. R., Thorne, A. W., Crane-Robinson, C. Histone acetylation and gene induction in human cells. FEBS Lett. 336 (1), 23-26 (1993).
- Tseng, Z., Wu, T., Liu, Y., Zhong, M., Xiao, A. Using native chromatin immunoprecipitation to interrogate histone variant protein deposition in embryonic stem cells. Methods Mol Biol. 1176, 11-22 (2014).
- Durkin, S. G., Glover, T. W. Chromosome fragile sites. Ann Rev Genetics. 41, 169-192 (2007).
- Lee, J. B., Keung, A. J. Chromatin immunoprecipitation in human and yeast cells. Methods Mol Biol. 1767, 257-269 (2018).
- Miyamoto, R., Yokoyama, A. Protocol for fractionation-assisted native ChIP (fanChIP) to capture protein-protein/DNA interactions on chromatin. STAR Protoc. 2 (2), 100404 (2021).
- Mendez, J., Stillman, B. Chromatin association of human origin recognition complex, cdc6, and minichromosome maintenance proteins during the cell cycle: Assembly of prereplication complexes in late mitosis. Mol Cell Biol. 20 (22), 8602-8612 (2000).
- Nowak, D. E., Tian, B., Brasier, A. R. Two-step cross-linking method for identification of NF-κB gene network by chromatin immunoprecipitation. BioTechniques. 39 (5), 715-725 (2005).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Lu, X., Parvathaneni, S., Hara, T., Lal, A., Sharma, S. Replication stress induces specific enrichment of RECQ1 at common fragile sites FRA3B and FRA16D. Mol Cancer. 12, 29 (2013).
- Ruijter, J. M., et al. Amplification efficiency: linking baseline and bias in the analysis of quantitative PCR data. Nucl Acids Res. 37 (6), e45 (2009).
- Lyu, X., Chastain, M., Chai, W. Genome-wide mapping and profiling of γH2AX binding hotspots in response to different replication stress inducers. BMC Genomics. 20, 579 (2019).
- Farmer, P. B., et al. Molecular epidemiology studies of carcinogenic environmental pollutants. Effects of polycyclic aromatic hydrocarbons (PAHs) in environmental pollution on exogenous and oxidative DNA damage. Mutat Res. 544 (2-3), 397-402 (2003).
- Phillips, D. H., Arlt, V. M. Genotoxicity: damage to DNA and its consequences. EXS. 99, 87-110 (2009).
- Nitsch, S., Schneider, R. Native ChIP: Studying the genome-wide distribution of histone modifications in cells and tissue. Meth Mol Biol. 2846, (2024).
- Nikitina, T., Wang, D., Gomberg, M., Grigoryev, S. A., Zhurkin, V. B. Combined micrococcal nuclease and exonuclease III digestion reveals precise positions of the nucleosome core/linker junctions: implications for high-resolution nucleosome mapping. J Mol Biol. 425 (11), 1946-1960 (2013).
- Teves, S. S., Henikoff, S. Salt fractionation of nucleosomes for genome-wide profiling. Methods Mol Biol. 833, 421-432 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved