Method Article
Забор крови и измерение гормонов для определения стадии овариального цикла у мартышек
В этой статье
Резюме
Этот протокол описывает забор крови и мочи для измерения уровней прогестерона/эстрадиола и хорионического гонадотропина для определения стадии овариального цикла. Уровни гормонов используются для прогнозирования и определения сроков овуляции, а гормоны вводятся для регулирования овариального цикла и роста ооцитов.
Аннотация
Обыкновенные мартышки – это маленькие обезьяны Нового Света. Поскольку многие из их биологических механизмов схожи с человеческими, мартышки потенциально полезны для медицинских и биологических исследований в различных областях, таких как нейробиология, регенеративная медицина и развитие. Тем не менее, существует нехватка литературы, описывающей методы многих основных экспериментов и процедур. Здесь подробно описаны методы определения уровня половых гормонов (прогестерона, эстрадиола и хорионического гонадотропина) у игрунок. Измерение этих гормонов позволяет предсказать стадию овариального цикла, которая обычно составляет 26-30 дней у мартышек; Точное определение имеет важное значение для сбора ооцитов/зигот в правильный момент времени и для подготовки самок-хозяев к созданию генетически модифицированных игрунок.
Кроме того, измерение уровня половых гормонов полезно для эндокринологии, этологии, раннего развития и исследований репродуктивной биологии. В этом протоколе подробно описаны методы забора крови из бедренной вены, разделения плазмы для измерения гормонов, измерения уровня хорионического гонадотропина с помощью мочи и плазмы, сброса овариального цикла с помощью инъекций аналога простагландина F2α для укорачивания и синхронизации цикла, а также стимулирования роста фолликулов и овуляции путем инъекции фолликулостимулирующего гормона и хорионического гонадотропина. Используя эти протоколы, можно определить стадии яичникового цикла для своевременного сбора ооцитов/зигот.
Введение
Обыкновенная мартышка (Callithrix jacchus) - маленькая обезьяна Нового Света со многими характеристиками, схожими с человеческими, а продолжительность ее овариального цикла составляет 26-30 дней 1,2. Исследования раннего развития и создания генетически модифицированных игрунок требуют сбора ооцитов и зигот на определенных этапах овариального цикла. Таким образом, точное определение стадии имеет решающее значение и может быть оценено путем измерения уровня гормонов прогестерона (P4) и эстрадиола (E2) в крови. Эти гормоны способствуют росту эндометрия, который необходим для имплантации. Р4 вырабатывается из желтого тела, которое образуется в яичниках сразу после овуляции. Е2 секретируется фолликулами яичников в ответ на фолликулостимулирующий гормон (ФСГ) из гипоталамус-гипофизарного комплекса в головном мозге. Уровень Е2 увеличивается по мере созревания фолликула, достигая пика перед овуляцией3. Высокий уровень Е2 вызывает импульсное высвобождение лютеинизирующего гормона (ЛГ) через гипоталамус-гипофизарный комплекс у человека; Этот всплеск ЛГ вызывает овуляцию. Однако у мартышек ген ЛГ претерпел дегенерацию в ходе эволюции, и овуляция вместо этого индуцируется высвобождением хорионического гонадотропина (ХГ), который имеет структуру, сходную с ЛГ, из гипофиза 4,5.
Овариальный цикл можно контролировать с помощью инъекций гормонов. Инъекции ФСГ у человека действуют на рецепторы ФСГ яичников и используются для стимулирования синтеза эстрогенов и роста фолликулов6. Инъекция ХГ человека (ХГЧ) в качестве заменителя ЛГ в конце фолликулярной фазы используется для стимуляции овуляции у человека7. Инъекции КГ также используются для лечения бесплодия человека, потому что КГ стимулирует желтое тело на ранних сроках беременности, что приводит к увеличению выработки P4. Инъекции простагландина F2α (PGF2α) обнуляют овариальный цикл8. У домашнего скота инъекция PGF2α используется для сокращения лютеиновой фазы и синхронизации цикла течки для управления репродуктивной функцией.
Хотя мартышки и люди имеют схожие биологические механизмы, что делает их идеальными модельными животными, существует нехватка литературы, описывающей основные методы многих часто используемых техник. Забор крови является одним из наиболее часто используемых методов 9,10,11,12. Однако у новичков иногда возникают проблемы с поиском вены. Следовательно, в этом исследовании был проведен анатомический анализ области бедренной вены. Основываясь на анатомических наблюдениях, этот протокол вводит проксимальную область бедренного треугольника в качестве легкого места для венепункции.
протокол
Все методы с участием мартышек соответствовали высоким этическим стандартам и стандартам благополучия и были одобрены Комитетом по уходу за животными и их использованию в Национальном центре детского здоровья и развития. Животные, используемые здесь, были однокомнатными или парными (одна самка и один самец) с 12 часами света в день.
1. Забор крови из бедренной вены
- Приготовьте шприц объемом 1 мл (короткий тип прост в использовании) с иглой 25 G, прикрепленной лезвием вверх. Во избежание закупорки кровью гепаринизируйте шприц, набрав в шприц 200 мкл неразбавленного раствора гепарина натрия. Равномерно смажьте внутреннюю часть шприца, несколько раз потянув его вверх и вниз; Затем вытолкните раствор гепарина из шприца.
ПРИМЕЧАНИЕ: Поскольку часто необходимо перейти на новый шприц, подготовьте несколько дополнительных гепаринизированных шприцев. - Подготовьте впитывающие ватные и спиртовые тампоны. Включите регулируемую лампу, чтобы осветить область, куда будет помещена игрунка для забора крови.
- Подготовьте удерживающее устройство (420 x 85 x 85 мм, рис. 1A), которое имеется в продаже (подробную информацию см. в таблице материалов ). Чтобы поместить мартышку в устройство, откройте удерживающую часть с помощью губчатого ремня, который фиксирует мартышки. Вставьте мартышку в удерживающее устройство лицевой стороной вверх.
ПРИМЕЧАНИЕ: Мартышки обычно спокойны в удерживающих устройствах, что может свести на нет необходимость в сдерживании, акклиматизации или дрессировке. - Поймать мартышку; вставить мартышку в цилиндрическую часть; и закрепите его, прижав губчатый ремень. Положите ногу, с которой будет собираться кровь, на другую (рисунок 1A). Удерживайте ноги недоминирующей рукой; Поместите средний и безымянный пальцы внутрь каждой ноги, чтобы закрепить их, и другие пальцы снаружи каждой ноги, чтобы зафиксировать их.
ПРИМЕЧАНИЕ: При ловле мартышек рекомендуется использовать перчатки для укуса. Если удерживающее устройство отсутствует, проведите забор крови под наркозом или в присутствии другого человека, удерживающего мартышку. - Проверьте, видна ли бедренная вена у основания бедра. Если нет, пропальпируйте пульсирующую артерию и используйте ее в качестве ориентира, чтобы проверить, проходит ли вена внутри нее (рисунок 1B-D).
ПРИМЕЧАНИЕ: Для улучшения видимости рекомендуется использовать подсветку стола и бритье волос. Видимость также можно улучшить, протерев спиртовыми тампонами. Лимфатические узлы в треугольнике часто расположены близко к вене и показывают темно-синий цвет в виде вены. Как их отличить, описано в разделе «Репрезентативные результаты». - Продезинфицируйте место прокола с помощью спиртового тампона. Вставьте лезвие иглы стороной вверх под углом 15°-20°. Чтобы игла не выскользнула из кровеносного сосуда во время забора крови, стабилизируйте руку, держащую шприц, например, уперев его в другую руку.
- Осторожно оттяните поршень назад, чтобы оказать отрицательное давление (Рисунок 1E). Вытолкните кончик иглы вперед. После того, как кровь попадет в шприц, сохраняйте положение кончика иглы до тех пор, пока не будет собран необходимый объем (500-700 мкл).
- Когда кровь не поступает в шприц, смените место прокола. Если при вытаскивании иглы вышла кровь, остановите кровотечение, придавив к месту прокола на 3 мин. После остановки кровотечения возобновите венепункцию.
- Если кровь, втягиваемая в шприц, перестает течь во время процесса забора, медленно толкните кончик иглы вперед, а затем потяните его назад, чтобы найти кровеносный сосуд. Это может восстановить приток крови в шприц. Если нет, вытащите иглу и проведите венепункцию с помощью нового шприца.
ПРИМЕЧАНИЕ: Используйте бедро на другой ноге, когда трудно собрать кровь с той же стороны.
- Осторожно вытащите иглу, слегка надавливая на место прокола с помощью мизинца. Затем с помощью впитывающей ватной палочки немедленно надавите на место прокола на 3 минуты, чтобы остановить кровотечение. Переверните шприц, чтобы смешать кровь и гепарин.
ПРИМЕЧАНИЕ: Приложите давление в течение более длительного времени (5 минут) при охлаждении при заборе артериальной крови и тщательно подтвердите кровотечение, чтобы предотвратить образование гематомы, которая иногда может привести к летальному исходу. - Убедившись, что кровотечение прекратилось, снимите губчатый ремень, возьмитесь за талию животного одной рукой и поверните животное так, чтобы можно было держать подмышку животного другой рукой с тыльной стороны.
- Верните мартышку в клетку. Чтобы уменьшить стресс и облегчить повторный забор крови, обеспечьте мартышку его любимой едой (например, печеньем, зефиром или бисквитом). Время от времени проверяйте возникновение гематомы.
ПРИМЕЧАНИЕ: Когда гематома обнаружена на ранней стадии, наложите давящую повязку, чтобы предотвратить прогрессирование гематомы. При обнаружении по прошествии длительного времени может потребоваться хирургическое удаление гематомы с перевязкой бедренной артерии и переливанием крови 9,13. - Отсоедините иглу от шприца, чтобы предотвратить гемолиз. Затем медленно вытолкните собранную кровь по внутренней стенке микропробирки объемом 1,5 мл.
ПРИМЕЧАНИЕ: Собранная кровь может храниться при температуре 4 °C в течение 24 часов перед отделением плазмы для измерения уровней P4/E2.
2. Отделение плазмы и определение гормонального фона
- Центрифугируйте кровь в пробирке объемом 1,5 мл при 1100 × г в течение 5 мин при 4 °С.
- Переложите отделенную плазму (надосадочную жидкость) из пробирки объемом 1,5 мл в новую пробирку/чашку, тщательно избегая включения клеток крови (осадка).
- Измеряйте уровни P4 и E2 с помощью набора ELISA или автоматического анализатора. Если количества плазмы недостаточно для автоматического анализатора, используйте раствор для разведения пробы.
ПРИМЕЧАНИЕ: Для измерения с помощью автоматического анализатора требуется >175 мкл плазмы для определения только уровня P4, а для определения P4 и E2 требуется >250 мкл плазмы.
3. Измерение ЦГ мочи для определения овуляции и беременности
ПРИМЕЧАНИЕ: Уровни CG у мартышек могут быть измерены с помощью иммунохроматографического теста как для овуляции, так и для беременности. В случае овуляции положительный результат можно получить за 0-2 дня до овуляции. В случае наступления беременности положительный результат выявляется с 15-20 дня примерно до 100 дня беременности. Для проведения теста требуется небольшое количество (90 μл) мочи (одна капля мочи равна ~30 μл).
- Метод лотка: Если в одной клетке находится более двух животных, переместите целевую мартышку (или других животных) в другую клетку накануне. Поставьте чистый лоток на дно клетки в ночь до или перед освещением. Моча не выводится из мочевого пузыря в течение ночи. Поэтому моча обычно выделяется из мочевого пузыря вскоре после зажигания.
ПРИМЕЧАНИЕ: Вход в комнату утром до зажигания солнца может нарушить цикл сна когорты. Моча обычно может быть собрана в течение примерно 30 минут после розжига. - Метод отжима: Подготовьте вымытые лотки к сбору мочи. Найдя мочевой пузырь мартышки, осторожно сожмите его спереди и с обеих сторон, используя всю длину пальцев (рисунок 1F). Собирайте мочу непосредственно перед освещением комнаты утром.
ПРИМЕЧАНИЕ: Если забор мочи не увенчался успехом из-за отсутствия мочи в мочевом пузыре, подождите некоторое время и повторите попытку. Будьте осторожны, не применяйте чрезмерную силу, потому что это может травмировать животное. - Сразу после сбора поместите образец мочи в лунку иммунохроматографического тест-набора. Прочтите результат через 10 минут в соответствии с инструкциями производителя.
4. Контроль и определение стадии овариального цикла для сбора ооцитов, зигот и эмбрионов
- Забор зародышевых пузырьков (GV) из яичников
- Введите внутримышечно 3 мкл 0,263 мг/мл клопростенола (синтетического аналога PGF2α), разведенного в 150 мкл физиологического раствора14 (рис. 2), для сброса овариального цикла в конце лютеиновой фазы (т.е. через ≥10 дней после начала лютеиновой фазы).
Примечание: Приготовление разбавленного раствора в большем объеме может быть удобным, так как разведенный клопростенол остается стабильным в течение как минимум нескольких недель при температуре +4 °C. - На следующий день (день 1) подтвердите начало фолликулярной фазы, проверив, что уровень Р4 снизился.
ПРИМЕЧАНИЕ: Сообщалось, что инъекции клопростенола резко снижают уровень P4 (обычно <10 нг/мл) в течение 24ч3. - С 1-го дня вводите ФСГ (25 МЕ, внутримышечно) один раз в 2 дня, в общей сложности 5 раз (дни 1, 3, 5, 7 и 9). На 10-й день во второй половине дня ввести ХГЧ (75 МЕ, внутримышечно).
- Соберите ГВ из яичников на 11 день методом фолликулярной аспирации под наркозом согласно литературе15,16.
ПРИМЕЧАНИЕ: Иногда овуляция происходит раньше, чем ожидалось. Таким образом, рекомендуется проверять уровни CG с 8 дня. Если тест CG положительный, проведите сбор GV в этот день.
- Введите внутримышечно 3 мкл 0,263 мг/мл клопростенола (синтетического аналога PGF2α), разведенного в 150 мкл физиологического раствора14 (рис. 2), для сброса овариального цикла в конце лютеиновой фазы (т.е. через ≥10 дней после начала лютеиновой фазы).
- Сбор ооцитов, зигот и ранних эмбрионов метафазы II (MII)
- Сбросьте овариальный цикл с помощью клопростенола, как описано в шаге 4.1.1.
- На следующий день (день 1) подтвердите начало фолликулярной фазы, проверив, что уровень Р4 снизился.
- Для сбора зигот и эмбрионов размещают самок игрунок вместе с самцами игрунок для случки с 6 дня.
- Начиная с 7-го дня, проверяйте уровень P4/E2 в крови и уровень CG в моче у женщин. Обнаружение ХГ является признаком овуляции в течение нескольких дней (обычно на следующий день). В день, когда уровень Р4 повышается, а уровень Е2 снижается по сравнению с предыдущим днем, соберите ооциты MII или эмбриональные зиготы 0-го дня (Е0) из яйцеводов 17,18.
- Для сбора эмбрионов, как описано в литературе, проводят промывание либо из яйцеводов (Е1-Е3, 1-8 клеток)17,18, либо из матки (Е5-Е10, 8 клеток-бластоциста)19,20,21,22 в соответствующий момент времени, в зависимости от целевой стадии.
Результаты
Подробная информация о животных, использованных в этом исследовании, приведена в таблице 1.
Анатомические анализы бедренной вены
Анатомический анализ бедренной вены проводили с участием 2-летнего самца обыкновенной мартышки (I 7713M), подвергавшегося эвтаназии. Бедренные вены и артерии расположены в бедренном треугольнике. Бедренный треугольник образуется на границах между брюшной стенкой и мышцами бедра (рисунок 1B-D). У основания бедра через центр перевернутого треугольника проходит большая вена, а параллельно за пределами вены проходит артерия. В нижней области вены и артерии становятся тоньше и перекрываются, при этом артерии располагаются поверх вен (рис. 1D).
Для забора крови следует нацелить вену, потому что повреждение артерии может вызвать гематому бедренной артерии, что может привести к сердечно-сосудистому шокупри сильном кровотечении. Хотя кровь может быть взята из любой части вены в треугольнике и его дистальной области, венепункция из проксимального участка бедренного треугольника рекомендуется из-за большого размера вены и ее кажущегося небольшим перекрытия с артерией. Кроме того, вена в проксимальном отделе является поверхностной, что позволяет легко определить ее расположение с помощью иглы. Поскольку она пульсирует, артерия в бедренном треугольнике иногда идентифицируется визуально или с помощью пальпации, и вена проходит прямо медиально к ней. Таким образом, наблюдение за пульсацией артерии помогает предсказать расположение вены.
Кроме того, синяя окраска, указывающая на наличие вены, обычно наблюдается под кожей в верхней части треугольника (рис. 1B, C). Однако лимфатические узлы в треугольнике часто расположены близко к вене и показывают темно-синий цвет, поэтому их внешний вид схож. К счастью, их можно отличить по подвижности: вена неподвижна, а лимфатические узлы подвижны. Таким образом, пульсация артерии и синий цвет вены являются двумя основными подсказками, используемыми для определения местоположения вены, хотя для их визуализации может потребоваться сбрить волосы.
Определение стадии в овариальном цикле
Уровни P4 и E2 контролировались у шести самок мартышек (в возрасте от 1 до 3 лет) для изучения продолжительности фолликулярной и лютеиновой фаз. Результаты показали среднюю продолжительность 11,58 дней (n = 6 от четырех мартышек) и 16,8 дней (n = 5 от трех мартышек) для фолликулярной и лютеиновой фаз соответственно (табл. 2). Ниже подробно описана динамика P4 и E2 одного (I6751F, 3-летнего) из шести игрунок. Забор крови и гормональные измерения у этого животного проводились каждые несколько дней в течение 38 дней (табл. 3).
Лютеиновая фаза (1-10 дни)
В качестве дня начала измерения был выбран день 1. Основываясь на уровне P4 (21 нг/мл), животное, вероятно, находилось в лютеиновой фазе. Высокий уровень P4 наблюдался с 1 по 10 день (≥21 нг/мл), что указывает на лютеиновую фазу. На 12-й день он резко упал до 4 нг/мл. Это значительное уменьшение свидетельствовало о переходе от лютеиновой к фолликулярной фазе. Снижение уровня Е2 с 10-го дня (241 нг/мл) до 12-го дня (189 нг/мл) также способствовало этому переходу.
Фолликулярная фаза (12-22 дни)
После перехода в фолликулярную фазу уровень Р4 оставался низким (4-6 нг/мл) до 19-го дня, а затем незначительно повышался с 19-го по 24-й день (19-й день – 6 нг/мл; 22-й день – 8 нг/мл; 24-й день – 9 нг/мл). Напротив, уровень Е2 значительно повысился с 19-го дня (94 нг/мл) до 22-го (322 нг/мл), а затем снизился с 22-го по 24-й день (158 нг/мл). Основываясь на повышенном уровне P4 и сниженном уровне E2, было предсказано, что овуляция должна была произойти между 22 и 24 днями, переходя из фолликулярной в лютеиновую фазу.
Лютеиновая фаза (24-36 дни)
После овуляции уровень P4 оставался высоким до 36-го дня, а затем снизился до 3 нг/мл на 38-й день. Таким образом, вполне вероятно, что переход от лютеиновой к фолликулярной фазе произошел между 36-38 днями. В соответствии с этим переходным периодом, уровень Е2 снизился в течение этого периода (36-й день, 2517 нг/мл; 38-й день, 73 нг/мл).
Прогнозирование и определение сроков овуляции
Для изучения взаимосвязи между уровнем ЦЖ в моче и датой овуляции были подготовлены семь игрунок (No 1-7). Для сброса овуляторного цикла вводили клопростенол (день 0). Затем проводили мониторинг уровня P4/E2 в крови и уровня CG в моче с 7-го дня. Мочу собирали сразу после зажигания. Забор крови в основном проводился утром. Предполагалось, что овуляция происходит, когда уровень Е2 значительно снизился по сравнению с предыдущим днем, как сообщалось17. В этот день действительно наблюдался разрыв фолликулов на поверхности яичников и наличие зигот/ооцитов в яйцеводах (табл. 4).
КГ была впервые обнаружена на 7-11 день (день 7, N = 1; день 8, N = 2; день 9, N = 1; день 10, N = 2; день 11, N = 1) (Таблица 4). Значительное снижение уровня Е2 (признак овуляции) наблюдалось через 0-3 дня после первого сигнала КГ. Продолжительность от первого обнаружения КГ до снижения E2 казалась большой, когда первое обнаружение КГ было более ранним (рис. 3A). Например, у одного животного (No 1) наблюдалось снижение сигнала Е2 через 3 дня после первого обнаружения КГ на 7-й день (табл. 4). Напротив, одновременное обнаружение первой компьютерной графики и снижение сигнала Е2 наблюдалось у одного животного (No 2) на 10-е сутки. Таким образом, хотя первое обнаружение КГ и овуляция наблюдались в один и тот же день у одного из пяти животных, овуляция произошла в течение нескольких дней после первого обнаружения КГ.
Набор для иммунохроматографических тестов на мартышку CG предназначен для использования мочи для тестирования. Исследование уровня CG обычно сопровождается определением уровня P4/E2 с помощью плазмы крови. Будет полезно, если для проведения ХГ-теста можно использовать плазму крови вместо мочи. Чтобы проверить это, была исследована плазма крови, оставшаяся после измерения уровня P4/E2 в указанных экспериментах. Плазма крови и моча были собраны у четырех животных в любой из дней проведения вышеуказанных экспериментов (дни обследования были обозначены двойными звездочками [**] в таблице 4). Используя мочу, два из четырех животных показали положительные результаты (баллы 5 и 3), а два других показали отрицательные результаты (балл 1). Плазма крови показала практически те же результаты, что и моча (рисунок 3B). Более сильный сигнал был получен при использовании плазмы крови. Поэтому при использовании плазмы крови суждение должно быть вынесено до 10 мин, которые устанавливаются для мочи.
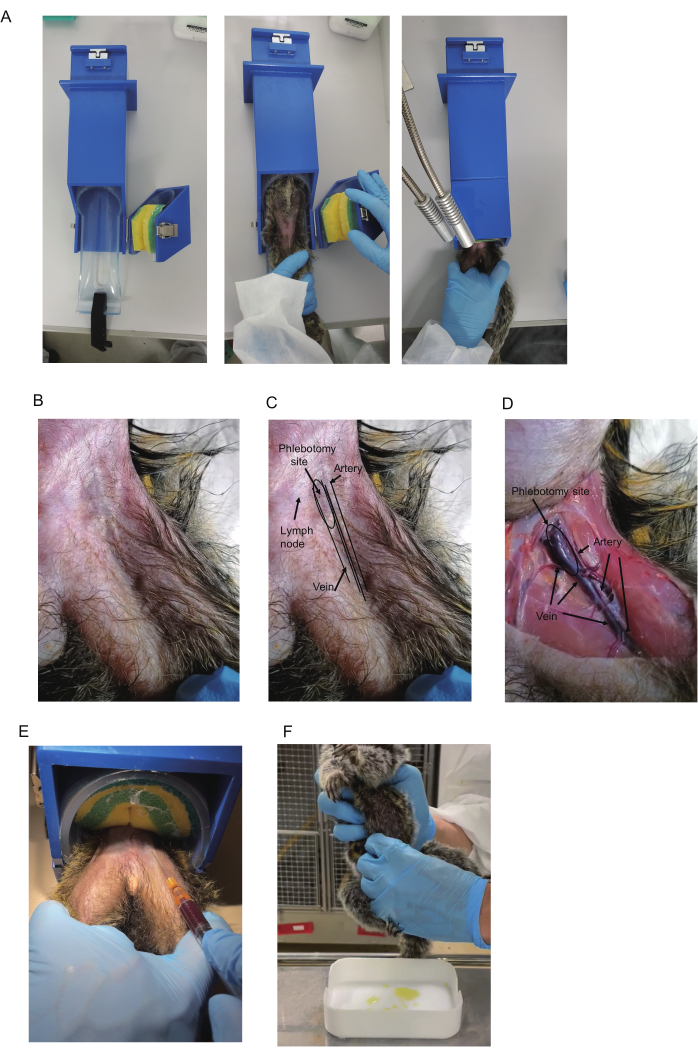
Рисунок 1: Забор крови у мартышек. (А) Для сбора крови используется ограничитель. (B) Мартышка на верхней части бедра. (В) Бедренный треугольник и кровеносные сосуды. Бедренная артерия в треугольнике часто видна и демонстрирует пульсацию. Синий цвет бедренной вены иногда виден в проксимальной области треугольника (обозначается как место флеботомии). Лимфатические узлы также имеют синий цвет. Тем не менее, лимфатические узлы подвижны, так как лимфатические узлы прикреплены к коже. (D) Анатомический вид бедра усыпленного животного. Указываются артерия, вена и место флеботомии. Это же животное показано в B-D. (E) Забор крови с помощью удерживающего устройства. Показано положение удержания ног мартышки и стекающей крови. (F) Сбор мочи у мартышки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
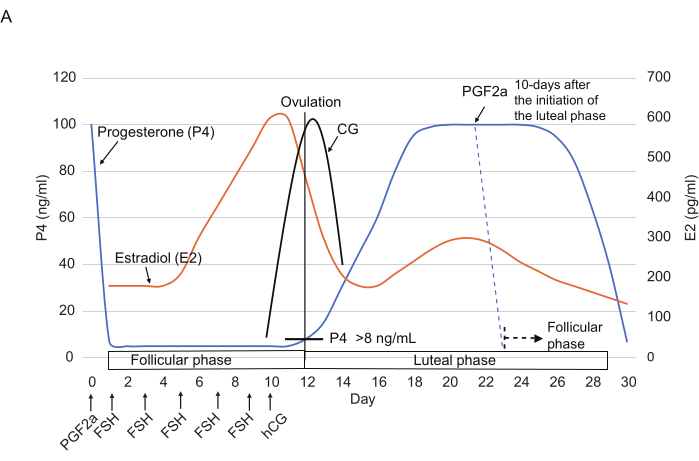
Рисунок 2: Типичные закономерности уровней P4, E2 и CG во время овариального цикла у мартышек. Указываются временные точки инъекций ФСГ, ХГЧ и PGF2α. Пунктирными линиями обозначен ожидаемый гормональный фон после инъекции PGF2α. Сокращения: Р4 = прогестерон; Е2 = эстрадиол; CG = хорионический гонадотропин; ФСГ = фолликулостимулирующий гормон; ХГЧ = хорионический гонадотропин человека; PGF2α = простагландин F2α. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
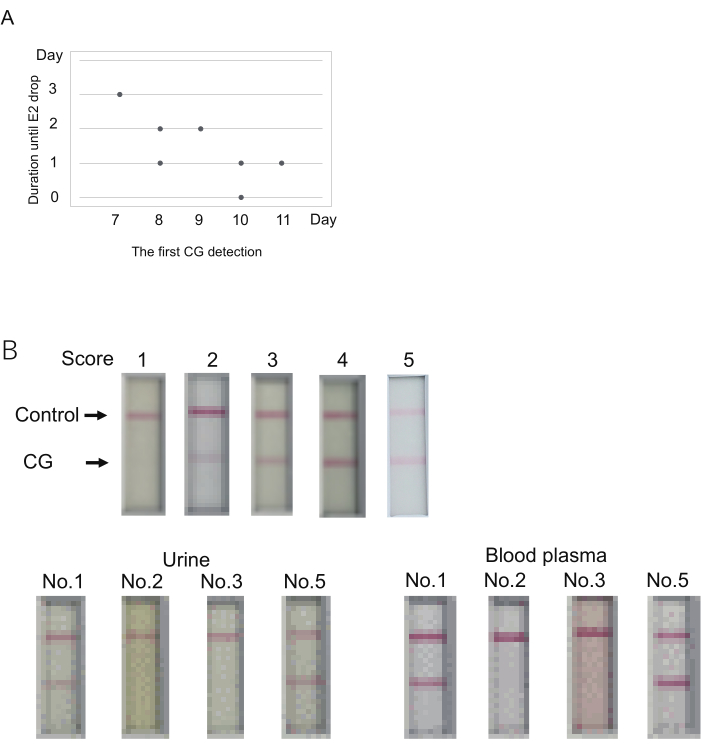
Рисунок 3: Определение уровня КГ для прогнозирования наступления овуляции. (A) Возможная связь между первым днем обнаружения КГ (оценка > 1) и продолжительностью до овуляции (падение E2). (B) Плазма крови может быть использована для иммунохроматографических ХГ-тестов. Репрезентативный результат каждого балла (верх). Оценка определялась через 10 мин после загрузки образца. Оценка 2 означает отсутствие полосы в течение 5 минут, но появление полосы в течение 10 минут. Забор крови проводился вскоре после сбора мочи. Были обследованы четыре игрунки (No 1, 2, 3, 5 в таблице S4). Используемые здесь образцы обозначены двойными звездочками в таблице 4. Плазму крови разбавляли до 50% с помощью разбавляющего буфера, используемого для измерения Е2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Животные, использованные в данном исследовании. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Продолжительность фолликулярной и лютеиновой фаз. Фазу определяли исходя из уровня Р4 (фолликулярная фаза Р4 ≤ 8, лютеиновая фаза Р4 > 8). Когда наблюдался фазовый переход между измерениями, точка изменения определялась как средняя точка между датами измерений. Продолжительность между двумя точками изменения рассматривалась как фолликулярная или лютеиновая фазы. Для обеспечения измерения продолжительности одной фазы для анализа не использовались данные с длинным (≥7 дней) интервалом или два раза из ≥6 дней интервалов в одной и той же фазе, в том числе при охвате двух фаз. Только когда два измерения проводились на одной и той же фазе, данные использовались. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Результаты измерений P4 и E2 в течение 38 дней у одной мартышки.Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4: Определение и прогнозирование овуляторных дней. Следы овуляции считались присутствующими, если в яичниках наблюдались участки кровотечения или места разрыва. Ооцит/зигота указывает на стадии ооцита/зиготы, полученные из яйцеводов в день падения Е2. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Определение местоположения вены является наиболее важным этапом сбора крови. Основываясь на анатомических наблюдениях, этот протокол вводит проксимальную область в бедренном треугольнике как легкое место для сбора крови у мартышек. Используя эту область, можно легко провести забор крови из крупной вены. Однако даже при использовании этого протокола иногда происходит травмирование артерии. При повреждении артерии рекомендуется полная остановка кровотечения путем надавливания на >5 мин для предотвращения гематомы. Кроме того, при приложении давления также эффективно охлаждение точечного участка с помощью кубика льда. Гематомы можно лечить гепарином (например, гелем Tensolvet 5.000 I.E.). Большинство гематом исчезают после 3-4 дней лечения гепарином и 0,05 мл мелоксикама (0,5 мг/мл, p.o.). Артерия проходит латерально к вене в проксимальной области бедра. В дистальном отделе вена и артерия казались ближе друг к другу и перекрывались в большей степени, при этом артерия располагалась вентрально к вене. Основываясь на этом позиционном соотношении, забор крови из проксимальной области бедра, вероятно, снижает риск повреждения артерий.
Кроме того, бедренная вена в проксимальном отделе толстая и расположена поверхностно, что позволяет легко локализовать ее с помощью иглы. Тем не менее, забор крови из дистальной области имеет преимущество, заключающееся в том, что проксимальные участки остаются нетронутыми, что позволяет немедленно провести повторную венепункцию из проксимальной области той же ноги, даже если вена повреждена во время забора крови. Это связано с тем, что дистальная область поврежденного участка обычно недоступна для немедленной венепункции. Однако, если забор крови не удался, повторный забор крови может быть выполнен из проксимального участка на другой ноге.
Объем циркулирующей крови у игрунок составляет ~25 мл (70 мл/кг)23. Для созревания 350 г мартышки требуется 1 неделя для восстановления после забора крови 2 мл, что эквивалентно 7,5% от общего объема крови6. Из бедренных вен можно без труда собрать 500-700 мкл крови. При необходимости повторного отбора проб рекомендуется собирать меньшее количество крови и использовать буфер для разведения для автоматического анализатора.
Хотя анестезия обычно не используется для забора крови, для новичков забор крови у животных, находящихся под наркозом, может быть намного проще, чем у бодрствующих животных. Тем не менее, следует соблюдать осторожность при использовании анестезии для забора крови, поскольку анестезия может повлиять на измеренные значения компонентов крови. Что касается гормональных измерений для определения стадии овариального цикла, сообщалось, что алфаксолон приводит к неожиданно более высокому уровню P424. Это было вызвано перекрестной реактивностью антител против Р4 к алфаксолону, который является производным Р4.
Структуры Р4 и Е2 (стероидные гормоны) идентичны у человека и мартышки. Таким образом, коммерческие наборы ИФА для людей P4 и E2 доступны для мартышек P4 и E2. Также доступны аутсорсинговые услуги по измерению гормонов крови человека. Напротив, существуют небольшие различия в аминокислотных последовательностях для полипептидных гормонов, таких как FSH, CG и ингибин. Что касается этих полипептидных гормонов, если набор можно использовать как для людей, так и для других эволюционно далеких видов, таких как мыши, он будет работать и для мартышек. Для измерения ингибина В можно использовать набор для иммуноферментного анализа человека/мыши/крысы (бета-субъединица В).
Повышение уровня Р4 является отличительным признаком овуляции (перехода из фолликулярной в лютеиновую фазу). Хотя различия между индивидуумами затрудняют точное определение даты овуляции только по уровню Р4, уровень Р4 в >8 нг/мл может быть использован в качестве приблизительного индикатора возникновения овуляции. Более надежным показателем даты овуляции является снижение уровня Е2 3,17. Овуляционные ооциты/зиготы действительно наблюдались в яйцеводах в день снижения Е2 (табл. 4). Таким образом, измерение Е2 позволяет нам точно определить дату овуляции. Помимо гормонального фона, информация о количестве дней после введения PGF2α является предиктором дня овуляции (табл. 4). Аналогичным образом, комбинаторное использование уровней Р4 и Е2 помогает определить сроки перехода к фолликулярной фазе, когда уровни Р4 резко снижаются, а уровни Е2 находятся на самом низком уровне.
У мартышек КГ вместо ЛГ выделяется из гипофиза для индуцирования овуляции. Кроме того, КГ выводится из клеток трофобласта, когда эмбрионы прикрепляются к эндометрию и имплантируются в него. Поскольку у игрунок отсутствует функциональный ген ЛГ , КГ, вместо ЛГ, выделяется из гипофиза длястимуляции овуляции. В исследовании сообщалось, что пики Е2 и КГ, свидетельствующие об овуляции, наблюдаются в один и тот жедень 12. В другом исследовании сообщалось, что в среднем пики Е2 (через 8,6 дня после введения PGF2α) предшествуют пикам ХГ (через 9,3 дня после введения PGF2α)25, что указывает на то, что овуляция может произойти до достижения пиков КГ. Компьютерная графика, в отличие от Е2, высвобождается импульсом непосредственно перед своим пиком. Импульсное высвобождение КГ начинается, в среднем, за ~1 день до своего пика. Тем не менее, наблюдался большой разброс в продолжительности от первого обнаружения уровня CG до снижения уровня E2 (рисунок 3A и таблица 4). Кроме того, сообщается, что компьютерная графика впервые обнаруживается как в утренних, так и в дневных образцах25.
Насколько нам известно, нет никаких сообщений об овуляции у мартышек, происходящей в определенное время суток. Кроме того, мартышки обычно выделяют сразу два или три ооцита, поэтому может быть определенный период, в течение которого высвобождаются все ооциты. Поскольку повышение уровня компьютерной графики происходит перед овуляцией, измерение компьютерной графики позволяет заранее предсказать дату овуляции. Такая информация особенно полезна для сбора ооцитов MII или эмбрионов 0-го дня в день овуляции. Таким образом, полезно провести комбинаторное измерение уровней P4/E2 и CG в крови (рис. 3B). У большинства видов приматов, в том числе и у человека, овуляция не происходит в течение некоторого времени после родов. Однако послеродовая овуляция происходит у мартышек через ~10 дней после родов. Следовательно, следующая поставка часто наблюдается через ~155 дней после предыдущей поставки. Эта последовательная беременность вместе с рождением двойни приводит к высокому уровню плодовитости у мартышек.
Гормональные колебания варьируются у разных особей, и некоторые не имеют постоянного цикла. У некоторых самок мартышек наблюдается постоянный низкий уровень P4/E2, что свидетельствует об отсутствии овуляции. Отсутствие овуляторного цикла может быть связано с незрелостью, проблемами со здоровьем, стрессом или подавлением овуляции у доминирующих репродуктивных самок26,27. Трое из 21 мартышки (>2 года), измеряющие гормональный фон, показали отсутствие регулярного овуляторного цикла в учреждении автора. Понимание причин и разработка соответствующих методов лечения позволят более эффективно использовать животных в экспериментах. Наблюдались лица с длительной лютеиновой фазой ~1 месяц и связанным с ней высоким уровнем Р42. В учреждении автора длительная лютеиновая фаза повторяется у одних и тех же особей. У двух из 21 мартышки проявилась эта аномалия. Одно из двух животных содержалось в одном доме, что исключало возможность того, что животное было беременным во время длительной лютеиновой фазы. Другая находится в паре с предположительно бесплодным мужчиной с помощью лучевой терапии, и поэтому она вряд ли была беременна во время длительной лютеиновой фазы. Даже при длительной лютеиновой фазе введение PGF2α снижает уровень P4 и перезапускает овариальный цикл. Измерение половых гормонов и понимание состояния овуляционного цикла помогает эффективно использовать животных в экспериментах и разведении.
Забор крови у особей используется не только для определения даты овуляции, но и для серологических тестов в диагностических целях. Точно так же измерение уровня гормонов используется не только для оценки дня овуляции, но и для изучения социального взаимодействия, развития ребенка и болезней. В будущем для изготовления генетически модифицированных игрушек предполагается развитие яичников и семенников из iPS-клеток. Соответствующий гормональный фон должен быть важен для нормального развития. Описанный здесь протокол будет полезен для измерения и контроля половых гормонов для создания гонад, полученных из iPS-клеток, у мартышек.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Мы хотели бы поблагодарить Чуншэнь Шена, Хироко Акуцу, Фумиё Сугики, Юну Хасимото, Хину Наритоми, Юки Сакамото и Микико Хоригомэ за их поддержку в разработке этого протокола и в повседневном уходе за мартышками; Такаюки Минэсигэ за комментарии к рукописи; Юкико Абэ и сотрудники лаборатории Aiba за обмен методами сбора зигот; CIEA за обмен информацией о содержании мартышек и экспериментах, которые они культивировали на протяжении 40 лет. Исследование было поддержано компаниями AMED, JST и KAKENHI в рамках грантов NoNo JP19gm6310010, JP20gm6310010, JP21gm6310010 и JP22gm6310010 (AMED), JPMJPR228B (JST), 20H05764, 20H03177 и 22K18356 (KAKENHI).
Материалы
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
Ссылки
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены