Method Article
أخذ عينات الدم وقياس الهرمونات لتحديد المرحلة في دورة المبيض في Marmosets
In This Article
Summary
يصف هذا البروتوكول أخذ عينات الدم والبول لقياس مستويات البروجسترون / استراديول وموجهة الغدد التناسلية المشيمية لتحديد مرحلة دورة المبيض. تستخدم مستويات الهرمون للتنبؤ بتحديد توقيت الإباضة ويتم حقن الهرمونات لتنظيم دورة المبيض ونمو البويضة.
Abstract
marmosets المشتركة هي العالم الجديد الصغيرة. نظرا لأن العديد من آلياتها البيولوجية تشبه آليات البشر ، فمن المحتمل أن تكون المرموسيت مفيدة لأبحاث البيولوجيا الطبية والبشرية عبر مجموعة من المجالات ، مثل علم الأعصاب والطب التجديدي والتنمية. ومع ذلك ، هناك نقص في الأدبيات التي تصف طرق العديد من التجارب والإجراءات الأساسية. هنا ، يتم وصف طرق مفصلة لتحديد مستويات الهرمونات الجنسية (البروجسترون ، استراديول ، وموجهة الغدد التناسلية المشيمية) في marmosets. يتيح قياس هذه الهرمونات التنبؤ بالمرحلة في دورة المبيض ، والتي عادة ما تكون 26-30 يوما في marmosets. التحديد الدقيق ضروري لحصاد البويضات / الزيجوت في النقطة الزمنية الصحيحة ولإعداد الإناث المضيفة لتوليد marmosets المعدلة وراثيا.
بالإضافة إلى ذلك ، فإن قياس مستويات هرمون الجنس مفيد لدراسات الغدد الصماء ، وعلم السلوك ، والتطور المبكر ، ودراسات البيولوجيا الإنجابية. يوفر هذا البروتوكول وصفا مفصلا لطرق أخذ عينات الدم من الوريد الفخذي ، وفصل البلازما لقياس الهرمونات ، وقياس مستويات موجهة الغدد التناسلية المشيمية باستخدام البول والبلازما ، وإعادة ضبط دورة المبيض باستخدام حقن البروستاجلاندين F2α التناظرية لتقصير ومزامنة الدورة ، وتعزيز نمو الجريبات والإباضة عن طريق حقن الهرمون المنبه للجريب وموجهة الغدد التناسلية المشيمية. باستخدام هذه البروتوكولات ، يمكن تحديد المراحل في دورة المبيض لجمع البويضات / الزيجوت في الوقت المناسب.
Introduction
المرموسيت الشائع (Callithrix jacchus) هو صغير من العالم الجديد له العديد من الخصائص المشابهة لتلك الخاصة بالبشر ، ومدة دورة المبيض هي 26-30 يوما 1,2. تتطلب الدراسات حول التطور المبكر وتوليد القردة المعدلة وراثيا حصاد البويضات والزيجوتات في مراحل محددة من دورة المبيض. وبالتالي ، فإن التحديد الدقيق للمرحلة أمر بالغ الأهمية ويمكن تقديره عن طريق قياس مستويات الدم من هرمونات البروجسترون (P4) والإستراديول (E2) 2,3. هذه الهرمونات تعزز نمو بطانة الرحم ، وهو أمر ضروري للزرع. يتم إنتاج P4 من الجسم الأصفر ، الذي يتشكل في المبايض مباشرة بعد الإباضة. يتم إفراز E2 بواسطة بصيلات المبيض استجابة للهرمون المنبه للجريب (FSH) من مجمع ما تحت المهاد والغدة النخامية في الدماغ. تزداد مستويات E2 مع نضوج الجريب ، وتبلغ ذروتها قبل الإباضة3. مستويات عالية E2 تسبب الإفراج النبضي من هرمون اللوتين (LH) عن طريق مجمع ما تحت المهاد والغدة النخامية في البشر. هذا التدفق LH يحفز الإباضة. ومع ذلك ، في marmosets ، خضع جين LH للانحطاط أثناء التطور ، وبدلا من ذلك يتم تحفيز الإباضة عن طريق إطلاق موجهة الغدد التناسلية المشيمية (CG) ، والتي لها بنية مماثلة ل LH ، من الغدة النخامية 4,5.
يمكن التحكم في دورة المبيض عن طريق حقن الهرمونات. تعمل حقن FSH ، في البشر ، على مستقبلات هرمون FSH المبيض وتستخدم لتعزيز تخليق هرمون الاستروجين ونمو الجريب6. يستخدم حقن CG البشري (hCG) كبديل ل LH في نهاية المرحلة الجرابية لتحفيز الإباضة لدى البشر7. تستخدم حقن CG أيضا لعلاج العقم البشري لأن CG يحفز الجسم الأصفر في الحمل المبكر ، مما يؤدي إلى زيادة إنتاج P4. حقن البروستاجلاندين F2α (PGF2α) تعيد ضبط دورة المبيض8. في الماشية المنزلية ، يتم استخدام حقن PGF2α لتقصير المرحلة الصفراء ومزامنة دورة الشبق لإدارة الإنجاب.
على الرغم من أن والبشر لديهم آليات بيولوجية متشابهة ، مما يجعلها نموذجية مثالية ، إلا أن هناك نقصا في الأدبيات التي تصف الطرق الأساسية للعديد من التقنيات المستخدمة في كثير من الأحيان. أخذ عينات الدم هي واحدة من أكثر التقنيات المستخدمةفي كثير من الأحيان 9،10،11،12. ومع ذلك ، يواجه المبتدئين أحيانا صعوبة في العثور على الوريد. ومن ثم ، أجرت هذه الدراسة تحليلات تشريحية لمنطقة الوريد الفخذي. استنادا إلى الملاحظات التشريحية ، يقدم هذا البروتوكول المنطقة القريبة من المثلث الفخذي كموقع سهل لبزل الوريد.
Protocol
استخدمت جميع الطرق التي تنطوي على marmosets معايير أخلاقية ورفاهية عالية وتمت الموافقة عليها من قبل اللجنة المؤسسية لرعاية واستخدام في المركز الوطني لصحة الطفل والتنمية. كانت المستخدمة هنا ذات منزل واحد أو منزل مزدوج (أنثى واحدة وذكر) مع 12 ساعة من الضوء يوميا.
1. أخذ عينات الدم من الوريد الفخذي
- قم بإعداد حقنة سعة 1 مل (النوع القصير سهل الاستخدام) بشفرة 25 جرام متصلة بشفرة لأعلى. لتجنب انسداد الدم ، قم بتسخين المحقنة عن طريق سحب 200 ميكرولتر من محلول صوديوم الهيبارين غير المخفف في المحقنة. قم بتغطية الجزء الداخلي من المحقنة بالتساوي عن طريق سحبها لأعلى ولأسفل عدة مرات ؛ ثم ، طرد محلول الهيبارين من المحقنة.
ملاحظة: نظرا لأن التغيير إلى حقنة جديدة غالبا ما يكون ضروريا ، فقم بإعداد بعض المحاقن الإضافية الهيبارين. - تحضير مسحات القطن والكحول الماصة. قم بتشغيل مصباح قابل للتعديل لإلقاء الضوء على المنطقة التي سيتم وضع فيها لأخذ عينات الدم.
- قم بإعداد جهاز التقييد (420 × 85 × 85 مم ، الشكل 1 أ) ، وهو متاح تجاريا (انظر جدول المواد للحصول على التفاصيل). لوضع marmoset في الجهاز ، افتح جزء الاحتفاظ بحزام الإسفنج ، الذي يؤمن marmosets. أدخل المرموسيت في جهاز التقييد متجها لأعلى.
ملاحظة: عادة ما تكون Marmosets هادئة في أجهزة التقييد التي قد تلغي الحاجة إلى التأقلم أو التدريب على ضبط النفس. - القبض على marmoset. أدخل المرموسيت في الجزء الأسطواني ؛ وقم بتثبيته بالضغط على حزام الإسفنج. ضع الساق التي سيتم جمع الدم منها فوق الأخرى (الشكل 1 أ). امسك الساقين باستخدام اليد غير المهيمنة ؛ ضع الأصابع الوسطى والبنصر داخل كل ساق لربطها والأصابع الأخرى خارج كل ساق لإصلاحها.
ملاحظة: يوصى باستخدام قفازات العض عند التقاط المارموسيت. في حالة عدم وجود جهاز تقييد ، قم بجمع الدم تحت التخدير أو مع شخص آخر يقيد المارموسيت. - تحقق مما إذا كان الوريد الفخذي مرئيا بالقرب من قاعدة الفخذ. إذا لم يكن الأمر كذلك ، فقم بالجس للعثور على الشريان النابض واستخدمه كمعلم للتحقق من أن الوريد يمتد بداخله (الشكل 1B-D).
ملاحظة: يوصى باستخدام إضاءة المكتب وحلاقة الشعر لتحسين الرؤية. يمكن أيضا تحسين الرؤية عن طريق الاحتكاك بمسحات الكحول. غالبا ما تقع الغدد الليمفاوية في المثلث بالقرب من الوريد وتظهر لونا أزرق داكنا كوريد. كيفية التمييز بينها موصوفة في قسم النتائج التمثيلية. - تطهير موقع ثقب باستخدام مسحة الكحول. أدخل جانب شفرة الإبرة لأعلى بزاوية 15 درجة -20 درجة. لمنع الإبرة من الانزلاق من الأوعية الدموية أثناء جمع الدم ، قم بتثبيت اليد التي تحمل المحقنة ، على سبيل المثال ، عن طريق وضعها من ناحية أخرى.
- اسحب المكبس برفق لتطبيق الضغط السلبي (الشكل 1E). ادفع طرف الإبرة للأمام. بمجرد دخول الدم إلى المحقنة ، حافظ على موضع طرف الإبرة حتى يتم جمع الحجم المطلوب (500-700 ميكرولتر).
- عندما لا يدخل الدم إلى المحقنة ، قم بتغيير موقع الثقب. إذا خرج الدم عند سحب الإبرة ، توقف عن النزيف عن طريق الضغط على موقع البزل لمدة 3 دقائق. بعد إيقاف النزيف ، أعد تشغيل بزل الوريد.
- إذا توقف الدم الذي يتم سحبه إلى المحقنة عن التدفق أثناء عملية السحب ، ادفع طرف الإبرة ببطء للأمام ثم اسحبه للخلف للعثور على الوعاء الدموي. هذا قد يعيد تدفق الدم إلى المحقنة. إذا لم يكن كذلك ، اسحب الإبرة وقم بإجراء بزل الوريد باستخدام حقنة جديدة.
ملاحظة: استخدم الفخذ على الساق الأخرى عندما يكون من الصعب جمع الدم من نفس الجانب.
- اسحب الإبرة بعناية أثناء الضغط برفق على موقع البزل باستخدام الإصبع الصغير. ثم ، باستخدام قطعة قطن ماصة ، اضغط على الفور على موقع البزل لمدة 3 دقائق لوقف النزيف. اقلب المحقنة لخلط الدم والهيبارين.
ملاحظة: اضغط لفترة أطول (5 دقائق) أثناء التبريد عند سحب الدم الشرياني ، وتأكد بعناية من توقف النزيف لمنع تكوين ورم دموي ، مما قد يؤدي في بعض الأحيان إلى نتيجة مميتة. - بعد التأكد من توقف النزيف ، قم بإزالة الحزام الإسفنجي ، وأمسك خصر باستخدام يد واحدة ، وقم بتدوير حتى يتمكن المرء من حمل إبط باستخدام يد أخرى من المؤخر.
- أعد المرموسيت إلى قفصه. لتقليل التوتر وتسهيل أخذ عينات الدم المتكررة ، زود المرموسيت بطعامه المفضل (على سبيل المثال ، البسكويت أو أعشاب من الفصيلة الخبازية أو كعكة إسفنجية). تحقق من حدوث ورم دموي في بعض الأحيان.
ملاحظة: عندما يتم العثور على ورم دموي في مرحلة مبكرة ، ضع ضمادة ضغط لمنع تطور الورم الدموي. عندما يتم العثور عليه بعد فترة طويلة ، قد تكون هناك حاجة إلى الاستئصال الجراحي للورم الدموي مع ربط الشريان الفخذي ونقل الدم 9,13. - افصل الإبرة عن المحقنة لمنع انحلال الدم. ثم اطرد الدم الذي تم جمعه ببطء على طول الجدار الداخلي لأنبوب دقيق سعة 1.5 مل.
ملاحظة: يمكن تخزين الدم الذي تم جمعه عند 4 درجاتمئوية لمدة تصل إلى 24 ساعة قبل فصل البلازما لقياس مستويات P4 / E2.
2. فصل البلازما وتحديد المستويات الهرمونية
- جهاز طرد مركزي الدم في أنبوب 1.5 مل عند 1100 × جم لمدة 5 دقائق عند 4 درجةمئوية.
- انقل البلازما المنفصلة (طاف) من أنبوب سعة 1.5 مل إلى أنبوب / كوب جديد ، مع تجنب بعناية إدراج خلايا الدم (الرواسب).
- قم بقياس مستويات P4 و E2 باستخدام مجموعة ELISA أو محلل تلقائي. إذا كانت كمية البلازما غير كافية للمحلل التلقائي ، فاستخدم محلول تخفيف العينة.
ملاحظة: للقياس باستخدام محلل أوتوماتيكي ، يلزم >175 ميكرولتر من البلازما لتحديد مستوى P4 فقط ، و >250 ميكرولتر من البلازما لتحديد كل من P4 و E2.
3. قياس CG البول للكشف عن الإباضة والحمل
ملاحظة: يمكن قياس مستويات CG في marmosets باستخدام اختبار مجموعة الكروماتوغرافيا المناعية لكل من الإباضة والحمل. في حالة الإباضة ، يمكن الحصول على نتيجة إيجابية قبل 0-2 أيام من الإباضة. في حالة الحمل ، يتم الكشف عن نتيجة إيجابية من 15-20 إلى يوم 100 تقريبا من الحمل. يتطلب الاختبار كمية صغيرة (90 ميكرولتر) من البول (قطرة واحدة من البول ~ 30 ميكرولتر).
- طريقة الدرج: إذا كان هناك أكثر من حيوانين في نفس القفص ، انقل المرموسيت المستهدف (أو الأخرى) إلى قفص آخر في اليوم السابق. ضع صينية نظيفة في أسفل القفص في الليلة السابقة أو السابقة للإضاءة. لا يتم تصريف البول من المثانة أثناء الليل. لذلك ، عادة ما يتم إطلاق البول من المثانة بعد فترة وجيزة من الإضاءة.
ملاحظة: قد يؤدي دخول الغرفة في الصباح قبل الإضاءة إلى تعطيل دورة نوم المجموعة. يمكن عادة جمع البول في غضون 30 دقيقة تقريبا بعد الإضاءة. - طريقة الضغط: تحضير الصواني المغسولة لجمع البول. بعد تحديد موقع مثانة المرموسيت ، اضغط عليها بعناية من الأمام وكلا الجانبين باستخدام طول الأصابع بالكامل (الشكل 1F). اجمع البول قبل إضاءة الغرفة في الصباح.
ملاحظة: إذا لم ينجح جمع البول بسبب عدم وجود بول في المثانة ، فانتظر بعض الوقت وحاول مرة أخرى. احرص على عدم استخدام القوة المفرطة لأن هذا سيصيب. - مباشرة بعد التجميع ، ضع عينة البول في بئر مجموعة اختبار الكروماتوغرافيا المناعية. اقرأ النتيجة بعد 10 دقائق وفقا لتعليمات الشركة المصنعة.
4. ضبط وتحديد مرحلة دورة المبيض لجمع البويضات والزيجوتات والأجنة
- الحويصلة الجرثومية (GV) جمع البويضات من المبيضين
- تطبيق حقنة عضلية مقدارها 3 ميكرولتر من 0.263 ملغم/مل كلوبروستينول (نظير اصطناعي PGF2α) مخفف في 150 ميكرولتر من محلول ملحي14 (الشكل 2) لإعادة ضبط دورة المبيض في نهاية الطور الأصفر (أي ≥بعد 10 أيام من بدء المرحلة الصفراء).
ملاحظة: قد يكون صنع المحلول المخفف بكميات أكبر مناسبا لأن الكلوبروستينول المخفف يظل مستقرا لعدة أسابيع على الأقل عند +4 درجة مئوية. - في اليوم التالي (اليوم 1) ، تأكد من بدء المرحلة الجرابية عن طريق التحقق من انخفاض مستوى P4.
ملاحظة: تم الإبلاغ عن حقن كلوبروستينول ليقلل بشكل كبير من مستويات P4 (عادة <10 نانوغرام / مل) في غضون 24 ساعة3. - من اليوم الأول ، حقن FSH (25 وحدة دولية ، في العضل) مرة واحدة كل يومين ليصبح المجموع 5x (الأيام 1 و 3 و 5 و 7 و 9). في اليوم 10 ، حقن قوات حرس السواحل الهايتية (75 وحدة دولية ، في العضل) في فترة ما بعد الظهر.
- جمع GVs من المبايض في اليوم 11 عن طريق الشفط المسامي تحت التخدير وفقا للأدبيات15،16.
ملاحظة: في بعض الأحيان ، يحدث الإباضة في وقت أبكر من المتوقع. وبالتالي ، يوصى بالتحقق من مستويات CG من اليوم 8. إذا كان اختبار CG إيجابيا ، فقم بإجراء جمع GV في هذا اليوم.
- تطبيق حقنة عضلية مقدارها 3 ميكرولتر من 0.263 ملغم/مل كلوبروستينول (نظير اصطناعي PGF2α) مخفف في 150 ميكرولتر من محلول ملحي14 (الشكل 2) لإعادة ضبط دورة المبيض في نهاية الطور الأصفر (أي ≥بعد 10 أيام من بدء المرحلة الصفراء).
- مجموعة من بويضات الطور الثاني (MII) والزيجوتات والأجنة المبكرة
- إعادة تعيين دورة المبيض باستخدام كلوبروستينول كما هو موضح في الخطوة 4.1.1.
- في اليوم التالي (اليوم 1) ، تأكد من بدء المرحلة الجرابية عن طريق التحقق من انخفاض مستوى P4.
- لجمع الزيجوت والأجنة ، منزل marmosets الإناث جنبا إلى جنب مع marmosets الذكور للتزاوج من يوم 6.
- من اليوم 7 ، تحقق من مستويات الدم P4 / E2 ومستويات CG البول للإناث. الكشف عن CG هو مؤشر على الإباضة في غضون بضعة أيام (عادة في اليوم التالي). في اليوم الذي تزداد فيه مستويات P4 وتنخفض مستويات E2 مقارنة باليوم السابق ، اجمع بويضات MII أو الزيجوت الجنيني في اليوم 0 (E0) من قنوات البيض17,18.
- لجمع الأجنة ، كما هو موضح في الأدبيات ، قم بإجراء التنظيف إما من قنوات البيض (E1-E3 ، 1-8 خلايا)17,18 أو الرحم (E5-E10 ، 8 خلايا - الكيسة الأريمية)19،20،21،22 في النقطة الزمنية المناسبة ، اعتمادا على المرحلة المستهدفة.
النتائج
التفاصيل المتعلقة بالحيوانات المستخدمة في هذه الدراسة مذكورة في الجدول 1.
التحاليل التشريحية للوريد الفخذي
تم إجراء التحليلات التشريحية للوريد الفخذي باستخدام ذكر من الذكور يبلغ من العمر 2 (I 7713M) يخضع للقتل الرحيم. تقع الأوردة والشرايين الفخذية في مثلث الفخذ. يتكون المثلث الفخذي عند الحدود بين جدار البطن وعضلات الفخذ (الشكل 1B-D). عند قاعدة الفخذ ، يمر الوريد الكبير عبر مركز المثلث المقلوب ، ويمتد الشريان بالتوازي خارج الوريد. في المنطقة السفلية ، تصبح الأوردة والشرايين أرق وتتداخل ، مع وضع الشرايين أعلى الأوردة (الشكل 1 د).
لأخذ عينات الدم ، يجب استهداف الوريد لأن إصابة الشرايين يمكن أن تسبب ورم دموي في الشريان الفخذي ، مما قد يؤدي إلى صدمة قلبية وعائية عندما يكون النزف شديدا13. على الرغم من أنه يمكن سحب الدم من أي جزء من الوريد في المثلث ومنطقته البعيدة ، يوصى ببزل الوريد من الموقع القريب من مثلث الفخذ بسبب الحجم الكبير للوريد وتداخله القليل على ما يبدو مع الشريان. بالإضافة إلى ذلك ، فإن الوريد في الموقع القريب سطحي ، مما يسمح بتحديد الموقع بسهولة باستخدام إبرة. نظرا لأنه ينبض ، يتم تحديد الشريان الموجود في مثلث الفخذ أحيانا بصريا أو عن طريق الجس ، ويمتد الوريد إليه فقط من الإنسي. وبالتالي ، فإن مراقبة نبض الشريان يساعد على التنبؤ بموقع الوريد.
علاوة على ذلك ، عادة ما يتم ملاحظة اللون الأزرق الذي يشير إلى الوريد تحت الجلد في الجزء العلوي من المثلث (الشكل 1B ، C). ومع ذلك ، غالبا ما توجد الغدد الليمفاوية في المثلث بالقرب من الوريد وتظهر لونا أزرق داكنا ، لذلك يكون مظهرها مشابها. لحسن الحظ ، يمكن تمييزها عن طريق حركتها: الوريد ثابت ، والغدد الليمفاوية متحركة. وبالتالي ، فإن نبض الشريان واللون الأزرق للوريد هما دليلان رئيسيان يستخدمان لتحديد موقع الوريد ، على الرغم من أنه قد يكون من الضروري حلق الشعر لتصورهما.
تحديد المرحلة في دورة المبيض
تم رصد مستويات P4 و E2 في ست إناث من (تتراوح أعمارهن من 1 إلى 3 سنوات) للتحقيق في مدة المراحل الجرابية والأصفر. أظهرت النتائج متوسط مدة 11.58 يوما (ن = 6 من أربعة مارموسيت) و 16.8 يوما (ن = 5 من ثلاث مارموسيت) للمراحل الجرابية والصفراء ، على التوالي (الجدول 2). في ما يلي ، يتم وصف ديناميكيات P4 و E2 لواحد (I6751F ، 3 سنوات) من الستة بالتفصيل. تم إجراء أخذ عينات الدم والقياسات الهرمونية في هذا كل بضعة أيام لمدة 38 يوما (الجدول 3).
المرحلة الصفراء (الأيام 1-10)
تم تعيين يوم بدء القياس على أنه اليوم 1. استنادا إلى مستوى P4 (21 نانوغرام / مل) ، كان على الأرجح في المرحلة الصفراء. لوحظ ارتفاع مستوى P4 من الأيام 1 إلى 10 (≥21 نانوغرام / مل) ، مما يشير إلى المرحلة الصفراء. في اليوم 12 ، انخفض بشكل حاد إلى 4 نانوغرام / مل. يشير هذا الانخفاض الكبير إلى الانتقال من المرحلة الصفراء إلى المرحلة المسامية. كما دعم هذا الانتقال انخفاض في مستوى E2 من اليوم 10 (241 نانوغرام / مل) إلى 12 (189 نانوغرام / مل).
المرحلة الجرابية (الأيام 12-22)
بعد الانتقال إلى المرحلة الجرابية ، ظل مستوى P4 منخفضا (4-6 نانوغرام / مل) حتى اليوم 19 ثم زاد قليلا من اليوم 19 إلى 24 (اليوم 19 ، 6 نانوغرام / مل ؛ اليوم 22 ، 8 نانوغرام / مل ؛ اليوم 24 ، 9 نانوغرام / مل). وعلى النقيض من ذلك، ارتفع مستوى E2 زيادة كبيرة من اليوم 19 (94 نانوغرام/مل) إلى 22 (322 نانوغرام/مل) ثم انخفض من اليوم 22 إلى 24 (158 نانوغرام/مل). بناء على زيادة مستويات P4 وانخفاض مستويات E2 ، كان من المتوقع أن يحدث الإباضة بين اليومين 22 و 24 ، والانتقال من المرحلة الجرابية إلى المرحلة الصفراء.
المرحلة الصفراء (الأيام 24-36)
بعد الإباضة ، ظل مستوى P4 مرتفعا حتى اليوم 36 ثم انخفض إلى 3 نانوغرام / مل في اليوم 38. وبالتالي ، فمن المحتمل أن يكون الانتقال من المرحلة الصفراء إلى المرحلة الجرابية قد حدث بين الأيام 36-38. واتساقا مع هذا التحول، انخفض مستوى E2 خلال هذه الفترة (اليوم 36، 2517 نانوغرام/مل؛ اليوم 38، 73 نانوغرام/مل).
التنبؤ وتحديد توقيت الإباضة
لفحص العلاقة بين مستوى CG في البول وتاريخ الإباضة ، تم تحضير سبعة قمر (رقم 1-7). تم حقن كلوبروستينول لإعادة ضبط دورة التبويض (اليوم 0). بعد ذلك ، تم إجراء مراقبة مستويات الدم P4 / E2 ومستويات CG في البول من اليوم 7. تم جمع البول مباشرة بعد الإضاءة. تم أخذ عينات الدم بشكل أساسي في الصباح. كان من المفترض أن الإباضة تحدث عندما انخفض مستوى E2 إلى حد كبير مقارنة باليوم السابق كما ورد في17. في ذلك اليوم ، لوحظ بالفعل تمزق الجريبي على سطح المبايض ، ووجود زيجوت / بويضات في قنوات البيض (الجدول 4).
تم اكتشاف CG لأول مرة خلال الأيام من 7 إلى 11 (اليوم 7 ، N = 1 ؛ اليوم 8 ، N = 2 ؛ اليوم 9 ، N = 1 ؛ اليوم 10 ، N = 2 ؛ اليوم 11 ، N = 1) (الجدول 4). لوحظ انخفاض كبير في مستويات E2 (إشارة الإباضة) بعد 0-3 أيام من إشارة CG الأولى. بدت المدة من أول اكتشاف CG إلى انخفاض E2 كبيرة عندما كان أول اكتشاف CG في وقت سابق (الشكل 3A). على سبيل المثال ، أظهر واحد (رقم 1) انخفاضا في إشارة E2 بعد 3 أيام من اكتشاف CG الأول في اليوم 7 (الجدول 4). في المقابل ، لوحظ تزامن أول اكتشاف CG وانخفاض إشارة E2 في واحد (رقم 2) في اليوم 10. وهكذا ، على الرغم من أن أول اكتشاف CG والإباضة لوحظ في نفس اليوم في أحد الخمسة ، حدث الإباضة في غضون أيام قليلة بعد الكشف الأول عن CG.
تم تصميم مجموعة اختبار الكروماتوجرافي المناعي ل marmoset CG لاستخدام البول للاختبار. عادة ما يصاحب فحص مستوى CG تحديد مستويات P4 / E2 باستخدام بلازما الدم. سيكون من المفيد إذا كان من الممكن استخدام بلازما الدم ، بدلا من البول ، لاختبار CG. لاختبار ذلك ، تم فحص بلازما الدم التي تركت بعد قياس مستوى P4 / E2 في التجارب المذكورة أعلاه. تم جمع بلازما الدم والبول من الحيوانات الأربعة في أي من أيام التجارب المذكورة أعلاه (تمت الإشارة إلى أيام الفحص بعلامات نجمية مزدوجة [**] في الجدول 4). باستخدام البول ، أظهر اثنان من الحيوانات الأربعة نتائج إيجابية (الدرجات 5 و 3) ، وأظهر الآخران نتائج سلبية (النتيجة 1). أظهرت بلازما الدم بشكل أساسي نفس نتائج البول (الشكل 3 ب). تم الحصول على إشارة أقوى باستخدام بلازما الدم. لذلك ، عند استخدام بلازما الدم ، يجب أن يصدر الحكم قبل 10 دقائق ، والتي يتم تعيينها للبول.
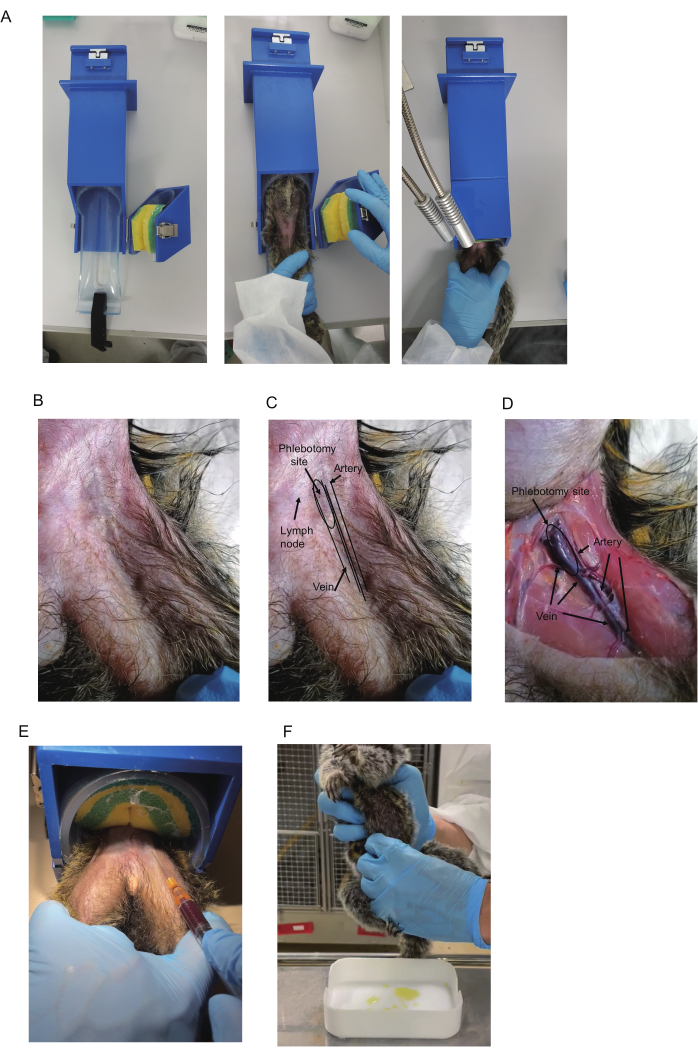
الشكل 1: جمع الدم من المرموسيت. (أ) يستخدم المقيد لجمع الدم. ب: المرموسيت أعلى الفخذ. ج: مثلث الفخذ والأوعية الدموية. غالبا ما يكون الشريان الفخذي في المثلث مرئيا ويظهر النبض. يظهر اللون الأزرق للوريد الفخذي أحيانا في المنطقة القريبة من المثلث (يشار إليه باسم موقع الفصد). الغدد الليمفاوية تظهر أيضا اللون الأزرق. ومع ذلك ، فإن الغدد الليمفاوية متحركة حيث ترتبط الغدد الليمفاوية بالجلد. د: منظر تشريحي لفخذ الذي قتل رحيما. يشار إلى موقع الشريان والوريد والفصد. يظهر نفس في B-D. ه: جمع الدم باستخدام مقيد. يظهر وضع تثبيت ساقي المرموسيت والدم الذي يتم سحبه. (و) جمع البول من حيوان المرموسيت. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
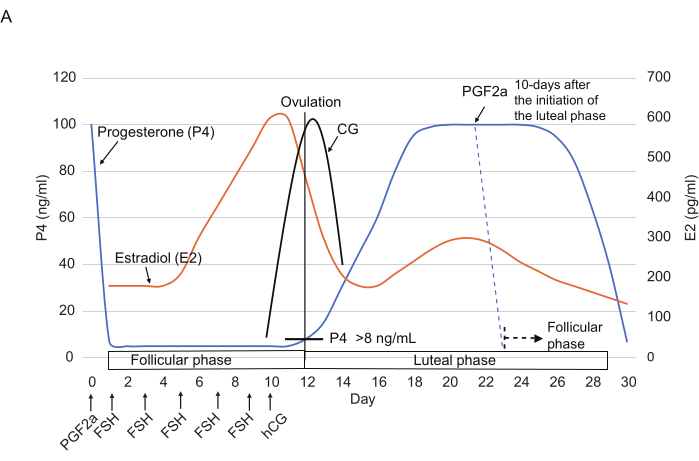
الشكل 2: الأنماط النموذجية لمستويات P4 و E2 و CG أثناء دورة المبيض في marmosets. يشار إلى النقاط الزمنية لحقن FSH و hCG و PGF2α. تظهر الخطوط المتقطعة النمط الهرموني المتوقع بعد حقن PGF2α. الاختصارات: P4 = البروجسترون. E2 = استراديول ؛ CG = موجهة الغدد التناسلية المشيمية. FSH = هرمون محفز للجريب. قوات حرس السواحل الهايتية = موجهة الغدد التناسلية المشيمية البشرية. PGF2α = البروستاجلاندين F2α. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
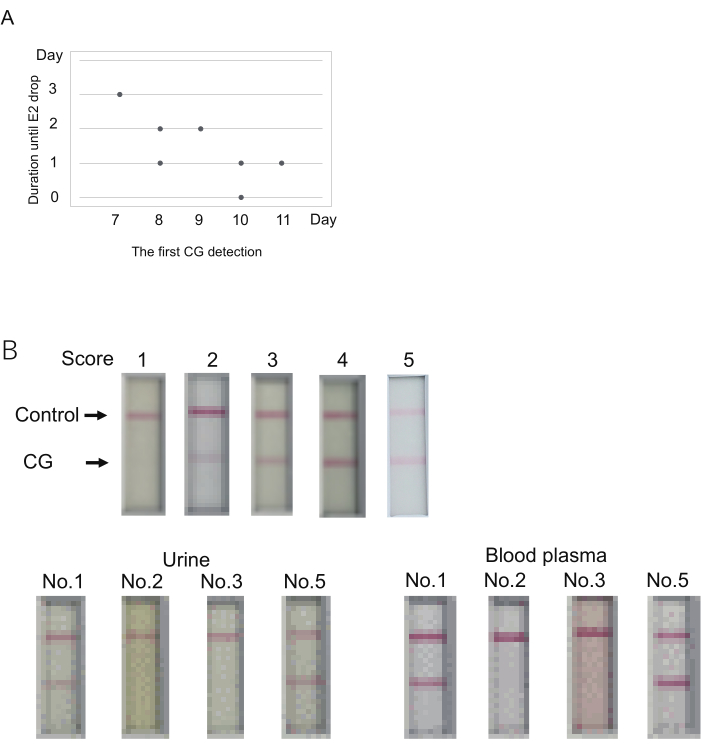
الشكل 3: تحديد مستوى CG للتنبؤ بحدوث التبويض. (أ) العلاقة المحتملة بين اليوم الأول للكشف عن CG (الدرجة > 1) والمدة حتى الإباضة (انخفاض E2). (ب) يمكن استخدام بلازما الدم في اختبارات CG الكروماتوجرافية المناعية. نتيجة تمثيلية لكل درجة (أعلى). تم تحديد النتيجة بعد 10 دقائق من تحميل العينة. النتيجة 2 لا تمثل أي فرقة في غضون 5 دقائق ولكن ظهور فرقة في غضون 10 دقائق. تم جمع الدم بعد وقت قصير من جمع البول. تم فحص أربعة مارموسيت (رقم 1 ، 2 ، 3 ، 5 في الجدول S4). يشار إلى العينات المستخدمة هنا كعلامات نجمية مزدوجة في الجدول 4. تم تخفيف بلازما الدم إلى 50٪ عن طريق المخزن المؤقت للتخفيف المستخدم لقياس E2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: مدة المراحل الجرابية والأصفر. تم تحديد المرحلة بناء على مستوى P4 (المرحلة الجرابية P4 ≤ 8 ، المرحلة الصفراء P4 > 8). عندما لوحظ تغير الطور بين القياسات ، تم تحديد نقطة المنتصف بين تواريخ القياس لتكون نقطة التغيير. اعتبرت المدة بين نقطتي التغيير مراحل مسامية أو صفراء. ولضمان قياس مدة مرحلة واحدة، لم تستخدم في التحليلات البيانات ذات الفاصل الزمني الطويل (≥7 أيام) أو مرتين من ≥6 أيام في نفس المرحلة، بما في ذلك عند تغطية المرحلتين. فقط عندما تم إجراء قياسين في نفس المرحلة ، تم استخدام البيانات. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: نتائج قياسات P4 و E2 لمدة 38 يوما في مارموسيت واحد.الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 4: تحديد أيام التبويض والتنبؤ بها. اعتبرت آثار الإباضة موجودة إذا لوحظت مواقع النزيف أو مواقع التمزق في المبايض. تشير البويضة / الزيجوت إلى مراحل البويضة / الزيجوت التي تم الحصول عليها من قنوات البيض في يوم انخفاض E2. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
تحديد موقع الوريد هو الخطوة الأكثر أهمية في جمع الدم. استنادا إلى الملاحظات التشريحية ، يقدم هذا البروتوكول المنطقة القريبة في مثلث الفخذ كموقع سهل لجمع الدم في المرموسيت. باستخدام هذه المنطقة ، يمكن إجراء أخذ عينات الدم من الوريد الكبير بسهولة. ومع ذلك ، حتى باستخدام هذا البروتوكول ، تحدث إصابة الشريان في بعض الأحيان. عند إصابة الشريان ، يقترح التوقف التام للنزيف عن طريق الضغط لمدة >5 دقيقة لمنع الورم الدموي. بالإضافة إلى ذلك ، أثناء الضغط ، يكون تبريد موقع التنقيط باستخدام مكعب ثلج فعالا أيضا. يمكن علاج الأورام الدموية بالهيبارين (على سبيل المثال ، Tensolvet 5.000 I.E. gel). تختفي معظم الأورام الدموية بعد 3-4 أيام متتالية من العلاج بالهيبارين و 0.05 مل من ميلوكسيكام (0.5 مجم / مل ، p.o.). يمتد الشريان بشكل جانبي إلى الوريد في المنطقة القريبة من الفخذ. في المنطقة البعيدة ، بدا الوريد والشريان أقرب إلى بعضهما البعض وتداخلا إلى حد كبير ، مع وجود الشريان البطني إلى الوريد. بناء على هذه العلاقة الموضعية ، من المحتمل أن يكون لأخذ عينات الدم من المنطقة القريبة من الفخذ خطر أقل للإصابة الشريانية.
بالإضافة إلى ذلك ، فإن الوريد الفخذي في المنطقة القريبة سميك ويقع بشكل سطحي ، مما يسمح بتحديد موقعه بسهولة باستخدام إبرة. ومع ذلك ، فإن أخذ عينات الدم من المنطقة البعيدة له ميزة ترك المواقع القريبة سليمة ، مما يسمح ببزل الوريد المتكرر الفوري من المنطقة القريبة من نفس الساق ، حتى في حالة تلف الوريد أثناء أخذ عينات الدم. وذلك لأن المنطقة البعيدة من الموقع المتضرر عادة ما تكون غير متاحة لبزل الوريد الفوري. ومع ذلك ، عندما لا ينجح جمع الدم ، يمكن إجراء أخذ عينات متكررة من الموقع القريب على الساق الأخرى.
حجم الدم المتداول في marmosets هو ~ 25 مل (70 مل / كجم) 23. يتطلب 350 جم من المرموسيت أسبوعا واحدا للتعافي من أخذ عينات دم 2 مل ، أي ما يعادل 7.5٪ من إجمالي حجم الدم6. من الأوردة الفخذية ، يمكن جمع 500-700 ميكرولتر من الدم دون صعوبة. عند الحاجة إلى أخذ عينات متكررة ، يوصى بجمع كميات أقل من الدم واستخدام مخزن مؤقت للتخفيف للمحلل التلقائي.
على الرغم من أن التخدير لا يستخدم بشكل عام لأخذ عينات الدم ، بالنسبة للمبتدئين ، قد يكون أخذ عينات الدم من المخدرة أسهل بكثير من المستيقظة. ومع ذلك ، هناك ما يبرر الحذر عند استخدام التخدير لأخذ عينات الدم لأن التخدير يمكن أن يؤثر على القيم المقاسة لمكونات الدم. فيما يتعلق بالقياسات الهرمونية لتحديد المرحلة في دورة المبيض ، أفيد أن الفاكسال وحده أدى إلى مستويات أعلى بشكل غير متوقع من P424. كان هذا بسبب التفاعل المتبادل للأجسام المضادة ل P4 مع alfaxalone ، وهو مشتق P4.
هياكل P4 و E2 (هرمونات الستيرويد) متطابقة بين البشر والمارموسيت. وبالتالي ، فإن مجموعات ELISA التجارية للبشر P4 و E2 متاحة ل marmoset P4 و E2. تتوفر أيضا خدمات الاستعانة بمصادر خارجية لقياس هرمون الدم البشري. على النقيض من ذلك ، هناك اختلافات طفيفة في تتابعات الأحماض الأمينية لهرمونات عديد الببتيد ، مثل FSH و CG و Inhibin. بالنسبة لهرمونات عديد الببتيد هذه، إذا كان من الممكن استخدام مجموعة أدوات لكل من البشر والأنواع التطورية البعيدة الأخرى، مثل الفئران، فإنها ستعمل مع أيضا. لقياس Inhibin B ، يمكن استخدام مجموعة المقايسة المناعية للإنزيم البشري / الفأر / الجرذ Inhibin B (الوحدة الفرعية Beta B).
الزيادة في مستوى P4 هي السمة المميزة للإباضة (الانتقال من المرحلة الجرابية إلى المرحلة الصفراء). على الرغم من أن الاختلافات بين الأفراد تجعل من الصعب تحديد تاريخ الإباضة من المستوى P4 وحده ، يمكن استخدام مستوى P4 البالغ >8 نانوغرام / مل كمؤشر تقريبي لحدوث الإباضة. مؤشر أكثر موثوقية لتاريخ الإباضة هو انخفاض في مستوى E2 3,17. وقد لوحظت بالفعل البويضات / الزيجوتات المبيضة في قنوات البيض في يوم انخفاض E2 (الجدول 4). وبالتالي ، فإن قياس E2 يمكننا من تحديد تاريخ الإباضة بالضبط. إلى جانب المستويات الهرمونية ، فإن المعلومات المتعلقة بعدد الأيام بعد إعطاء PGF2α هي مؤشر ليوم الإباضة (الجدول 4). وبالمثل ، يساعد الاستخدام التوافقي لمستويات P4 و E2 على تحديد توقيت الانتقال إلى المرحلة الجرابية ، عندما تنخفض مستويات P4 بشكل كبير وتكون مستويات E2 في أدنى مستوياتها.
في مربى القرق، ينطلق CG، بدلا من الهرمون اللوتيني، من الغدة النخامية للحث على الإباضة. بالإضافة إلى ذلك ، يتم إفراز CG من خلايا الأرومة الغاذية عندما تلتصق الأجنة ببطانة الرحم وتزرع فيها. نظرا لأن marmosets تفتقر إلى جين LH وظيفي ، يتم إطلاق CG ، بدلا من LH ، من الغدة النخامية لتحفيز الإباضة5. ذكرت دراسة أن قمم E2 و CG ، التي تدل على الإباضة ، لوحظت في نفس اليوم12. أفادت دراسة أخرى أنه في المتوسط، تسبق قمم E2 (8.6 أيام بعد إعطاء PGF2α) قمم CG (9.3 أيام بعد إعطاء PGF2α)25، مما يشير إلى أن الإباضة قد تحدث قبل الوصول إلى قمم CG. CG ، على عكس E2 ، يتم إطلاقه بالنبض قبل ذروته مباشرة. يبدأ إطلاق نبض CG ، في المتوسط ، ~ 1 يوم قبل ذروته. ومع ذلك ، لوحظ تباين كبير في المدة من الكشف الأول عن مستوى CG إلى الانخفاض في مستوى E2 (الشكل 3A والجدول 4). بالإضافة إلى ذلك ، تم الإبلاغ عن اكتشاف CG لأول مرة في كل من عينات الصباح وبعد الظهر25.
على حد علمنا ، لا يوجد تقرير عن الإباضة في marmosets التي تحدث في وقت معين من اليوم. بالإضافة إلى ذلك ، عادة ما تطلق marmosets اثنين أو ثلاثة من البويضات في وقت واحد ، لذلك قد تكون هناك فترة معينة يتم خلالها إطلاق جميع البويضات. نظرا لحدوث زيادة في مستويات CG قبل الإباضة ، فإن قياس CG يتيح التنبؤ بتاريخ الإباضة مسبقا. هذه المعلومات مفيدة بشكل خاص لجمع بويضات MII أو أجنة اليوم 0 في يوم الإباضة. وبالتالي ، فإن القياس التوافقي لمستويات الدم P4 / E2 ومستويات CG مفيد (الشكل 3B). في معظم أنواع الرئيسيات ، بما في ذلك البشر ، لا يحدث الإباضة لفترة من الوقت بعد الولادة. ومع ذلك ، يحدث الإباضة بعد الولادة في marmosets ~ 10 أيام بعد الولادة. وبالتالي ، غالبا ما يتم ملاحظة التسليم التالي ~ 155 يوما بعد التسليم السابق. هذا الحمل المتسلسل ، جنبا إلى جنب مع ولادة التوائم ، يؤدي إلى مستوى عال من الخصوبة في marmosets.
تختلف التقلبات الهرمونية بين الأفراد ، وبعضها ليس له دورة ثابتة. تظهر بعض إناث مستويات منخفضة ثابتة من P4 / E2 ، مما يشير إلى نقص الإباضة. يمكن أن يعزى عدم وجود دورة التبويض إلى عدم النضج أو المشاكل الصحية أو الإجهاد أو تثبيط الإباضة من قبل الإناث الإنجابية المهيمنة26,27. أظهرت ثلاثة من 21 marmosets (> 2 سنة) قياس المستويات الهرمونية عدم وجود دورة التبويض العادية في مرفق المؤلف. إن فهم الأسباب وتطوير العلاجات المناسبة سيمكن من الاستخدام الأكثر فعالية للحيوانات في التجارب. لوحظ الأفراد الذين لديهم مرحلة صفراء طويلة من ~ 1 شهر وما يرتبط بها من مستوى P4 مرتفع2. في منشأة المؤلف ، تتكرر المرحلة الصفراء المطولة في نفس الأفراد. أظهر اثنان من 21 marmosets هذا الشذوذ. كان أحد الحيوانين في منزل واحد ، باستثناء احتمال أن يكون حاملا خلال المرحلة الصفراء الطويلة. يقترن الآخر بذكر يفترض أنه مصاب بالعقم عن طريق العلاج الإشعاعي ، وبالتالي من غير المحتمل أن تكون حاملا خلال المرحلة الصفراء الطويلة. حتى في المرحلة الصفراء المطولة ، فإن إعطاء PGF2α يخفض مستوى P4 ويعيد ضبط دورة المبيض. يساعد قياس الهرمونات الجنسية وفهم حالة دورة الإباضة على الاستخدام الفعال للحيوانات في التجارب والتكاثر.
يتم استخدام أخذ عينات الدم من الأفراد ليس فقط لتقدير تاريخ الإباضة ولكن أيضا للاختبارات المصلية لأغراض التشخيص. وبالمثل ، يتم استخدام قياس مستويات الهرمون ليس فقط لتقدير يوم الإباضة ولكن أيضا لدراسة التفاعل الاجتماعي ونمو الطفل والأمراض. في المستقبل ، لصنع marmosets المعدلة وراثيا ، من المتوقع تطوير المبايض والخصيتين من خلايا iPS. يجب أن تكون المستويات الهرمونية المناسبة مهمة للتطور الطبيعي. سيكون البروتوكول الموضح هنا مفيدا لقياس الهرمونات الجنسية والتحكم فيها لصنع المناسل المشتقة من الخلايا الجذعية المستحثة متعددة القدرات في القرق.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نود أن نشكر تشونشين شين ، هيروكو أكوتسو ، فوميو سوجيكي ، يونا هاشيموتو ، هينا ناريتومي ، يوكي ساكاموتو ، وميكيكو هوريغومي على دعمهم في إنشاء هذا البروتوكول وفي الرعاية اليومية للمارموسيت. تاكايوكي مينيشيغي للتعليق على المخطوطة؛ يوكيكو آبي وأعضاء مختبر أيبا لتقاسم تقنيات جمع الزيجوت؛ CIEA لتبادل المعلومات حول مساكن marmosets والتجارب التي زرعوها على مدى 40 عاما. تم دعم هذا البحث من قبل AMED و JST و KAKENHI بموجب أرقام المنحة JP19gm6310010 و JP20gm6310010 و JP21gm6310010 و JP22gm6310010 (AMED) و JPMJPR228B (JST) و 20H05764 و 20H03177 و 22K18356 (KAKENHI).
Materials
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
References
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved