Method Article
Blutentnahme und Hormonmessung zur Bestimmung des Stadiums im Eierstockzyklus bei Weißbüschelaffen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt Blut- und Urinproben zur Messung des Progesteron-/Östradiol- und Choriongonadotropinspiegels zur Bestimmung des Stadiums des Eierstockzyklus. Der Hormonspiegel wird verwendet, um den Zeitpunkt des Eisprungs vorherzusagen und zu bestimmen, und Hormone werden injiziert, um den Eierstockzyklus und das Eizellwachstum zu regulieren.
Zusammenfassung
Weißbüschelaffen sind kleine Neuweltaffen. Da viele ihrer biologischen Mechanismen denen des Menschen ähneln, sind Weißbüschelaffen potenziell nützlich für die medizinische und humanbiologische Forschung in einer Reihe von Bereichen, wie z. B. Neurowissenschaften, regenerative Medizin und Entwicklung. Es fehlt jedoch an Literatur, die Methoden für viele grundlegende Experimente und Verfahren beschreibt. Im Folgenden werden detaillierte Methoden zur Bestimmung des Spiegels von Sexualhormonen (Progesteron, Östradiol und Choriongonadotropin) bei Weißbüschelaffen beschrieben. Die Messung dieser Hormone ermöglicht die Vorhersage des Stadiums im Eierstockzyklus, das bei Weißbüschelaffen typischerweise 26-30 Tage beträgt; Eine genaue Bestimmung ist unerlässlich für die Entnahme von Eizellen/Zygoten zum richtigen Zeitpunkt und für die Vorbereitung der Wirtsweibchen auf die Erzeugung von gentechnisch veränderten Weißbüschelaffen.
Darüber hinaus ist die Messung des Sexualhormonspiegels nützlich für endokrinologische und ethlogische, frühe Entwicklungs- und reproduktionsbiologische Studien. Dieses Protokoll enthält eine detaillierte Beschreibung der Verfahren zur Blutentnahme aus der Oberschenkelvene, zur Trennung von Plasma zur Hormonmessung, zur Messung des Choriongonadotropinspiegels mittels Urin und Plasma, zum Zurücksetzen des Eierstockzyklus durch Injektion eines Prostaglandin-F2α-Analogons zur Verkürzung und Synchronisierung des Zyklus und zur Förderung des Follikelwachstums und des Eisprungs durch Injektion von follikelstimulierendem Hormon und Choriongonadotropin. Mit Hilfe dieser Protokolle können die Stadien des Eierstockzyklus für die rechtzeitige Entnahme von Eizellen/Zygoten bestimmt werden.
Einleitung
Der Weißbüschelaffe (Callithrix jacchus) ist ein kleiner Neuweltaffe mit vielen ähnlichen Merkmalen wie der Mensch, und die Dauer seines Eierstockzyklus beträgt 26-30 Tage 1,2. Studien über die frühe Entwicklung und die Erzeugung von gentechnisch veränderten Weißbüschelaffen erfordern die Entnahme von Eizellen und Zygoten in bestimmten Stadien des Eierstockzyklus. Daher ist eine genaue Bestimmung des Stadiums von entscheidender Bedeutung und kann durch Messung der Blutspiegel der Hormone Progesteron (P4) und Östradiol (E2)2,3 abgeschätzt werden. Diese Hormone fördern das Wachstum der Gebärmutterschleimhaut, das für die Einnistung notwendig ist. P4 wird aus dem Gelbkörper hergestellt, der sich unmittelbar nach dem Eisprung in den Eierstöcken bildet. E2 wird von den Eierstockfollikeln als Reaktion auf das follikelstimulierende Hormon (FSH) aus dem Hypothalamus-Hypophysen-Komplex im Gehirn sezerniert. Der E2-Spiegel steigt mit zunehmender Reife des Follikels an und erreicht vor dem Eisprungseinen Höhepunkt 3. Hohe E2-Spiegel verursachen beim Menschen die pulsierende Freisetzung des luteinisierenden Hormons (LH) über den Hypothalamus-Hypophysen-Komplex; Dieser LH-Anstieg induziert den Eisprung. Bei Weißbüschelaffen erfuhr das LH-Gen jedoch im Laufe der Evolution eine Degeneration, und der Eisprung wird stattdessen durch die Freisetzung von Choriongonadotropin (CG) aus der Hypophyse induziert, das eine ähnliche Struktur wie LH hat 4,5.
Der Eierstockzyklus kann durch Hormoninjektionen gesteuert werden. FSH-Injektionen wirken beim Menschen auf die FSH-Rezeptoren der Eierstöcke und werden zur Förderung der Östrogensynthese und des Follikelwachstums eingesetzt6. Die Injektion von humanem CG (hCG) als Ersatz für LH am Ende der Follikelphase wird verwendet, um den Eisprung beim Menschen zu stimulieren7. CG-Injektionen werden auch zur Behandlung von menschlicher Unfruchtbarkeit eingesetzt, da CG das Corpus luteum in der Frühschwangerschaft stimuliert, was zu einer erhöhten P4-Produktion führt. Prostaglandin F2α (PGF2α) Injektionen setzen den Eierstockzyklus zurück8. Bei Hausrindern wird die PGF2α-Injektion verwendet, um die Lutealphase zu verkürzen und den Brunstzyklus für das Reproduktionsmanagement zu synchronisieren.
Obwohl Weißbüschelaffen und Menschen ähnliche biologische Mechanismen haben und damit ideale Modelltiere sind, fehlt es an Literatur, die grundlegende Methoden für viele häufig verwendete Techniken beschreibt. Die Blutentnahme ist eine der am häufigsten verwendeten Techniken 9,10,11,12. Anfänger haben jedoch manchmal Schwierigkeiten, die Vene zu finden. Daher wurden in dieser Studie anatomische Analysen der Venenregion femoralis durchgeführt. Basierend auf anatomischen Beobachtungen führt dieses Protokoll die proximale Region des Femurdreiecks als eine einfache Stelle für die Venenpunktion ein.
Protokoll
Alle Methoden, bei denen Weißbüschelaffen eingesetzt werden, basieren auf hohen ethischen und tierschutzrechtlichen Standards und wurden vom Institutional Animal Care and Use Committee des National Center for Child Health and Development genehmigt. Die Tiere, die hier eingesetzt wurden, waren Einzel- oder Paarställe (ein Weibchen und ein Männchen) mit 12 Stunden Licht pro Tag.
1. Blutentnahme der Oberschenkelvene
- Bereiten Sie eine 1-ml-Spritze vor (der kurze Typ ist einfach zu verwenden) mit einer 25-G-Nadel, die mit der Klinge nach oben befestigt ist. Um Blutverstopfungen zu vermeiden, heparinisieren Sie die Spritze, indem Sie 200 μl unverdünnte Heparinnatriumlösung in die Spritze ziehen. Beschichten Sie die Innenseite der Spritze gleichmäßig, indem Sie sie mehrmals auf und ab ziehen; Stoßen Sie dann die Heparinlösung aus der Spritze aus.
HINWEIS: Da der Wechsel auf eine neue Spritze oft notwendig ist, bereiten Sie einige zusätzliche heparinisierte Spritzen vor. - Bereiten Sie saugfähige Watte- und Alkoholtupfer vor. Schalten Sie eine verstellbare Lampe ein, um den Bereich zu beleuchten, in den der Weißbüschelaffe für die Blutentnahme gesetzt wird.
- Bereiten Sie die Rückhaltevorrichtung (420 x 85 x 85 mm, Bild 1A) vor, die im Handel erhältlich ist (siehe Materialtabelle für Details). Um einen Weißbüschelaffen in das Gerät zu setzen, öffnen Sie das Retentionsteil mit dem Schwammgurt, der die Weißbüschelaffen sichert. Setzen Sie den Weißbüschelaffen mit der Vorderseite nach oben in die Rückhaltevorrichtung ein.
HINWEIS: Weißbüschelaffen sind in der Regel ruhig in Rückhaltevorrichtungen, was die Notwendigkeit einer Rückhaltegewöhnung oder eines Trainings zunichte machen kann. - Fangen Sie den Weißbüschelaffen; Setzen Sie den Weißbüschelaffen in den zylindrischen Teil ein; und sichern Sie es, indem Sie den Schwammgurt nach unten drücken. Legen Sie das Bein, von dem Blut entnommen werden soll, auf das andere (Abbildung 1A). Halten Sie die Beine mit der nicht dominanten Hand; Lege den Mittel- und Ringfinger in jedes Bein, um sie zu befestigen, und die anderen Finger außerhalb jedes Beins, um sie zu fixieren.
HINWEIS: Beim Fangen von Weißbüschelaffen werden Beißhandschuhe empfohlen. Wenn keine Rückhaltevorrichtung vorhanden ist, führen Sie die Blutentnahme unter Narkose oder mit einer anderen Person durch, die den Weißbüschelaffen festhält. - Prüfen Sie, ob die Oberschenkelvene in der Nähe der Basis des Oberschenkels sichtbar ist. Wenn nicht, tasten Sie ab, um die pulsierende Arterie zu finden, und verwenden Sie sie als Orientierungspunkt, um zu überprüfen, ob die Vene in ihr verläuft (Abbildung 1B-D).
HINWEIS: Schreibtischbeleuchtung und Haarrasur werden empfohlen, um die Sichtbarkeit zu verbessern. Die Sichtbarkeit kann auch durch Reiben mit Alkoholtupfern verbessert werden. Lymphknoten im Dreieck befinden sich oft in der Nähe der Vene und zeigen eine dunkelblaue Farbe als Vene. Wie man sie unterscheidet, wird im Abschnitt Repräsentative Ergebnisse beschrieben. - Desinfizieren Sie die Einstichstelle mit einem Alkoholtupfer. Führen Sie die Nadelklinge mit der Klingenseite nach oben in einem Winkel von 15°-20° ein. Um zu verhindern, dass die Nadel bei der Blutentnahme aus dem Blutgefäß rutscht, stabilisieren Sie die Hand, die die Spritze hält, indem Sie sie zum anderen auflegen.
- Ziehen Sie den Kolben vorsichtig zurück, um Unterdruck auszuüben (Abbildung 1E). Schiebe die Nadelspitze nach vorne. Sobald das Blut in die Spritze gelangt ist, halten Sie die Position der Nadelspitze aufrecht, bis das erforderliche Volumen (500-700 μl) entnommen wurde.
- Wenn kein Blut in die Spritze eindringt, wechseln Sie die Einstichstelle. Wenn beim Herausziehen der Nadel Blut austritt, stoppen Sie die Blutung, indem Sie 3 Minuten lang Druck auf die Einstichstelle ausüben. Nachdem Sie die Blutung gestoppt haben, starten Sie die Venenpunktion neu.
- Wenn das Blut, das in die Spritze gezogen wird, während des Entnahmevorgangs nicht mehr fließt, schieben Sie die Nadelspitze langsam nach vorne und ziehen Sie sie dann zurück, um das Blutgefäß zu finden. Dadurch kann der Blutfluss in die Spritze wiederhergestellt werden. Wenn nicht, ziehen Sie die Nadel heraus und führen Sie eine Venenpunktion mit einer neuen Spritze durch.
HINWEIS: Verwenden Sie den Oberschenkel am anderen Bein, wenn es schwierig ist, Blut von derselben Seite zu sammeln.
- Ziehen Sie die Nadel vorsichtig heraus und drücken Sie mit dem kleinen Finger leicht auf die Einstichstelle. Üben Sie dann mit einem saugfähigen Wattestäbchen sofort 3 Minuten lang Druck auf die Einstichstelle aus, um die Blutung zu stoppen. Drehen Sie die Spritze um, um Blut und Heparin zu mischen.
HINWEIS: Üben Sie während des Abkühlens einen längeren Zeitraum (5 Minuten) Druck aus, wenn arterielles Blut entnommen wird, und bestätigen Sie sorgfältig das Nachlassen der Blutung, um die Bildung von Hämatomen zu verhindern, die manchmal zu einem tödlichen Ausgang führen können. - Nachdem Sie sich vergewissert haben, dass die Blutung aufgehört hat, entfernen Sie den Schwammgurt, halten Sie die Taille des Tieres mit einer Hand fest und drehen Sie das Tier so, dass man den Unterarm des Tieres mit einer anderen Hand von hinten halten kann.
- Setze den Weißbüschelaffen in seinen Käfig zurück. Um Stress abzubauen und wiederholte Blutabnahmen zu erleichtern, versorgen Sie den Weißbüschelaffen mit seiner Lieblingsnahrung (z. B. Kekse, Marshmallows oder Biskuitkuchen). Überprüfen Sie gelegentlich das Auftreten von Hämatomen.
HINWEIS: Wenn ein Hämatom in einem frühen Stadium festgestellt wird, legen Sie einen Druckverband an, um das Fortschreiten des Hämatoms zu verhindern. Wenn es nach längerer Zeit gefunden wird, kann eine chirurgische Entfernung des Hämatoms mit Ligatur der Oberschenkelarterie und Bluttransfusion erforderlich sein 9,13. - Lösen Sie die Nadel von der Spritze, um eine Hämolyse zu verhindern. Stoßen Sie dann das gesammelte Blut langsam entlang der Innenwand eines 1,5-ml-Mikroröhrchens aus.
HINWEIS: Das entnommene Blut kann bis zu 24 Stunden lang bei 4 °C gelagert werden, bevor es zur Messung des P4/E2-Spiegels im Plasma getrennt wird.
2. Abtrennung des Plasmas und Bestimmung des Hormonspiegels
- Zentrifugieren Sie das Blut in einem 1,5-ml-Röhrchen mit 1.100 × g für 5 min bei 4 °C.
- Übertragen Sie das abgetrennte Plasma (Überstand) aus dem 1,5-ml-Röhrchen in ein neues Röhrchen/einen neuen Becher, wobei der Einschluss von Blutzellen (Sediment) sorgfältig vermieden wird.
- Messen Sie die P4- und E2-Werte mit einem ELISA-Kit oder einem automatischen Analysator. Wenn die Plasmamenge für den automatischen Analysator nicht ausreicht, verwenden Sie eine Probenverdünnungslösung.
HINWEIS: Für die Messung mit einem automatischen Analysator sind >175 μl Plasma erforderlich, um nur einen P4-Gehalt zu bestimmen, und >250 μl Plasma sind erforderlich, um sowohl P4 als auch E2 zu bestimmen.
3. Messung des Schwerpunkts des Urins zur Erkennung von Eisprung und Schwangerschaft
HINWEIS: Der Schwerpunktspiegel bei Weißbüschelaffen kann mit einem immunchromatographischen Kit-Test sowohl für den Eisprung als auch für die Schwangerschaft gemessen werden. Im Falle des Eisprungs kann 0-2 Tage vor dem Eisprung ein positives Ergebnis erzielt werden. Im Falle einer Schwangerschaft wird ein positives Ergebnis vom 15. bis 20. Tag bis etwa zum 100. Tag der Schwangerschaft festgestellt. Für den Test wird eine kleine Menge (90 μl) Urin benötigt (ein Tropfen Urin entspricht ~30 μl).
- Tray-Methode: Wenn sich mehr als zwei Tiere im selben Käfig befinden, bringen Sie den Ziel-Weißbüschelaffen (oder die anderen Tiere) am Vortag in einen anderen Käfig. Stellen Sie am Abend vor oder vor dem Anzünden ein sauberes Tablett auf den Boden des Käfigs. Der Urin wird während der Nacht nicht aus der Blase abgelassen. Daher wird der Urin in der Regel kurz nach dem Anzünden aus der Blase freigesetzt.
HINWEIS: Das Betreten des Raumes am Morgen vor der Beleuchtung kann den Schlafzyklus der Kohorte stören. Der Urin kann in der Regel innerhalb von ca. 30 Minuten nach dem Anzünden gesammelt werden. - Quetschmethode: Bereiten Sie die gewaschenen Schalen für die Urinsammlung vor. Nachdem Sie die Blase des Weißbüschelaffen lokalisiert haben, drücken Sie sie vorsichtig von vorne und von beiden Seiten mit der gesamten Länge der Finger zusammen (Abbildung 1F). Sammeln Sie Urin, bevor Sie morgens den Raum erhellen.
HINWEIS: Wenn die Urinsammlung aufgrund des Fehlens von Urin in der Blase nicht erfolgreich ist, warten Sie eine Weile und versuchen Sie es erneut. Achten Sie darauf, keine übermäßige Gewalt anzuwenden, da dies das Tier verletzen kann. - Geben Sie die Urinprobe unmittelbar nach der Entnahme in die Vertiefung des immunchromatographischen Testkits. Lesen Sie das Ergebnis nach 10 Minuten gemäß den Anweisungen des Herstellers ab.
4. Kontrolle und Bestimmung des Stadiums des Eierstockzyklus für die Entnahme von Eizellen, Zygoten und Embryonen
- Keimvesikel (GV) Eizellentnahme aus den Eierstöcken
- Verabreichen Sie eine intramuskuläre Injektion von 3 μl 0,263 mg/ml Cloprostenol (ein synthetisches PGF2α-Analogon), verdünnt in 150 μl Kochsalzlösung14 (Abbildung 2), um den Eierstockzyklus am Ende der Lutealphase (d. h. ≥10 Tage nach Beginn der Lutealphase) zurückzusetzen.
HINWEIS: Es kann zweckmäßig sein, die verdünnte Lösung in einem größeren Volumen herzustellen, da das verdünnte Clofrostenol mindestens mehrere Wochen lang bei +4 °C stabil bleibt. - Bestätigen Sie am nächsten Tag (Tag 1) den Beginn der Follikelphase, indem Sie überprüfen, ob der P4-Spiegel gesunken ist.
HINWEIS: Es wurde berichtet, dass die Cloprostenol-Injektion den P4-Spiegel (normalerweise <10 ng/ml) innerhalb von 24 h drastisch senkt3. - Injizieren Sie ab Tag 1 FSH (25 I.E., intramuskulär) einmal alle 2 Tage für insgesamt 5x (Tage 1, 3, 5, 7 und 9). An Tag 10 injizieren Sie nachmittags hCG (75 IE, intramuskulär).
- Entnahme von GVs aus den Eierstöcken am Tag 11 durch follikuläre Aspiration unter Narkose gemäß der Literatur15,16.
HINWEIS: Manchmal findet der Eisprung früher als erwartet statt. Daher wird empfohlen, die Schwerpunktwerte ab dem 8. Tag zu überprüfen. Wenn der CG-Test positiv ist, führen Sie an diesem Tag eine GV-Entnahme durch.
- Verabreichen Sie eine intramuskuläre Injektion von 3 μl 0,263 mg/ml Cloprostenol (ein synthetisches PGF2α-Analogon), verdünnt in 150 μl Kochsalzlösung14 (Abbildung 2), um den Eierstockzyklus am Ende der Lutealphase (d. h. ≥10 Tage nach Beginn der Lutealphase) zurückzusetzen.
- Entnahme von Metaphase II (MII) Eizellen, Zygoten und frühen Embryonen
- Setzen Sie den Eierstockzyklus mit Cloprostenol zurück, wie in Schritt 4.1.1 beschrieben.
- Bestätigen Sie am nächsten Tag (Tag 1) den Beginn der Follikelphase, indem Sie überprüfen, ob der P4-Spiegel gesunken ist.
- Für die Entnahme von Zygoten und Embryonen halten Sie weibliche Weißbüschelaffen zusammen mit männlichen Weißbüschelaffen zur Paarung ab dem 6. Tag.
- Überprüfen Sie ab dem 7. Tag die P4/E2-Spiegel im Blut und die Schwerpunktwerte im Urin der Frauen. Der Nachweis von CG ist ein Hinweis auf den Eisprung innerhalb weniger Tage (in der Regel am nächsten Tag). An dem Tag, an dem die P4-Spiegel ansteigen und die E2-Spiegel im Vergleich zum Vortag sinken, werden MII-Eizellen oder embryonale Tag 0 (E0)-Zygoten aus den Eileiternentnommen 17,18.
- Für die Embryonenentnahme, wie in der Literatur beschrieben, führen Sie je nach Zielstadium entweder eine Spülung aus den Eileitern (E1-E3, 1-8 Zellen)17,18 oder aus der Gebärmutter (E5-E10, 8 Zellen-Blastozyste)19,20,21,22 durch.
Ergebnisse
Einzelheiten zu den in dieser Studie verwendeten Tieren sind in Tabelle 1 aufgeführt.
Anatomische Analysen der Vena femoralis
Anatomische Analysen der Oberschenkelvene wurden an einem 2-jährigen männlichen Weißbüschelaffen (I 7713M) durchgeführt, der sich einer Euthanasie unterziehen musste. Die Oberschenkelvenen und Arterien befinden sich im Femurdreieck. Das femorale Dreieck bildet sich an den Grenzen zwischen der Bauchwand und der Oberschenkelmuskulatur (Abbildung 1B-D). An der Basis des Oberschenkels verläuft eine große Vene durch die Mitte des umgekehrten Dreiecks, und eine Arterie verläuft parallel außerhalb der Vene. Im unteren Bereich werden die Venen und Arterien dünner und überlappen sich, wobei die Arterien auf den Venen liegen (Abbildung 1D).
Bei der Blutentnahme sollte die Vene ins Visier genommen werden, da eine arterielle Verletzung ein Hämatom der Oberschenkelarterie verursachen kann, das bei schweren Blutungen zu einem kardiovaskulären Schock führen kann13. Obwohl Blut aus jedem Teil der Vene im Dreieck und seinem distalen Bereich entnommen werden kann, wird eine Venenpunktion von der proximalen Stelle des femoralen Dreiecks aufgrund der Größe der Vene und ihrer scheinbar geringen Überlappung mit der Arterie empfohlen. Darüber hinaus ist die Vene an der proximalen Stelle oberflächlich, was eine einfache Lokalisierung mit einer Nadel ermöglicht. Da sie pulsiert, wird die Arterie im Femurdreieck manchmal visuell oder durch Abtasten identifiziert, und die Vene verläuft gerade medial davon. So hilft die Beobachtung der Arterienpulsation, die Lage der Vene vorherzusagen.
Darüber hinaus wird in der Regel eine blaue Färbung, die auf die Vene hinweist, unter der Haut am oberen Rand des Dreiecks beobachtet (Abbildung 1B,C). Lymphknoten im Dreieck befinden sich jedoch oft in der Nähe der Vene und zeigen eine dunkelblaue Farbe, sodass ihr Aussehen ähnlich ist. Glücklicherweise unterscheidet man sie an ihrer Beweglichkeit: Die Vene ist stationär und die Lymphknoten sind beweglich. So sind die Pulsation der Arterie und die blaue Farbe der Vene zwei wichtige Hinweise, die zur Lokalisierung der Vene verwendet werden, obwohl es notwendig sein kann, die Haare zu rasieren, um sie zu visualisieren.
Bestimmung des Stadiums im Eierstockzyklus
Die P4- und E2-Spiegel wurden bei sechs weiblichen Weißbüschelaffen (im Alter von 1 bis 3 Jahren) überwacht, um die Dauer der Follikel- und Lutealphase zu untersuchen. Die Ergebnisse zeigten eine durchschnittliche Dauer von 11,58 Tagen (n = 6 von vier Weißbüschelaffen) bzw. 16,8 Tagen (n = 5 von drei Weißbüschelaffen) für die Follikel- bzw. Lutealphase (Tabelle 2). Im Folgenden wird die P4- und E2-Dynamik eines (I6751F, 3-jährige) der sechs Weißbüschelaffen detailliert beschrieben. Blutproben und Hormonmessungen wurden bei diesem Tier 38 Tage lang alle paar Tage durchgeführt (Tabelle 3).
Lutealphase (Tage 1-10)
Der Starttag der Messung wurde auf Tag 1 festgelegt. Basierend auf dem P4-Spiegel (21 ng/ml) befand sich das Tier wahrscheinlich in der Lutealphase. Von Tag 1 bis 10 wurde ein hoher P4-Spiegel beobachtet (≥21 ng/ml), was auf die Lutealphase hindeutet. An Tag 12 fiel sie stark auf 4 ng/ml. Diese signifikante Abnahme deutete auf den Übergang von der Luteal- in die Follikelphase hin. Eine Abnahme des E2-Spiegels von Tag 10 (241 ng/ml) auf Tag 12 (189 ng/ml) unterstützte diesen Übergang ebenfalls.
Follikelphase (Tage 12-22)
Nach dem Übergang in die follikuläre Phase blieb der P4-Spiegel bis zum 19. Tag niedrig (4-6 ng/ml) und stieg dann von Tag 19 bis 24 leicht an (Tag 19, 6 ng/ml; Tag 22, 8 ng/ml; Tag 24, 9 ng/ml). Im Gegensatz dazu stieg der E2-Spiegel signifikant von Tag 19 (94 ng/ml) auf 22 (322 ng/ml) an und sank dann von Tag 22 auf 24 (158 ng/ml). Basierend auf den erhöhten P4- und verringerten E2-Spiegeln wurde vorhergesagt, dass der Eisprung zwischen dem 22. und 24. Tag stattfand und von der follikulären in die Lutealphase überging.
Lutealphase (Tag 24-36)
Nach dem Eisprung blieb der P4-Spiegel bis zum 36. Tag hoch und fiel dann an Tag 38 auf 3 ng/ml. Es ist also wahrscheinlich, dass der Übergang von der Luteal- in die Follikelphase zwischen dem 36. und 38. Tag stattfand. In Übereinstimmung mit diesem Übergang sank der E2-Spiegel in diesem Zeitraum (Tag 36, 2517 ng/ml; Tag 38, 73 ng/ml).
Vorhersage und Bestimmung des Zeitpunkts des Eisprungs
Um den Zusammenhang zwischen dem Schwerpunktspiegel im Urin und dem Zeitpunkt des Eisprungs zu untersuchen, wurden sieben Weißbüschelaffen (Nr. 1-7) präpariert. Cloprostenol wurde injiziert, um den Ovulationszyklus (Tag 0) zurückzusetzen. Dann wurde ab Tag 7 eine Überwachung der P4/E2-Spiegel im Blut und der CG-Spiegel im Urin durchgeführt. Der Urin wurde unmittelbar nach dem Anzünden gesammelt. Die Blutentnahme erfolgte im Wesentlichen am Morgen. Es wurde davon ausgegangen, dass der Eisprung dann stattfindet, wenn der E2-Spiegel im Vergleich zu dem vom Vortag weitgehend gesenkt wurde, wie berichtet17. An diesem Tag wurde tatsächlich die Follikelruptur auf der Oberfläche der Eierstöcke und das Vorhandensein von Zygoten/Eizellen in den Eileitern beobachtet (Tabelle 4).
CG wurde erstmals an den Tagen 7 bis 11 (Tag 7, N = 1; Tag 8, N = 2; Tag 9, N = 1; Tag 10, N = 2; Tag 11, N = 1) nachgewiesen (Tabelle 4). Der starke Abfall des E2-Spiegels (Hinweis auf den Eisprung) wurde 0-3 Tage nach dem ersten CG-Signal beobachtet. Die Dauer von der ersten CG-Detektion bis zur E2-Abnahme schien groß zu sein, wenn die erste CG-Detektion früher erfolgte (Abbildung 3A). Zum Beispiel zeigte ein Tier (Nr. 1) 3 Tage nach dem ersten CG-Nachweis an Tag 7 einen Abfall des E2-Signals (Tabelle 4). Im Gegensatz dazu wurde das gleichzeitige Auftreten des ersten CG-Nachweises und des Abfalls des E2-Signals bei einem Tier (Nr. 2) an Tag 10 beobachtet. Obwohl also der erste CG-Nachweis und der Eisprung bei einem der fünf Tiere am selben Tag beobachtet wurden, erfolgte der Eisprung innerhalb weniger Tage nach dem ersten Nachweis von CG.
Das immunchromatographische Testkit für Weißbüschelaffen CG ist für die Verwendung von Urin für Tests konzipiert. Die Untersuchung des CG-Spiegels geht in der Regel mit der Bestimmung der P4/E2-Spiegel mittels Blutplasma einher. Es ist hilfreich, wenn für den CG-Test Blutplasma anstelle von Urin verwendet werden kann. Um dies zu überprüfen, wurde das Blutplasma untersucht, das nach der P4/E2-Spiegelmessung in den obigen Experimenten übrig blieb. Blutplasma und Urin wurden von den vier Tieren an einem der Tage der oben genannten Versuche entnommen (die Untersuchungstage waren in Tabelle 4 mit doppelten Sternchen [**] gekennzeichnet). Bei der Verwendung von Urin zeigten zwei der vier Tiere positive Ergebnisse (Scores 5 und 3), während die anderen beiden negative Ergebnisse zeigten (Score 1). Blutplasma zeigte im Wesentlichen die gleichen Ergebnisse wie Urin (Abbildung 3B). Das stärkere Signal wurde durch die Verwendung von Blutplasma erreicht. Daher sollte bei der Verwendung von Blutplasma das Urteil vor 10 Minuten erfolgen, die für den Urin eingestellt sind.
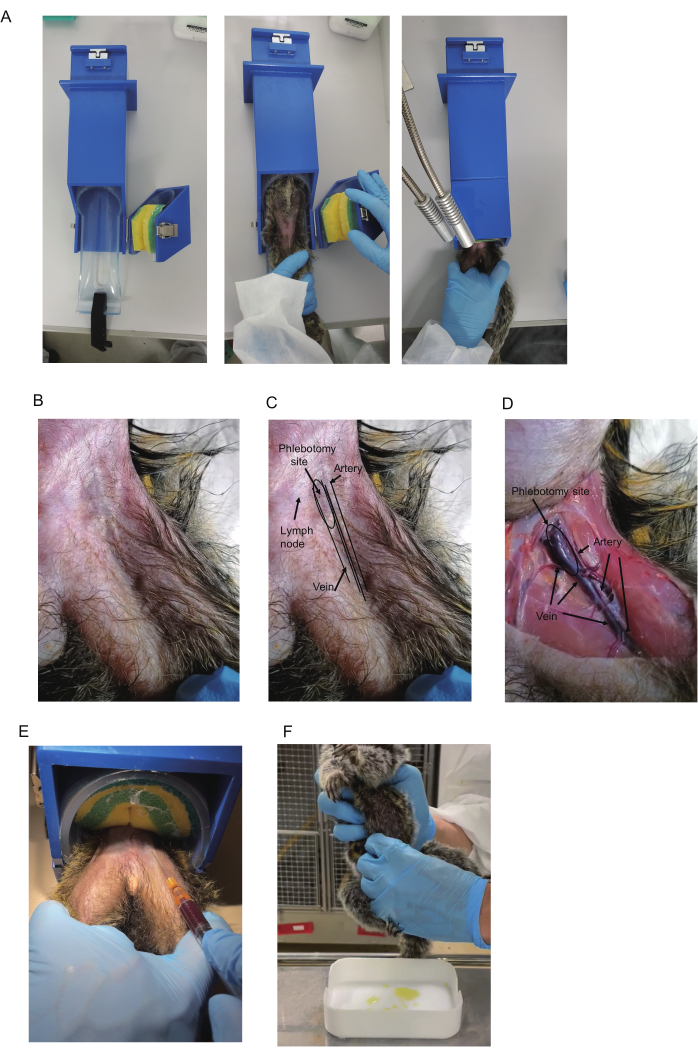
Abbildung 1: Blutentnahme von Weißbüschelaffen. (A) Für die Blutentnahme wird ein Halteapparat verwendet. (B) Weißbüschelaffen-Oberschenkel. (C) Femurdreieck und Blutgefäße. Die Oberschenkelarterie im Dreieck ist oft sichtbar und zeigt eine Pulsation. Die blaue Farbe der Vena femoralis ist manchmal im proximalen Bereich des Dreiecks sichtbar (angegeben als Phlebotomiestelle). Auch die Lymphknoten zeigen eine blaue Farbe. Lymphknoten sind jedoch beweglich, da Lymphknoten an der Haut befestigt sind. (D) Anatomische Ansicht des Oberschenkels des eingeschläferten Tieres. Die Arterie, die Vene und die Phlebotomiestelle sind angegeben. Das gleiche Tier ist in B-D zu sehen. (E) Blutentnahme mit einem Halteapparat. Gezeigt werden die Halteposition der Beine des Weißbüschelaffen und die Blutentnahme. (F) Urinentnahme von einem Weißbüschelaffen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
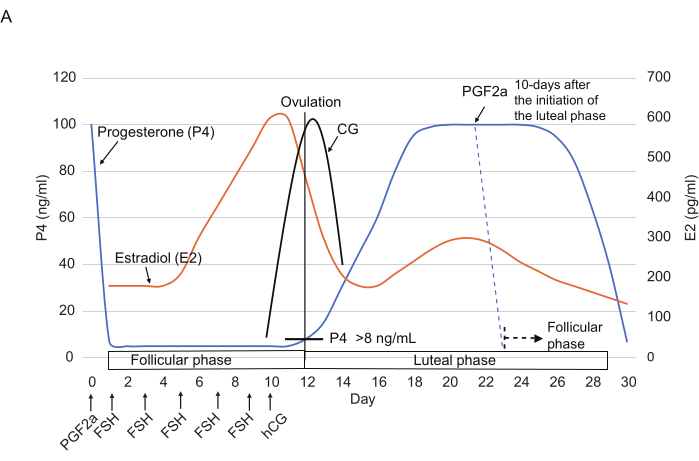
Abbildung 2: Typische Muster der P4-, E2- und CG-Spiegel während des Ovarialzyklus bei Weißbüschelaffen. Die Zeitpunkte der FSH-, hCG- und PGF2α-Injektionen sind angegeben. Gestrichelte Linien zeigen das erwartete Hormonmuster nach PGF2α-Injektion. Abkürzungen: P4 = Progesteron; E2 = Östradiol; CG = Choriongonadotropin; FSH = follikelstimulierendes Hormon; hCG = humanes Choriongonadotropin; PGF2α = prostaglandin F2α. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
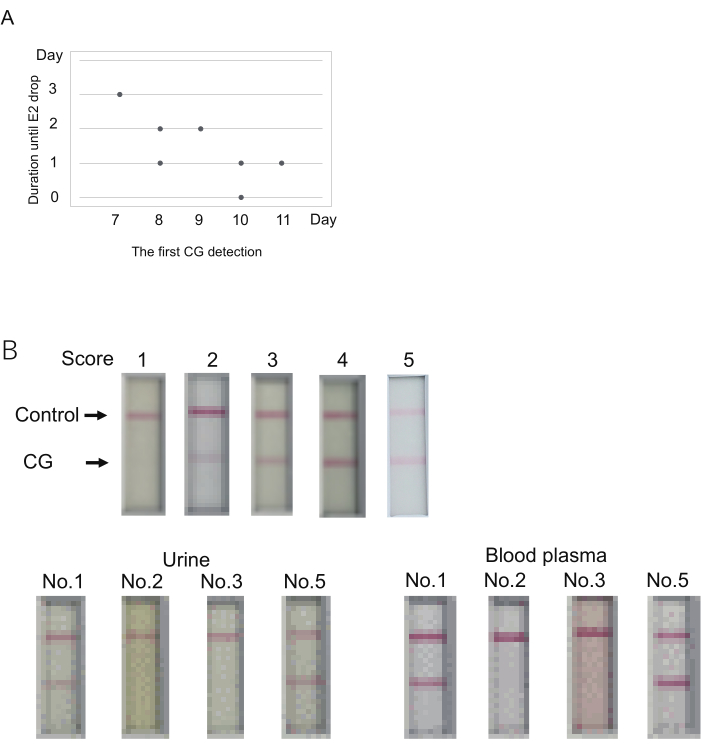
Abbildung 3: Bestimmung des CG-Spiegels zur Vorhersage des Auftretens des Eisprungs. (A) Der mögliche Zusammenhang zwischen dem ersten Tag der CG-Detektion (Score > 1) und der Dauer bis zum Eisprung (E2-Tropfen). (B) Blutplasma kann für immunchromatographische CG-Tests verwendet werden. Ein repräsentatives Ergebnis jeder Punktzahl (top). Der Score wurde 10 min nach dem Laden der Probe bestimmt. Score 2 repräsentiert keine Band innerhalb von 5 Minuten, sondern das Auftreten einer Band innerhalb von 10 Minuten. Die Blutentnahme wurde kurz nach der Urinentnahme durchgeführt. Es wurden vier Weißbüschelaffen (Nr. 1, 2, 3, 5 in Tabelle S4) untersucht. Die hier verwendeten Proben sind in Tabelle 4 mit doppelten Sternchen gekennzeichnet. Das Blutplasma wurde durch Verdünnungspuffer, der für die E2-Messung verwendet wurde, auf 50 % verdünnt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: In dieser Studie verwendete Tiere. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Dauer der Follikel- und Lutealphase. Die Bestimmung der Phase erfolgte anhand des P4-Spiegels (follikuläre Phase P4 ≤ 8, Lutealphase P4 > 8). Wenn zwischen den Messungen eine Phasenänderung beobachtet wurde, wurde der Mittelpunkt zwischen den Messdaten als Änderungspunkt bestimmt. Die Dauer zwischen den beiden Wechselpunkten wurde als Follikel- oder Lutealphase angesehen. Um die Messung der Dauer einer einzelnen Phase zu gewährleisten, wurden die Daten mit einem langen (≥7 Tage) Intervall oder zwei von ≥6 Tagen in derselben Phase, auch wenn sie sich über die beiden Phasen erstrecken, nicht für die Analysen verwendet. Erst wenn zwei Messungen in der gleichen Phase durchgeführt wurden, wurden die Daten verwendet. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Ergebnisse der P4- und E2-Messungen über 38 Tage bei einem Weißbüschelaffen.Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Bestimmung und Vorhersage von Ovulationstagen. Die Spuren des Eisprungs wurden als vorhanden angesehen, wenn Blutungsstellen oder Rupturstellen in den Eierstöcken beobachtet wurden. Die Eizelle/Zygote gibt die Stadien der Eizelle/Zygote an, die am Tag des E2-Abfalls aus den Eileitern gewonnen wurden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die Lokalisierung der Vene ist der wichtigste Schritt bei der Blutentnahme. Basierend auf anatomischen Beobachtungen führt dieses Protokoll den proximalen Bereich im Femurdreieck als einfache Stelle für die Blutentnahme bei Weißbüschelaffen ein. In diesem Bereich kann problemlos eine Blutentnahme aus einer großen Vene durchgeführt werden. Selbst bei Verwendung dieses Protokolls kommt es jedoch manchmal zu einer Verletzung einer Arterie. Bei einer Verletzung einer Arterie wird empfohlen, die Blutung durch Ausübung von Druck für >5 Minuten vollständig zu stoppen, um Hämatome zu verhindern. Darüber hinaus ist bei der Druckausübung auch die Kühlung der punktförmigen Stelle mit einem Eiswürfel effektiv. Hämatome können mit Heparin behandelt werden (z.B. Tensolvet 5.000 I.E. Gel). Die meisten Hämatome verschwinden nach 3-4 aufeinanderfolgenden Tagen der Behandlung mit Heparin und 0,05 ml Meloxicam (0,5 mg/ml, p.o.). Die Arterie verläuft seitlich zur Vene im proximalen Bereich des Oberschenkels. Im distalen Bereich schienen Vene und Arterie näher beieinander zu liegen und überlappten sich stärker, wobei die Arterie ventral zur Vene lag. Basierend auf dieser Positionsbeziehung hat die Blutentnahme aus dem proximalen Bereich des Oberschenkels wahrscheinlich ein verringertes Risiko für arterielle Verletzungen.
Darüber hinaus ist die Vena femoralis im proximalen Bereich dick und oberflächlich lokalisiert, was eine einfache Lokalisierung mit einer Nadel ermöglicht. Die Blutentnahme aus dem distalen Bereich hat jedoch den Vorteil, dass die proximalen Stellen intakt bleiben, was eine sofortige wiederholte Venenpunktion aus dem proximalen Bereich desselben Beins ermöglicht, selbst wenn die Vene während der Blutentnahme beschädigt wird. Dies liegt daran, dass der distale Bereich der geschädigten Stelle in der Regel nicht für eine sofortige Venenpunktion zur Verfügung steht. Wenn die Blutentnahme jedoch nicht erfolgreich ist, kann eine wiederholte Probenahme an der proximalen Stelle am anderen Bein durchgeführt werden.
Das Volumen des zirkulierenden Blutes bei Weißbüschelaffen beträgt ~25 ml (70 ml/kg)23. Ein Weißbüschelaffe von 350 g benötigt 1 Woche, um sich von einer 2-ml-Blutprobe zu erholen, was 7,5 % des gesamten Blutvolumens entspricht6. Aus den Oberschenkelvenen können problemlos 500-700 μl Blut entnommen werden. Wenn eine wiederholte Probenahme erforderlich ist, wird die Entnahme kleinerer Blutmengen und die Verwendung eines Verdünnungspuffers für den automatischen Analysator empfohlen.
Obwohl die Anästhesie in der Regel nicht für die Blutentnahme verwendet wird, kann die Blutentnahme von anästhesierten Tieren für Anfänger viel einfacher sein als von wachen Tieren. Bei der Verwendung von Anästhesie zur Blutentnahme ist jedoch Vorsicht geboten, da die Anästhesie die Messwerte der Blutbestandteile beeinflussen kann. In Bezug auf hormonelle Messungen zur Bestimmung des Stadiums im Eierstockzyklus wurde berichtet, dass Alfaxalone zu unerwartet höheren P4-Spiegeln führte24. Dies wurde durch die Kreuzreaktivität von Anti-P4-Antikörpern mit Alfaxalon verursacht, einem P4-Derivat.
Die Strukturen von P4 und E2 (Steroidhormone) sind bei Menschen und Weißbüschelaffen identisch. Kommerzielle ELISA-Kits für humanes P4 und E2 sind daher für Weißbüschelaffen P4 und E2 erhältlich. Outsourcing-Dienstleistungen für die Messung von menschlichen Bluthormonen sind ebenfalls verfügbar. Im Gegensatz dazu gibt es geringfügige Unterschiede in den Aminosäuresequenzen für Polypeptidhormone wie FSH, CG und Inhibin. Wenn ein Kit für diese Polypeptidhormone sowohl für Menschen als auch für andere evolutionär entfernte Spezies, wie z. B. Mäuse, verwendet werden kann, funktioniert es auch für Weißbüschelaffen. Für die Messung von Inhibin B kann ein Enzymimmunoassay-Kit für Mensch/Maus/Ratte (Beta B-Untereinheit) verwendet werden.
Ein Anstieg des P4-Spiegels ist ein Kennzeichen des Eisprungs (Übergang von der Follikel- in die Lutealphase). Obwohl es aufgrund von Schwankungen zwischen den Individuen schwierig ist, das Datum des Eisprungs allein anhand des P4-Spiegels zu bestimmen, kann ein P4-Wert von >8 ng/ml als grober Indikator für das Auftreten des Eisprungs verwendet werden. Ein zuverlässigerer Indikator für den Zeitpunkt des Eisprungs ist eine Abnahme des E2-Spiegels 3,17. Ovulierte Eizellen/Zygoten wurden tatsächlich am Tag der E2-Abnahme in den Eileitern beobachtet (Tabelle 4). Die Messung von E2 ermöglicht es uns also, das genaue Datum des Eisprungs zu bestimmen. Neben den Hormonspiegeln ist die Angabe der Anzahl der Tage nach der Verabreichung von PGF2α ein Prädiktor für den Tag des Eisprungs (Tabelle 4). In ähnlicher Weise hilft die kombinatorische Verwendung von P4- und E2-Spiegeln, den Zeitpunkt des Übergangs in die Follikelphase zu identifizieren, wenn die P4-Spiegel dramatisch sinken und die E2-Spiegel am niedrigsten sind.
Bei Weißbüschelaffen wird CG anstelle von LH aus der Hypophyse freigesetzt, um den Eisprung auszulösen. Darüber hinaus wird CG aus Trophoblastzellen ausgeschieden, wenn sich Embryonen an das Endometrium anheften und sich dort einnisten. Da Weißbüschelaffen kein funktionsfähiges LH-Gen haben, wird CG anstelle von LH aus der Hypophyse freigesetzt, um den Eisprung zu stimulieren5. Eine Studie berichtete, dass E2- und CG-Spitzenwerte, die auf den Eisprung hinweisen, am selben Tag beobachtet werden12. Eine andere Studie berichtete, dass im Durchschnitt E2-Peaks (8,6 Tage nach PGF2α-Verabreichung) den CG-Peaks (9,3 Tage nach PGF2α-Verabreichung) vorausgehen25, was darauf hindeutet, dass der Eisprung vor Erreichen der CG-Peaks stattfinden kann. Im Gegensatz zu E2 wird der Puls kurz vor seinem Höhepunkt freigesetzt. Die Impulsfreisetzung von CG beginnt im Durchschnitt ~1 Tag vor ihrem Höhepunkt. Es wurde jedoch eine große Variation in der Dauer von der ersten Detektion des Schwerpunktspiegels bis zum Abfall des E2-Spiegels beobachtet (Abbildung 3A und Tabelle 4). Darüber hinaus wird berichtet, dass CG erstmals sowohl in Morgen- als auch in Nachmittagsproben nachgewiesen wurde25.
Unseres Wissens gibt es keine Berichte über einen Eisprung bei Weißbüschelaffen, der zu einer bestimmten Tageszeit stattfindet. Außerdem setzen Weißbüschelaffen in der Regel zwei oder drei Eizellen auf einmal frei, so dass es einen gewissen Zeitraum geben kann, in dem alle Eizellen freigesetzt werden. Da vor dem Eisprung erhöhte Schwerpunktwerte auftreten, ermöglicht die Schwerpunktmessung die Vorhersage des Eisprungdatums im Voraus. Solche Informationen sind besonders nützlich für die Entnahme von MII-Eizellen oder Embryonen am Tag 0 am Tag des Eisprungs. Daher ist eine kombinatorische Messung der P4/E2-Spiegel und der CG-Spiegel im Blut sinnvoll (Abbildung 3B). Bei den meisten Primatenarten, einschließlich des Menschen, findet der Eisprung erst eine Weile nach der Entbindung statt. Der postpartale Eisprung tritt jedoch bei Weißbüschelaffen ~10 Tage nach der Entbindung auf. Folglich wird die nächste Lieferung oft ~155 Tage nach der letzten Lieferung beobachtet. Diese sequentielle Schwangerschaft führt zusammen mit der Geburt von Zwillingen zu einer hohen Fruchtbarkeit bei Weißbüschelaffen.
Hormonelle Schwankungen variieren von Person zu Person, und einige haben keinen konstanten Zyklus. Einige weibliche Weißbüschelaffen zeigen konstant niedrige P4/E2-Werte, was auf einen fehlenden Eisprung hindeutet. Das Fehlen eines Ovulationszyklus kann auf Unreife, gesundheitliche Probleme, Stress oder Ovulationshemmung bei dominanten reproduktiven Weibchen zurückgeführt werden26,27. Drei der 21 Weißbüschelaffen (>2 Jahre alt), die den Hormonspiegel maßen, zeigten das Fehlen eines regelmäßigen Ovulationszyklus in der Einrichtung des Autors. Das Verständnis der Ursachen und die Entwicklung geeigneter Behandlungen ermöglichen einen effektiveren Einsatz von Tieren in Versuchen. Es wurden Personen mit einer verlängerten Lutealphase von ~1 Monat und einem damit verbundenen hohen P4-Spiegel beobachtet2. In der Einrichtung des Autors wird eine verlängerte Lutealphase bei denselben Individuen wiederholt. Zwei der 21 Weißbüschelaffen zeigten diese Anomalie. Eines der beiden Tiere war in einer Einzelhaltung untergebracht, was die Möglichkeit ausschloss, dass das Tier während der verlängerten Lutealphase trächtig war. Die andere wird durch Strahlenbehandlung mit einem vermutlich unfruchtbaren Männchen gepaart, so dass es unwahrscheinlich ist, dass sie während der verlängerten Lutealphase schwanger war. Selbst in einer verlängerten Lutealphase senkt die Verabreichung von PGF2α den P4-Spiegel und setzt den Eierstockzyklus zurück. Die Messung von Sexualhormonen und das Verständnis des Status des Eisprungzyklus helfen dabei, Tiere effektiv in Versuchen und in der Zucht einzusetzen.
Die Blutentnahme von Personen wird nicht nur zur Abschätzung des Eisprungdatums, sondern auch für serologische Tests zu diagnostischen Zwecken verwendet. In ähnlicher Weise wird die Messung des Hormonspiegels nicht nur zur Abschätzung des Tages des Eisprungs verwendet, sondern auch zur Untersuchung der sozialen Interaktion, der kindlichen Entwicklung und von Krankheiten. Für die Herstellung von gentechnisch veränderten Weißbüschelaffen ist in Zukunft die Entwicklung von Eierstöcken und Hoden aus iPS-Zellen zu erwarten. Ein angemessener Hormonspiegel sollte für eine normale Entwicklung wichtig sein. Das hier beschriebene Protokoll wird für die Messung und Kontrolle von Sexualhormonen zur Herstellung von iPS-Zellen abgeleiteten Gonaden in Weißbüschelaffen nützlich sein.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken Chunshen Shen, Hiroko Akutsu, Fumiyo Sugiki, Yuuna Hashimoto, Hina Naritomi, Yuuki Sakamoto und Mikiko Horigome für ihre Unterstützung bei der Etablierung dieses Protokolls und bei der täglichen Pflege der Weißbüschelaffen; Takayuki Mineshige für die Kommentare zum Manuskript; Yukiko Abe und den Mitgliedern des Aiba-Labors für den Austausch von Zygoten-Entnahmetechniken; CIEA für die Weitergabe von Informationen über die Behausung von Weißbüschelaffen und Experimente, die sie über 40 Jahre hinweg kultiviert haben. Diese Forschung wurde von AMED, JST und KAKENHI unter den Fördernummern JP19gm6310010, JP20gm6310010, JP21gm6310010 und JP22gm6310010 (AMED), JPMJPR228B (JST), 20H05764, 20H03177 und 22K18356 (KAKENHI) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
Referenzen
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten