Method Article
マーモセットの卵巣周期の病期を決定するための採血とホルモン測定
要約
このプロトコルは、プロゲステロン/エストラジオールおよび絨毛性ゴナドトロピンのレベルを測定して卵巣周期の段階を決定するための血液および尿のサンプリングについて説明します。ホルモンレベルは排卵のタイミングを予測および決定するために使用され、ホルモンは卵巣周期と卵子の成長を調節するために注射されます。
要約
一般的なマーモセットは小さな新世界のサルです。マーモセットの生物学的メカニズムの多くはヒトと似ているため、マーモセットは神経科学、再生医療、開発など、さまざまな分野の医学研究やヒト生物学の研究に役立つ可能性があります。しかし、多くの基本的な実験や手順の方法を説明する文献は不足しています。ここでは、マーモセット中の性ホルモン(プロゲステロン、エストラジオール、および絨毛性ゴナドトロピン)のレベルを決定するための詳細な方法について説明します。これらのホルモンの測定により、マーモセットでは通常26〜30日である卵巣周期の段階を予測できます。正確な測定は、正しい時点で卵子/受精卵を捕獲し、遺伝子組み換えマーモセットを生成するための宿主雌の準備に不可欠です。
さらに、性ホルモンレベルの測定は、内分泌学、動物行動学、初期発生、および生殖生物学の研究に役立ちます。このプロトコルは、大腿静脈からの採血、ホルモン測定のための血漿の分離、尿と血漿を使用した絨毛性ゴナドトロピンレベルの測定、プロスタグランジンF2αアナログの注射を使用して卵巣周期をリセットして周期を短縮し同期する方法、および卵胞刺激ホルモンと絨毛性ゴナドトロピンを注射することにより卵胞の成長と排卵を促進する方法の詳細な説明を提供します。これらのプロトコルを使用して、卵子/受精卵のタイムリーな収集のために卵巣周期の段階を決定できます。
概要
一般的なマーモセット(Callithrix jacchus)は、人間と同様の多くの特徴を持つ小さな新世界サルであり、その卵巣周期の期間は26-30日です1,2。遺伝子組み換えマーモセットの初期発生と生成に関する研究では、卵巣周期の特定の段階で卵子と受精卵を採取する必要があります。したがって、病期の正確な決定は非常に重要であり、ホルモンのプロゲステロン(P4)とエストラジオール(E2)2,3の血中濃度を測定することによって推定できます。これらのホルモンは、着床に必要な子宮内膜の成長を促進します。P4は黄体から産生され、黄体は排卵直後に卵巣に形成されます。E2は、脳の視床下部-下垂体複合体からの卵胞刺激ホルモン(FSH)に応答して卵巣卵胞から分泌されます。E2レベルは、卵胞が成熟するにつれて増加し、排卵前にピークに達します3。E2レベルが高いと、ヒトでは視床下部-下垂体複合体を介して黄体形成ホルモン(LH)がパルス放出されます。このLHサージは排卵を誘発します。しかし、マーモセットでは、LH遺伝子は進化の過程で変性し、代わりにLHと同様の構造を持つ絨毛性ゴナドトロピン(CG)が下垂体から放出されることで排卵が誘発されます4,5。
卵巣周期はホルモン注射によって制御できます。ヒトのFSH注射は、卵巣のFSH受容体に作用し、エストロゲン合成と卵胞の成長を促進するために使用されます6。卵胞期の終わりにLHの代わりにヒトCG(hCG)を注射することは、ヒトの排卵を刺激するために使用されます7。CG注射は、妊娠初期にCGが黄体を刺激し、P4産生を増加させるため、ヒトの不妊症の治療にも使用されます。プロスタグランジンF2α(PGF2α)注射は卵巣周期をリセットします8。家畜では、PGF2α注射を使用して黄体期を短縮し、発情周期を同期させて生殖管理を行います。
マーモセットとヒトは生物学的なメカニズムが似ているため、理想的なモデル動物ですが、よく使われる多くの技術の基本的な方法を説明した文献が不足しています。採血は、最も頻繁に使用される手法の1つです9,10,11,12。しかし、初心者の方は静脈を見つけるのに苦労することがあります。したがって、この研究では、大腿静脈領域の解剖学的分析を実施しました。解剖学的観察に基づいて、このプロトコルでは、大腿骨三角形の近位領域を静脈穿刺の簡単な部位として紹介します。
プロトコル
マーモセットを用いたすべての方法は、高い倫理観と福祉基準を活用し、国立成育医療研究センターの動物施設管理委員会によって承認されました。ここで使用された動物は、1日あたり12時間の光で、シングルハウスまたはペアハウス(雌1匹と雄1匹)でした。
1.大腿静脈の採血
- 1mLのシリンジ(ショートタイプが使いやすい)を用意し、25Gの針をブレード面を上にして取り付けます。血液の詰まりを防ぐため、200 μLの原液ヘパリンナトリウム溶液をシリンジに引き込んでシリンジをヘパリン化します。シリンジを数回上下に引っ張って、シリンジの内側を均等にコーティングします。次に、シリンジからヘパリン溶液を排出します。
注:新しいシリンジへの交換がしばしば必要になるため、いくつかの追加のヘパリン添加シリンジを準備します。 - 吸収性の綿棒とアルコール綿棒を準備します。調整可能なランプのスイッチを入れて、採血のためにマーモセットが置かれる領域を照らします。
- 市販の拘束装置(420 x 85 x 85 mm、 図1A)を準備します(詳細については 、資料の表 を参照)。マーモセットを装置にセットするには、マーモセットを固定するスポンジベルトで保持部を開きます。マーモセットを上向きに拘束装置に挿入します。
注:マーモセットは通常、拘束装置で落ち着いているため、拘束順応やトレーニングの必要性がなくなる場合があります。 - マーモセットを捕まえる。マーモセットを円筒形部分に挿入します。スポンジベルトを押し下げて固定します。採血する脚をもう一方の脚の上に置きます(図1A)。利き手ではない手で脚を持ちます。中指と薬指を各脚の内側に置いて固定し、もう一方の指を各脚の外側に置いて固定します。
注:マーモセットを捕獲するときは、バイトグローブをお勧めします。拘束装置がない場合は、麻酔下で、またはマーモセットを拘束している他の人と一緒に採血してください。 - 大腿骨静脈が大腿部の付け根近くに見えるかどうかを確認します。そうでない場合は、触診して脈動する動脈を見つけ、それを目印として使用して、静脈がその中を走っていることを確認します(図1B-D)。
注意: 視認性を向上させるために、デスクの照明とヘアシェービングをお勧めします。アルコール綿棒でこすることでも視認性が向上します。三角形のリンパ節は、静脈の近くに位置することが多く、静脈として濃い青色を示します。これらを区別する方法については、代表的な結果のセクションで説明します。 - アルコール綿棒を使用して穿刺部位を消毒します。針身の刃を上にして15°〜20°の角度で挿入します。採血時に針が血管から滑り落ちないように、注射器を持っている手をもう一方の手で休ませるなどして安定させます。
- プランジャーをゆっくりと引き戻して、負圧を加えます(図1E)。針先を前方に押します。血液がシリンジに入ったら、必要な量(500〜700μL)が収集されるまで針先の位置を維持します。
- 血液が注射器に入らない場合は、穿刺部位を変更してください。針を抜くときに血液が出てきた場合は、穿刺部位に3分間圧力をかけて止血します。出血が止まった後、静脈穿刺を再開します。
- シリンジに引き込まれる血液がドローイングプロセス中に流れなくなった場合は、針先をゆっくりと前方に押してから、後ろに引いて血管を見つけます。これにより、注射器への血液の流れが回復する可能性があります。そうでない場合は、針を引き出し、新しい注射器を使用して静脈穿刺を行います。
注意: 同じ側から血液を採取するのが難しい場合は、もう一方の脚の太ももを使用してください。
- 小指を使って穿刺部位を軽く押しながら、丁寧に針を引き抜きます。次に、吸収性の綿棒を使用して、すぐに穿刺部位に3分間圧力をかけ、出血を止めます。シリンジを反転させて血液とヘパリンを混合します。
注:動脈血を採取するときは、冷却しながら長時間(5分間)圧力をかけ、出血の経過を注意深く確認して、致命的な結果につながる可能性のある血腫の形成を防ぎます。 - 出血が止まったことを確認したら、スポンジベルトを外し、片手で動物の腰をつかみ、もう片方の手で動物の脇の下を背側から持てるように回転させます。
- マーモセットをケージに戻します。ストレスを軽減し、採血の繰り返しを容易にするために、マーモセットに好きな食べ物(ビスケット、マシュマロ、スポンジケーキなど)を提供します。血腫の発生状況を時々確認してください。
注:初期段階で血腫が見つかった場合は、血腫の進行を防ぐために圧迫包帯を貼ってください。久しぶりに発見された場合、大腿動脈の結紮による血腫の外科的切除と輸血が必要になることがあります9,13。 - 溶血を防ぐために、針をシリンジから取り外します。次に、収集した血液を1.5mLのマイクロチューブの内壁に沿ってゆっくりと排出します。
注:収集した血液は、P4 / E2レベルを測定するために、血漿分離の前に最大24時間4 °Cで保存できます。
2. 血漿の分離とホルモンレベルの測定
- 1.5 mLチューブ内の血液を1,100 × g で4 °Cで5分間遠心分離します。
- 分離した血漿(上清)を1.5 mLチューブから新しいチューブ/カップに移し、血球(沈殿物)の混入を慎重に避けます。.
- ELISAキットまたは自動アナライザを使用して、P4およびE2レベルを測定します。自動分析装置に血漿量が足りない場合は、試料希釈液を使用してください。
注:自動分析装置を使用した測定では、P4レベルのみを決定するために>175μLの血漿が必要であり、P4とE2の両方を決定するには>250μLの血漿が必要です。
3. 排卵・妊娠を検出するための尿CG測定
注:マーモセットのCGレベルは、排卵と妊娠の両方について、イムノクロマトグラフィーキットテストを使用して測定できます。排卵の場合、排卵の0〜2日前に陽性の結果を得ることができます。妊娠の場合、妊娠15〜20日目から約100日目に陽性の結果が検出されます。この検査には少量(90μL)の尿が必要です(1滴の尿は~30μLです)。
- トレー方式:同じケージに2匹以上いる場合は、前日に対象のマーモセット(または他の動物)を別のケージに移動させます。照明の前夜または照明の前に、ケージの底に清潔なトレイを置きます。夜間は膀胱から尿が排出されません。したがって、尿は通常、照明直後に膀胱から放出されます。
注:朝、照明が点灯する前の部屋に入ると、コホートの睡眠サイクルが乱れる可能性があります。通常、点灯後約30分以内に尿を採取できます。 - 圧搾方法:洗浄したトレイを採尿用に準備します。マーモセットの膀胱の位置を特定したら、指の全長を使用して、前面と両側から慎重に絞ります(図1F)。朝、部屋を照らす直前に尿を溜めてください。
注:膀胱に尿がないために尿の収集が失敗した場合は、しばらく待ってから再試行してください。無理な力を加えると動物を傷つける恐れがありますので、ご注意ください。 - 採取後すぐに、尿サンプルをイムノクロマトグラフィーテストキットのウェルに入れます。製造元の指示に従って、10分後に結果を読み取ります。
4.卵子、受精卵、および胚の収集のための卵巣周期段階の制御と決定
- 卵巣からの胚小胞(GV)卵子の採取
- 150 μLの生理食塩水14 (図2)で希釈した0.263 mg / mLクロプロステノール(合成PGF2α類似体)を3 μLの筋肉内注射を行い、黄体期の終わり(つまり、黄体期の開始から≥10日後)に卵巣周期をリセットします。.
注:希釈したクロプロステノールは、少なくとも+4°Cで数週間安定しているため、希釈溶液をより大きな量にすると便利な場合があります。 - 翌日(1日目)に、P4レベルが低下したことを確認して、卵胞期の開始を確認します。
注:クロプロステノール注射は、24時間3以内にP4レベル(通常は<10 ng / mL)を劇的に減少させることが報告されています。. - 1日目から、FSH(25 IU、筋肉内)を2日ごとに1回、合計5回(1、3、5、7、9日目)注入します。10日目は、午後にhCG(75 IU、筋肉内)を注射します。
- 文献15,16 によれば、麻酔下での卵胞吸引により、11 日目に卵巣から GV を収集します。
注:時々、排卵は予想よりも早く起こります。したがって、8日目からCGレベルを確認することをお勧めします。重心検査が陽性の場合は、この日にGV採取を行ってください。
- 150 μLの生理食塩水14 (図2)で希釈した0.263 mg / mLクロプロステノール(合成PGF2α類似体)を3 μLの筋肉内注射を行い、黄体期の終わり(つまり、黄体期の開始から≥10日後)に卵巣周期をリセットします。.
- 中期II(MII)卵子、受精卵、および初期胚の収集
- ステップ4.1.1で説明されているように、クロプロステノールを使用して卵巣周期をリセットします。.
- 翌日(1日目)に、P4レベルが低下したことを確認して、卵胞期の開始を確認します。
- 受精卵と胚の採集は、6日目から交尾のために雌のマーモセットと雄のマーモセットを一緒に飼育します。
- 7日目から、女性の血中P4 / E2レベルと尿CGレベルを確認します。重心の検出は、数日以内(通常は翌日)の排卵の指標です。前日と比較してP4レベルが増加し、E2レベルが減少した日に、卵管17,18からMII卵子または胚0日目(E0)接合子を採取する。
- 胚収集については、文献に記載されているように、卵管(E1〜E3、1〜8細胞)17,18または子宮(E5-E10、8細胞-胚盤胞)19,20,21,22のいずれかから、標的の病期に応じて適切な時点でフラッシングを行う。
結果
本研究で使用した動物に関する詳細は 、表1に示す。
大腿静脈の解剖学的分析
大腿静脈の解剖学的分析は、安楽死中の2歳のオスのコモンマーモセット(I 7713M)を使用して行われました。大腿静脈と動脈は大腿骨の三角形にあります。大腿骨三角形は、腹壁と大腿筋の境界に形成されます(図1B-D)。大腿部の付け根では、逆三角形の中心に大きな静脈が走り、静脈の外側に平行に動脈が走っています。下部では、静脈と動脈が細くなり重なり合い、動脈は静脈の上部に配置されます(図1D)。
採血では、動脈損傷が大腿動脈血腫を引き起こす可能性があり、出血がひどい場合に心血管ショックを引き起こす可能性があるため、静脈を標的にする必要があります13。血液は三角形とその遠位領域の静脈のどの部分からでも採取できますが、静脈のサイズが大きく、動脈との重なりがほとんど見えないため、大腿骨三角形の近位部位からの静脈穿刺が推奨されます。さらに、近位部位の静脈は表面的であるため、針を使用して簡単に位置を特定できます。大腿骨三角形の動脈は脈動するため、視覚的または触診によって識別されることがあり、静脈はそれのすぐ内側に走っています。したがって、動脈の脈動の観察は、静脈の位置を予測するのに役立ちます。
さらに、静脈を示す青色の着色は、通常、三角形の上部の皮膚の下に観察されます(図1B、C)。ただし、三角形のリンパ節は静脈の近くに位置し、濃い青色を示すことが多いため、外観は似ています。幸いなことに、それらはその可動性によって区別することができます:静脈は静止しており、リンパ節は可動です。したがって、動脈の脈動と静脈の青色は、静脈の位置を特定するために使用される2つの主要な手がかりですが、それらを視覚化するには髪の毛を剃る必要がある場合があります。
卵巣周期の病期の決定
6匹の雌マーモセット(1歳から3歳まで)のP4およびE2レベルをモニターし、卵胞期と黄体期の期間を調査しました。その結果、卵胞期と黄体期の平均期間はそれぞれ11.58日(4つのマーモセットからn = 6)と16.8日(3つのマーモセットからn = 5)であることが示されました(表2)。以下では、6匹のマーモセットのうち1匹(I6751F、3歳児)のP4とE2の動態について詳しく説明します。この動物の採血とホルモン測定は、38日間にわたって数日おきに行われました(表3)。
黄体期(1〜10日目)
測定の開始日は1日目に設定されました。P4レベル(21 ng / mL)に基づくと、動物は黄体期にあった可能性があります。1日目から10日目にかけて高いP4レベル(≥21 ng / mL)が観察され、黄体期が示唆されました。12日目には、4 ng/mLに急激に低下しました。この有意な減少は、黄体期から卵胞期への移行を示しました。10日目(241 ng/mL)から12日目(189 ng/mL)へのE2レベルの低下も、この移行を裏付けていました。
卵胞期(12-22日目)
卵胞期に移行した後、P4レベルは19日目まで低いまま(4〜6 ng / mL)、その後19日目から24日目にかけてわずかに増加しました(19日目、6 ng / mL、22日目、8 ng / mL、24日目、9 ng / mL)。対照的に、E2レベルは19日目(94 ng / mL)から22日目(322 ng / mL)に有意に増加し、その後22日目から24日目(158 ng / mL)に減少しました。P4の増加とE2レベルの減少に基づいて、排卵は22日目から24日目の間に発生し、卵胞期から黄体期に移行したと予測されました。
黄体期(24-36日目)
排卵後、P4レベルは36日目まで高いままで、その後38日目に3 ng / mLに低下しました。.したがって、黄体期から卵胞期への移行は36〜38日目の間に起こった可能性があります。この移行と一致して、E2レベルはこの期間中に減少しました(36日目、2517 ng / mL、38日目、73 ng / mL)。
排卵のタイミングの予測と決定
尿中重心値と排卵日との関係を調べるために、7種類のマーモセット(No.1-7)を調製した。排卵周期をリセットするためにクロプロステノールを注射しました(0日目)。その後、7日目から血中P4/E2値と尿中重心値のモニタリングを行った。点灯直後に尿を採取しました。採血は基本的に午前中に行われました。排卵は、報告された17のように、E2レベルが前日と比較して大幅に低下したときに起こると考えられていました。その日、卵胞の破裂は確かに卵巣の表面で観察され、卵管には接合子/卵子の存在が観察されました(表4)。
重心は、7日目から11日目(7日目、N = 1、8日目、N = 2、9日目、N = 1、10日目、N = 2、11日目、N = 1)に最初に検出された(表4)。E2レベル(排卵の指標)の大幅な低下は、最初のCG信号の0〜3日後に観察されました。最初の重心検出からE2減少までの期間は、最初の重心検出が早いほど長かったようです(図3A)。例えば、1匹の動物(No.1)は、最初の重心検出から3日後の7日目にE2シグナルの低下を示しました(表4)。対照的に、最初のCG検出とE2シグナルのドロップの同時発生は、10日目に1匹の動物(No.2)で観察されました。したがって、最初の重心視の検出と排卵は5匹の動物のうちの1匹で同じ日に観察されましたが、排卵は重心の最初の検出から数日以内に起こりました。
マーモセットCGのイムノクロマトグラフィー検査キットは、尿を検査に使用するように設計されています。重心レベルの検査は、通常、血漿を使用してP4/E2レベルを決定することに伴います。重心検査では、尿の代わりに血漿を使えると助かります。これを検証するために、上記の実験でP4/E2レベル測定後に残った血漿を調べました。血漿と尿は、上記の実験のいずれかの日に4匹の動物から採取されました(検査の日は 表4の二重アスタリスク[**]で示されています)。尿を用いたところ、4匹中2匹が陽性(スコア5と3)、他の2匹が陰性(スコア1)でした。血漿は尿と基本的に同じ結果を示しました(図3B)。より強いシグナルは、血漿を使用して得られました。そのため、血漿を使用する場合は、尿に設定されている10分前に判断する必要があります。
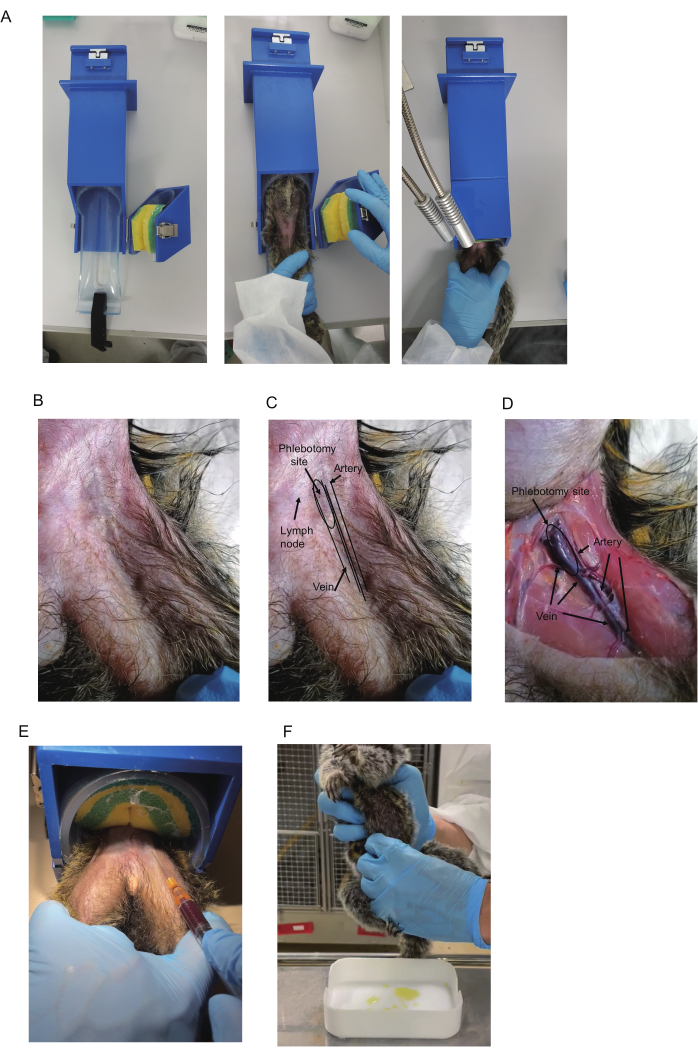
図1:マーモセットからの採血 (A)採血には拘束具を使用。(B)マーモセット太ももの上部。(C)大腿骨の三角形と血管。三角形の大腿動脈はしばしば見え、脈動を示します。大腿静脈の青色は、三角形の近位領域(瀉血部位として示される)に見えることがあります。リンパ節も青色を示します。ただし、リンパ節はリンパ節が皮膚に付着しているため、リンパ節は可動します。(D)安楽死させた動物の大腿部の解剖学的図。動脈、静脈、および瀉血部位が示されています。同じ動物がB-Dに示されています。(E)拘束具を使用した採血。マーモセットの足の保持位置と採血中の様子が写っています。(F)マーモセットからの尿の収集。この図の拡大版を表示するには、ここをクリックしてください。
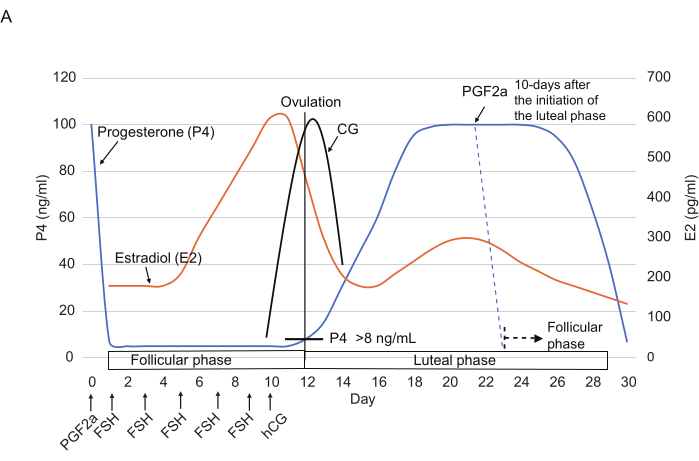
図2:マーモセットの卵巣周期中のP4、E2、およびCGレベルの典型的なパターン。 FSH、hCG、および PGF2α 注入の時点が示されています。破線はPGF2α注射後に予想されるホルモンパターンを示しています。略語:P4 =プロゲステロン。E2 =エストラジオール;CG =絨毛性ゴナドトロピン;FSH =卵胞刺激ホルモン;hCG =ヒト絨毛性ゴナドトロピン;PGF2α = プロスタグランジン F2α。 この図の拡大版を表示するには、ここをクリックしてください。
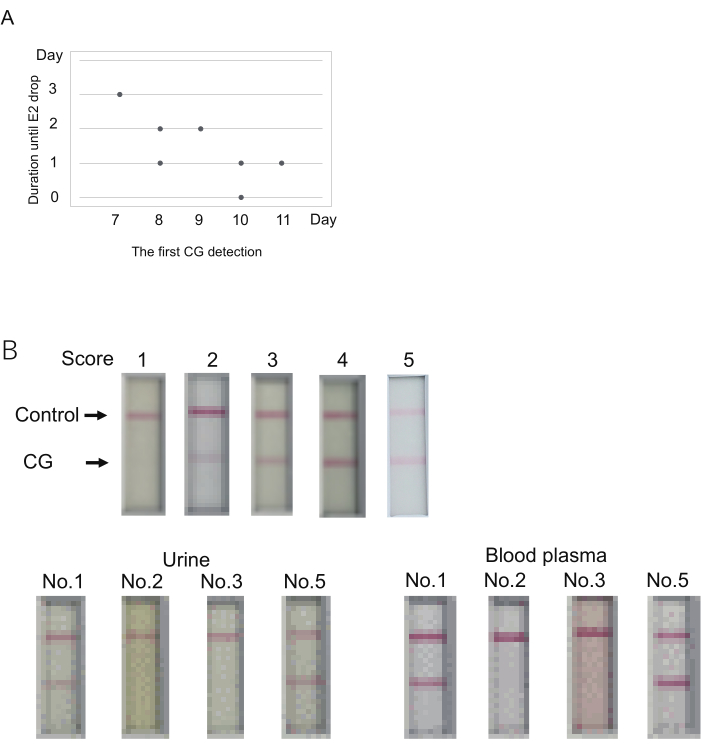
図3:排卵の発生を予測するための重心レベルの決定 (A)重心検出の初日(スコア> 1)と排卵までの期間(E2低下)との間の可能な関係。(B)血漿はイムノクロマトCG検査に使用できます。各スコアの代表的な結果 (上)。スコアは、サンプルのロードから 10 分後に決定されました。スコア 2 は、5 分以内にバンドが出現せず、10 分以内にバンドが出現したことを表します。採血は尿の採取後すぐに行われました。4種類のマーモセット( 表S4のNo.1、No.2、3、5)を調べた。ここで使用されているサンプルは、 表4に二重のアスタリスクで示されています。血漿は、E2測定に使用した希釈バッファーにより50%に希釈しました。 この図の拡大版を表示するには、ここをクリックしてください。
表1:この研究で使用された動物。この表をダウンロードするには、ここをクリックしてください。
表2:卵胞期と黄体期の期間。 位相は、P4レベル(卵胞期P4≤8、黄体期P4>8)に基づいて決定されました。測定間で相変化が観察された場合、測定日の間の中間点が変化点であると決定されました。2つの変化点間の期間は、卵胞期または黄体期と見なされました。1つのフェーズの期間を確実に測定するために、同じフェーズ内の長い(≥7日)間隔または≥6日間隔の2倍のデータは、2つのフェーズにまたがる場合を含め、分析には使用されませんでした。2つの測定が同じフェーズで行われた場合にのみ、データが使用されました。この表をダウンロードするには、ここをクリックしてください。
表3:1つのマーモセットで38日間のP4およびE2測定結果。この表をダウンロードするには、ここをクリックしてください。
表4:排卵日の決定と予測。 排卵の痕跡は、卵巣に出血部位または破裂部位が観察された場合に存在すると考えられました。卵子/受精卵は、E2ドロップの日に卵管から得られた卵子/受精卵の病期を示します。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
静脈の位置を特定することは、採血の最も重要なステップです。解剖学的観察に基づいて、このプロトコルは、マーモセットの採血の容易な場所として大腿骨三角形の近位領域を導入します。このエリアを利用することで、大静脈からの採血が容易に行えます。しかし、このプロトコルを使用しても、動脈の損傷が発生することがあります。動脈を損傷した場合、血腫を予防するために、>5分間圧力をかけて出血を完全に止めることをお勧めします。また、圧力をかけながら、角氷を使って点状部位を冷やすのも効果的です。血腫はヘパリン(例:Tensolvet 5.000 I.E.ゲル)で治療できます。ほとんどの血腫は、ヘパリンと0.05 mLのメロキシカム(0.5 mg / mL、PO)による3〜4日間の連続した治療後に消失します。動脈は、大腿部の近位領域の静脈に対して横方向に走っています。遠位領域では、静脈と動脈は互いに接近し、より重なり合っているように見え、動脈は静脈の腹側に位置していました。この位置関係に基づくと、大腿部の近位領域からの採血は、動脈損傷のリスクが低下する可能性があります。
また、近位部の大腿静脈は厚く、表面的に位置しているため、針で簡単に位置を特定することができます。しかし、遠位部からの採血は、近位部をそのまま残すことができるという利点があり、採血中に静脈が損傷した場合でも、同じ脚の近位部からすぐに静脈穿刺を繰り返すことができます。これは、損傷した部位の遠位領域は通常、即時の静脈穿刺に利用できないためです。ただし、採血が失敗した場合は、もう一方の脚の近位部位から繰り返しサンプリングを行うことができます。
マーモセットの循環血液量は~25 mL(70 mL/kg)23です。350 gのマーモセットは、2 mLの採血から回復するのに1週間を要し、これは全血液量の7.5%に相当します6。大腿静脈からは、500〜700μLの血液を難なく採取できます。繰り返しサンプリングが必要な場合は、少量の血液を採取し、自動分析装置に希釈バッファーを使用することをお勧めします。
麻酔は一般的に採血には使用されませんが、初心者にとっては、麻酔をかけた動物からの採血は、覚醒している動物からの採血よりもはるかに簡単かもしれません。ただし、採血に麻酔を使用する場合は、麻酔が血液成分の測定値に影響を与える可能性があるため、注意が必要です。卵巣周期の病期を決定するためのホルモン測定に関連して、アルファキサロンはP424のレベルを予想外に高めたと報告されました。これは、抗P4抗体がP4誘導体であるアルファキサロンと交差反応性によって引き起こされたものです。
P4とE2(ステロイドホルモン)の構造は、人間とマーモセットで同じです。したがって、ヒトP4およびE2用の市販のELISAキットは、マーモセットP4およびE2用に使用できます。また、ヒトの血中ホルモン測定のアウトソーシングサービスも承っております。対照的に、ポリペプチドホルモン(FSH、CG、インヒビンなど)のアミノ酸配列にはわずかな違いがあります。これらのポリペプチドホルモンについては、キットがヒトとマウスなどの他の進化上の遠い種の両方に使用できる場合、マーモセットにも機能します。インヒビンBの測定には、ヒト/マウス/ラットのインヒビンB(ベータBサブユニット)酵素免疫測定キットを使用できます。
P4レベルの増加は、排卵(卵胞期から黄体期への移行)の特徴です。P4値だけでは個人差があるため、排卵日を特定することは困難ですが、P4値が>8ng/mLであれば、排卵の発生の目安として活用できます。排卵日のより信頼性の高い指標は、E2レベル3,17の減少です。排卵子/受精卵は、E2減少の日に卵管で実際に観察されました(表4)。したがって、E2の測定により、正確な排卵日を特定することができます。ホルモンレベルに加えて、PGF2α投与後の日数に関する情報は、排卵日の予測因子です(表4)。同様に、P4 レベルと E2 レベルの組み合わせ使用は、P4 レベルが劇的に減少し、E2 レベルが最も低くなる卵胞期への移行のタイミングを特定するのに役立ちます。
マーモセットでは、LHの代わりにCGが下垂体から放出され、排卵を誘発します。さらに、CGは、胚が子宮内膜に付着して着床するときに栄養膜細胞から排泄されます。マーモセットは機能的な LH 遺伝子を欠いているため、LHの代わりにCGが下垂体から放出され、排卵を刺激する5。ある研究では、排卵を示すE2ピークとCGピークが同じ日に観察されることが報告されました12。別の研究では、平均して、E2ピーク(PGF2α投与の8.6日後)がCGピーク(PGF2α投与の9.3日後)に先行すると報告されており、これはCGピークに達する前に排卵が起こる可能性があることを示している。CGはE2とは異なり、ピークの直前にパルス放出されます。重心のパルス放出は、平均してピークの~1日前に開始されます。しかし、CGレベルの最初の検出からE2レベルの低下までの期間には大きな変動が観察されました(図3A および 表4)。さらに、CGは午前と午後の両方のサンプルで最初に検出されたと報告されています25。
私たちの知る限り、マーモセットの排卵が特定の時間に発生したという報告はありません。また、マーモセットは通常、一度に2〜3個の卵子を放出するため、一定期間にわたってすべての卵子が放出されることもあります。排卵前に重心値の増加が起こるため、重心測定により排卵日を事前に予測することができます。このような情報は、排卵日のMII卵子または0日目の胚の収集に特に有用です。したがって、血中P4/E2レベルとCGレベルの組み合わせ測定が有用です(図3B)。ヒトを含むほとんどの霊長類では、分娩後しばらくは排卵が起こりません。しかし、産後の排卵はマーモセットで出産後~10日で起こります。その結果、次の配信は、前の配信から~155日後に観察されることがよくあります。この連続した妊娠は、双子の出産とともに、マーモセットの繁殖力が高いレベルをもたらします。
ホルモンの変動は個人によって異なり、一定の周期を持たないものもあります。一部の雌マーモセットは、排卵の欠如を示す低いP4 / E2レベルを常に示しています。排卵周期の欠如は、優勢な生殖女性による未熟さ、健康問題、ストレス、または排卵阻害に起因する可能性があります26,27。ホルモンレベルを測定した21匹のマーモセット(>2歳)のうち3匹は、著者の施設で定期的な排卵周期がないことを示しました。原因を解明し、適切な治療法を開発することで、動物をより効果的に実験に利用することが可能になります。黄体期が~1ヶ月の長期化とそれに伴う高P4レベルの個人が観察されました2。著者の施設では、同じ個人で長期の黄体期が繰り返されます。21匹のマーモセットのうち2匹がこの異常を示しました。2匹のうち1匹はシングルハウスで飼われていましたが、長期の黄体期に妊娠していた可能性は除かれました。もう一人は、放射線治療によっておそらく不妊の男性とペアになっているため、彼女は長期の黄体期に妊娠していた可能性は低いです。黄体期が長期化する場合でも、PGF2αの投与によりP4レベルが下がり、卵巣周期がリセットされます。性ホルモンを測定し、排卵周期の状態を理解することは、実験や繁殖における動物の効果的な使用に役立ちます。
個人からの採血は、排卵日の推定だけでなく、診断目的の血清学的検査にも使用されます。同様に、ホルモンレベルの測定は、排卵日の推定だけでなく、社会的相互作用、子供の発達、および病気の研究にも使用されます。今後、遺伝子改変マーモセットの作製には、iPS細胞から卵巣や精巣を作製することが期待されています。適切なホルモンレベルは正常な発達にとって重要であるべきです。ここで説明するプロトコールは、マーモセットでiPS細胞由来生殖腺を作るための性ホルモンの測定と制御に役立ちます。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
このプロトコルの確立とマーモセットの日常的なケアにご協力いただいた沈春さん、阿久津弘子さん、阿久津弘子さん、杉木史代さん、橋本優菜さん、成富陽菜さん、坂本祐樹さん、堀米美紀子さんに感謝いたします。峯重隆之氏(原稿へのコメント)阿部由紀子さんと相葉研究室のメンバーは、接合子の収集技術を共有してくれました。CIEAは、マーモセットの飼育や40年以上にわたって培ってきた実験に関する情報を共有していただきました。本研究は、日本教育委員会、科学技術振興機構、科学研究費補助金(JP19gm6310010、JP20gm6310010、JP21gm6310010、JP22gm6310010)(AMED)、JPMJPR228B(JST)、20H05764、20H03177、22K18356(科学研究費)の助成を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
参考文献
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved