Method Article
דגימת דם ומדידת הורמונים לקביעת השלב במחזור השחלה במרמוסטים
In This Article
Summary
פרוטוקול זה מתאר דגימת דם ושתן למדידת רמות פרוגסטרון/אסטרדיול וגונדוטרופין כוריוני כדי לקבוע את שלב מחזור השחלות. רמות ההורמונים משמשות לחיזוי וקביעת עיתוי הביוץ והורמונים מוזרקים כדי לווסת את מחזור השחלות ואת צמיחת הביציות.
Abstract
מרמוסטים נפוצים הם קופי עולם חדש קטנים. מאחר שרבים מהמנגנונים הביולוגיים שלהם דומים לאלה של בני אדם, מרמוסטים עשויים להיות שימושיים למחקר רפואי וביולוגי אנושי במגוון תחומים, כגון מדעי המוח, רפואה רגנרטיבית ופיתוח. עם זאת, חסרה ספרות המתארת שיטות לניסויים ונהלים בסיסיים רבים. כאן מתוארות שיטות מפורטות לקביעת רמות הורמוני המין (פרוגסטרון, אסטרדיול וגונדוטרופין כוריוני) במרמוסטים. המדידה של הורמונים אלה מאפשרת לחזות את השלב במחזור השחלות, שהוא בדרך כלל 26-30 יום במרמוסטים; קביעה מדויקת חיונית לקצירת ביציות/זיגוטות בנקודת הזמן הנכונה ולהכנת נקבות פונדקאיות ליצירת מרמוסטים מהונדסים גנטית.
בנוסף, מדידת רמות הורמוני המין שימושית לאנדוקרינולוגיה, אתולוגיה, התפתחות מוקדמת וביולוגיה של הרבייה. פרוטוקול זה מספק תיאור מפורט של השיטות לדגימת דם מווריד הירך, הפרדת פלזמה למדידת הורמונים, מדידת רמות גונדוטרופין כוריוני באמצעות שתן ופלזמה, איפוס מחזור השחלות באמצעות זריקות של אנלוגי פרוסטגלנדין F2α כדי לקצר ולסנכרן את המחזור, וקידום צמיחת זקיקים וביוץ על ידי הזרקת הורמון מגרה זקיק וגונדוטרופין כוריוני. באמצעות פרוטוקולים אלה, ניתן לקבוע את השלבים במחזור השחלתי לאיסוף בזמן של ביציות/זיגוטות.
Introduction
המרמוסט המצוי (Callithrix jacchus) הוא קוף עולם חדש קטן בעל מאפיינים רבים הדומים לאלה של בני אדם, ומשך מחזור השחלות שלו הוא 26-30 יום 1,2. מחקרים על התפתחות מוקדמת ויצירת מרמוסטים מהונדסים גנטית דורשים קצירת ביציות וזיגוטה בשלבים ספציפיים במחזור השחלות. לכן, קביעה מדויקת של השלב היא קריטית וניתן להעריך אותה על ידי מדידת רמות הדם של ההורמונים פרוגסטרון (P4) ואסטרדיול (E2)2,3. הורמונים אלה מקדמים צמיחה רירית הרחם, אשר הכרחי להשתלה. P4 מיוצר מקורפוס לוטאום, שנוצר בשחלות מיד לאחר הביוץ. E2 מופרש על ידי זקיקי השחלות בתגובה להורמון מגרה זקיקים (FSH) מקומפלקס ההיפותלמוס-יותרת המוח במוח. רמות E2 עולות ככל שהזקיק מתבגר, ומגיעות לשיא לפני הביוץ3. רמות E2 גבוהות גורמות לשחרור פועם של הורמון luteinizing (LH) דרך קומפלקס ההיפותלמוס-יותרת המוח בבני אדם; נחשול LH זה גורם לביוץ. עם זאת, במרמוסטים, הגן LH עבר ניוון במהלך האבולוציה, והביוץ נגרם במקום זאת על ידי שחרור גונדוטרופין כוריוני (CG), בעל מבנה דומה לזה של LH, מבלוטת יותרת המוח 4,5.
מחזור השחלות יכול להיות נשלט על ידי זריקות הורמונים. זריקות FSH, בבני אדם, פועלות על קולטני FSH בשחלות ומשמשות לקידום סינתזת אסטרוגן וצמיחת זקיקים6. הזרקת CG אנושי (hCG) כתחליף ל- LH בסוף השלב הפוליקולרי משמשת לגירוי ביוץ בבני אדם7. זריקות CG משמשות גם לטיפול באי פוריות אנושית מכיוון ש- CG מגרה את הקורפוס לוטאום בתחילת ההריון, וכתוצאה מכך ייצור P4 מוגבר. זריקות פרוסטגלנדין F2α (PGF2α) מאפסות את מחזור השחלות8. בבקר ביתי, הזרקת PGF2α משמשת לקיצור השלב הלוטאלי ולסנכרון מחזור הייחום לניהול הרבייה.
למרות שלמרמוסטים ולבני אדם יש מנגנונים ביולוגיים דומים, מה שהופך אותם לחיות מודל אידיאליות, חסרה ספרות המתארת שיטות בסיסיות לטכניקות רבות המשמשות לעתים קרובות. דגימת דם היא אחת הטכניקות הנפוצות ביותר 9,10,11,12. עם זאת, מתחילים לפעמים מתקשים למצוא את הווריד. לפיכך, מחקר זה ערך ניתוחים אנטומיים של אזור ורידים הירך. בהתבסס על תצפיות אנטומיות, פרוטוקול זה מציג את האזור הפרוקסימלי של משולש הירך כאתר קל לניקור.
Protocol
כל השיטות שכללו מרמוסטים השתמשו בסטנדרטים אתיים ורווחתיים גבוהים ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים במרכז הלאומי לבריאות והתפתחות הילד. בעלי החיים ששימשו כאן היו בעלי בתים בודדים או זוגיים (נקבה אחת וזכר אחד) עם 12 שעות אור ביום.
1. דגימת דם של וריד הירך
- הכינו מזרק 1 מ"ל (הסוג הקצר קל לשימוש) עם מחט 25 גרם המחוברת לצד הלהב כלפי מעלה. כדי למנוע סתימת דם, heparinize את המזרק על ידי משיכת 200 μL של תמיסת נתרן הפרין לא מדולל לתוך המזרק. מצפים את החלק הפנימי של המזרק באופן שווה על ידי משיכת אותו למעלה ולמטה מספר פעמים; לאחר מכן, לגרש את תמיסת הפרין מן המזרק.
הערה: מכיוון שלעתים קרובות יש צורך בהחלפה למזרק חדש, הכינו מספר מזרקים נוספים. - הכינו צמר גפן סופג ומקלוני אלכוהול. הדליקו מנורה מתכווננת שתאיר את האזור בו יוצב המרמוסט לדגימת דם.
- הכן את התקן הריסון (420 x 85 x 85 מ"מ, איור 1A), הזמין מסחרית (ראה טבלת חומרים לפרטים). כדי להכניס מרמוסט להתקן, פתח את חלק השמירה באמצעות חגורת הספוג, המאבטחת מרמוסטים. הכנס את המרמוסט להתקן הריסון כשפניו כלפי מעלה.
הערה: מרמוסטים בדרך כלל רגועים במכשירי ריסון אשר עשויים לשלול את הצורך בהתאקלמות או אימון ריסון. - ללכוד את marmoset; להכניס את המרמוסט לחלק הגלילי; ולאבטח אותו על ידי לחיצה על חגורת הספוג. הניחו את הרגל שממנה יש לאסוף דם על גבי הרגל השנייה (איור 1A). להחזיק את הרגליים באמצעות היד הלא דומיננטית; הניחו את האצבע האמצעית ואת הקמיצה בתוך כל רגל כדי להדק אותן ואת האצבעות האחרות מחוץ לכל רגל כדי לתקן אותן.
הערה: כפפות נשיכה מומלצות בעת לכידת מרמוסטים. אם אין מכשיר ריסון, יש לבצע איסוף דם בהרדמה או עם אדם אחר המרסן. - בדוק אם וריד הירך גלוי ליד בסיס הירך. אם לא, מישוש כדי למצוא את העורק הפועם והשתמש בו כנקודת ציון כדי לבדוק שהוריד עובר בתוכו (איור 1B-D).
הערה: תאורה שולחנית וגילוח שיער מומלצים לשיפור הראות. ניתן לשפר את הראות גם על ידי שפשוף עם מקלוני אלכוהול. בלוטות הלימפה במשולש ממוקמות לעתים קרובות קרוב לווריד ומראות צבע כחול כהה כווריד. כיצד להבחין ביניהם מתואר בסעיף תוצאות מייצגות. - יש לחטא את אתר הניקוב באמצעות ספוגית אלכוהול. הכנס את להב המחט כלפי מעלה בזווית של 15°-20°. כדי למנוע מהמחט להחליק מכלי הדם במהלך איסוף הדם, ייצבו את היד האוחזת במזרק, למשל, על ידי הנחתו מצד שני.
- משכו בעדינות את הבוכנה לאחור כדי להפעיל לחץ שלילי (איור 1E). דחפו את קצה המחט קדימה. לאחר כניסת הדם למזרק, שמרו על מיקום קצה המחט עד לאיסוף הנפח הנדרש (500-700 מיקרוליטר).
- כאשר הדם אינו נכנס מזרק, לשנות את האתר של לנקב. אם הדם יוצא בעת שליפת המחט, להפסיק את הדימום על ידי הפעלת לחץ על אתר לנקב במשך 3 דקות. לאחר עצירת הדימום, הפעל מחדש את הניקוב.
- אם הדם הנשאב לתוך המזרק מפסיק לזרום במהלך תהליך הציור, לדחוף לאט את קצה המחט קדימה ולאחר מכן למשוך אותו בחזרה כדי למצוא את כלי הדם. זה עשוי לשחזר את זרימת הדם לתוך המזרק. אם לא, לשלוף את המחט ולבצע ניקור באמצעות מזרק חדש.
הערה: השתמש בירך ברגל השנייה כאשר קשה לאסוף דם מאותו צד.
- בזהירות למשוך את המחט תוך לחיצה קלה על אתר הניקוב באמצעות האצבע הקטנה. לאחר מכן, באמצעות צמר גפן סופג, מיד להפעיל לחץ על אתר לנקב במשך 3 דקות כדי לעצור את הדימום. הפוך את המזרק כדי לערבב דם והפרין.
הערה: יש להפעיל לחץ למשך זמן רב יותר (5 דקות) בזמן קירור בעת שאיבת דם עורקי, ולאשר בזהירות את הפסקת הדימום כדי למנוע היווצרות המטומה, שלעיתים עלולה לגרום לתוצאה קטלנית. - לאחר שווידאתם שהדימום פסק, הסירו את חגורת הספוג, אחזו במותניו של בעל החיים ביד אחת, וסובבו את בעל החיים כך שניתן יהיה להחזיק את בית השחי של בעל החיים ביד נוספת מהישבן.
- החזירו את המרמוסט לכלוב שלו. כדי להפחית את הלחץ ולהקל על דגימות דם חוזרות, ספקו למרמוסט את המזון האהוב עליו (למשל, ביסקוויטים, מרשמלו או עוגת ספוג). בדוק את התרחשות המטומה מדי פעם.
הערה: כאשר המטומה נמצאת בשלב מוקדם, להחיל תחבושת לחץ כדי למנוע את התקדמות המטומה. כאשר הוא נמצא לאחר זמן רב, הסרה כירורגית של hematoma עם קשירה של עורק הירך עירוי דם עשוי להיות נחוץ 9,13. - נתקו את המחט מהמזרק כדי למנוע המוליזה. לאחר מכן, לגרש לאט את הדם שנאסף לאורך הקיר הפנימי של microtube 1.5 מ"ל.
הערה: הדם שנאסף יכול להיות מאוחסן ב 4 oC עד 24 שעות לפני הפרדת פלזמה למדידת רמות P4 / E2.
2. הפרדת פלזמה וקביעת רמות הורמונליות
- צנטריפוגה את הדם בצינור 1.5 מ"ל ב 1,100 × גרם במשך 5 דקות ב 4 oC.
- העבר את הפלזמה המופרדת (supernatant) מצינור 1.5 מ"ל לצינור / חדשה, בזהירות הימנעות מהכללת תאי דם (משקעים).
- מדוד את רמות P4 ו- E2 באמצעות ערכת ELISA או מנתח אוטומטי. אם כמות הפלזמה אינה מספיקה למנתח האוטומטי, השתמש בתמיסת דילול דגימה.
הערה: עבור מדידה באמצעות אנלייזר אוטומטי, >175 μL של פלזמה נדרש לקביעת רמת P4 בלבד, ו >250 μL של פלזמה נדרש לקביעת P4 ו- E2.
3. מדידת CG בשתן לזיהוי ביוץ והריון
הערה: ניתן למדוד את רמות ה-CG במרמוסטים באמצעות בדיקת ערכה אימונוכרומטוגרפית הן לביוץ והן להריון. במקרה של ביוץ, תוצאה חיובית ניתן לקבל 0-2 ימים לפני הביוץ. במקרה של הריון, תוצאה חיובית מזוהה בין ימים 15-20 עד בערך יום 100 של ההריון. הבדיקה דורשת כמות קטנה (90 μL) של שתן (טיפה אחת של שתן היא ~ 30 μL).
- שיטת מגש: אם יותר משני בעלי חיים נמצאים באותו כלוב, העבירו את מרמוסט המטרה (או את החיות האחרות) לכלוב אחר יום קודם. הניחו מגש נקי בתחתית הכלוב בלילה שלפני או לפני ההדלקה. השתן אינו מנוקז משלפוחית השתן במהלך הלילה. לכן, השתן משתחרר בדרך כלל משלפוחית השתן זמן קצר לאחר התאורה.
הערה: כניסה לחדר בבוקר לפני התאורה עלולה לשבש את מחזור השינה של הקבוצה. בדרך כלל ניתן לאסוף שתן תוך כ-30 דקות לאחר ההדלקה. - שיטת סחיטה: מכינים את המגשים השטופים לאיסוף שתן. לאחר איתור שלפוחית השתן של המרמוסט, סחטו אותה בזהירות מקדימה ומשני הצדדים לכל אורך האצבעות (איור 1F). אספו שתן רגע לפני שאתם מאירים את החדר בבוקר.
הערה: אם איסוף השתן אינו מצליח עקב היעדר שתן בשלפוחית השתן, המתן זמן מה ונסה שוב. היזהר לא להשתמש בכוח מופרז כי זה יפצע את החיה. - מיד לאחר האיסוף, מניחים את דגימת השתן בבאר של ערכת הבדיקה האימונוכרומטוגרפית. קרא את התוצאה לאחר 10 דקות בהתאם להוראות היצרן.
4. בקרה וקביעה של שלב מחזור השחלות לאיסוף ביציות, זיגוטות ועוברים
- שלפוחית נבט (GV) איסוף ביציות מהשחלות
- מתן זריקה תוך שרירית של 3 μL של 0.263 מ"ג/מ"ל cloprostenol (אנלוג PGF2α סינתטי) מדולל ב 150 μL של מלוחים14 (איור 2) כדי לאפס את מחזור השחלות בסוף השלב הלוטאלי (כלומר, ≥10 ימים לאחר תחילת השלב הלוטאלי).
הערה: ביצוע התמיסה המדוללת בנפח גדול יותר עשוי להיות נוח מכיוון שהקלופרוסטנול המדולל נשאר יציב, לפחות, מספר שבועות ב +4 ° C. - למחרת (יום 1), אשר את התחלת השלב הפוליקולרי על ידי בדיקה שרמת P4 ירדה.
הערה: הזרקת Cloprostenol דווח להפחית באופן דרמטי את רמות P4 (בדרך כלל <10 ng / mL) בתוך 24 שעות3. - מהיום הראשון, יש להזריק FSH (25 IU, תוך שרירי) אחת ליומיים ובסך הכל 5x (ימים 1, 3, 5, 7 ו-9). ביום 10, הזריקו hCG (75 IU, תוך שרירי) אחר הצהריים.
- לאסוף GVs מן השחלות ביום 11 על ידי שאיפת זקיקים תחת הרדמה על פי הספרות15,16.
הערה: לפעמים, הביוץ מתרחש מוקדם מהצפוי. לכן, מומלץ לבדוק את רמות CG מהיום 8. אם בדיקת CG חיובית, בצע איסוף GV ביום זה.
- מתן זריקה תוך שרירית של 3 μL של 0.263 מ"ג/מ"ל cloprostenol (אנלוג PGF2α סינתטי) מדולל ב 150 μL של מלוחים14 (איור 2) כדי לאפס את מחזור השחלות בסוף השלב הלוטאלי (כלומר, ≥10 ימים לאחר תחילת השלב הלוטאלי).
- אוסף של ביציות, זיגוטות ועוברים מוקדמים מסוג metaphase II (MII)
- אפס את מחזור השחלות באמצעות cloprostenol כמתואר בשלב 4.1.1.
- למחרת (יום 1), אשר את התחלת השלב הפוליקולרי על ידי בדיקה שרמת P4 ירדה.
- לאיסוף הזיגוטה והעוברים, אכלסו מרמוסטים נקבות יחד עם מרמוסטים זכרים להזדווגות מהיום השישי.
- מהיום השביעי, בדקו את רמות P4/E2 בדם ואת רמות CG השתן של הנקבות. גילוי CG הוא אינדיקציה לביוץ תוך מספר ימים (בדרך כלל למחרת). ביום שבו רמות P4 עולות ורמות E2 יורדות בהשוואה ליום הקודם, אספו ביציות MII או זיגוטות עובריות ביום 0 (E0) מהאובידוקט17,18.
- לאיסוף עוברים, כמתואר בספרות, יש לבצע שטיפה מהאובידוקט (E1-E3, 1-8 תאים)17,18 או מהרחם (E5-E10, 8 תאים-בלסטוציסט)19,20,21,22 בנקודת הזמן המתאימה, בהתאם לשלב היעד.
תוצאות
פרטים הקשורים לבעלי החיים ששימשו במחקר זה מפורטים בטבלה 1.
ניתוחים אנטומיים של וריד הירך
ניתוחים אנטומיים של וריד הירך בוצעו באמצעות מרמוסט מצוי זכר בן שנתיים (I 7713M) שעבר המתת חסד. ורידי הירך והעורקים ממוקמים במשולש הירך. משולש הירך נוצר בגבולות שבין דופן הבטן לשרירי הירך (איור 1B-D). בבסיס הירך, וריד גדול עובר במרכז המשולש ההפוך, ועורק עובר במקביל מחוץ לווריד. באזור התחתון, הוורידים והעורקים נעשים דקים וחופפים, כאשר העורקים ממוקמים על גבי הוורידים (איור 1D).
עבור דגימת דם, הווריד צריך להיות ממוקד כי פגיעה עורקי יכול לגרום שטף דם עורק הירך, אשר עלול להוביל להלם לב וכלי דם כאשר הדימום הוא חמור13. למרות שניתן לשאוב דם מכל חלק של הווריד במשולש והאזור הדיסטלי שלו, מומלץ לנקב מהאתר הפרוקסימלי של משולש הירך בגלל גודלו הגדול של הווריד והחפיפה הקטנה לכאורה שלו עם העורק. בנוסף, הווריד באתר הפרוקסימלי הוא שטחי, ומאפשר מיקום קל באמצעות מחט. מכיוון שהוא פועם, העורק במשולש הירך מזוהה לעיתים חזותית או על ידי מישוש, והווריד עובר אליו רק מדיאלי. לפיכך, התצפית של פעימת העורקים מסייעת לחזות את מיקום הווריד.
יתר על כן, צבע כחול המעיד על הווריד נצפה בדרך כלל מתחת לעור בחלק העליון של המשולש (איור 1B,C). עם זאת, בלוטות הלימפה במשולש ממוקמים לעתים קרובות קרוב לווריד ולהראות צבע כחול כהה, ולכן המראה שלהם דומה. למרבה המזל, הם יכולים להיות מובחנים על ידי הניידות שלהם: הווריד הוא נייח, בלוטות הלימפה הם ניידים. לפיכך, פעימת העורק והצבע הכחול של הווריד הם שני רמזים עיקריים המשמשים לאיתור הווריד, אם כי ייתכן שיהיה צורך לגלח את השיער כדי לדמיין אותם.
קביעת השלב במחזור השחלתי
רמות P4 ו-E2 נוטרו בשש נקבות מרמוסטים (בגילאי שנה עד שלוש) כדי לחקור את משך השלב הפוליקולרי והלוטאלי. התוצאות הראו משך זמן ממוצע של 11.58 ימים (n = 6 מארבעה מרמוסטים) ו-16.8 ימים (n = 5 משלושה מרמוסטים) עבור השלב הפוליקולרי והלוטאלי, בהתאמה (טבלה 2). בהמשך, הדינמיקה P4 ו- E2 של אחד (I6751F, בן 3) של ששת המרמוסטים מתוארת בפירוט. דגימות דם ומדידות הורמונים בחיה זו בוצעו כל כמה ימים במשך 38 ימים (טבלה 3).
שלב לוטאלי (ימים 1-10)
יום תחילת המדידה נקבע ליום 1. בהתבסס על רמת P4 (21 ננוגרם/מ"ל), סביר להניח שהחיה הייתה בשלב הלוטאלי. רמת P4 גבוהה נצפתה בימים 1 עד 10 (≥21 ננוגרם/מ"ל), מה שמרמז על השלב הלוטאלי. ביום ה-12 הוא ירד בחדות ל-4 ננוגרם/מ"ל. ירידה משמעותית זו הצביעה על המעבר משלב לוטאלי לשלב הזקיקי. ירידה ברמת E2 מהיום ה-10 (241 ננוגרם/מ"ל) ל-12 (189 ננוגרם/מ"ל) תמכה גם היא במעבר זה.
שלב זקיקי (ימים 12-22)
לאחר המעבר לשלב הזקיקים, רמת P4 נשארה נמוכה (4-6 ננוגרם/מ"ל) עד היום ה-19 ואז עלתה מעט מהיום ה-19 ל-24 (יום 19, 6 ננוגרם/מ"ל; יום 22, 8 ננוגרם/מ"ל; יום 24, 9 ננוגרם/מ"ל). לעומת זאת, רמת E2 עלתה באופן משמעותי מהיום ה-19 (94 ננוגרם/מ"ל) ל-22 (322 ננוגרם/מ"ל) ולאחר מכן ירדה מהיום ה-22 ל-24 (158 ננוגרם/מ"ל). בהתבסס על העלייה ברמות P4 וירידה ברמות E2, הביוץ היה צפוי להתרחש בין הימים 22 ו -24, מעבר משלב הזקיקים לשלב הלוטאלי.
שלב לוטאלי (ימים 24-36)
לאחר הביוץ, רמת P4 נשארה גבוהה עד יום 36 ואז ירדה ל 3 ng / mL ביום 38. לפיכך, סביר להניח כי המעבר מהשלב הלוטאלי לשלב הפוליקולרי התרחש בין הימים 36-38. בהתאם למעבר זה, רמת E2 ירדה במהלך תקופה זו (יום 36, 2517 ננוגרם/מ"ל; יום 38, 73 ננוגרם/מ"ל).
חיזוי וקביעת עיתוי הביוץ
כדי לבחון את הקשר בין רמת CG בשתן לבין תאריך הביוץ, הוכנו שבעה מרמוסטים (מס' 1-7). קלופרוסטנול הוזרק כדי לאפס את מחזור הביוץ (יום 0). לאחר מכן, ניטור רמות P4/E2 בדם ורמות CG בשתן בוצע מהיום השביעי. השתן נאסף מיד לאחר ההדלקה. דגימת הדם בוצעה למעשה בבוקר. ההנחה הייתה כי הביוץ מתרחש כאשר רמת E2 ירדה במידה רבה בהשוואה לזו שביום הקודם כפי שדווח17. באותו יום אכן נצפה קרע זקיקי על פני השחלות, ונוכחות של זיגוטות/ביציות בביציות (טבלה 4).
CG זוהה לראשונה בימים 7 עד 11 (יום 7, N = 1; יום 8, N = 2; יום 9, N = 1; יום 10, N = 2; יום 11, N = 1) (טבלה 4). הירידה הגדולה ברמות E2 (אינדיקציה לביוץ) נצפתה 0-3 ימים לאחר אות ה- CG הראשון. משך הזמן מגילוי ה-CG הראשון ועד לירידה ב-E2 נראה גדול כאשר זיהוי ה-CG הראשון היה מוקדם יותר (איור 3A). לדוגמה, חיה אחת (מס' 1) הראתה ירידה באות E2 3 ימים לאחר גילוי ה-CG הראשון ביום ה-7 (טבלה 4). לעומת זאת, המופע המשותף של גילוי ה-CG הראשון ונפילת אות E2 נצפה בחיה אחת (מס' 2) ביום ה-10. לכן, למרות שזיהוי ה-CG הראשון והביוץ נצפו באותו יום באחת מחמש החיות, הביוץ התרחש תוך מספר ימים לאחר הגילוי הראשון של CG.
ערכת הבדיקה האימונוכרומטוגרפית עבור marmoset CG נועדה להשתמש בשתן לבדיקה. בדיקת רמת ה-CG מלווה בדרך כלל בקביעת רמות P4/E2 באמצעות פלסמה בדם. זה יהיה מועיל אם פלסמה בדם, במקום שתן, ניתן להשתמש עבור בדיקת CG. כדי לבדוק זאת, נבדקה פלסמת הדם שנותרה לאחר מדידת רמת P4/E2 בניסויים הנ"ל. פלסמת דם ושתן נאספו מארבעת בעלי החיים בכל אחד מימי הניסויים הנ"ל (ימי הבדיקה צוינו בכוכביות כפולות [**] בטבלה 4). באמצעות שימוש בשתן, שניים מתוך ארבעת בעלי החיים הראו תוצאות חיוביות (ציונים 5 ו-3), והשניים האחרים הראו תוצאות שליליות (ציון 1). פלסמה בדם הראתה למעשה את אותן תוצאות כמו שתן (איור 3B). האות החזק יותר התקבל באמצעות פלסמה בדם. לכן, בעת שימוש פלזמה בדם, שיקול הדעת צריך להיעשות לפני 10 דקות, אשר מוגדר שתן.
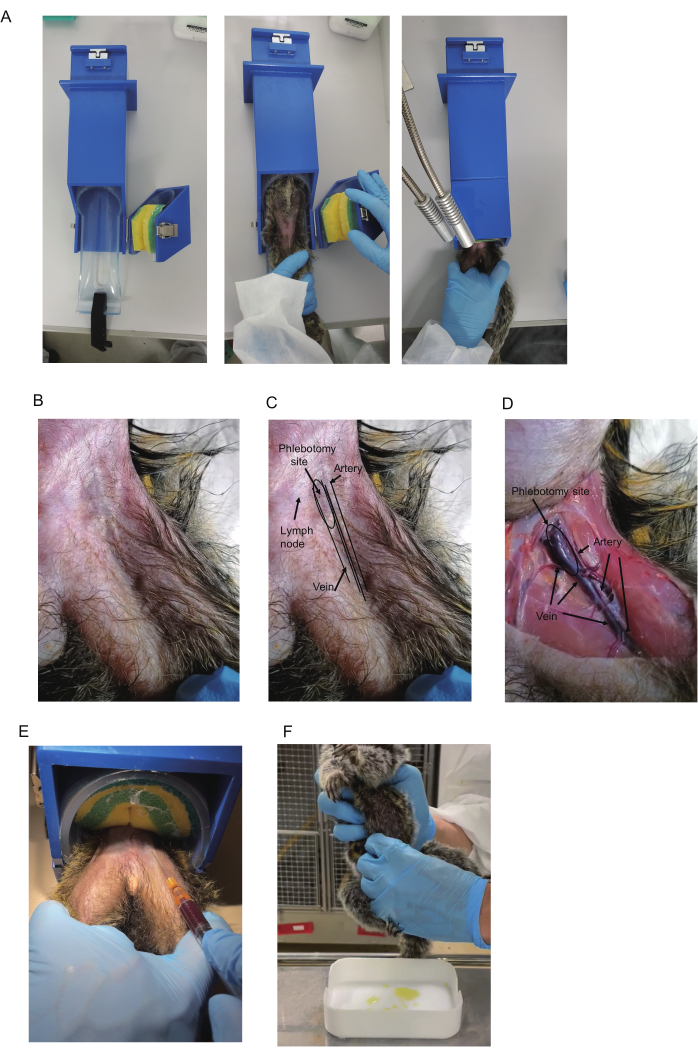
איור 1: איסוף דם ממרמוסטים. (A) משמש לרסן לאיסוף דם. (B) ירך עליונה של מרמוסט. (C) משולש הירך וכלי הדם. עורק הירך במשולש נראה לעתים קרובות ומראה פעימה. הצבע הכחול של וריד הירך נראה לפעמים באזור הפרוקסימלי של המשולש (מסומן כאתר phlebotomy). בלוטות הלימפה מראות גם צבע כחול. עם זאת, בלוטות הלימפה ניתנות להזזה מכיוון שבלוטות הלימפה מחוברות לעור. (D) מבט אנטומי על הירך של החיה המורדמת. העורק, הווריד ואתר הפלבוטומיה מסומנים. אותה חיה מוצגת ב-ב-ד. (ה) איסוף דם באמצעות ריסון. מנח האחיזה של רגלי המרמוסט והדם הנשאב מוצגים. (F) איסוף שתן ממרמוסט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
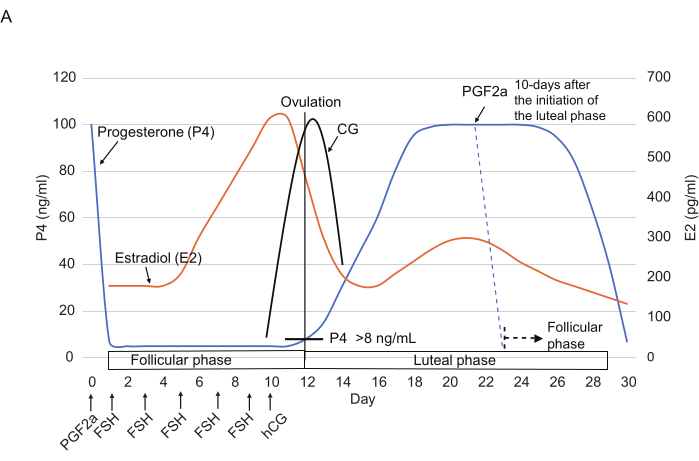
איור 2: דפוסים אופייניים של רמות P4, E2 ו-CG במהלך מחזור השחלות במרמוסטים. נקודות הזמן של הזרקות FSH, hCG ו- PGF2α מסומנות. קווים מקווקווים מראים את התבנית ההורמונלית הצפויה לאחר הזרקת PGF2α. קיצורים: P4 = פרוגסטרון; E2 = אסטרדיול; CG = גונדוטרופין כוריוני; FSH = הורמון מגרה זקיק; hCG = גונדוטרופין כוריוני אנושי; PGF2α = פרוסטגלנדין F2α. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
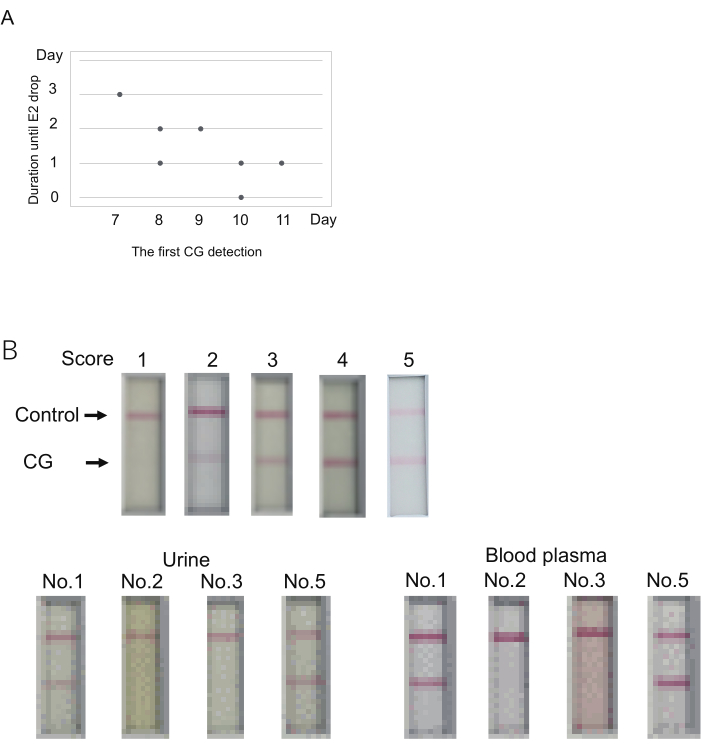
איור 3: קביעת רמת CG לחיזוי התרחשות הביוץ. (A) הקשר האפשרי בין היום הראשון לגילוי CG (ציון > 1) לבין משך הזמן עד הביוץ (ירידה E2). (B) פלסמה בדם יכולה לשמש לבדיקות CG אימונוכרומטוגרפיות. תוצאה מייצגת של כל ציון (למעלה). הניקוד נקבע 10 דקות לאחר טעינת הדגימה. ציון 2 מייצג אף להקה תוך 5 דקות, אלא הופעה של להקה תוך 10 דקות. איסוף הדם בוצע זמן קצר לאחר איסוף השתן. נבדקו ארבעה מרמוסטים (מס' 1, 2, 3, 5 בלוח S4). דוגמאות המשמשות כאן מסומנות ככוכביות כפולות בטבלה 4. פלסמת הדם דוללה ל-50% על ידי חיץ דילול המשמש למדידת E2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: בעלי חיים ששימשו במחקר זה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: משך השלבים הפוליקולריים והלוטאליים. הפאזה נקבעה על בסיס רמת P4 (פאזה פוליקולרית P4 ≤ 8, פאזה לוטאלית P4 > 8). כאשר נצפה שינוי פאזה בין המדידות, נקודת האמצע בין תאריכי המדידה נקבעה כנקודת השינוי. משך הזמן בין שתי נקודות השינוי נחשב לשלב פוליקולרי או לוטאלי. כדי להבטיח את מדידת משך הזמן של פאזה אחת, הנתונים עם מרווח ארוך (≥7 ימים) או פעמיים של מרווחים של ≥6 ימים באותו שלב, כולל כאשר הם משתרעים על פני שני השלבים, לא שימשו לניתוחים. רק כאשר נערכו שתי מדידות באותו שלב, נעשה שימוש בנתונים. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: תוצאות מדידות P4 ו-E2 במשך 38 ימים במרמוסט אחד.אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: קביעה וחיזוי של ימי ביוץ. עקבות הביוץ נחשבו נוכחים אם נצפו אתרי דימום או אתרי קרע בשחלות. ביצית/זיגוטה מציינת את שלבי הביצית/זיגוטה המתקבלים מאובידוקט ביום נפילת E2. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
איתור הווריד הוא השלב הקריטי ביותר באיסוף הדם. בהתבסס על תצפיות אנטומיות, פרוטוקול זה מציג את האזור הפרוקסימלי במשולש הירך כאתר קל לאיסוף דם במרמוסטים. באמצעות אזור זה, דגימת דם מווריד גדול ניתן לבצע בקלות. עם זאת, גם באמצעות פרוטוקול זה, פגיעה בעורק מתרחשת לפעמים. כאשר פוגעים בעורק, עצירה מוחלטת של הדימום על ידי הפעלת לחץ במשך >5 דקות מוצע למנוע המטומה. בנוסף, בעת הפעלת לחץ, קירור אתר ניקוב באמצעות קוביית קרח הוא גם יעיל. ניתן לטפל בהמטומות באמצעות הפרין (למשל, Tensolvet 5.000 I.E. gel). רוב ההמטומות נעלמות לאחר 3-4 ימים רצופים של טיפול עם הפרין ו 0.05 מ"ל של meloxicam (0.5 מ"ג / מ"ל, p.o). העורק פועל לרוחב אל הווריד באזור הפרוקסימלי של הירך. באזור הדיסטלי, הווריד והעורק נראו קרובים יותר זה לזה וחפפו במידה רבה יותר, כאשר העורק ממוקם בגחון לווריד. בהתבסס על קשר מיקום זה, דגימת דם מהאזור הפרוקסימלי של הירך ככל הנראה יש סיכון מופחת לפגיעה עורקית.
בנוסף, וריד הירך באזור הפרוקסימלי עבה וממוקם באופן שטחי, המאפשר מיקום קל באמצעות מחט. עם זאת, לדגימת דם מהאזור הדיסטלי יש יתרון בכך שהיא משאירה את האתרים הפרוקסימליים שלמים, ומאפשרת ניקור חוזר מיידי מהאזור הפרוקסימלי של אותה רגל, גם אם הווריד נפגע במהלך דגימת הדם. הסיבה לכך היא שהאזור הדיסטלי של האתר הפגוע בדרך כלל אינו זמין לניקור מיידי. עם זאת, כאשר איסוף הדם אינו מוצלח, דגימה חוזרת יכולה להתבצע מהאתר הפרוקסימלי ברגל השנייה.
נפח הדם במחזור במרמוסטים הוא ~ 25 מ"ל (70 מ"ל / ק"ג)23. מרמוסט של 350 גרם דורש שבוע אחד כדי להתאושש מדגימת דם של 2 מ"ל, שווה ערך ל -7.5% מנפח הדם הכולל6. מן ורידים הירך, 500-700 μL של דם ניתן לאסוף ללא קושי. כאשר יש צורך בדגימה חוזרת, מומלץ לאסוף כמויות קטנות יותר של דם ולהשתמש בחיץ דילול עבור המנתח האוטומטי.
למרות שהרדמה אינה משמשת בדרך כלל לדגימת דם, למתחילים, דגימת דם מבעלי חיים מורדמים עשויה להיות קלה בהרבה מאשר מבעלי חיים ערים. עם זאת, נדרשת זהירות בעת שימוש בהרדמה לדגימת דם מכיוון שהרדמה יכולה להשפיע על הערכים הנמדדים של מרכיבי הדם. ביחס למדידות הורמונליות לקביעת השלב במחזור השחלות, דווח כי אלפקס הביא לרמות גבוהות באופן בלתי צפוי של P424. זה נגרם על ידי תגובתיות צולבת של נוגדן אנטי P4 ל alfaxalone, שהוא נגזרת P4.
מבנים של P4 ו-E2 (הורמונים סטרואידים) זהים בין בני אדם למרמוסטים. ערכות ELISA מסחריות עבור P4 ו- E2 אנושיות זמינות, אם כן, עבור מרמוסט P4 ו- E2. שירותי מיקור חוץ למדידת הורמוני דם אנושיים זמינים גם כן. לעומת זאת, ישנם הבדלים קלים ברצפי חומצות אמינו עבור הורמונים פוליפפטידיים, כגון FSH, CG ואינהימין. עבור הורמונים פוליפפטידים אלה, אם ערכה יכולה לשמש הן עבור בני אדם והן עבור מינים אבולוציוניים מרוחקים אחרים, כגון עכברים, היא תעבוד גם עבור מרמוסטים. למדידת אינהיבין B, ניתן להשתמש בערכת אימונואסאי אנזים אדם/עכבר/חולדה אינהיבין B (תת-יחידה בטא B).
עלייה ברמת P4 היא סימן היכר של ביוץ (מעבר משלב הזקיקים לשלב הלוטאלי). למרות ששינויים בין אנשים מקשים על איתור תאריך הביוץ מרמת P4 בלבד, רמת P4 של >8 ng/mL יכולה לשמש כאינדיקטור גס להתרחשות הביוץ. אינדיקטור אמין יותר לתאריך הביוץ הוא ירידה ברמת E2 3,17. ביציות/זיגוטות ביוץ אכן נצפו בביציות ביום ירידת E2 (טבלה 4). לפיכך, המדידה של E2 מאפשרת לנו לאתר את תאריך הביוץ המדויק. מלבד הרמות ההורמונליות, מידע על מספר הימים לאחר מתן PGF2α מנבא את יום הביוץ (טבלה 4). באופן דומה, שימוש קומבינטורי ברמות P4 ו-E2 מסייע לזהות את עיתוי המעבר לשלב הזקיקים, כאשר רמות P4 יורדות באופן דרמטי ורמות E2 הן הנמוכות ביותר.
במרמוסטים, CG, במקום LH, משתחרר מבלוטת יותרת המוח כדי לגרום לביוץ. בנוסף, CG מופרש מתאי טרופובלסטים כאשר עוברים נצמדים ומושתלים ברירית הרחם. מכיוון שלמרמוסטים חסר גן LH פונקציונלי, CG, במקום LH, משתחרר מבלוטת יותרת המוח כדי לעורר ביוץ5. מחקר דיווח כי שיאי E2 ו- CG, המעידים על ביוץ, נצפים באותו יום12. מחקר אחר דיווח כי בממוצע, פסגות E2 (8.6 ימים לאחר מתן PGF2α) קודמות לשיאי CG (9.3 ימים לאחר מתן PGF2α)25, מה שמצביע על כך שהביוץ עשוי להתרחש לפני ההגעה לפסגות CG. CG, בניגוד ל-E2, משתחרר בפולסים ממש לפני השיא. שחרור הדופק של CG מתחיל, בממוצע, ~ יום אחד לפני השיא שלו. אולם נצפתה שונות גדולה במשך הזמן מהגילוי הראשון של רמת ה-CG ועד לירידה ברמת E2 (איור 3A וטבלה 4). בנוסף, CG מדווח כי זוהה לראשונה הן בדגימות בוקר והן אחר הצהריים25.
למיטב ידיעתנו, אין דיווח על ביוץ במרמוסטים המתרחש בשעה מסוימת ביום. בנוסף, מרמוסטים בדרך כלל משחררים שתיים או שלוש ביציות בבת אחת, כך שעשויה להיות תקופה מסוימת שבה כל הביציות משתחררות. מכיוון שרמות CG מוגברות מתרחשות לפני הביוץ, מדידת CG מאפשרת לחזות מראש את תאריך הביוץ. מידע זה שימושי במיוחד עבור איסוף של ביציות MII או יום 0 עוברים ביום הביוץ. לפיכך, מדידה קומבינטורית של רמות P4/E2 בדם ורמות CG היא שימושית (איור 3B). ברוב מיני הפרימטים, כולל בני אדם, הביוץ אינו מתרחש זמן מה לאחר הלידה. עם זאת, ביוץ לאחר לידה מתרחש במרמוסטים ~ 10 ימים לאחר הלידה. כתוצאה מכך, המשלוח הבא נצפה לעתים קרובות ~ 155 ימים לאחר המסירה הקודמת. הריון רציף זה, יחד עם לידת תאומים, גורם לרמה גבוהה של פוריות במרמוסטים.
תנודות הורמונליות משתנות בין אנשים, ולחלקן אין מחזור קבוע. חלק מהמרמוסטים הנשיים מראים רמות P4/E2 נמוכות קבועות, מה שמעיד על חוסר ביוץ. היעדר מחזור ביוץ ניתן לייחס חוסר בגרות, בעיות בריאות, מתח, או עיכוב ביוץ על ידי נקבות רבייה דומיננטיות26,27. שלושה מתוך 21 המרמוסטים (בני > 2) שמדדו רמות הורמונליות הראו היעדר מחזור ביוץ סדיר במתקן של המחבר. הבנת הגורמים ופיתוח טיפולים מתאימים יאפשרו שימוש יעיל יותר בבעלי חיים בניסויים. נצפו אנשים עם שלב לוטאלי ממושך של ~1 חודש ורמת P4 גבוהה קשורה2. במתקן של המחבר, שלב לוטאלי ממושך חוזר על עצמו באותם אנשים. שניים מתוך 21 המרמוסטים הראו חריגה זו. אחת משתי החיות הייתה חד-ביתית, למעט האפשרות שהחיה הייתה בהריון בשלב הלוטאלי הממושך. השנייה משויכת לזכר עקר ככל הנראה על ידי הקרנות, ולכן לא סביר שהיא הייתה בהריון בשלב הלוטאלי הממושך. אפילו בשלב לוטאלי ממושך, מתן PGF2α מוריד את רמת P4 ומאפס את מחזור השחלות. מדידת הורמוני המין והבנת מצב מחזור הביוץ מסייעת לשימוש יעיל בבעלי חיים בניסויים וברבייה.
דגימת דם מאנשים משמשת לא רק להערכת תאריך הביוץ אלא גם לבדיקות סרולוגיות למטרות אבחון. באופן דומה, מדידת רמות ההורמונים משמשת לא רק להערכת יום הביוץ אלא גם לחקר אינטראקציה חברתית, התפתחות הילד ומחלות. בעתיד, עבור ביצוע marmosets מהונדסים גנטית, פיתוח שחלות ואשכים מתאי iPS צפוי. רמות הורמונליות מתאימות צריכות להיות חשובות להתפתחות תקינה. הפרוטוקול המתואר כאן יהיה שימושי למדידה ובקרה של הורמוני מין להכנת גונדות שמקורן בתאי iPS במרמוסטים.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
ברצוננו להודות לצ'ונשן שן, הירוקו אקוטסו, פומיו סוגיקי, יונה האשימוטו, הינה נריטומי, יוקי סאקאמוטו ומימיקו הוריגום על תמיכתם בביסוס פרוטוקול זה ובטיפול היומיומי במרמוסטים; Takayuki Mineshige להערות על כתב היד; יוקיקו אבה וחברי מעבדת Aiba לשיתוף טכניקות איסוף זיגוטות; CIEA על שיתוף המידע על דיור מרמוסטים וניסויים שהם טיפחו במשך 40 שנה. מחקר זה נתמך על ידי AMED, JST ו-KAKENHI במסגרת המענק מס' JP19gm6310010, JP20gm6310010, JP21gm6310010 ו-JP22gm6310010 (AMED), JPMJPR228B (JST), 20H05764, 20H03177 ו-22K18356 (KAKENHI).
Materials
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
References
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved