Method Article
Prélèvement sanguin et mesure hormonale pour déterminer le stade du cycle ovarien chez les ouistitis
Dans cet article
Résumé
Ce protocole décrit des prélèvements sanguins et urinaires pour mesurer les taux de progestérone/œstradiol et de gonadotrophine chorionique afin de déterminer le stade du cycle ovarien. Les niveaux d’hormones sont utilisés pour prédire et déterminer le moment de l’ovulation et des hormones sont injectées pour réguler le cycle ovarien et la croissance des ovocytes.
Résumé
Les ouistitis communs sont de petits singes du Nouveau Monde. Étant donné que bon nombre de leurs mécanismes biologiques sont similaires à ceux des humains, les ouistitis sont potentiellement utiles pour la recherche médicale et en biologie humaine dans une gamme de domaines, tels que les neurosciences, la médecine régénérative et le développement. Cependant, il y a un manque de littérature décrivant les méthodes pour de nombreuses expériences et procédures de base. Ici, des méthodes détaillées pour déterminer les niveaux d’hormones sexuelles (progestérone, œstradiol et gonadotrophine chorionique) chez les ouistitis sont décrites. La mesure de ces hormones permet de prédire le stade du cycle ovarien, qui est généralement de 26 à 30 jours chez les ouistitis ; Une détermination précise est essentielle pour la récolte des ovocytes/zygotes au bon moment et pour la préparation des femelles hôtes à la génération de ouistitis génétiquement modifiés.
De plus, la mesure des niveaux d’hormones sexuelles est utile pour l’endocrinologie, l’éthologie, le développement précoce et les études de biologie de la reproduction. Ce protocole fournit une description détaillée des méthodes de prélèvement sanguin dans la veine fémorale, de séparation du plasma pour la mesure hormonale, de mesure des taux de gonadotrophine chorionique à l’aide de l’urine et du plasma, de réinitialisation du cycle ovarien à l’aide d’injections d’un analogue de la prostaglandine F2α pour raccourcir et synchroniser le cycle, et de favoriser la croissance folliculaire et l’ovulation par injection d’hormone folliculo-stimulante et de gonadotrophine chorionique. À l’aide de ces protocoles, les étapes du cycle ovarien peuvent être déterminées pour la collecte rapide des ovocytes/zygotes.
Introduction
Le ouistiti commun (Callithrix jacchus) est un petit singe du Nouveau Monde avec de nombreuses caractéristiques similaires à celles des humains, et la durée de son cycle ovarien est de 26-30 jours 1,2. Les études sur le développement précoce et la génération de ouistitis génétiquement modifiés nécessitent le prélèvement d’ovocytes et de zygotes à des stades spécifiques du cycle ovarien. Ainsi, la détermination précise du stade est cruciale et peut être estimée en mesurant les taux sanguins des hormones progestérone (P4) et œstradiol (E2)2,3. Ces hormones favorisent la croissance de l’endomètre, nécessaire à l’implantation. P4 est produit à partir du corps jaune, qui se forme dans les ovaires immédiatement après l’ovulation. L’E2 est sécrété par les follicules ovariens en réponse à l’hormone folliculo-stimulante (FSH) du complexe hypothalamus-hypophyse dans le cerveau. Les niveaux d’E2 augmentent à mesure que le follicule mûrit, atteignant un pic avant l’ovulation3. Des niveaux élevés d’E2 provoquent la libération pulsée de l’hormone lutéinisante (LH) via le complexe hypothalamus-hypophyse chez l’homme ; cette poussée de LH induit l’ovulation. Cependant, chez les ouistitis, le gène LH a subi une dégénérescence au cours de l’évolution, et l’ovulation est plutôt induite par la libération de gonadotrophine chorionique (CG), qui a une structure similaire à celle de LH, de la glande pituitaire 4,5.
Le cycle ovarien peut être contrôlé par des injections d’hormones. Les injections de FSH, chez l’homme, agissent sur les récepteurs de la FSH ovarienne et sont utilisées pour favoriser la synthèse des œstrogènes et la croissance des follicules6. L’injection de CG humaine (hCG) en substitut de la LH à la fin de la phase folliculaire est utilisée pour stimuler l’ovulation chez l’homme7. Les injections de CG sont également utilisées pour traiter l’infertilité humaine, car la CG stimule le corps jaune au début de la grossesse, ce qui entraîne une augmentation de la production de P4. Les injections de prostaglandine F2α (PGF2α) réinitialisent le cycle ovarien8. Chez les bovins domestiques, l’injection de PGF2α est utilisée pour raccourcir la phase lutéale et synchroniser le cycle de l’œstrus pour la gestion de la reproduction.
Bien que les ouistitis et les humains aient des mécanismes biologiques similaires, ce qui en fait des animaux modèles idéaux, il y a un manque de littérature décrivant les méthodes de base pour de nombreuses techniques souvent utilisées. Le prélèvement sanguin est l’une des techniques les plus souvent utilisées 9,10,11,12. Cependant, les débutants ont parfois du mal à trouver la veine. Par conséquent, cette étude a effectué des analyses anatomiques de la région de la veine fémorale. Basé sur des observations anatomiques, ce protocole présente la région proximale du triangle fémoral comme un site facile pour la ponction veineuse.
Protocole
Toutes les méthodes impliquant des ouistitis utilisaient des normes éthiques et de bien-être élevées et ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux du Centre national pour la santé et le développement de l’enfant. Les animaux utilisés ici étaient logés individuellement ou en couple (une femelle et un mâle) avec 12 h de lumière par jour.
1. Prélèvement sanguin de la veine fémorale
- Préparez une seringue de 1 ml (le type court est facile à utiliser) avec une aiguille de 25 G attachée côté lame vers le haut. Pour éviter l’obstruction du sang, héparinisez la seringue en aspirant 200 μL de solution d’héparine sodique non diluée dans la seringue. Enduisez uniformément l’intérieur de la seringue en la tirant plusieurs fois de haut en bas ; Ensuite, expulsez la solution d’héparine de la seringue.
REMARQUE : Étant donné qu’il est souvent nécessaire de passer à une nouvelle seringue, préparez quelques seringues héparinées supplémentaires. - Préparez des cotons-tiges absorbants et des tampons imbibés d’alcool. Allumez une lampe orientable pour éclairer la zone où le ouistiti sera placé pour le prélèvement sanguin.
- Préparez le dispositif de retenue (420 x 85 x 85 mm, figure 1A), qui est disponible dans le commerce (voir le tableau des matériaux pour plus de détails). Pour placer un ouistiti dans l’appareil, ouvrez la partie de rétention avec la ceinture éponge, qui sécurise les ouistitis. Insérez le ouistiti dans le dispositif de retenue vers le haut.
REMARQUE : Les ouistitis sont généralement calmes dans les dispositifs de retenue, ce qui peut annuler la nécessité de s’acclimater ou de s’entraîner à la contention. - Capturer le ouistiti ; insérer le ouistiti dans la partie cylindrique ; et fixez-le en appuyant sur la ceinture éponge. Placez la jambe à partir de laquelle le sang doit être prélevé sur l’autre (Figure 1A). Tenez les jambes à l’aide de la main non dominante ; Placez le majeur et l’annulaire à l’intérieur de chaque jambe pour les attacher et les autres doigts à l’extérieur de chaque jambe pour les fixer.
REMARQUE : Il est recommandé d’utiliser des gants anti-morsure pour capturer des ouistitis. S’il n’y a pas de dispositif de contention, effectuez un prélèvement sanguin sous anesthésie ou avec une autre personne qui retient le ouistiti. - Vérifiez si la veine fémorale est visible près de la base de la cuisse. Si ce n’est pas le cas, palper pour trouver l’artère pulsée et l’utiliser comme point de repère pour vérifier que la veine passe à l’intérieur de celle-ci (Figure 1B-D).
REMARQUE : L’éclairage du bureau et le rasage des cheveux sont recommandés pour améliorer la visibilité. La visibilité peut également être améliorée en frottant avec des tampons imbibés d’alcool. Les ganglions lymphatiques du triangle sont souvent situés près de la veine et présentent une couleur bleu foncé comme une veine. La façon de les distinguer est décrite dans la section Résultats représentatifs. - Désinfectez le site de ponction à l’aide d’un tampon imbibé d’alcool. Insérez l’aiguille côté lame vers le haut à un angle de 15°-20°. Pour éviter que l’aiguille ne glisse hors du vaisseau sanguin lors du prélèvement sanguin, stabilisez la main qui tient la seringue, par exemple en la reposant sur l’autre main.
- Tirez doucement le piston vers l’arrière pour appliquer une pression négative (Figure 1E). Poussez la pointe de l’aiguille vers l’avant. Une fois que le sang pénètre dans la seringue, maintenez la position de l’extrémité de l’aiguille jusqu’à ce que le volume requis (500-700 μL) ait été prélevé.
- Lorsque le sang ne pénètre pas dans la seringue, changez le site de ponction. Si le sang s’écoule lorsque vous retirez l’aiguille, arrêtez le saignement en appliquant une pression sur le site de ponction pendant 3 minutes. Après avoir arrêté le saignement, redémarrez la ponction veineuse.
- Si le sang aspiré dans la seringue cesse de circuler pendant le processus de prélèvement, poussez lentement la pointe de l’aiguille vers l’avant, puis tirez-la vers l’arrière pour trouver le vaisseau sanguin. Cela peut rétablir le flux sanguin dans la seringue. Si ce n’est pas le cas, retirez l’aiguille et effectuez la ponction veineuse à l’aide d’une nouvelle seringue.
REMARQUE : Utilisez la cuisse de l’autre jambe lorsqu’il est difficile de prélever du sang du même côté.
- Retirez délicatement l’aiguille tout en appuyant légèrement sur le site de ponction à l’aide de l’auriculaire. Ensuite, à l’aide d’un coton-tige absorbant, appliquez immédiatement une pression sur le site de ponction pendant 3 minutes pour arrêter le saignement. Retournez la seringue pour mélanger le sang et l’héparine.
REMARQUE : Appliquez une pression pendant une période plus longue (5 min) tout en refroidissant lorsque le sang artériel est prélevé, et confirmez soigneusement la fin du saignement pour prévenir la formation d’un hématome, qui peut parfois entraîner une issue fatale. - Après avoir confirmé que le saignement a cessé, retirez la ceinture d’éponge, tenez la taille de l’animal d’une main et faites pivoter l’animal de manière à ce que l’on puisse tenir l’aisselle de l’animal avec une autre main de l’arrière.
- Remettez le ouistiti dans sa cage. Pour réduire le stress et faciliter les prélèvements sanguins répétés, fournissez au ouistiti sa nourriture préférée (par exemple, des biscuits, des guimauves ou une génoise). Vérifiez l’apparition d’un hématome de temps en temps.
REMARQUE : Lorsque l’hématome est détecté à un stade précoce, appliquez un bandage compressif pour prévenir la progression de l’hématome. Lorsqu’il est détecté après une longue période, l’ablation chirurgicale de l’hématome avec ligature de l’artère fémorale et transfusion sanguine peut être nécessaire 9,13. - Détachez l’aiguille de la seringue pour éviter l’hémolyse. Ensuite, expulsez lentement le sang recueilli le long de la paroi intérieure d’un microtube de 1,5 ml.
REMARQUE : Le sang collecté peut être stocké à 4 oC jusqu’à 24 h avant la séparation du plasma pour mesurer les niveaux de P4/E2.
2. Séparation du plasma et détermination des taux hormonaux
- Centrifuger le sang dans un tube de 1,5 mL à 1 100 × g pendant 5 min à 4 °C.
- Transférez le plasma séparé (surnageant) du tube de 1,5 mL dans un nouveau tube/gobelet, en évitant soigneusement l’inclusion de cellules sanguines (sédiments).
- Mesurez les niveaux P4 et E2 à l’aide d’un kit ELISA ou d’un analyseur automatique. Si la quantité de plasma n’est pas suffisante pour l’analyseur automatique, utilisez une solution de dilution de l’échantillon.
REMARQUE : Pour la mesure à l’aide d’un analyseur automatique, >175 μL de plasma sont nécessaires pour déterminer uniquement un niveau P4, et >250 μL de plasma sont nécessaires pour déterminer à la fois P4 et E2.
3. Mesure de la CG urinaire pour détecter l’ovulation et la grossesse
REMARQUE : Les niveaux de CG chez les ouistitis peuvent être mesurés à l’aide d’un test immunochromatographique pour l’ovulation et la grossesse. Dans le cas de l’ovulation, un résultat positif peut être obtenu 0 à 2 jours avant l’ovulation. Dans le cas d’une grossesse, un résultat positif est détecté entre les jours 15 et 20 jusqu’au 100e jour environ de la grossesse. Le test nécessite une petite quantité (90 μL) d’urine (une goutte d’urine équivaut à ~30 μL).
- Méthode du plateau : Si plus de deux animaux se trouvent dans la même cage, déplacez le ouistiti cible (ou les autres animaux) dans une autre cage la veille. Placez un plateau propre au fond de la cage la veille ou avant l’allumage. L’urine n’est pas évacuée de la vessie pendant la nuit. Par conséquent, l’urine est généralement libérée de la vessie peu de temps après l’allumage.
REMARQUE : Entrer dans la pièce le matin avant l’éclairage peut perturber le cycle de sommeil de la cohorte. L’urine peut généralement être recueillie dans les 30 minutes environ suivant l’allumage. - Méthode de pressage : Préparez les plateaux lavés pour la collecte de l’urine. Après avoir localisé la vessie du ouistiti, pressez-la soigneusement de l’avant et des deux côtés sur toute la longueur des doigts (figure 1F). Prélevez l’urine juste avant d’éclairer la pièce le matin.
REMARQUE : Si le prélèvement d’urine échoue en raison de l’absence d’urine dans la vessie, attendez un moment et réessayez. Attention à ne pas utiliser une force excessive car cela blesserait l’animal. - Immédiatement après le prélèvement, placez l’échantillon d’urine dans le puits du kit de test immunochromatographique. Lisez le résultat après 10 minutes selon les instructions du fabricant.
4. Contrôle et détermination du stade du cycle ovarien pour la collecte d’ovocytes, de zygotes et d’embryons
- Prélèvement d’ovocytes de la vésicule germinale (GV) dans les ovaires
- Administrer une injection intramusculaire de 3 μL de cloprosténol à 0,263 mg/mL (un analogue synthétique du PGF2α) dilué dans 150 μL de solution saline14 (figure 2) pour réinitialiser le cycle ovarien à la fin de la phase lutéale (c’est-à-dire ≥10 jours après le début de la phase lutéale).
REMARQUE : Préparer la solution diluée dans un plus grand volume peut être pratique car le cloprosténol dilué reste stable pendant au moins plusieurs semaines à +4 °C. - Le lendemain (jour 1), confirmez l’initiation de la phase folliculaire en vérifiant que le taux de P4 a chuté.
REMARQUE : Il a été rapporté que l’injection de cloprosténol diminue considérablement les niveaux de P4 (généralement <10 ng/mL) en 24 h3. - À partir du jour 1, injectez de la FSH (25 UI, par voie intramusculaire) une fois tous les 2 jours pour un total de 5x (jours 1, 3, 5, 7 et 9). Le 10e jour, injecter de l’hCG (75 UI, par voie intramusculaire) dans l’après-midi.
- Prélever les GV des ovaires le 11e jour par aspiration folliculaire sous anesthésie selon la littérature15,16.
REMARQUE : Parfois, l’ovulation se produit plus tôt que prévu. Ainsi, il est recommandé de vérifier les niveaux de CG à partir du jour 8. Si le test CG est positif, effectuez le prélèvement GV ce jour-là.
- Administrer une injection intramusculaire de 3 μL de cloprosténol à 0,263 mg/mL (un analogue synthétique du PGF2α) dilué dans 150 μL de solution saline14 (figure 2) pour réinitialiser le cycle ovarien à la fin de la phase lutéale (c’est-à-dire ≥10 jours après le début de la phase lutéale).
- Collecte d’ovocytes, de zygotes et d’embryons précoces en métaphase II (MII)
- Réinitialisez le cycle ovarien à l’aide de cloprosténol comme décrit à l’étape 4.1.1.
- Le lendemain (jour 1), confirmez l’initiation de la phase folliculaire en vérifiant que le taux de P4 a chuté.
- Pour la collecte de zygotes et d’embryons, hébergez des ouistitis femelles avec des ouistitis mâles pour l’accouplement à partir du 6e jour.
- À partir du jour 7, vérifiez les taux sanguins de P4/E2 et les niveaux de CG urinaire des femelles. La détection de la CG est une indication de l’ovulation en quelques jours (généralement le lendemain). Le jour où les niveaux de P4 augmentent et les niveaux d’E2 diminuent par rapport à la veille, prélever les ovocytes MII ou les zygotes embryonnaires du jour 0 (E0) des oviductes17,18.
- Pour le prélèvement d’embryons, tel que décrit dans la littérature, effectuer le rinçage soit des oviductes (E1-E3, 1-8 cellules)17,18, soit de l’utérus (E5-E10, 8 cellules-blastocyste)19,20,21,22 au moment approprié, en fonction du stade ciblé.
Résultats
Le tableau 1 donne des précisions sur les animaux utilisés dans cette étude.
Analyses anatomiques de la veine fémorale
Des analyses anatomiques de la veine fémorale ont été effectuées à l’aide d’un ouistiti commun mâle de 2 ans (I 7713M) euthanasié. Les veines et les artères fémorales sont situées dans le triangle fémoral. Le triangle fémoral se forme à la limite entre la paroi abdominale et les muscles de la cuisse (Figure 1B-D). À la base de la cuisse, une grosse veine traverse le centre du triangle inversé et une artère est parallèle à l’extérieur de la veine. Dans la région inférieure, les veines et les artères s’amincissent et se chevauchent, les artères étant positionnées au-dessus des veines (Figure 1D).
Pour le prélèvement sanguin, la veine doit être ciblée car une lésion artérielle peut provoquer un hématome de l’artère fémorale, ce qui peut entraîner un choc cardiovasculaire lorsque l’hémorragie est sévère13. Bien que le sang puisse être prélevé dans n’importe quelle partie de la veine du triangle et de sa région distale, la ponction veineuse du site proximal du triangle fémoral est recommandée en raison de la grande taille de la veine et de son chevauchement apparemment faible avec l’artère. De plus, la veine du site proximal est superficielle, ce qui permet de la localiser facilement à l’aide d’une aiguille. Parce qu’elle pulse, l’artère du triangle fémoral est parfois identifiée visuellement ou par palpation, et la veine s’étend juste médialement à celle-ci. Ainsi, l’observation de la pulsation artérielle permet de prédire l’emplacement de la veine.
De plus, une coloration bleue indicatrice de la veine est généralement observée sous la peau au sommet du triangle (Figure 1B,C). Cependant, les ganglions lymphatiques du triangle sont souvent situés près de la veine et présentent une couleur bleu foncé, de sorte que leur apparence est similaire. Heureusement, ils se distinguent par leur mobilité : la veine est stationnaire et les ganglions lymphatiques sont mobiles. Ainsi, la pulsation de l’artère et la couleur bleue de la veine sont deux indices majeurs utilisés pour localiser la veine, bien qu’il puisse être nécessaire de raser les cheveux pour les visualiser.
Détermination du stade du cycle ovarien
Les niveaux de P4 et d’E2 ont été surveillés chez six ouistitis femelles (âgées de 1 à 3 ans) afin d’étudier la durée des phases folliculaire et lutéale. Les résultats ont montré une durée moyenne de 11,58 jours (n = 6 pour quatre ouistitis) et de 16,8 jours (n = 5 pour trois ouistitis) pour les phases folliculaire et lutéale, respectivement (tableau 2). Dans ce qui suit, la dynamique P4 et E2 d’un (I6751F, 3 ans) des six ouistitis est décrite en détail. Des prélèvements sanguins et des mesures hormonales ont été effectués chez cet animal à quelques jours d’intervalle pendant 38 jours (tableau 3).
Phase lutéale (jours 1 à 10)
Le jour de début de la mesure a été fixé au jour 1. D’après le taux de P4 (21 ng/mL), l’animal était probablement en phase lutéale. Un taux élevé de P4 a été observé du 1er au 10e jour (≥21 ng/mL), suggérant la phase lutéale. Le 12e jour, il a chuté brusquement à 4 ng/mL. Cette diminution significative indiquait le passage de la phase lutéale à la phase folliculaire. Une diminution du taux d’E2 entre le jour 10 (241 ng/mL) et le jour 12 (189 ng/mL) a également soutenu cette transition.
Phase folliculaire (jours 12 à 22)
Après la transition vers la phase folliculaire, le taux de P4 est resté faible (4-6 ng/mL) jusqu’au 19e jour, puis a légèrement augmenté du 19e au 24e jour (19e jour, 6 ng/mL ; 22e jour, 8 ng/mL ; 24e jour, 9 ng/mL). En revanche, le taux d’E2 a augmenté de manière significative du jour 19 (94 ng/mL) à 22 (322 ng/mL), puis a diminué du jour 22 au jour 24 (158 ng/mL). Sur la base de l’augmentation des niveaux de P4 et de la diminution des niveaux d’E2, l’ovulation a été prédite entre les jours 22 et 24, passant de la phase folliculaire à la phase lutéale.
Phase lutéale (jours 24-36)
Après l’ovulation, le taux de P4 est resté élevé jusqu’au 36e jour, puis a chuté à 3 ng/mL le 38e jour. Ainsi, il est probable que la transition de la phase lutéale à la phase folliculaire se soit produite entre les jours 36 et 38. Conformément à cette transition, le taux d’E2 a diminué au cours de cette période (jour 36, 2517 ng/mL ; jour 38, 73 ng/mL).
Prédiction et détermination du moment de l’ovulation
Pour examiner la relation entre le taux de CG dans l’urine et la date d’ovulation, sept ouistitis (n° 1 à 7) ont été préparés. Du cloprosténol a été injecté pour réinitialiser le cycle ovulatoire (jour 0). Ensuite, une surveillance des taux sanguins de P4/E2 et des taux de CG urinaires a été effectuée à partir du jour 7. L’urine a été recueillie immédiatement après l’allumage. Les prélèvements sanguins ont été effectués essentiellement le matin. On a supposé que l’ovulation se produisait lorsque le niveau d’E2 avait été largement abaissé par rapport à celui de la veille, comme indiqué17. Ce jour-là, la rupture folliculaire a en effet été observée à la surface des ovaires, et la présence de zygotes/ovocytes dans les oviductes (Tableau 4).
La CG a été détectée pour la première fois au cours des jours 7 à 11 (jour 7, N = 1 ; jour 8, N = 2 ; jour 9, N = 1 ; jour 10, N = 2 ; jour 11, N = 1) (tableau 4). La forte baisse des niveaux d’E2 (indication de l’ovulation) a été observée 0 à 3 jours après le premier signal CG. La durée entre la première détection de CG et la diminution de E2 semblait être importante lorsque la première détection de CG était plus précoce (Figure 3A). Par exemple, un animal (n° 1) a montré une baisse du signal E2 3 jours après la première détection de CG le jour 7 (tableau 4). En revanche, la cooccurrence de la première détection de CG et de la chute du signal E2 a été observée chez un animal (n° 2) le jour 10. Ainsi, bien que la première détection de CG et l’ovulation aient été observées le même jour chez l’un des cinq animaux, l’ovulation s’est produite quelques jours après la première détection de CG.
Le kit de test immunochromatographique pour le ouistiti CG est conçu pour utiliser l’urine pour les tests. L’examen du taux de CG accompagne généralement la détermination des niveaux de P4/E2 à l’aide du plasma sanguin. Il sera utile que le plasma sanguin, au lieu de l’urine, puisse être utilisé pour le test CG. Pour tester cela, le plasma sanguin qui a été laissé après la mesure du niveau P4/E2 dans les expériences ci-dessus a été examiné. Le plasma sanguin et l’urine des quatre animaux ont été prélevés l’un ou l’autre des jours des expériences ci-dessus (les jours d’examen étaient indiqués par des astérisques doubles [**] dans le tableau 4). En utilisant l’urine, deux des quatre animaux ont montré des résultats positifs (scores 5 et 3), et les deux autres ont montré des résultats négatifs (score 1). Le plasma sanguin a montré essentiellement les mêmes résultats que l’urine (figure 3B). Le signal le plus fort a été obtenu en utilisant du plasma sanguin. Par conséquent, lors de l’utilisation de plasma sanguin, le jugement doit être fait avant 10 minutes, qui sont définies pour l’urine.
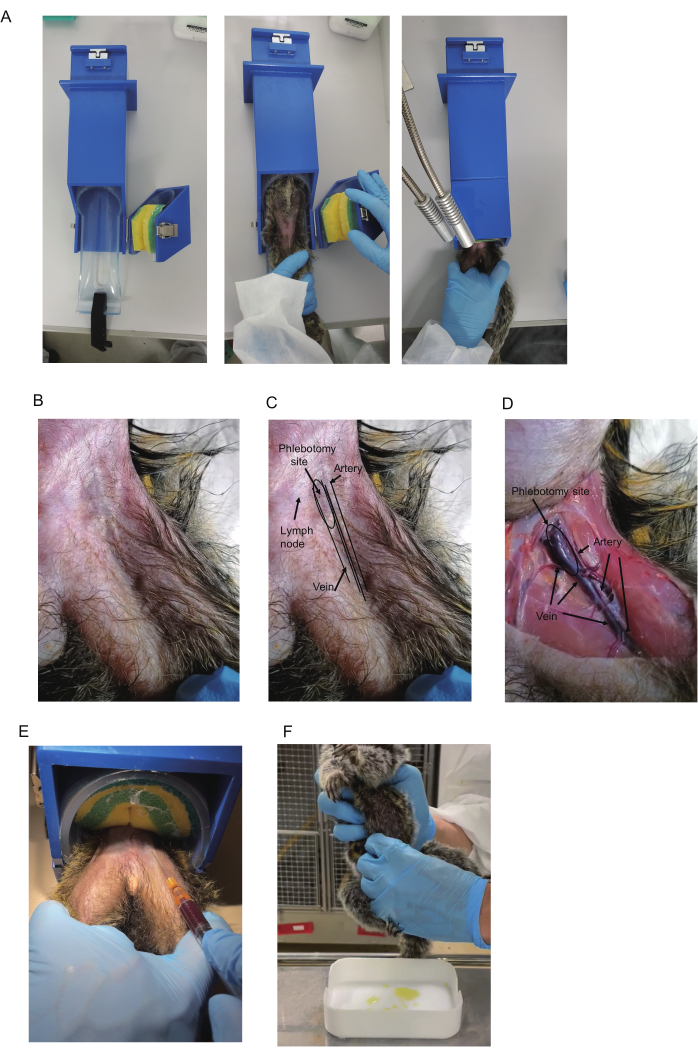
Figure 1 : Prélèvement de sang sur des ouistitis. (A) Un dispositif de contention est utilisé pour le prélèvement de sang. (B) Haut de la cuisse du ouistiti. (C) Triangle fémoral et vaisseaux sanguins. L’artère fémorale dans le triangle est souvent visible et présente des pulsations. La couleur bleue de la veine fémorale est parfois visible dans la zone proximale du triangle (indiquée comme le site de phlébotomie). Les ganglions lymphatiques présentent également une couleur bleue. Cependant, les ganglions lymphatiques sont mobiles car les ganglions lymphatiques sont attachés à la peau. (D) Vue anatomique de la cuisse de l’animal euthanasié. L’artère, la veine et le site de la phlébotomie sont indiqués. Le même animal est représenté en B-D. (E) Prélèvement sanguin à l’aide d’un dispositif de contention. La position de maintien des pattes du ouistiti et le sang prélevé sont montrés. (F) Prélèvement d’urine sur un ouistiti. Veuillez cliquer ici pour voir une version agrandie de cette figure.
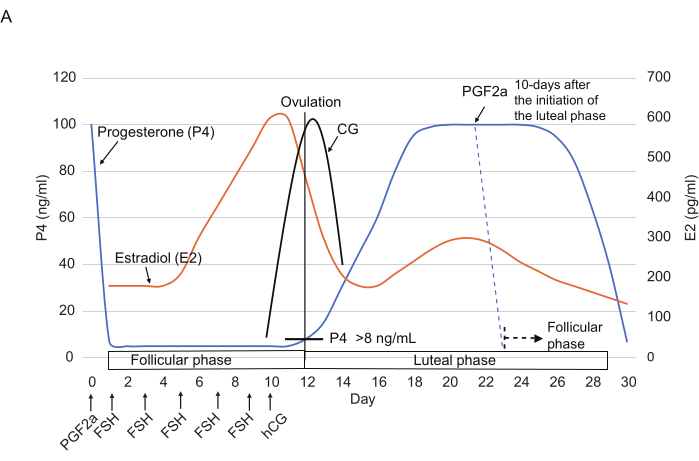
Figure 2 : Profils typiques des niveaux de P4, E2 et CG au cours du cycle ovarien chez les ouistitis. Les points temporels des injections de FSH, hCG et PGF2α sont indiqués. Les lignes pointillées indiquent le schéma hormonal attendu après l’injection de PGF2α. Abréviations : P4 = progestérone ; E2 = œstradiol ; CG = gonadotrophine chorionique ; FSH = hormone folliculo-stimulante ; hCG = gonadotrophine chorionique humaine ; PGF2α = prostaglandine F2α. Veuillez cliquer ici pour voir une version agrandie de cette figure.
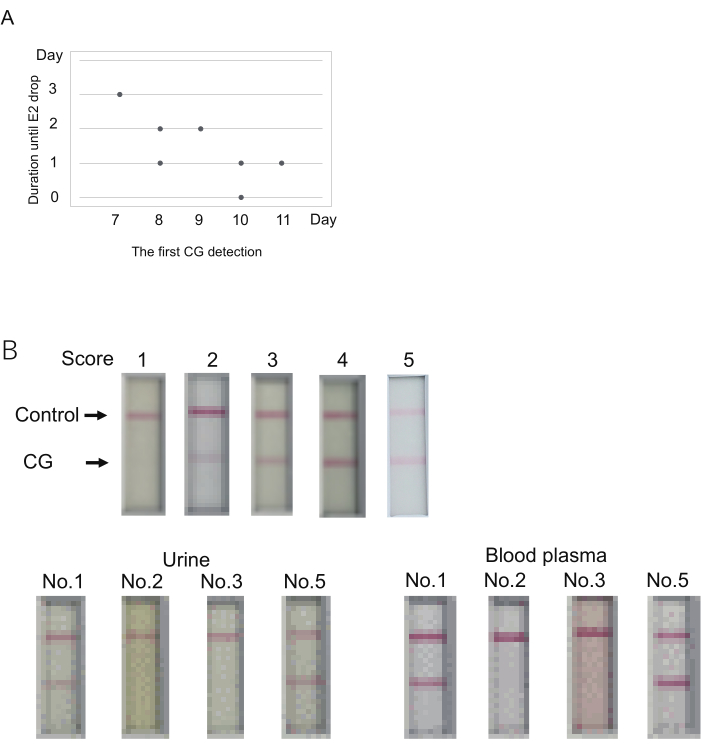
Figure 3 : Détermination du taux de CG pour prédire l’apparition de l’ovulation. (A) La relation possible entre le premier jour de détection de la CG (score > 1) et la durée jusqu’à l’ovulation (chute E2). (B) Le plasma sanguin peut être utilisé pour les tests immunochromatographiques CG. Un résultat représentatif de chaque score (en haut). Le score a été déterminé 10 minutes après le chargement de l’échantillon. Le score 2 représente l’absence de groupe dans les 5 minutes mais l’apparition d’un groupe dans les 10 minutes. Le prélèvement sanguin a été effectué peu de temps après le prélèvement d’urine. Quatre ouistitis (n° 1, 2, 3, 5 dans le tableau S4) ont été examinés. Les échantillons utilisés ici sont indiqués par des astérisques doubles dans le tableau 4. Le plasma sanguin a été dilué à 50 % par un tampon de dilution utilisé pour la mesure de l’E2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Animaux utilisés dans cette étude. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Durée des phases folliculaire et lutéale. La phase a été déterminée sur la base du taux de P4 (phase folliculaire P4 ≤ 8, phase lutéale P4 > 8). Lorsqu’un changement de phase a été observé entre les mesures, le point médian entre les dates de mesure a été déterminé comme étant le point de changement. La durée entre les deux points de changement a été considérée comme des phases folliculaires ou lutéales. Pour assurer la mesure de la durée d’une seule phase, les données avec un intervalle long (≥7 jours) ou deux de ≥6 jours d’intervalle dans la même phase, y compris lorsqu’elles couvrent les deux phases, n’ont pas été utilisées pour les analyses. Ce n’est que lorsque deux mesures ont été effectuées dans la même phase que les données ont été utilisées. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Résultats des mesures de P4 et d’E2 pendant 38 jours chez un ouistiti.Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Détermination et prédiction des jours ovulatoires. Les traces d’ovulation étaient considérées comme présentes si des sites de saignement ou de rupture étaient observés dans les ovaires. L’ovocyte/zygote indique les stades de l’ovocyte/zygote obtenus à partir des oviductes le jour de la chute de E2. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
La localisation de la veine est l’étape la plus critique dans la collecte de sang. Basé sur des observations anatomiques, ce protocole présente la zone proximale dans le triangle fémoral comme un site facile pour la collecte de sang chez les ouistitis. En utilisant cette zone, le prélèvement sanguin d’une grosse veine peut être facilement effectué. Cependant, même en utilisant ce protocole, des lésions à une artère se produisent parfois. Lors d’une blessure à une artère, il est suggéré d’arrêter complètement le saignement en appliquant une pression pendant >5 minutes pour prévenir l’hématome. De plus, lors de l’application d’une pression, le refroidissement du site ponctué à l’aide d’un glaçon est également efficace. Les hématomes peuvent être traités avec de l’héparine (par exemple, le gel Tensolvet 5.000 I.E.). La plupart des hématomes disparaissent après 3 à 4 jours consécutifs de traitement à l’héparine et à 0,05 mL de méloxicam (0,5 mg/mL, p.o.). L’artère s’étend latéralement à la veine dans la zone proximale de la cuisse. Dans la région distale, la veine et l’artère semblaient plus proches l’une de l’autre et se chevauchaient dans une plus grande mesure, l’artère étant située ventrale à la veine. Sur la base de cette relation positionnelle, le prélèvement sanguin dans la région proximale de la cuisse présente probablement une diminution du risque de lésion artérielle.
De plus, la veine fémorale dans la région proximale est épaisse et située superficiellement, ce qui permet une localisation facile à l’aide d’une aiguille. Cependant, le prélèvement sanguin dans la région distale a l’avantage de laisser les sites proximaux intacts, ce qui permet une ponction veineuse répétée immédiate de la région proximale de la même jambe, même si la veine est endommagée lors du prélèvement sanguin. En effet, la zone distale du site endommagé est généralement indisponible pour une ponction veineuse immédiate. Cependant, lorsque le prélèvement sanguin n’aboutit pas, des prélèvements répétés peuvent être effectués à partir du site proximal de l’autre jambe.
Le volume de sang circulant chez les ouistitis est de ~25 mL (70 mL/kg)23. Un ouistiti de 350 g a besoin de 1 semaine pour récupérer d’un échantillon de sang de 2 ml, ce qui équivaut à 7,5 % du volume sanguin total6. Dans les veines fémorales, 500 à 700 μL de sang peuvent être prélevés sans difficulté. Lorsqu’un prélèvement répété est nécessaire, il est recommandé de prélever de petites quantités de sang et d’utiliser un tampon de dilution pour l’analyseur automatique.
Bien que l’anesthésie ne soit généralement pas utilisée pour le prélèvement sanguin, pour les débutants, le prélèvement sanguin sur des animaux anesthésiés peut être beaucoup plus facile que sur des animaux éveillés. Cependant, la prudence est de mise lors de l’utilisation de l’anesthésie pour le prélèvement sanguin, car l’anesthésie peut affecter les valeurs mesurées des composants sanguins. En ce qui concerne les mesures hormonales permettant de déterminer le stade du cycle ovarien, il a été rapporté que l’alfaxalone entraînait des taux étonnamment plus élevés de P424. Cela a été causé par la réactivité croisée de l’anticorps anti-P4 à l’alfaxalone, qui est un dérivé de P4.
Les structures de P4 et E2 (hormones stéroïdes) sont identiques entre les humains et les ouistitis. Des kits ELISA commerciaux pour les ouistites P4 et E2 humains sont donc disponibles pour les ouistitis P4 et E2. Des services d’externalisation pour la mesure des hormones sanguines humaines sont également disponibles. En revanche, il existe de légères différences dans les séquences d’acides aminés pour les hormones polypeptidiques, telles que la FSH, la CG et l’inhibine. Pour ces hormones polypeptidiques, si un kit peut être utilisé à la fois pour les humains et d’autres espèces éloignées de l’évolution, comme les souris, il fonctionnera également pour les ouistitis. Pour la mesure de l’inhibine B, un kit d’immunodosage enzymatique de l’inhibine B humaine/souris/rat (sous-unité bêta B) peut être utilisé.
Une augmentation du taux de P4 est une caractéristique de l’ovulation (transition de la phase folliculaire à la phase lutéale). Bien que les variations entre les individus rendent difficile de déterminer la date de l’ovulation à partir du seul taux de P4, un taux de P4 de >8 ng/mL peut être utilisé comme indicateur approximatif de l’apparition de l’ovulation. Un indicateur plus fiable de la date d’ovulation est une diminution du niveau E2 3,17. Des ovocytes/zygotes ovulés ont en effet été observés dans les oviductes le jour de la diminution de E2 (Tableau 4). Ainsi, la mesure de E2 nous permet de déterminer la date exacte de l’ovulation. Outre les niveaux hormonaux, l’information sur le nombre de jours après l’administration de PGF2α est un prédicteur du jour de l’ovulation (tableau 4). De même, l’utilisation combinatoire des niveaux P4 et E2 permet d’identifier le moment de la transition vers la phase folliculaire, lorsque les niveaux de P4 diminuent considérablement et que les niveaux d’E2 sont à leur plus bas.
Chez les ouistitis, le CG, au lieu de LH, est libéré par l’hypophyse pour induire l’ovulation. De plus, le CG est excrété par les cellules trophoblastiques lorsque les embryons se fixent et s’implantent dans l’endomètre. Parce que les ouistitis n’ont pas de gène LH fonctionnel, le CG, au lieu de LH, est libéré par la glande pituitaire pour stimuler l’ovulation5. Une étude a rapporté que les pics E2 et CG, indiquant l’ovulation, sont observés le même jour12. Une autre étude a rapporté qu’en moyenne, les pics E2 (8,6 jours après l’administration de PGF2α) précèdent les pics de CG (9,3 jours après l’administration de PGF2α)25, indiquant que l’ovulation peut se produire avant d’atteindre les pics de CG. CG, contrairement à E2, est émis par impulsion juste avant son pic. La libération d’impulsions de CG commence, en moyenne, ~1 jour avant son pic. Cependant, une grande variation de durée entre la première détection du niveau de CG et la baisse du niveau E2 a été observée (figure 3A et tableau 4). De plus, la CG aurait été détectée pour la première fois dans les échantillons du matin et de l’après-midi25.
À notre connaissance, il n’y a pas de rapport d’ovulation chez les ouistitis survenant à un moment particulier de la journée. De plus, les ouistitis libèrent généralement deux ou trois ovocytes à la fois, de sorte qu’il peut y avoir une certaine période pendant laquelle tous les ovocytes sont libérés. Étant donné que l’augmentation des niveaux de CG se produit avant l’ovulation, la mesure de CG permet de prédire la date de l’ovulation à l’avance. Ces informations sont particulièrement utiles pour le prélèvement d’ovocytes MII ou d’embryons du jour 0 le jour de l’ovulation. Ainsi, une mesure combinatoire des taux sanguins de P4/E2 et de CG est utile (Figure 3B). Chez la plupart des espèces de primates, y compris les humains, l’ovulation ne se produit pas pendant un certain temps après l’accouchement. Cependant, l’ovulation post-partum se produit chez les ouistitis ~10 jours après l’accouchement. Par conséquent, la livraison suivante est souvent observée ~155 jours après la livraison précédente. Cette grossesse séquentielle, associée à l’accouchement de jumeaux, entraîne un niveau élevé de fécondité chez les ouistitis.
Les fluctuations hormonales varient d’un individu à l’autre, et certaines n’ont pas un cycle constant. Certaines femelles ouistitis présentent constamment de faibles niveaux de P4/E2, ce qui indique une absence d’ovulation. L’absence de cycle ovulatoire peut être attribuée à l’immaturité, à des problèmes de santé, au stress ou à l’inhibition de l’ovulation par les femelles reproductrices dominantes26,27. Trois des 21 ouistitis (> ans mesurant les niveaux hormonaux) ont montré l’absence d’un cycle ovulatoire régulier dans l’établissement de l’auteur. Comprendre les causes et mettre au point des traitements appropriés permettra une utilisation plus efficace des animaux dans les expériences. Des individus présentant une phase lutéale prolongée de ~1 mois et un taux élevé de P4 associé ont été observés2. Dans l’établissement de l’auteur, une phase lutéale prolongée se répète chez les mêmes individus. Deux des 21 ouistitis présentaient cette anomalie. L’un des deux animaux était logé dans une maison individuelle, ce qui exclut la possibilité que l’animal ait été enceinte pendant la phase lutéale prolongée. L’autre est accouplée à un mâle présumé infertile par radiothérapie, et il est donc peu probable qu’elle soit enceinte pendant la phase lutéale prolongée. Même dans une phase lutéale prolongée, l’administration de PGF2α abaisse le niveau de P4 et réinitialise le cycle ovarien. La mesure des hormones sexuelles et la compréhension de l’état du cycle d’ovulation aident à l’utilisation efficace des animaux dans les expériences et la reproduction.
L’échantillonnage sanguin des individus est utilisé non seulement pour l’estimation de la date d’ovulation, mais aussi pour les tests sérologiques à des fins de diagnostic. De même, la mesure des niveaux d’hormones est utilisée non seulement pour estimer le jour de l’ovulation, mais aussi pour étudier l’interaction sociale, le développement de l’enfant et les maladies. À l’avenir, pour la fabrication de ouistitis génétiquement modifiés, on s’attend à ce que les ovaires et les testicules se développent à partir de cellules iPS. Des niveaux hormonaux appropriés devraient être importants pour un développement normal. Le protocole décrit ici sera utile pour la mesure et le contrôle des hormones sexuelles pour la fabrication de gonades dérivées de cellules iPS chez les ouistitis.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous tenons à remercier Chunshen Shen, Hiroko Akutsu, Fumiyo Sugiki, Yuuna Hashimoto, Hina Naritomi, Yuuki Sakamoto et Mikiko Horigome pour leur soutien dans l’établissement de ce protocole et dans les soins quotidiens des ouistitis ; Takayuki Mineshige pour ses commentaires sur le manuscrit ; Yukiko Abe et les membres du laboratoire Aiba pour avoir partagé les techniques de collecte de zygotes ; CIEA pour le partage d’informations sur l’habitat et les expériences de ouistitis qu’ils ont cultivées pendant 40 ans. Cette recherche a été soutenue par AMED, JST et KAKENHI dans le cadre des subventions n° JP19gm6310010, JP20gm6310010, JP21gm6310010 et JP22gm6310010 (AMED), JPMJPR228B (JST), 20H05764, 20H03177 et 22K18356 (KAKENHI).
matériels
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
Références
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon