Method Article
用于确定狨猴卵巢周期阶段的血液采样和激素测量
摘要
该方案描述了用于测量孕酮/雌二醇和绒毛膜促性腺激素水平以确定卵巢周期阶段的血液和尿液采样。激素水平用于预测和确定排卵的时间,并注射激素以调节卵巢周期和卵母细胞生长。
摘要
普通狨猴是新大陆的小型猴子。由于狨猴的许多生物机制与人类相似,因此它们可能可用于神经科学、再生医学和发育等一系列领域的医学和人类生物学研究。然而,缺乏描述许多基本实验和程序方法的文献。这里描述了测定狨猴性激素(黄体酮、雌二醇和绒毛膜促性腺激素)水平的详细方法。这些激素的测量可以预测卵巢周期的阶段,狨猴通常为 26-30 天;准确测定对于在正确的时间点收获卵母细胞/受精卵以及为生成转基因狨猴准备宿主雌性至关重要。
此外,性激素水平的测量可用于内分泌学、行为学、早期发育和生殖生物学研究。该方案详细描述了从股静脉采血、分离血浆用于激素测量、使用尿液和血浆测量绒毛膜促性腺激素水平、使用注射前列腺素 F2α 类似物重置卵巢周期以缩短和同步周期,以及通过注射促卵泡激素和绒毛膜促性腺激素促进卵泡生长和排卵的方法。使用这些方案,可以确定卵巢周期的阶段,以便及时收集卵母细胞/受精卵。
引言
普通狨猴 (Callithrix jacchus) 是一种小型新大陆猴子,具有许多与人类相似的特征,其卵巢周期的持续时间为 26-30 天 1,2。对转基因狨猴的早期发育和生成的研究需要在卵巢周期的特定阶段收获卵母细胞和受精卵。因此,准确确定分期至关重要,可以通过测量激素黄体酮 (P4) 和雌二醇 (E2) 的血液水平来估计2,3。这些激素促进子宫内膜生长,这是植入所必需的。P4 由黄体产生,黄体在排卵后立即在卵巢中形成。E2 由卵巢卵泡分泌,以响应大脑中下丘脑-垂体复合体的促卵泡激素 (FSH)。E2 水平随着卵泡的成熟而增加,在排卵前达到峰值3。高 E2 水平导致人类通过下丘脑-垂体复合体脉冲释放黄体生成素 (LH);这种 LH 激增会诱导排卵。然而,在狨猴中,LH 基因在进化过程中发生了退化,排卵是由垂体释放绒毛膜促性腺激素 (CG) 诱导的,该蛋白的结构与 LH 相似 4,5。
卵巢周期可以通过激素注射来控制。人类 FSH 注射剂作用于卵巢 FSH 受体,用于促进雌激素合成和卵泡生长6。在卵泡期结束时注射人 CG (hCG) 作为 LH 的替代品,用于刺激人类排卵7。CG 注射也用于治疗人类不育症,因为 CG 会在怀孕早期刺激黄体,导致 P4 产生增加。前列腺素 F2α (PGF2α) 注射可重置卵巢周期8。在家牛中,PGF2α 注射用于缩短黄体期并同步发情周期以进行繁殖管理。
尽管狨猴和人类具有相似的生物机制,使它们成为理想的模式动物,但缺乏描述许多常用技术的基本方法的文献。采血是最常用的技术之一 9,10,11,12。然而,初学者有时很难找到静脉。因此,本研究对股静脉区域进行了解剖分析。根据解剖观察,该方案将股骨三角的近端区域引入静脉穿刺的简单部位。
研究方案
所有涉及狨猴的方法都采用了高道德和福利标准,并得到了国家儿童健康与发展中心的机构动物护理和使用委员会的批准。这里使用的动物是单舍或双舍(一雌一雄),每天光照 12 小时。
1. 股静脉采血
- 准备一个 1 mL 注射器(短型易于使用),刀片面朝上连接 25 G 针头。为避免血液堵塞,将 200 μL 未稀释的肝素钠溶液吸入注射器中,使注射器肝素化。上下拉动数次,均匀涂布注射器内部;然后,从注射器中排出肝素溶液。
注意:由于通常需要更换新的注射器,因此请准备一些额外的肝素化注射器。 - 准备吸水棉签和酒精棉签。打开可调节灯,照亮将放置狨猴进行血液采样的区域。
- 准备市售的约束装置(420 x 85 x 85 毫米, 图 1A)(有关详细信息 ,请参阅材料表 )。要将狨猴放入设备中,请用海绵带打开固定部分,以固定狨猴。将狨猴面朝上插入约束装置中。
注意:狨猴通常在约束装置中很平静,这可能不需要约束、适应或训练。 - 捕捉狨猴;将狨猴插入圆柱形部分;然后按下海绵带将其固定。将要采集血液的腿放在另一条腿上(图 1A)。用非惯用手握住双腿;将中指和无名指放在每条腿内侧以固定它们,将其他手指放在每条腿外侧以固定它们。
注意:捕捉狨猴时,建议使用咬合手套。如果没有约束装置,请在麻醉下或与另一个约束狨猴的人一起进行血液采集。 - 检查大腿根部附近是否可见股静脉。如果没有,请触诊找到搏动的动脉并将其用作标志,以检查静脉是否在其内部运行(图 1B-D)。
注意:建议使用桌面照明和剃须以提高能见度。用酒精棉签摩擦也可以提高能见度。三角形中的淋巴结通常位于静脉附近,并显示为深蓝色的静脉。如何区分它们 在 Representative Results 部分。 - 使用酒精棉签对穿刺部位进行消毒。以 15°-20° 的角度插入针片面朝上。为防止针头在采血过程中从血管中滑出,请稳定握住注射器的手,例如,将注射器放在另一只手上。
- 轻轻拉回柱塞以施加负压(图 1E)。向前推动针尖。血液进入注射器后,保持针尖的位置,直到收集到所需的体积 (500-700 μL)。
- 当血液没有进入注射器时,改变穿刺部位。如果拔针时有血流出,请对穿刺部位施加压力 3 分钟以止血。止血后,重新开始静脉穿刺。
- 如果抽入注射器的血液在抽吸过程中停止流动,请慢慢向前推动针尖,然后将其向后拉以找到血管。这可能会恢复流入注射器的血液。如果没有,请拔出针头并使用新注射器进行静脉穿刺。
注意:当难以从同一侧采集血液时,使用另一条腿的大腿。
- 小心地拔出针头,同时用小指轻轻按压穿刺部位。然后,使用吸水棉签,立即对穿刺部位施加压力 3 分钟以止血。倒置注射器以混合血液和肝素。
注意:抽取动脉血时,在冷却时施加较长时间的压力(5 分钟),并仔细确认出血的头部,以防止形成血肿,血肿有时会导致致命的后果。 - 确认出血已停止后,取下海绵带,用一只手握住动物的腰部,然后旋转动物,以便可以用另一只手从背部握住动物的腋下。
- 将狨猴放回笼子里。为了减轻压力并促进重复采血,请为狨猴提供它最喜欢的食物(例如饼干、棉花糖或海绵蛋糕)。偶尔检查血肿的发生情况。
注意:当早期发现血肿时,请使用压力绷带以防止血肿进展。当长时间后发现时,可能需要手术切除血肿并结扎股动脉并输血 9,13。 - 从注射器上拆下针头以防止溶血。然后,沿着 1.5 mL 微管的内壁缓慢排出收集的血液。
注意:在血浆分离之前,收集的血液可以在 4 °C 下储存长达 24 小时,以测量 P4/E2 水平。
2. 血浆分离和激素水平测定
- 将血液放入 1.5 mL 管中,在 4 °C 下以 1,100 × g 离心 5 分钟。
- 将分离的血浆(上清液)从 1.5 mL 试管转移到新的试管/杯中,小心避免包含血细胞(沉淀物)。
- 使用 ELISA 试剂盒或自动分析仪测量 P4 和 E2 水平。如果血浆量不足以用于自动分析仪,请使用样品稀释溶液。
注:对于使用自动分析仪的测量,仅需要 >175 μL 血浆即可测定 P4 水平,>250 μL 血浆即可测定 P4 和 E2。
3. 尿 CG 测量以检测排卵和怀孕
注意:狨猴的 CG 水平可以使用免疫层析试剂盒测试来测量排卵和怀孕。在排卵的情况下,可以在排卵前 0-2 天获得阳性结果。在怀孕的情况下,从怀孕的第 15-20 天到大约 100 天检测到阳性结果。该测试需要少量 (90 μL) 尿液(一滴尿液为 ~30 μL)。
- 托盘法:如果同一个笼子里有两只以上的动物,请在前一天将目标狨猴(或其他动物)移动到另一个笼子里。在照明前一晚或之前将干净的托盘放在笼子底部。夜间尿液没有从膀胱中排出。因此,尿液通常在点燃后不久从膀胱中排出。
注意:早上在照明前进入房间可能会打乱该群组的睡眠周期。通常可以在点燃后约 30 分钟内收集尿液。 - 挤压方法:准备清洗过的托盘以收集尿液。找到狨猴的膀胱后,用手指的整个长度从正面和两侧小心地挤压它(图 1F)。在早上点亮房间之前收集尿液。
注意:如果由于膀胱中没有尿液而导致尿液收集不成功,请稍等片刻,然后再试一次。小心不要过度用力,因为这会伤害动物。 - 采集后,立即将尿液样品放入免疫层析检测试剂盒的孔中。根据制造商的说明,10 分钟后读取结果。
4. 控制和测定收集卵母细胞、受精卵和胚胎的卵巢周期阶段
- 从卵巢收集生发囊泡 (GV) 卵母细胞
- 肌肉注射 3 μL 0.263 mg/mL 氯前列醇(一种合成的 PGF2α 类似物),稀释在 150 μL 生理盐水14 中(图 2),以重置黄体期结束时的卵巢周期(即黄体期开始后 ≥10 天)。
注:将稀释的溶液制备成更大体积可能很方便,因为稀释的氯前列醇在 +4 °C 下至少可保持稳定数周。 - 第二天(第 1 天),通过检查 P4 水平是否已下降来确认卵泡期的开始。
注意:据报道,氯前列醇注射液可在 24 小时内显着降低 P4 水平(通常为 <10 ng/mL)3。 - 从第 1 天开始,每 2 天注射一次 FSH(25 IU,肌肉注射),总共 5 次(第 1、3、5、7 和 9 天)。第 10 天,下午注射 hCG (75 IU,肌肉注射)。
- 根据文献15,16,在麻醉下通过卵泡抽吸在第 11 天从卵巢中收集 GV。
注意:有时,排卵发生得比预期的要早。因此,建议从第 8 天开始检查 CG 水平。如果 CG 测试呈阳性,请在当天进行 GV 采集。
- 肌肉注射 3 μL 0.263 mg/mL 氯前列醇(一种合成的 PGF2α 类似物),稀释在 150 μL 生理盐水14 中(图 2),以重置黄体期结束时的卵巢周期(即黄体期开始后 ≥10 天)。
- 中期 II (MII) 卵母细胞、受精卵和早期胚胎的收集
- 如步骤 4.1.1 中所述,使用氯前列醇重置卵巢周期。
- 第二天(第 1 天),通过检查 P4 水平是否已下降来确认卵泡期的开始。
- 为了收集受精卵和胚胎,从第 6 天开始将雌性狨猴与雄性狨猴一起饲养进行交配。
- 从第 7 天开始,检查女性的血液 P4/E2 水平和尿液 CG 水平。检测到 CG 是几天内(通常是第二天)排卵的迹象。与 P4 水平相比,P4 水平增加且 E2 水平降低的那一天,从输卵管17,18 中收集 MII 卵母细胞或胚胎第 0 天 (E0) 受精卵。
- 对于胚胎收集,如文献中所述,根据目标阶段,在适当的时间点从输卵管(E1-E3,1-8 个细胞)17,18 或子宫(E5-E10,8 个细胞-囊胚)19,20,21,22 进行冲洗。
结果
表 1 列出了与本研究中使用的动物相关的详细信息。
股静脉的解剖学分析
使用接受安乐死的 2 岁雄性普通狨猴 (I 7713M) 进行股静脉解剖分析。股静脉和动脉位于股骨三角中。股骨三角形形成于腹壁和大腿肌肉之间的边界处(图 1B-D)。在大腿根部,一条大静脉穿过倒三角形的中心,一条动脉在静脉外平行。在下部区域,静脉和动脉变细并重叠,动脉位于静脉顶部(图 1D)。
对于血液采样,应以静脉为目标,因为动脉损伤会导致股动脉血肿,当出血严重时,可能导致心血管休克13。虽然可以从三角静脉的任何部分及其远端区域抽血,但建议从股三角近端部位进行静脉穿刺,因为静脉体积大,而且与动脉的重叠似乎很少。此外,近端部位的静脉是浅表的,可以使用针头轻松定位。因为它有搏动,所以有时通过肉眼或触诊来识别股骨三角中的动脉,并且静脉位于其内侧。因此,观察动脉搏动有助于预测静脉的位置。
此外,通常在三角形顶部的皮肤下观察到指示静脉的蓝色(图 1B、C)。然而,三角形中的淋巴结通常位于静脉附近,并呈现深蓝色,因此它们的外观相似。幸运的是,它们可以通过活动性来区分:静脉是静止的,淋巴结是可移动的。因此,动脉的搏动和静脉的蓝色是用于定位静脉的两个主要线索,尽管可能需要剃掉头发才能看到它们。
确定卵巢周期的阶段
监测 6 只雌性狨猴 (年龄从 1 岁到 3 岁) 的 P4 和 E2 水平,以研究卵泡期和黄体期的持续时间。结果显示,卵泡期和黄体期的平均持续时间分别为 11.58 天 (4 只狨猴的 n = 6) 和 16.8 天 (3 只狨猴的 n = 5) (表 2)。在下文中,详细描述了六只狨猴中的一只(I4F,3 岁)的 P2 和 E3 动态。每隔几天对这只动物进行一次血液采样和激素测量,持续 38 天(表 3)。
黄体期(第 1-10 天)
测量的开始日期设置为第 1 天。根据 P4 水平 (21 ng/mL),动物可能处于黄体期。从第 1 天到第 10 天观察到高 P4 水平 (≥21 ng/mL),表明黄体期。第 12 天,它急剧下降至 4 ng/mL。这种显着下降表明从黄体期到卵泡期的转变。E2 水平从第 10 天 (241 ng/mL) 降低到第 12 天 (189 ng/mL) 也支持这种转变。
卵泡期(第 12-22 天)
过渡到卵泡期后,P4 水平保持较低水平 (4-6 ng/mL) 直到第 19 天,然后从第 19 天到第 24 天 (第 19 天,6 ng/mL;第 22 天,8 ng/mL;第 24 天,9 ng/mL)。相比之下,E2 水平从第 19 天 (94 ng/mL) 显著增加到第 22 天 (322 ng/mL),然后从第 22 天到第 24 天 (158 ng/mL) 下降。根据 P4 水平升高和 E2 水平降低,预计排卵发生在第 22 天和第 24 天之间,从卵泡过渡到黄体期。
黄体期(第 24-36 天)
排卵后,P4 水平一直保持高位直至第 36 天,然后在第 38 天降至 3 ng/mL。因此,从黄体期到卵泡期的转变很可能发生在第 36-38 天之间。与此转变一致,E2 水平在此期间下降(第 36 天,2517 ng/mL;第 38 天,73 ng/mL)。
预测和确定排卵时间
为了检查尿液 CG 水平与排卵日期之间的关系,准备了 7 只狨猴 (1-7 号)。注射氯前列醇以重置排卵周期 (第 0 天)。然后,从第 7 天开始监测血液 P4/E2 水平和尿液 CG 水平。点燃后立即收集尿液。血液采样基本上在早上进行。据推测,当 E2 水平与前一天相比大幅下降时,就会发生排卵,如报道17 所示。那天,确实在卵巢表面观察到卵泡破裂,输卵管中存在受精卵/卵母细胞(表 4)。
CG 在第 7 至 11 天 (第 7 天,N = 1;第 8 天,N = 2;第 9 天,N = 1;第 10 天,N = 2;第 11 天,N = 1) 首次检测到(表 4)。在第一个 CG 信号后 0-3 天观察到 E2 水平(排卵的迹象)大幅下降。当第一次 CG 检测更早时,从第一次 CG 检测到 E2 减少的持续时间似乎很大(图 3A)。例如,一只动物(1 号)在第 7 天首次检测到 CG 后 3 天显示 E2 信号下降(表 4)。相比之下,在第 10 天在一只动物 (第 2 只) 中观察到第一次 CG 检测和 E2 信号下降的共现。因此,尽管在五只动物中的一只中观察到第一次 CG 检测和排卵是在同一天发生的,但排卵发生在第一次检测到 CG 后的几天内。
用于狨猴 CG 的免疫层析检测试剂盒旨在使用尿液进行检测。CG 水平的检查通常伴随着使用血浆测定 P4/E2 水平。如果可以使用血浆而不是尿液进行 CG 测试,将会有所帮助。为了测试这一点,检查了上述实验中 P4/E2 水平测量后留下的血浆。在上述实验的任一天从四只动物身上收集血浆和尿液(检查天数在 表 4 中用双星号 [**] 表示)。使用尿液,四只动物中有两只显示出阳性结果(得分 5 和 3),另外两只显示出阴性结果(得分 1)。血浆显示的结果与尿液基本相同(图 3B)。使用血浆获得更强的信号。因此,使用血浆时,应在 10 分钟之前做出判断,这是为尿液设定的。
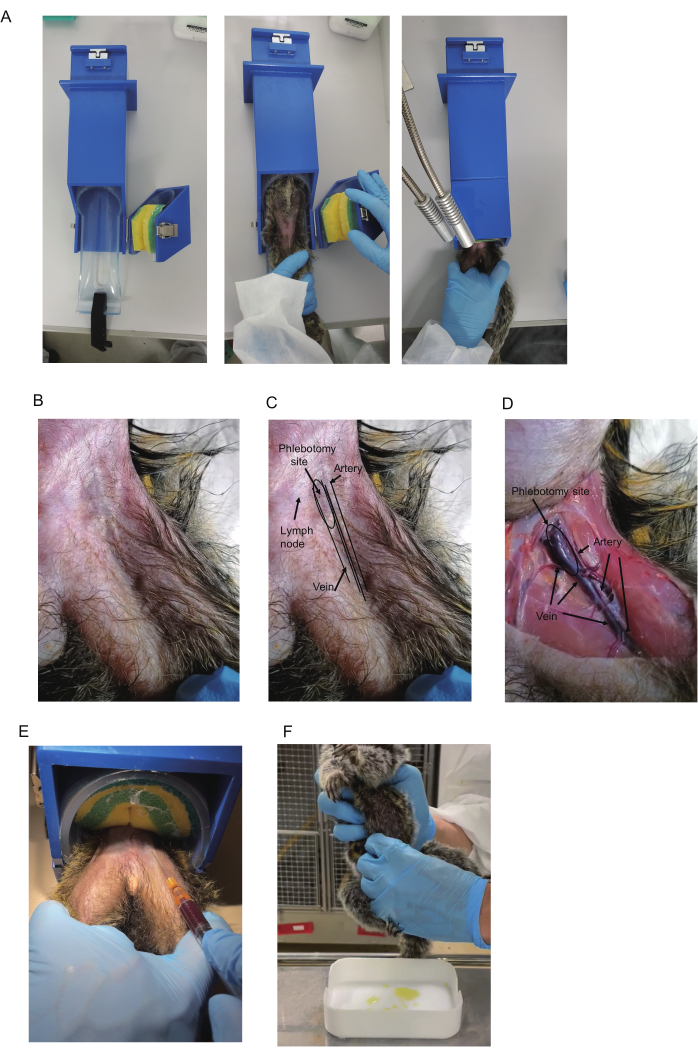
图 1:狨猴的血液采集。(A) 限制器用于血液采集。(B) 狨猴大腿上部。(C) 股骨三角和血管。三角形中的股动脉通常是可见的,并显示搏动。股静脉的蓝色有时在三角形的近端区域可见(表示为静脉切开部位)。淋巴结也呈蓝色。然而,由于淋巴结附着在皮肤上,因此淋巴结是可移动的。(D) 安乐死动物大腿的解剖图。指示动脉、静脉和静脉切开部位。同样的动物显示在 B-D 中。(E) 使用限制器采集血液。显示了狨猴腿部的保持位置和正在抽取的血液。(F) 狨猴的尿液收集。请单击此处查看此图的较大版本。
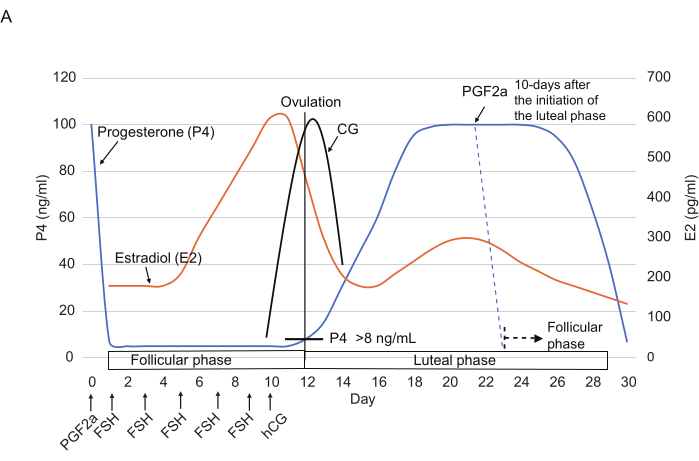
图 2:狨猴卵巢周期中 P4、E2 和 CG 水平的典型模式。 显示了 FSH 、 hCG 和 PGF2α 注射的时间点。虚线显示注射 PGF2α 后预期的荷尔蒙模式。缩写: P4 = 孕酮;E2 = 雌二醇;CG = 绒毛膜促性腺激素;FSH = 卵泡刺激素;hCG = 人绒毛膜促性腺激素;PGF2α = 前列腺素 F2α。 请单击此处查看此图的较大版本。
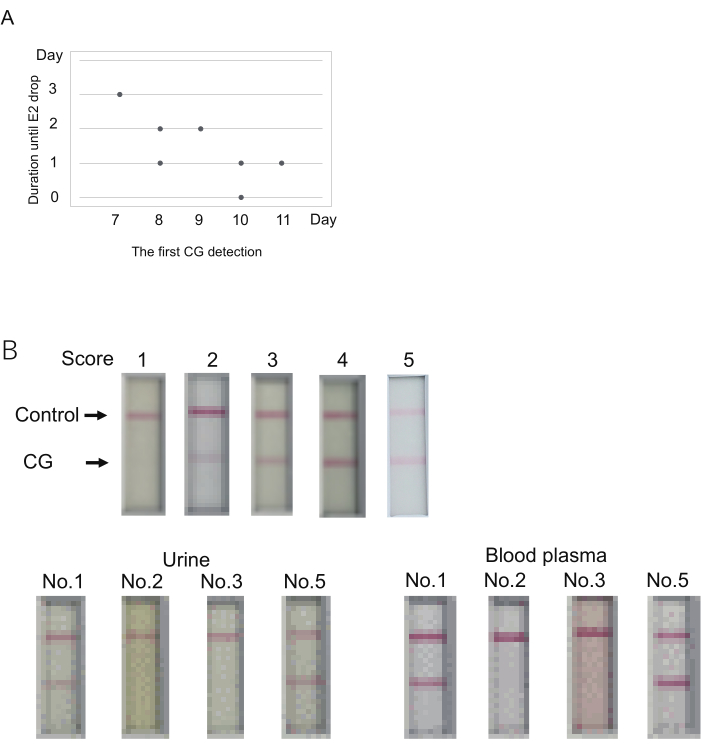
图 3:确定 CG 水平以预测排卵的发生。 (A) CG 检测的第一天(评分 > 1)与排卵前的持续时间(E2 下降)之间的可能关系。(B) 血浆可用于免疫层析 CG 检测。每个分数的代表性结果 (top)。样品加载后 10 分钟确定分数。分数 2 表示 5 分钟内没有条带,但 10 分钟内出现条带。收集尿液后不久进行采血。检查了四种狨猴( 表 S4 中的 1、2、3、5 号)。此处使用的示例在 表 4 中用双星号表示。用稀释缓冲液将血浆稀释至 50% 用于 E2 测量。 请单击此处查看此图的较大版本。
表 1:本研究中使用的动物。请点击此处下载此表格。
表 2:卵泡期和黄体期的持续时间。 根据 P4 水平确定期 (卵泡期 P4 ≤ 8 ,黄体期 P4 > 8)。当在测量之间观察到相变时,测量日期之间的中点被确定为变化点。两个变化点之间的持续时间被视为卵泡期或黄体期。为了确保测量单个阶段的持续时间,在同一阶段(包括跨越两个阶段时)间隔较长(≥7 天)或两次 ≥6 天间隔的数据未用于分析。只有当在同一阶段进行两次测量时,才会使用数据。请点击此处下载此表格。
表 3:一只狨猴 38 天的 P4 和 E2 测量结果。请点击此处下载此表格。
表 4:排卵天数的确定和预测。 如果在卵巢中观察到出血部位或破裂部位,则认为存在排卵痕迹。卵母细胞/受精卵表示 E2 滴注当天从输卵管获得的卵母细胞/受精卵的阶段。请点击此处下载此表格。
讨论
定位静脉是采血中最关键的步骤。根据解剖观察,该方案将股骨三角的近端区域引入狨猴中作为采血的简单部位。使用这个区域,可以很容易地从大静脉进行血液采样。然而,即使使用这种方案,有时也会发生动脉损伤。当动脉受伤时,建议通过施加压力 >5 分钟来完全止血,以防止血肿。此外,在施加压力的同时,使用冰块冷却点状部位也很有效。血肿可以用肝素(例如 Tensolvet 5.000 I.E. 凝胶)治疗。用肝素和 0.05 mL 美洛昔康 (0.5 mg/mL,口服) 连续治疗 3-4 天后,大多数血肿消失。动脉横向延伸到大腿近端区域的静脉。在远端区域,静脉和动脉似乎彼此更接近,重叠程度更大,动脉位于静脉腹侧。基于这种位置关系,从大腿近端区域采集血液可能降低动脉损伤的风险。
此外,近端区域的股静脉很粗,位于浅表,可以使用针头轻松定位。然而,从远端区域采血的优点是保持近端部位完好无损,即使静脉在采血过程中受损,也可以立即从同一条腿的近端区域重复静脉穿刺。这是因为受损部位的远端区域通常无法立即进行静脉穿刺。然而,当采血不成功时,可以从另一条腿的近端部位重复取样。
狨猴的循环血液体积为 ~25 mL (70 mL/kg)23。一只 350 克的狨猴需要 1 周才能从 2 mL 采血中恢复,相当于总血容量的 7.5%6。从股静脉中,可以毫无困难地收集 500-700 μL 的血液。当需要重复采样时,建议收集少量血液并使用自动分析仪的稀释缓冲液。
虽然麻醉通常不用于血液采样,但对于初学者来说,从麻醉动物身上取血可能比从清醒的动物身上取血要容易得多。但是,使用麻醉进行血液采样时需要谨慎,因为麻醉会影响血液成分的测量值。关于用于确定卵巢周期阶段的荷尔蒙测量,据报道,阿法沙酮导致 P424 水平出乎意料地升高。这是由抗 P4 抗体与阿法沙酮(一种 P4 衍生物)的交叉反应引起的。
P4 和 E2(类固醇激素)的结构在人类和狨猴之间是相同的。因此,可用于用于狨猴 P4 和 E2 的商用 ELISA 试剂盒。还提供人类血液激素测量的外包服务。相比之下,多肽激素(如 FSH、CG 和 Inhibin)的氨基酸序列略有不同。对于这些多肽激素,如果一个试剂盒可以同时用于人类和其他进化的远距离物种,例如小鼠,那么它也适用于狨猴。对于抑制素 B 的测量,可以使用人/小鼠/大鼠抑制素 B(β B 亚基)酶免疫测定试剂盒。
P4 水平增加是排卵(从卵泡期过渡到黄体期)的标志。尽管个体之间的差异使得仅从 P4 水平很难确定排卵日期,但 >8 ng/mL 的 P4 水平可以作为排卵发生的粗略指标。排卵日期更可靠的指标是 E2 水平 3,17 的下降。在 E2 减少的当天,确实在输卵管中观察到排卵卵母细胞/受精卵(表 4)。因此,E2 的测量使我们能够确定确切的排卵日期。除了荷尔蒙水平外,PGF2α 给药后天数的信息是排卵日的预测指标(表 4)。同样,P4 和 E2 水平的组合使用有助于确定过渡到卵泡期的时间,此时 P4 水平急剧下降且 E2 水平处于最低水平。
在狨猴中,CG 而不是 LH 从垂体释放以诱导排卵。此外,当胚胎附着并植入子宫内膜时,CG 会从滋养层细胞中排泄。由于狨猴缺乏功能性 LH 基因,因此从垂体释放 CG 而不是 LH 以刺激排卵5。一项研究报告称,指示排卵的 E2 和 CG 峰值在同一天12 观察到。另一项研究报告称,平均而言,E2 峰值(PGF2α 给药后 8.6 天)先于 CG 峰值(PGF2α 给药后 9.3 天)25,这表明排卵可能发生在达到 CG 峰值之前。与 E2 不同,CG 在其峰值之前进行脉冲释放。CG 的脉冲释放平均在其峰值前 ~1 天开始。然而,观察到从第一次检测到 CG 水平到 E2 水平下降的持续时间存在很大变化(图 3A 和 表 4)。此外,据报道,CG 首次在上午和下午的样本中检测到25。
据我们所知,没有关于狨猴在一天中的特定时间发生排卵的报道。此外,狨猴通常会一次释放两个或三个卵母细胞,因此可能会有一段时间释放所有卵母细胞。由于 CG 水平升高发生在排卵前,因此 CG 测量可以提前预测排卵日期。这些信息对于在排卵当天收集 MII 卵母细胞或第 0 天胚胎特别有用。因此,血液 P4/E2 水平和 CG 水平的组合测量是有用的(图 3B)。在大多数灵长类动物物种中,包括人类,分娩后一段时间内不会发生排卵。然而,产后排卵发生在狨猴分娩后 ~10 天。因此,下一次投放通常在上一次投放后 ~155 天进行。这种连续怀孕,加上双胞胎的分娩,导致狨猴的繁殖力水平很高。
荷尔蒙波动因人而异,有些没有恒定的周期。一些雌性狨猴表现出持续的低 P4/E2 水平,这表明缺乏排卵。缺乏排卵周期可归因于不成熟、健康问题、压力或占主导地位的生殖雌性排卵抑制26,27。测量荷尔蒙水平的 21 只狨猴(>2 岁)中有 3 只表明作者的设施缺乏规律的排卵周期。了解原因并开发适当的治疗方法将使动物在实验中更有效地使用。观察到黄体期延长 ~1 个月且相关的高 P4 水平的个体2。在作者的设施中,延长的黄体期在同一个体中重复。21 只狨猴中有 2 只表现出这种异常。两只动物中的一只是单舍的,排除了动物在延长的黄体期怀孕的可能性。另一个通过放射治疗与可能不育的男性配对,因此她在延长的黄体期不太可能怀孕。即使在延长的黄体期,PGF2α 给药也会降低 P4 水平并重置卵巢周期。测量性激素和了解排卵周期状态有助于在实验和育种中有效利用动物。
个体的血液采样不仅用于估计排卵日期,还用于诊断目的的血清学测试。同样,激素水平的测量不仅用于估计排卵日,还用于研究社交互动、儿童发育和疾病。未来,为了制造转基因狨猴,预计会从 iPS 细胞发育出卵巢和睾丸。适当的荷尔蒙水平对于正常发育很重要。此处描述的方案将有助于测量和控制用于制造狨猴 iPS 细胞衍生性腺的性激素。
披露声明
作者没有需要声明的利益冲突。
致谢
我们要感谢 Chunshen Shen、Hiroko Akutsu、Fumiyo Sugiki、Yuuna Hashimoto、Hina Naritomi、Yuuki Sakamoto 和 Mikiko Horigome 在建立本协议和狨猴日常护理方面的支持;Takayuki Mineshige 对手稿的评论;Yukiko Abe 和 Aiba 实验室的成员分享了受精卵采集技术;CIEA 分享了有关狨猴住房和他们 40 多年来培育的实验的信息。这项研究得到了 AMED、JST 和 KAKENHI 的支持,资助号为 JP19gm6310010、JP20gm6310010、JP21gm6310010 和 JP22gm6310010 (AMED)、JPMJPR228B (JST)、20H05764、20H03177 和 22K18356 (KAKENHI)。
材料
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
参考文献
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。