Method Article
Amostragem de sangue e medição hormonal para determinar o estágio do ciclo ovariano em saguis
Neste Artigo
Resumo
Este protocolo descreve amostras de sangue e urina para medir os níveis de progesterona/estradiol e gonadotrofina coriônica para determinar o estágio do ciclo ovariano. Os níveis hormonais são usados para prever e determinar o momento da ovulação e os hormônios são injetados para regular o ciclo ovariano e o crescimento do oócito.
Resumo
Os saguis comuns são pequenos macacos do Novo Mundo. Como muitos de seus mecanismos biológicos são semelhantes aos dos humanos, os saguis são potencialmente úteis para pesquisas médicas e de biologia humana em vários campos, como neurociência, medicina regenerativa e desenvolvimento. No entanto, há uma falta de literatura descrevendo métodos para muitos experimentos e procedimentos básicos. Aqui, são descritos métodos detalhados para determinar os níveis de hormônios sexuais (progesterona, estradiol e gonadotrofina coriônica) em saguis. A medição desses hormônios permite a previsão do estágio do ciclo ovariano, que normalmente é de 26 a 30 dias em saguis; A determinação precisa é essencial para a colheita de oócitos/zigotos no momento correto e para a preparação de fêmeas hospedeiras para a geração de saguis geneticamente modificados.
Além disso, a medição dos níveis de hormônios sexuais é útil para estudos de endocrinologia, etologia, desenvolvimento inicial e biologia reprodutiva. Este protocolo fornece uma descrição detalhada dos métodos de amostragem de sangue da veia femoral, separação de plasma para medição hormonal, medição dos níveis de gonadotrofina coriônica usando urina e plasma, redefinição do ciclo ovariano usando injeções de um análogo de prostaglandina F2α para encurtar e sincronizar o ciclo e promovendo o crescimento folicular e a ovulação injetando hormônio folículo-estimulante e gonadotrofina coriônica. Usando esses protocolos, os estágios do ciclo ovariano podem ser determinados para a coleta oportuna de oócitos/zigotos.
Introdução
O sagui comum (Callithrix jacchus) é um pequeno macaco do Novo Mundo com muitas características semelhantes às dos humanos, e a duração de seu ciclo ovariano é de 26 a 30 dias 1,2. Estudos sobre o desenvolvimento inicial e a geração de saguis geneticamente modificados requerem a colheita de oócitos e zigotos em estágios específicos do ciclo ovariano. Assim, a determinação precisa do estágio é crucial e pode ser estimada pela medição dos níveis sanguíneos dos hormônios progesterona (P4) e estradiol (E2)2,3. Esses hormônios promovem o crescimento endometrial, necessário para a implantação. P4 é produzido a partir do corpo lúteo, que se forma nos ovários imediatamente após a ovulação. E2 é secretado pelos folículos ovarianos em resposta ao hormônio folículo-estimulante (FSH) do complexo hipotálamo-hipófise no cérebro. Os níveis de E2 aumentam à medida que o folículo amadurece, atingindo o pico antes da ovulação3. Altos níveis de E2 causam a liberação pulsada do hormônio luteinizante (LH) através do complexo hipotálamo-hipófise em humanos; esse aumento de LH induz a ovulação. No entanto, em saguis, o gene LH sofreu degeneração durante a evolução, e a ovulação é induzida pela liberação de gonadotrofina coriônica (CG), que tem uma estrutura semelhante à do LH, da glândula pituitária 4,5.
O ciclo ovariano pode ser controlado por injeções hormonais. As injeções de FSH, em humanos, atuam nos receptores ovarianos de FSH e são usadas para promover a síntese de estrogênio e o crescimento folicular6. A injeção de CG humano (hCG) como substituto do LH no final da fase folicular é usada para estimular a ovulação em humanos7. As injeções de CG também são usadas para tratar a infertilidade humana porque o CG estimula o corpo lúteo no início da gravidez, resultando em aumento da produção de P4. As injeções de prostaglandina F2α (PGF2α) redefinem o ciclo ovariano8. Em bovinos domésticos, a injeção de PGF2α é usada para encurtar a fase lútea e sincronizar o ciclo estral para o manejo reprodutivo.
Embora saguis e humanos tenham mecanismos biológicos semelhantes, tornando-os animais modelo ideais, há uma falta de literatura que descreva métodos básicos para muitas técnicas frequentemente usadas. A coleta de sangue é uma das técnicas mais utilizadas 9,10,11,12. No entanto, os iniciantes às vezes têm dificuldade em encontrar a veia. Assim, este estudo realizou análises anatômicas da região da veia femoral. Com base em observações anatômicas, este protocolo apresenta a região proximal do triângulo femoral como um local fácil para punção venosa.
Protocolo
Todos os métodos envolvendo saguis utilizaram altos padrões éticos e de bem-estar e foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Centro Nacional de Saúde e Desenvolvimento Infantil. Os animais utilizados aqui foram alojados individualmente ou pareados (uma fêmea e um macho) com 12 h de luz por dia.
1. Amostragem de sangue da veia femoral
- Prepare uma seringa de 1 ml (o tipo curto é fácil de utilizar) com uma agulha de 25 G fixada com a lâmina virada para cima. Para evitar entupimento do sangue, heparinize a seringa aspirando 200 μL de solução de heparina sódica não diluída para a seringa. Cubra o interior da seringa uniformemente, puxando-a para cima e para baixo várias vezes; Em seguida, expulse a solução de heparina da seringa.
NOTA: Como a mudança para uma nova seringa é frequentemente necessária, prepare algumas seringas heparinizadas adicionais. - Prepare algodão absorvente e cotonetes com álcool. Ligue uma lâmpada ajustável para iluminar a área onde o sagui será colocado para coleta de sangue.
- Prepare o dispositivo de retenção (420 x 85 x 85 mm, Figura 1A), que está disponível comercialmente (consulte a Tabela de Materiais para obter detalhes). Para colocar um sagui no dispositivo, abra a parte de retenção com o cinto de esponja, que prende os saguis. Insira o sagui no dispositivo de retenção voltado para cima.
NOTA: Os saguis geralmente são calmos em dispositivos de contenção, o que pode anular a necessidade de contenção, aclimatação ou treinamento. - Capture o sagui; insira o sagui na parte cilíndrica; e prenda-o pressionando a correia de esponja. Coloque a perna da qual o sangue deve ser coletado em cima da outra (Figura 1A). Segure as pernas usando a mão não dominante; Coloque os dedos médio e anelar dentro de cada perna para prendê-los e os outros dedos fora de cada perna para fixá-los.
NOTA: Luvas de mordida são recomendadas ao capturar saguis. Se um dispositivo de contenção não estiver presente, faça a coleta de sangue sob anestesia ou com outra pessoa prendendo o sagui. - Verifique se a veia femoral está visível perto da base da coxa. Caso contrário, palpe para encontrar a artéria pulsante e use-a como ponto de referência para verificar se a veia corre dentro dela (Figura 1B-D).
NOTA: Recomenda-se iluminação de mesa e depilação para melhorar a visibilidade. A visibilidade também pode ser melhorada esfregando com cotonetes embebidos em álcool. Os gânglios linfáticos no triângulo geralmente estão localizados perto da veia e mostram uma cor azul escura como veia. Como distingui-los é descrito na seção Resultados representativos. - Desinfete o local da punção usando um cotonete embebido em álcool. Insira a agulha com o lado da lâmina para cima em um ângulo de 15°-20°. Para evitar que a agulha escorregue para fora do vaso sanguíneo durante a coleta de sangue, estabilize a mão que segura a seringa, por exemplo, apoiando-a na outra mão.
- Puxe suavemente o êmbolo para trás para aplicar pressão negativa (Figura 1E). Empurre a ponta da agulha para frente. Assim que o sangue entrar na seringa, mantenha a posição da ponta da agulha até que o volume necessário (500-700 μL) tenha sido coletado.
- Quando o sangue não entrar na seringa, mude o local da punção. Se o sangue sair ao retirar a agulha, pare o sangramento aplicando pressão no local da punção por 3 min. Depois de parar o sangramento, reinicie a punção venosa.
- Se o sangue que está sendo aspirado para a seringa parar de fluir durante o processo de coleta, empurre lentamente a ponta da agulha para frente e puxe-a para trás para encontrar o vaso sanguíneo. Isso pode restaurar o fluxo de sangue para a seringa. Caso contrário, retire a agulha e faça a punção venosa usando uma seringa nova.
NOTA: Use a coxa da outra perna quando for difícil coletar sangue do mesmo lado.
- Puxe cuidadosamente a agulha enquanto pressiona levemente o local da punção usando o dedo mindinho. Em seguida, usando um cotonete absorvente, aplique pressão imediatamente no local da punção por 3 min para estancar o sangramento. Inverta a seringa para misturar sangue e heparina.
NOTA: Aplique pressão por mais tempo (5 min) enquanto resfria quando o sangue arterial é coletado e confirme cuidadosamente a cessação do sangramento para evitar a formação de hematoma, que às vezes pode resultar em um resultado fatal. - Depois de confirmar que o sangramento cessou, remova o cinto de esponja, segure a cintura do animal com uma mão e gire o animal para que se possa segurar a axila do animal com a outra mão por trás.
- Retorne o sagui para sua gaiola. Para reduzir o estresse e facilitar a coleta repetida de sangue, forneça ao sagui sua comida favorita (por exemplo, biscoitos, marshmallows ou pão de ló). Verifique a ocorrência de hematoma ocasionalmente.
NOTA: Quando o hematoma for encontrado no estágio inicial, aplique um curativo de pressão para evitar a progressão do hematoma. Quando é encontrado após muito tempo, pode ser necessária a remoção cirúrgica do hematoma com ligadura da artéria femoral e transfusão sanguínea 9,13. - Retire a agulha da seringa para evitar hemólise. Em seguida, expulse lentamente o sangue coletado ao longo da parede interna de um microtubo de 1,5 mL.
NOTA: O sangue coletado pode ser armazenado a 4 oC por até 24 h antes da separação do plasma para medir os níveis de P4 / E2.
2. Separação do plasma e determinação dos níveis hormonais
- Centrifugue o sangue em um tubo de 1,5 mL a 1.100 × g por 5 min a 4 oC.
- Transfira o plasma separado (sobrenadante) do tubo de 1,5 mL para um novo tubo/copo, evitando cuidadosamente a inclusão de células sanguíneas (sedimento).
- Meça os níveis de P4 e E2 usando um kit ELISA ou um analisador automático. Se a quantidade de plasma não for suficiente para o analisador automático, utilizar uma solução de diluição da amostra.
NOTA: Para a medição usando um analisador automático, são necessários > 175 μL de plasma para determinar apenas um nível de P4 e > 250 μL de plasma para determinar P4 e E2.
3. Medição de CG de urina para detectar ovulação e gravidez
NOTA: Os níveis de CG em saguis podem ser medidos usando um teste de kit imunocromatográfico para ovulação e gravidez. No caso da ovulação, um resultado positivo pode ser obtido 0-2 dias antes da ovulação. No caso de gravidez, um resultado positivo é detectado dos dias 15-20 até aproximadamente o dia 100 de gravidez. O teste requer uma pequena quantidade (90 μL) de urina (uma gota de urina equivale a ~ 30 μL).
- Método da bandeja: Se mais de dois animais estiverem na mesma gaiola, mova o sagui alvo (ou os outros animais) para outra gaiola no dia anterior. Coloque uma bandeja limpa no fundo da gaiola na noite anterior ou anterior ao acendimento. A urina não é drenada da bexiga durante a noite. Portanto, a urina geralmente é liberada da bexiga logo após o acendimento.
NOTA: Entrar na sala pela manhã antes da iluminação pode interromper o ciclo de sono da coorte. A urina geralmente pode ser coletada em aproximadamente 30 minutos após o acendimento. - Método de compressão: Prepare as bandejas lavadas para a coleta de urina. Depois de localizar a bexiga do sagui, aperte-a cuidadosamente pela frente e pelos dois lados usando todo o comprimento dos dedos (Figura 1F). Colete a urina antes de iluminar a sala pela manhã.
NOTA: Se a coleta de urina não for bem-sucedida devido à ausência de urina na bexiga, aguarde um pouco e tente novamente. Tenha cuidado para não usar força excessiva, pois isso ferirá o animal. - Imediatamente após a coleta, coloque a amostra de urina no poço do kit de teste imunocromatográfico. Leia o resultado após 10 minutos de acordo com as instruções do fabricante.
4. Controle e determinação do estágio do ciclo ovariano para a coleta de oócitos, zigotos e embriões
- Coleta de oócitos de vesículas germinativas (GV) dos ovários
- Administre uma injeção intramuscular de 3 μL de cloprostenol 0,263 mg / mL (um análogo sintético de PGF2α) diluído em 150 μL de solução salina14 (Figura 2) para redefinir o ciclo ovariano no final da fase lútea (ou seja, ≥10 dias após o início da fase lútea).
NOTA: Fazer a solução diluída em um volume maior pode ser conveniente, pois o cloprostenol diluído permanece estável por, pelo menos, várias semanas a +4 °C. - No dia seguinte (dia 1), confirme o início da fase folicular verificando se o nível de P4 caiu.
NOTA: Foi relatado que a injeção de cloprostenol diminui drasticamente os níveis de P4 (geralmente <10 ng / mL) em 24 h3. - A partir do dia 1, injete FSH (25 UI, intramuscular) uma vez a cada 2 dias para um total de 5x (dias 1, 3, 5, 7 e 9). No dia 10, injete hCG (75 UI, intramuscular) à tarde.
- Coletar GVs dos ovários no dia 11 por aspiração folicular sob anestesia de acordo com a literatura15,16.
NOTA: Às vezes, a ovulação ocorre mais cedo do que o esperado. Assim, recomenda-se verificar os níveis de CG a partir do 8º dia. Se o teste de GC for positivo, realizar a coleta de GV neste dia.
- Administre uma injeção intramuscular de 3 μL de cloprostenol 0,263 mg / mL (um análogo sintético de PGF2α) diluído em 150 μL de solução salina14 (Figura 2) para redefinir o ciclo ovariano no final da fase lútea (ou seja, ≥10 dias após o início da fase lútea).
- Coleta de oócitos metafásicos II (MII), zigotos e embriões precoces
- Reponha o ciclo ovárico utilizando cloprostenol conforme descrito no passo 4.1.1.
- No dia seguinte (dia 1), confirme o início da fase folicular verificando se o nível de P4 caiu.
- Para a coleta de zigotos e embriões, alojar saguis fêmeas junto com saguis machos para acasalamento a partir do dia 6.
- A partir do dia 7, verifique os níveis sanguíneos de P4/E2 e os níveis de CG na urina das fêmeas. A detecção de CG é uma indicação de ovulação dentro de alguns dias (geralmente no dia seguinte). No dia em que os níveis de P4 aumentam e os níveis de E2 diminuem em relação ao dia anterior, coletar oócitos MII ou zigotos embrionários de dia 0 (E0) dos ovidutos17,18.
- Para a coleta de embriões, conforme descrito na literatura, realize a lavagem dos ovidutos (E1-E3, 1-8 células)17,18 ou do útero (E5-E10, 8 células-blastocisto)19,20,21,22 no momento apropriado, dependendo do estágio alvo.
Resultados
Os detalhes relacionados aos animais utilizados neste estudo estão listados na Tabela 1.
Análise anatômica da veia femoral
As análises anatômicas da veia femoral foram realizadas em um sagui-comum macho de 2 anos de idade (I 7713M) submetido à eutanásia. As veias e artérias femorais estão localizadas no triângulo femoral. O triângulo femoral é formado nos limites entre a parede abdominal e os músculos da coxa (Figura 1B-D). Na base da coxa, uma grande veia atravessa o centro do triângulo invertido e uma artéria corre paralelamente fora da veia. Na região inferior, as veias e artérias tornam-se mais finas e se sobrepõem, com as artérias posicionadas no topo das veias (Figura 1D).
Para a coleta de sangue, a veia deve ser direcionada, pois uma lesão arterial pode causar hematoma da artéria femoral, que pode levar ao choque cardiovascular quando a hemorragia é grave13. Embora o sangue possa ser retirado de qualquer parte da veia do triângulo e de sua área distal, a punção venosa do local proximal do triângulo femoral é recomendada devido ao grande tamanho da veia e sua aparente pouca sobreposição com a artéria. Além disso, a veia no local proximal é superficial, permitindo fácil localização com agulha. Por pulsar, a artéria no triângulo femoral às vezes é identificada visualmente ou por palpação, e a veia corre medial a ela. Assim, a observação da pulsação arterial ajuda a predizer a localização da veia.
Além disso, uma coloração azul indicativa da veia é geralmente observada sob a pele no topo do triângulo (Figura 1B, C). No entanto, os gânglios linfáticos no triângulo geralmente estão localizados perto da veia e apresentam uma cor azul escura, portanto, sua aparência é semelhante. Felizmente, eles podem ser distinguidos por sua mobilidade: a veia é estacionária e os gânglios linfáticos são móveis. Assim, a pulsação da artéria e a cor azul da veia são duas pistas principais usadas para localizar a veia, embora possa ser necessário raspar o cabelo para visualizá-las.
Determinação do estágio do ciclo ovariano
Os níveis de P4 e E2 foram monitorados em seis saguis fêmeas (variando de 1 a 3 anos de idade) para investigar a duração das fases folicular e lútea. Os resultados mostraram uma duração média de 11,58 dias (n = 6 de quatro saguis) e 16,8 dias (n = 5 de três saguis) para as fases folicular e lútea, respectivamente (Tabela 2). A seguir, a dinâmica P4 e E2 de um (I6751F, 3 anos de idade) dos seis saguis é descrita em detalhes. Amostras de sangue e dosagens hormonais neste animal foram realizadas a cada poucos dias durante 38 dias (Tabela 3).
Fase lútea (dias 1-10)
O dia de início da medição foi definido como dia 1. Com base no nível de P4 (21 ng/mL), o animal provavelmente estava na fase lútea. Um alto nível de P4 foi observado dos dias 1 a 10 (≥21 ng/mL), sugerindo a fase lútea. No dia 12, caiu drasticamente para 4 ng/mL. Essa diminuição significativa indicou a transição da fase lútea para a folicular. Uma diminuição no nível de E2 do dia 10 (241 ng/mL) para o 12 (189 ng/mL) também apoiou essa transição.
Fase folicular (dias 12-22)
Após a transição para a fase folicular, o nível de P4 permaneceu baixo (4-6 ng/mL) até o dia 19 e depois aumentou ligeiramente do dia 19 ao 24 (dia 19, 6 ng/mL; dia 22, 8 ng/mL; dia 24, 9 ng/mL). Em contraste, o nível de E2 aumentou significativamente do dia 19 (94 ng/mL) para 22 (322 ng/mL) e depois diminuiu do dia 22 para o 24 (158 ng/mL). Com base no aumento dos níveis de P4 e diminuição dos níveis de E2, a ovulação foi prevista para ocorrer entre os dias 22 e 24, passando da fase folicular para a lútea.
Fase lútea (dias 24-36)
Após a ovulação, o nível de P4 permaneceu alto até o dia 36 e depois caiu para 3 ng/mL no dia 38. Assim, é provável que a transição da fase lútea para a folicular tenha ocorrido entre os dias 36-38. Consistente com essa transição, o nível de E2 diminuiu durante esse período (dia 36, 2517 ng / mL; dia 38, 73 ng / mL).
Previsão e determinação do momento da ovulação
Para examinar a relação entre o nível de CG na urina e a data de ovulação, sete saguis (nº 1-7) foram preparados. O cloprostenol foi injetado para redefinir o ciclo ovulatório (dia 0). Em seguida, foi realizada a monitorização dos níveis sanguíneos de P4/E2 e do CG urinário a partir do 7º dia. A urina foi coletada imediatamente após o acendimento. A coleta de sangue foi realizada essencialmente no período da manhã. Supôs-se que a ovulação ocorre quando o nível de E2 caiu em grande parte em comparação com o dia anterior, conforme relatado17. Nesse dia, a ruptura folicular foi de fato observada na superfície dos ovários, e a presença de zigotos/oócitos nos ovidutos (Tabela 4).
O GC foi detectado pela primeira vez durante os dias 7 a 11 (dia 7, N = 1; dia 8, N = 2; dia 9, N = 1; dia 10, N = 2; dia 11, N = 1) (Tabela 4). A grande queda nos níveis de E2 (indicação da ovulação) foi observada 0-3 dias após o primeiro sinal do GC. A duração desde a primeira detecção de CG até a diminuição de E2 pareceu ser grande quando a primeira detecção de CG foi mais cedo (Figura 3A). Por exemplo, um animal (nº 1) apresentou queda no sinal E2 3 dias após a primeira detecção de CG no dia 7 (Tabela 4). Em contraste, a co-ocorrência da primeira detecção de CG e a queda do sinal E2 foi observada em um animal (nº 2) no dia 10. Assim, embora a primeira detecção de CG e a ovulação tenham sido observadas no mesmo dia em um dos cinco animais, a ovulação ocorreu poucos dias após a primeira detecção de CG.
O kit de teste imunocromatográfico para saguis CG foi projetado para usar urina para testes. O exame do nível de CG geralmente acompanha a determinação dos níveis de P4/E2 usando plasma sanguíneo. Será útil se o plasma sanguíneo, em vez da urina, puder ser usado para o teste de CG. Para testar isso, o plasma sanguíneo que sobrou após a medição do nível de P4 / E2 nos experimentos acima foi examinado. O plasma sanguíneo e a urina foram coletados dos quatro animais em qualquer um dos dias dos experimentos acima (os dias de exame foram indicados por asteriscos duplos [**] na Tabela 4). Usando a urina, dois dos quatro animais apresentaram resultados positivos (escores 5 e 3) e os outros dois apresentaram resultados negativos (escore 1). O plasma sanguíneo mostrou essencialmente os mesmos resultados que a urina (Figura 3B). O sinal mais forte foi obtido usando plasma sanguíneo. Portanto, ao usar plasma sanguíneo, o julgamento deve ser feito antes de 10 minutos, que é definido para a urina.
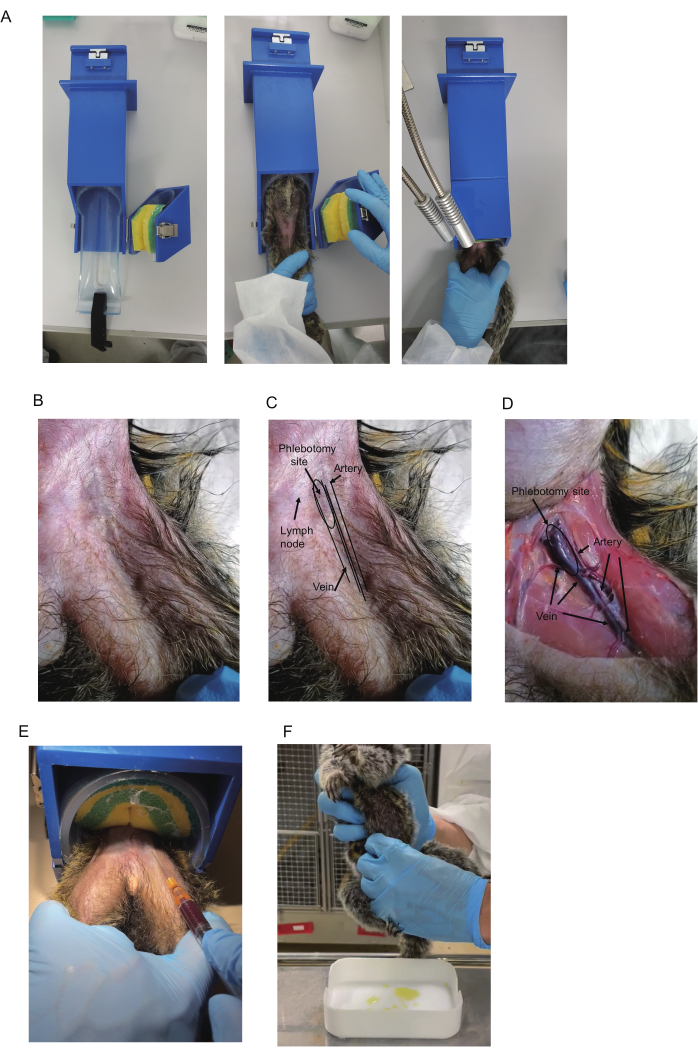
Figura 1: Coleta de sangue de saguis. (A) Um limitador é usado para coleta de sangue. (B) Parte superior da coxa do sagui. (C) Triângulo femoral e vasos sanguíneos. A artéria femoral no triângulo é frequentemente visível e mostra pulsação. A cor azul da veia femoral às vezes é visível na área proximal do triângulo (indicada como local da flebotomia). Os gânglios linfáticos também apresentam uma cor azul. No entanto, os gânglios linfáticos são móveis, pois os gânglios linfáticos estão ligados à pele. (D) Visão anatômica da coxa do animal sacrificado. A artéria, a veia e o local da flebotomia são indicados. O mesmo animal é mostrado em B-D. (E) Coleta de sangue usando um limitador. A posição de retenção das pernas do sagui e o sangue sendo coletado são mostrados. (F) Coleta de urina de um sagui. Clique aqui para ver uma versão maior desta figura.
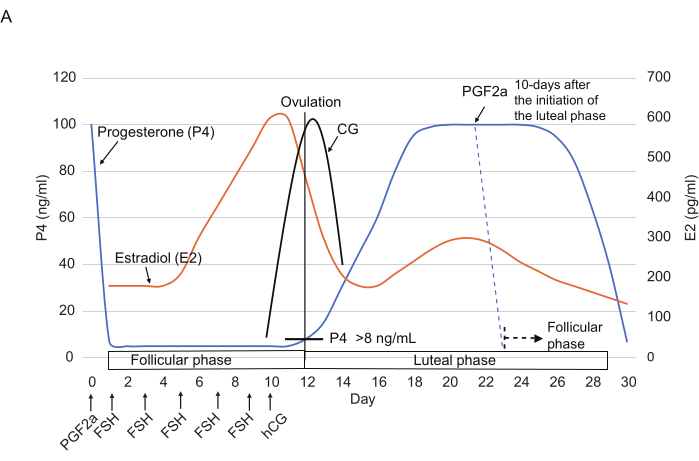
Figura 2: Padrões típicos dos níveis de P4, E2 e CG durante o ciclo ovariano em saguis. Os pontos de tempo das injeções de FSH, hCG e PGF2α são indicados. As linhas tracejadas mostram o padrão hormonal esperado após a injeção de PGF2α. Abreviaturas: P4 = progesterona; E2 = estradiol; GC = gonadotrofina coriônica; FSH = hormônio folículo-estimulante; hCG = gonadotrofina coriônica humana; PGF2α = prostaglandina F2α. Clique aqui para ver uma versão maior desta figura.
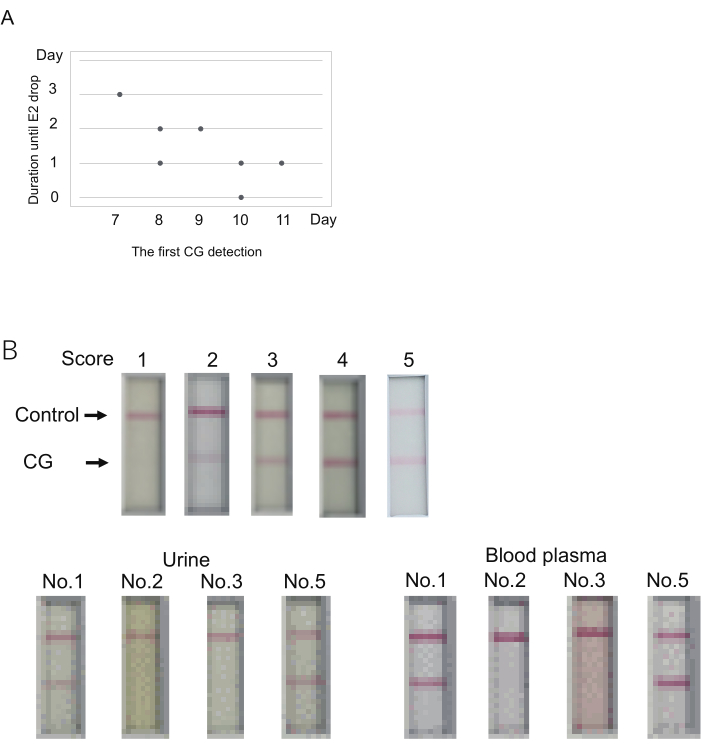
Figura 3: Determinação do nível de CG para predizer a ocorrência de ovulação. (A) A possível relação entre o primeiro dia de detecção do CG (escore > 1) e a duração até a ovulação (queda de E2). (B) O plasma sanguíneo pode ser usado para testes imunocromatográficos de CG. Um resultado representativo de cada pontuação (topo). O escore foi determinado 10 min após o carregamento da amostra. A pontuação 2 não representa nenhuma banda em 5 minutos, mas a aparência de uma banda em 10 minutos. A coleta de sangue foi realizada logo após a coleta da urina. Quatro saguis (nº 1, 2, 3, 5 na Tabela S4) foram examinados. As amostras usadas aqui são indicadas como asteriscos duplos na Tabela 4. O plasma sanguíneo foi diluído a 50% pelo tampão de diluição usado para a medição de E2. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Animais utilizados neste estudo. Clique aqui para baixar esta tabela.
Tabela 2: Duração das fases folicular e lútea. A fase foi determinada com base no nível de P4 (fase folicular P4 ≤ 8, fase lútea P4 > 8). Quando a mudança de fase foi observada entre as medições, o ponto médio entre as datas de medição foi determinado como o ponto de mudança. A duração entre os dois pontos de mudança foi considerada como fases folicular ou lútea. Para garantir a medição da duração de uma única fase, os dados com intervalo longo (≥7 dias) ou duas vezes de intervalos de ≥6 dias na mesma fase, inclusive quando abrangendo as duas fases, não foram utilizados para as análises. Somente quando duas medições foram realizadas na mesma fase, os dados foram empregados. Clique aqui para baixar esta tabela.
Tabela 3: Resultados das medições de P4 e E2 por 38 dias em um sagui.Clique aqui para baixar esta tabela.
Tabela 4: Determinação e previsão dos dias ovulatórios. Os traços de ovulação foram considerados presentes se locais de sangramento ou locais de ruptura fossem observados nos ovários. Oócito/zigoto indica os estágios do oócito/zigoto obtidos dos ovidutos no dia da queda de E2. Clique aqui para baixar esta tabela.
Discussão
A localização da veia é a etapa mais crítica na coleta de sangue. Com base em observações anatômicas, este protocolo apresenta a área proximal no triângulo femoral como um local fácil para coleta de sangue em saguis. Usando esta área, a amostragem de sangue de uma veia grande pode ser facilmente realizada. No entanto, mesmo usando este protocolo, às vezes ocorre lesão em uma artéria. Ao lesionar uma artéria, sugere-se a interrupção completa do sangramento aplicando pressão por >5 min para evitar hematoma. Além disso, ao aplicar pressão, o resfriamento do local pontilhado usando um cubo de gelo também é eficaz. Os hematomas podem ser tratados com heparina (por exemplo, Tensolvet 5.000 I.E. gel). A maioria dos hematomas desaparece após 3-4 dias consecutivos de tratamento com heparina e 0,05 mL de meloxicam (0,5 mg/mL, v.o.). A artéria corre lateralmente à veia na área proximal da coxa. Na área distal, a veia e a artéria pareciam mais próximas uma da outra e se sobrepunham em maior extensão, com a artéria localizada ventral à veia. Com base nessa relação posicional, a coleta de sangue da área proximal da coxa provavelmente tem um risco reduzido de lesão arterial.
Além disso, a veia femoral na região proximal é espessa e localizada superficialmente, permitindo fácil localização com agulha. No entanto, a coleta de sangue da área distal tem a vantagem de deixar os locais proximais intactos, permitindo a repetição imediata da punção venosa da área proximal da mesma perna, mesmo que a veia seja danificada durante a coleta de sangue. Isso ocorre porque a área distal do local danificado geralmente não está disponível para punção venosa imediata. No entanto, quando a coleta de sangue não é bem-sucedida, a amostragem repetida pode ser realizada a partir do local proximal na outra perna.
O volume de sangue circulante em saguis é de ~ 25 mL (70 mL / kg) 23. Um sagui de 350 g requer 1 semana para se recuperar de 2 mL de coleta de sangue, equivalente a 7,5% do volume total de sangue6. Das veias femorais, 500-700 μL de sangue podem ser coletados sem dificuldade. Quando é necessária uma amostragem repetida, recomenda-se a coleta de quantidades menores de sangue e o uso de um tampão de diluição para o analisador automático.
Embora a anestesia geralmente não seja usada para amostragem de sangue, para iniciantes, a amostragem de sangue de animais anestesiados pode ser muito mais fácil do que de animais acordados. No entanto, é necessário cuidado ao usar anestesia para coleta de sangue, pois a anestesia pode afetar os valores medidos dos componentes sanguíneos. Em relação às medidas hormonais para determinar o estágio do ciclo ovariano, foi relatado que a alfaxalona resultou em níveis inesperadamente mais altos de P424. Isso foi causado pela reatividade cruzada do anticorpo anti-P4 à alfaxona, que é um derivado do P4.
As estruturas de P4 e E2 (hormônios esteróides) são idênticas entre humanos e saguis. Kits ELISA comerciais para P4 e E2 humanos estão, portanto, disponíveis para saguis P4 e E2. Serviços de terceirização para medição de hormônios no sangue humano também estão disponíveis. Por outro lado, existem pequenas diferenças nas sequências de aminoácidos para hormônios polipeptídicos, como FSH, CG e inibina. Para esses hormônios polipeptídicos, se um kit puder ser usado para humanos e outras espécies evolutivamente distantes, como camundongos, ele também funcionará para saguis. Para medição de inibina B, pode ser usado um kit de imunoensaio enzimático de inibina B (subunidade Beta B) humano/camundongo/rato.
Um aumento no nível de P4 é uma marca registrada da ovulação (transição da fase folicular para a lútea). Embora as variações entre os indivíduos dificultem a identificação da data da ovulação apenas a partir do nível P4, um nível P4 de >8 ng/mL pode ser usado como um indicador aproximado da ocorrência da ovulação. Um indicador mais confiável da data de ovulação é a diminuição do nível de E2 3,17. Oócitos/zigotos ovulados foram de fato observados nos ovidutos no dia da diminuição do E2 (Tabela 4). Assim, a medição de E2 nos permite identificar a data exata da ovulação. Além dos níveis hormonais, a informação sobre o número de dias após a administração de PGF2α é um preditor do dia da ovulação (Tabela 4). Da mesma forma, o uso combinatório dos níveis de P4 e E2 ajuda a identificar o momento da transição para a fase folicular, quando os níveis de P4 diminuem drasticamente e os níveis de E2 estão mais baixos.
Nos saguis, o CG, em vez do LH, é liberado da glândula pituitária para induzir a ovulação. Além disso, o CG é excretado das células trofoblásticas quando os embriões se ligam e se implantam no endométrio. Como os saguis não possuem um gene LH funcional, o CG, em vez do LH, é liberado da glândula pituitária para estimular a ovulação5. Um estudo relatou que os picos de E2 e GC, indicativos de ovulação, são observados no mesmo dia12. Outro estudo relatou que, em média, os picos de E2 (8,6 dias após a administração de PGF2α) precedem os picos de GC (9,3 dias após a administração de PGF2α)25, indicando que a ovulação pode ocorrer antes de atingir os picos de GC. CG, ao contrário de E2, é liberado por pulso pouco antes de seu pico. A liberação de pulso de CG começa, em média, ~ 1 dia antes de seu pico. No entanto, observou-se uma grande variação na duração desde a primeira detecção do nível de CG até a queda do nível de E2 (Figura 3A e Tabela 4). Além disso, o GC é relatado como detectado pela primeira vez nas amostras da manhã e da tarde25.
Até onde sabemos, não há relato de ovulação em saguis ocorrendo em uma determinada hora do dia. Além disso, os saguis geralmente liberam dois ou três oócitos de uma só vez, então pode haver um certo período durante o qual todos os oócitos são liberados. Como o aumento dos níveis de CG ocorre antes da ovulação, a medição do CG permite a previsão da data da ovulação com antecedência. Essas informações são particularmente úteis para a coleta de oócitos MII ou embriões do dia 0 no dia da ovulação. Assim, uma medida combinatória dos níveis sanguíneos de P4/E2 e CG é útil (Figura 3B). Na maioria das espécies de primatas, incluindo humanos, a ovulação não ocorre por um tempo após o parto. No entanto, a ovulação pós-parto ocorre em saguis ~ 10 dias após o parto. Consequentemente, a próxima entrega é frequentemente observada ~ 155 dias após a entrega anterior. Essa gravidez sequencial, juntamente com o parto de gêmeos, resulta em um alto nível de fecundidade nos saguis.
As flutuações hormonais variam entre os indivíduos, e alguns não têm um ciclo constante. Algumas fêmeas de saguis apresentam níveis baixos constantes de P4/E2, o que indica falta de ovulação. A falta de um ciclo ovulatório pode ser atribuída à imaturidade, problemas de saúde, estresse ou inibição da ovulação por fêmeas reprodutivas dominantes26,27. Três dos 21 saguis (>2 anos) que medem os níveis hormonais mostraram a falta de um ciclo ovulatório regular nas instalações do autor. Compreender as causas e desenvolver tratamentos adequados permitirá o uso mais eficaz de animais em experimentos. Indivíduos com uma fase lútea prolongada de ~ 1 mês e um alto nível de P4 associado foram observados2. Nas instalações do autor, uma fase lútea prolongada é repetida nos mesmos indivíduos. Dois dos 21 saguis mostraram essa anormalidade. Um dos dois animais era monoalojado, excluindo a possibilidade de o animal estar prenhe durante a fase lútea prolongada. A outra está emparelhada com um homem presumivelmente infértil por tratamento com radiação e, portanto, é improvável que ela estivesse grávida durante a fase lútea prolongada. Mesmo em uma fase lútea prolongada, a administração de PGF2α reduz o nível de P4 e redefine o ciclo ovariano. Medir os hormônios sexuais e entender o status do ciclo de ovulação ajuda no uso eficaz de animais em experimentos e reprodução.
A amostragem de sangue de indivíduos é usada não apenas para estimativa da data de ovulação, mas também para testes sorológicos para fins de diagnóstico. Da mesma forma, a medição dos níveis hormonais é usada não apenas para estimar o dia da ovulação, mas também para estudar a interação social, o desenvolvimento infantil e as doenças. No futuro, para a fabricação de saguis geneticamente modificados, espera-se o desenvolvimento de ovários e testículos a partir de células iPS. Níveis hormonais adequados devem ser importantes para o desenvolvimento normal. O protocolo descrito aqui será útil para a medição e controle de hormônios sexuais para a fabricação de gônadas derivadas de células iPS em saguis.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Gostaríamos de agradecer a Chunshen Shen, Hiroko Akutsu, Fumiyo Sugiki, Yuuna Hashimoto, Hina Naritomi, Yuuki Sakamoto e Mikiko Horigome por seu apoio no estabelecimento deste protocolo e no cuidado diário dos saguis; Takayuki Mineshige pelos comentários sobre o manuscrito; Yukiko Abe e os membros do laboratório Aiba por compartilhar técnicas de coleta de zigotos; CIEA por compartilhar as informações sobre o alojamento dos saguis e experimentos que eles cultivaram ao longo de 40 anos. Esta pesquisa foi apoiada pela AMED, JST e KAKENHI sob os subsídios nº JP19gm6310010, JP20gm6310010, JP21gm6310010 e JP22gm6310010 (AMED), JPMJPR228B (JST), 20H05764, 20H03177 e 22K18356 (KAKENHI).
Materiais
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
Referências
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados