Method Article
마모셋의 난소 주기의 단계를 결정하기 위한 혈액 샘플링 및 호르몬 측정
요약
이 프로토콜은 난소 주기 단계를 결정하기 위해 프로게스테론/에스트라디올 및 융모성 성선 자극 호르몬 수치를 측정하기 위한 혈액 및 소변 샘플링에 대해 설명합니다. 호르몬 수치는 배란 시기를 예측하고 결정하는 데 사용되며 호르몬은 난소 주기와 난모세포 성장을 조절하기 위해 주입됩니다.
초록
일반적인 마모셋은 작은 신세계 원숭이입니다. 마모셋의 생물학적 메커니즘 중 많은 부분이 인간과 유사하기 때문에 마모셋은 신경 과학, 재생 의학 및 개발과 같은 다양한 분야의 의학 및 인간 생물학 연구에 잠재적으로 유용할 수 있습니다. 그러나 많은 기본 실험 및 절차에 대한 방법을 설명하는 문헌이 부족합니다. 여기에서는 마모셋의 성호르몬(프로게스테론, 에스트라디올, 융모성 성선 자극 호르몬)의 수치를 측정하는 자세한 방법을 설명합니다. 이러한 호르몬의 측정은 난소 주기의 단계를 예측할 수 있게 하며, 이는 일반적으로 마모셋에서 26-30일입니다. 정확한 측정은 정확한 시점에 난모세포/접합체를 수확하고 유전자 변형 마모셋 생성을 위한 숙주 암컷을 준비하는 데 필수적입니다.
또한 성물질 수치 측정은 내분비학, 행동학, 조기 발달 및 생식 생물학 연구에 유용합니다. 이 프로토콜은 대퇴 정맥에서 혈액 채취, 호르몬 측정을 위한 혈장 분리, 소변 및 혈장을 사용한 융모성 성선 자극 호르몬 수치 측정, 주기를 단축 및 동기화하기 위해 프로스타글란딘 F2α 유사체 주사를 사용하여 난소 주기를 재설정하고, 난포 자극 호르몬과 융모성 성선 자극 호르몬을 주입하여 난포 성장 및 배란을 촉진하는 방법에 대한 자세한 설명을 제공합니다. 이러한 프로토콜을 사용하여 난모세포/접합체의 적시 수집을 위해 난소 주기의 단계를 결정할 수 있습니다.
서문
일반적인 마모셋(Callithrix jacchus)은 인간과 유사한 많은 특성을 가진 작은 신세계 원숭이이며 난소 주기의 기간은 26-30일 1,2입니다. 유전자 변형 마모셋의 조기 발달 및 생성에 대한 연구는 난소 주기의 특정 단계에서 난모세포와 접합체를 채취해야 합니다. 따라서 병기의 정확한 측정이 중요하며 프로게스테론(P4) 및 에스트라디올(E2)2,3 호르몬의 혈중 농도를 측정하여 추정할 수 있습니다. 이 호르몬은 착상에 필요한 자궁내막 성장을 촉진합니다. P4는 배란 직후 난소에서 형성되는 황체(corpus luteum)에서 생성됩니다. E2는 뇌의 시상하부-뇌하수체 복합체에서 나오는 난포 자극 호르몬(FSH)에 반응하여 난포에서 분비됩니다. E2 수치는 난포가 성숙함에 따라 증가하여 배란 전에 최고조에 달한다3. 높은 E2 수치는 인간의 시상하부-뇌하수체 복합체를 통해 황체 형성 호르몬(LH)의 펄스 방출을 유발합니다. 이 LH 급증은 배란을 유도합니다. 그러나 마모셋에서 LH 유전자는 진화 과정에서 퇴화를 겪었고, 대신 뇌하수체 4,5에서 LH와 유사한 구조를 가진 융모성 성선 자극 호르몬(CG)의 방출에 의해 배란이 유도됩니다.
난소 주기는 호르몬 주사로 조절할 수 있습니다. 난소 난포자극호르몬(FSH) 주사는 난소 난소 난포자극호르몬(FSH) 수용체에 작용하여 에스트로겐 합성과 난포 성장을 촉진하는 데 사용된다6. 난포 단계가 끝날 때 LH의 대체물로 인간 CG(hCG)를 주입하는 것은 인간의 배란을 자극하는 데 사용된다7. CG 주사는 임신 초기에 황체를 자극하여 P4 생산을 증가시키기 때문에 인간 불임 치료에도 사용됩니다. 프로스타글란딘 F2α(PGF2α) 주사는 난소 주기를 재설정한다8. 가축의 경우 PGF2α 주사를 사용하여 황체기를 단축하고 생식 관리를 위해 발정 주기를 동기화합니다.
마모셋과 인간은 유사한 생물학적 메커니즘을 가지고 있어 이상적인 모델 동물이 되지만, 자주 사용되는 많은 기술에 대한 기본 방법을 설명하는 문헌이 부족합니다. 혈액 채취는 가장 자주 사용되는 기술중 하나입니다 9,10,11,12. 그러나 초보자는 때때로 정맥을 찾는 데 어려움을 겪습니다. 따라서 본 연구는 대퇴 정맥 부위의 해부학적 분석을 수행하였다. 해부학적 관찰을 바탕으로 이 프로토콜은 대퇴골 삼각형의 근위 영역을 정맥 천자를 위한 쉬운 부위로 소개합니다.
프로토콜
마모셋과 관련된 모든 방법은 높은 윤리 및 복지 기준을 활용했으며 국립 아동 건강 발달 센터(National Center for Child Health and Development)의 기관 동물 보호 및 사용 위원회(Institutional Animal Care and Use Committee)의 승인을 받았습니다. 여기에 사용 된 동물은 하루에 12 시간의 빛이있는 단일 주택 또는 쌍 주택 (암컷 1 마리와 남성 1 마리)이었습니다.
1. 대퇴 정맥의 혈액 채취
- 1m L의 주사기(짧은 타입은 사용하기 쉽다)를 25G 바늘이 칼날이 위로 향하게 부착하여 준비합니다. 혈액이 막히는 것을 방지하려면 희석되지 않은 헤파린 나트륨 용액 200μL를 주사기에 끌어들여 주사기를 헤파린화합니다. 주사기 내부를 여러 번 위아래로 당겨 고르게 코팅합니다. 그런 다음 주사기에서 헤파린 용액을 배출합니다.
알림: 새 주사기로 교체해야 하는 경우가 많으므로 몇 가지 추가 헤파린 주사기를 준비하십시오. - 흡수성 면봉과 알코올 면봉을 준비합니다. 조정 가능한 램프를 켜서 혈액 샘플링을 위해 마모셋을 놓을 영역을 비춥니다.
- 시중에서 판매되는 구속 장치(420 x 85 x 85mm, 그림 1A)를 준비합니다(자세한 내용은 재료 표 참조). 마모셋을 장치에 넣으려면 마모셋을 고정하는 스폰지 벨트로 고정 부분을 엽니다. 마모셋을 위로 향하게 하여 구속 장치에 삽입합니다.
알림: 마모셋은 일반적으로 구속 장치에서 침착하며, 이는 구속 적응 또는 훈련의 필요성을 무효화할 수 있습니다. - 마모셋을 포획하십시오. 마모셋을 원통형 부분에 삽입하십시오. 스펀지 벨트를 눌러 고정합니다. 혈액을 채취할 다리를 다른 다리 위에 놓습니다(그림 1A). 자주 사용하지 않는 손을 사용하여 다리를 잡습니다. 가운데 손가락과 약지를 양쪽 다리 안쪽에 넣어 고정하고 다른 손가락을 양쪽 다리 바깥쪽에 넣어 고정합니다.
알림: 마모셋을 포획할 때는 바이트 장갑을 착용하는 것이 좋습니다. 구속 장치가 없는 경우 마취 하에 또는 마모셋을 제지하는 다른 사람과 함께 혈액 채취를 수행하십시오. - 허벅지 기저부 근처에 대퇴 정맥이 보이는지 확인하십시오. 그렇지 않은 경우 촉진하여 맥동하는 동맥을 찾고 이를 이정표로 사용하여 정맥이 동맥 내부로 흐르는지 확인합니다(그림 1B-D).
알림: 책상 조명과 머리 면도는 가시성을 높이기 위해 권장됩니다. 알코올 면봉으로 문질러 가시성을 향상시킬 수도 있습니다. 삼각형의 림프절은 종종 정맥에 가깝게 위치하며 정맥으로 짙은 파란색을 나타냅니다. 이를 구별하는 방법은 대표 결과 섹션에 설명되어 있습니다. - 알코올 면봉을 사용하여 천자 부위를 소독합니다. 바늘 날이 위로 향하게 15°-20° 각도로 삽입합니다. 채취 중에 바늘이 혈관 밖으로 미끄러지는 것을 방지하기 위해ample, 주사기를 잡은 손을 다른 손에 올려 놓음으로써 안정시킵니다.
- 플런저를 부드럽게 뒤로 당겨 음압을 가합니다(그림 1E). 바늘 끝을 앞으로 밉니다. 혈액이 주사기에 들어가면 필요한 부피(500-700μL)가 수집될 때까지 바늘 끝의 위치를 유지합니다.
- 혈액이 주사기에 들어가지 않으면 천자 부위를 변경하십시오. 바늘을 뽑았을 때 피가 나오면 천자 부위에 3분 동안 압력을 가하여 출혈을 멈춥니다. 출혈을 멈춘 후 정맥 천자를 다시 시작하십시오.
- 채취 과정에서 주사기로 뽑히는 혈액이 흐르지 않으면 바늘 끝을 천천히 앞으로 밀었다가 뒤로 당겨 혈관을 찾습니다. 이렇게 하면 주사기로 들어가는 혈액의 흐름이 복원될 수 있습니다. 그렇지 않은 경우 바늘을 뽑고 새 주사기를 사용하여 정맥 천자를 수행합니다.
알림: 같은 쪽에서 혈액을 채취하기 어려운 경우 다른 쪽 다리의 허벅지를 사용하십시오.
- 새끼 손가락으로 천자 부위를 가볍게 누르면서 바늘을 조심스럽게 빼냅니다. 그런 다음 흡수성 면봉을 사용하여 즉시 천자 부위에 3분 동안 압력을 가하여 출혈을 멈춥니다. 혈액과 헤파린을 섞기 위해 주사기를 뒤집습니다.
알림: 동맥혈을 뽑을 때 냉각하면서 더 오랜 시간(5분) 동안 압력을 가하고 때때로 치명적인 결과를 초래할 수 있는 혈종 형성을 방지하기 위해 출혈 소멸을 주의 깊게 확인하십시오. - 출혈이 멈춘 것을 확인한 후 스펀지 벨트를 제거하고 한 손으로 동물의 허리를 잡고 다른 손으로 동물의 겨드랑이를 잡을 수 있도록 동물을 회전시킵니다.
- 마모셋을 우리로 되돌려 놓습니다. 스트레스를 줄이고 반복적인 혈액 채취를 용이하게 하려면 마모셋에게 좋아하는 음식(예: 비스킷, 마시멜로 또는 스폰지 케이크)을 제공하십시오. 혈종의 발생을 수시로 확인하십시오.
알림: 초기에 혈종이 발견되면 혈종의 진행을 방지하기 위해 압박 붕대를 감습니다. 오랜 시간이 지난 후에 발견되면 대퇴 동맥 결찰술과 수혈을 통한 혈종의 외과적 제거가 필요할 수 있습니다 9,13. - 용혈을 방지하기 위해 주사기에서 바늘을 분리합니다. 그런 다음 1.5mL 마이크로튜브의 내벽을 따라 수집된 혈액을 천천히 배출합니다.
알림: 수집된 혈액은 P4/E24 수치를 측정하기 위해 혈장 분리 전에 최대 4시간 동안 2 °C에서 보관할 수 있습니다.
2. 혈장 분리 및 호르몬 수치 측정
- 1.5mL 튜브에 1,100× g 의 혈액을 넣고 4 °C에서 5분 동안 원심분리합니다.
- 1.5mL 튜브에서 분리된 혈장(상층액)을 새 튜브/컵으로 옮기고 혈액 세포(침전물)가 포함되지 않도록 주의합니다.
- ELISA 키트 또는 자동 분석기를 사용하여 P4 및 E2 수준을 측정합니다. 혈장의 양이 자동 분석기에 충분하지 않은 경우 시료 희석 용액을 사용하십시오.
참고: 자동 분석기를 사용한 측정의 경우 P4 수준만 측정하려면 >175μL의 플라즈마가 필요하고 P4 및 E2를 모두 측정하려면 >250μL의 플라즈마가 필요합니다.
3. 배란과 임신을 감지하기 위한 소변 CG 측정
참고: 마모셋의 CG 수치는 배란과 임신 모두에 대해 면역크로마토그래피 키트 테스트를 사용하여 측정할 수 있습니다. 배란의 경우 배란 0-2일 전에 양성 결과를 얻을 수 있습니다. 임신의 경우 임신 15-20일에서 대략 100일째까지 양성 결과가 감지됩니다. 이 검사에는 소량(90μL)의 소변이 필요합니다(소변 한 방울은 ~30μL).
- 트레이 방법: 두 마리 이상의 동물이 동일한 케이지에 있는 경우 대상 마모셋(또는 다른 동물)을 전날 다른 케이지로 옮깁니다. 불을 켜기 전이나 전날 밤에 케이지 바닥에 깨끗한 트레이를 놓습니다. 밤에는 방광에서 소변이 배출되지 않습니다. 따라서 소변은 일반적으로 조명 직후에 방광에서 배출됩니다.
알림: 아침에 조명이 켜지기 전에 방에 들어가면 코호트의 수면 주기를 방해할 수 있습니다. 소변은 일반적으로 조명 후 약 30분 이내에 수집될 수 있습니다. - 짜는 방법: 소변 채취를 위해 세척된 트레이를 준비합니다. 마모셋의 방광을 찾은 후 손가락 전체 길이를 사용하여 앞쪽과 양쪽에서 조심스럽게 짜냅니다(그림 1F). 아침에 방을 밝히기 직전에 소변을 채취하십시오.
알림: 방광에 소변이 없어 소변 채취에 실패하면 잠시 기다렸다가 다시 시도하십시오. 동물이 다칠 수 있으므로 과도한 힘을 가하지 않도록 주의하십시오. - 채취 직후 소변 샘플을 면역크로마토그래피 테스트 키트의 웰에 넣습니다. 제조업체의 지침에 따라 10분 후에 결과를 읽으십시오.
4. 난모세포, 접합체 및 배아 채취를 위한 난소 주기 단계의 제어 및 결정
- 생식 소포(GV): 난소에서 난모세포 수집
- 150μL의 식염수14 에 희석한 0.263mg/mL 클로프로스테놀(합성 PGF2α 유사체) 3μL의 근육 주사를 투여하여(그림 2) 황체기 말기(즉, 황체기 시작 후 ≥10일 후)에 난소 주기를 재설정합니다.
참고: 희석된 클로프로스테놀은 +4°C에서 최소 몇 주 동안 안정적으로 유지되므로 희석된 용액을 더 큰 부피로 만드는 것이 편리할 수 있습니다. - 다음날(1일차)에 P4 수치가 떨어졌는지 확인하여 난포기의 시작을 확인합니다.
참고: 클로프로스테놀 주사는 24시간 이내에 P4 수치(보통 <10ng/mL)를 극적으로 감소시키는 것으로 보고되었습니다3. - 1일차부터 FSH(25IU, 근육주사)를 2일에 한 번씩 총 5회(1일, 3일, 5일, 7일, 9일)에 주사합니다. 10일째 되는 날, 오후에 hCG(75 IU, 근육주사)를 주사합니다.
- 문헌11에 따라 마취하에 여포 흡인으로 난소에서 GV를 수집합니다 15,16.
참고: 때때로 배란이 예상보다 일찍 발생합니다. 따라서 8일째부터 CG 레벨을 확인하는 것이 좋습니다. CG 검사에서 양성이 나오면 당일 GV 채취를 실시합니다.
- 150μL의 식염수14 에 희석한 0.263mg/mL 클로프로스테놀(합성 PGF2α 유사체) 3μL의 근육 주사를 투여하여(그림 2) 황체기 말기(즉, 황체기 시작 후 ≥10일 후)에 난소 주기를 재설정합니다.
- metaphase II (MII) 난모세포, 접합체 및 초기 배아 수집
- 4.1.1단계에서 설명한 대로 클로프로스테놀을 사용하여 난소 주기를 재설정합니다.
- 다음날(1일차)에 P4 수치가 떨어졌는지 확인하여 난포기의 시작을 확인합니다.
- 접합체와 배아를 수집하기 위해 암컷 마모셋을 수컷 마모셋과 함께 수용하여 6일째부터 짝짓기를 합니다.
- 7일째부터 암컷의 혈액 P4/E2 수치와 소변 CG 수치를 확인합니다. CG의 검출은 며칠 이내(보통 다음날) 배란의 징후입니다. 전날에 비해 P4 수치가 증가하고 E2 수치가 감소하는 날, 난관17,18에서 MII 난모세포 또는 배아 0일(E0) 접합체를 수집합니다.
- 배아 채취를 위해 문헌에 설명된 바와 같이 표적 단계에 따라 적절한 시점에 난관(E1-E3, 1-8 세포)17,18 또는 자궁(E5-E10, 8 세포-배반포)19,20,21,22에서 세척을 수행합니다.
결과
본 연구에서 사용된 동물에 대한 자세한 내용은 표 1에 기재되어 있다.
대퇴 정맥의 해부학적 분석
대퇴 정맥의 해부학적 분석은 안락사를 받는 2세 수컷 커먼 마모셋(I 7713M)을 사용하여 수행되었습니다. 대퇴 정맥과 동맥은 대퇴 삼각형에 있습니다. 대퇴 삼각형은 복벽과 허벅지 근육 사이의 경계에 형성됩니다(그림 1B-D). 허벅지 기저부에는 큰 정맥이 역삼각형의 중심을 통과하고 동맥이 정맥 바깥쪽에 평행하게 뻗어 있습니다. 아래쪽 부위에서는 정맥과 동맥이 더 얇아지고 겹치며 동맥은 정맥 위에 위치합니다(그림 1D).
혈액 채취를 위해 정맥을 대상으로 해야 하는데, 동맥 손상은 대퇴 동맥 혈종을 유발할 수 있으며, 출혈이 심할 경우 심혈관 쇼크를 유발할 수 있기 때문에 정맥을 대상으로 해야 한다13. 혈액은 삼각형의 정맥과 원위 부위의 정맥 어느 부분에서나 채취할 수 있지만, 정맥의 크기가 크고 동맥과 거의 겹치지 않는 것처럼 보이기 때문에 대퇴 삼각형의 근위 부위에서 정맥 천자를 받는 것이 권장됩니다. 또한 근위 부위의 정맥은 표재성이므로 바늘을 사용하여 쉽게 위치를 찾을 수 있습니다. 대퇴 삼각형의 동맥은 맥박이 뛰기 때문에 때때로 시각적으로 또는 촉진으로 식별되며 정맥은 그 바로 내측을 따라 흐릅니다. 따라서 동맥 맥동을 관찰하면 정맥의 위치를 예측하는 데 도움이 됩니다.
또한, 정맥을 나타내는 파란색은 일반적으로 삼각형 상단의 피부 아래에서 관찰됩니다(그림 1B,C). 그러나 삼각형의 림프절은 정맥에 가깝게 위치하는 경우가 많고 짙은 파란색을 띠기 때문에 모양이 비슷합니다. 다행히도, 그들은 그들의 이동성에 의해 구별 될 수 있습니다 : 정맥은 고정되어 있고 림프절은 움직일 수 있습니다. 따라서 동맥의 맥박과 정맥의 푸른 색은 정맥을 찾는 데 사용되는 두 가지 주요 단서이지만 시각화하기 위해 머리카락을 면도해야 할 수도 있습니다.
난소 주기의 단계 결정
P4 및 E2 수치는 여포 및 황체기의 지속 기간을 조사하기 위해 6마리의 암컷 마모셋(1세에서 3세에 이르기까지)에서 모니터링되었습니다. 그 결과, 여포기와 황체기의 평균 지속 기간은 각각 11.58일(4개의 마모셋에서 n=6)과 16.8일(3개의 마모셋에서 n=5)로 나타났다(표 2). 다음에서는 6 개의 마모셋 중 하나 (I6751F, 3 세)의 P4 및 E2 역학에 대해 자세히 설명합니다. 이 동물에서 혈액 샘플링 및 호르몬 측정은 38일 동안 몇 일마다 수행되었습니다(표 3).
황체기(1-10일)
측정 시작일은 1일로 설정되었습니다. P4 수치(21ng/mL)에 근거하여, 이 동물은 황체기에 있었을 가능성이 높습니다. 1일에서 10일까지(≥21ng/mL) 높은 P4 수치가 관찰되었으며, 이는 황체기를 시사합니다. 12일째에는 4ng/mL로 급격히 떨어졌습니다. 이 현저한 감소는 황체기에서 난포기로의 전환을 나타냅니다. E2 수치가 10일째(241ng/mL)에서 12일(189ng/mL)로 감소한 것도 이러한 전환을 뒷받침했습니다.
난포기(12-22일)
난포기로 전환한 후 P4 수치는 19일까지 낮음(4-6ng/mL)을 유지하다가 19일째부터 24일째까지 약간 증가했습니다(19일째, 6ng/mL, 22일째, 8ng/mL, 24일째, 9ng/mL). 대조적으로, E2 수치는 19일째(94ng/mL)에서 22일(322ng/mL)로 유의하게 증가한 후 22일째(158ng/mL)로 감소했습니다. P4 증가와 E2 수치 감소를 바탕으로 배란은 난포기에서 황체기로 전환되는 22일에서 24일 사이에 발생한 것으로 예측되었습니다.
황체기(24-36일)
배란 후 P4 수치는 36일까지 높게 유지되다가 38일째에 3ng/mL로 떨어졌습니다. 따라서 황체기에서 난포기로의 전환은 36-38일 사이에 발생했을 가능성이 높습니다. 이러한 전환과 일관되게 이 기간 동안 E2 수치가 감소했습니다(36일, 2517ng/mL, 38일, 73ng/mL).
배란 시기의 예측 및 결정
소변 CG 수치와 배란일 사이의 관계를 조사하기 위해 7개의 마모셋(No. 1-7)을 준비했습니다. 배란 주기(0일)를 재설정하기 위해 클로프로스테놀을 주사했습니다. 그런 다음 7일째부터 혈액 P4/E2 수치와 소변 CG 수치를 모니터링했습니다. 점화 후 즉시 소변을 채취했습니다. 혈액 채취는 기본적으로 아침에 수행되었습니다. 배란은17일 보고된 바와 같이 전날에 비해 E2 수치가 크게 떨어졌을 때 발생하는 것으로 추정되었습니다. 그날 실제로 난소 표면에서 난포 파열이 관찰되었고, 난관에 접합체/난모세포가 존재함이 확인되었습니다(표 4).
CG는 7일째 내지 11일째(7일째, N=1일, N=2일, 9일째, N=1일, 10일째, N=2일, 11일째, N=1)에 처음으로 검출되었다(표 4). E2 수준(배란 표시)의 큰 감소는 첫 번째 CG 신호 후 0-3일 후에 관찰되었습니다. 첫 번째 CG 검출부터 E2 감소까지의 기간은 첫 번째 CG 검출이 더 일찍 이루어졌을 때 더 긴 것으로 보입니다(그림 3A). 예를 들어, 한 동물(No. 1)은 첫 번째 CG 검출 후 7일째에 E2 신호의 감소를 보여주었습니다(표 4). 대조적으로, 첫 번째 CG 검출과 E2 신호의 강하의 동시 발생은 10일째에 한 동물(2번)에서 관찰되었습니다. 따라서, 비록 첫 번째 CG 검출과 배란이 5마리의 동물 중 하나에서 같은 날에 관찰되었지만, 배란은 CG의 첫 번째 검출 후 몇 일 이내에 일어났다.
마모셋 CG용 면역크로마토그래피 테스트 키트는 검사에 소변을 사용하도록 설계되었습니다. CG 수치 검사는 일반적으로 혈장을 사용하여 P4/E2 수치를 측정하는 데 수반됩니다. CG 검사에는 소변 대신 혈장을 사용할 수 있다면 도움이 될 것입니다. 이를 시험하기 위해 위의 실험에서 P4/E2 수치 측정 후 남은 혈장을 검사하였다. 혈장 및 소변은 상기 실험의 어느 날이든 4마리의 동물로부터 수집하였다(검사 날짜는 표 4에서 이중 별표[**]로 표시하였다). 소변을 사용하여 4마리 중 2마리는 양성 결과(점수 5 및 3)를 보였고 다른 2마리는 음성 결과(점수 1)를 보였습니다. 혈장은 소변과 본질적으로 동일한 결과를 보여주었습니다(그림 3B). 더 강한 신호는 혈장을 사용하여 얻었습니다. 따라서 혈장을 사용할 때는 소변으로 설정된 10분 전에 판단을 내려야 합니다.
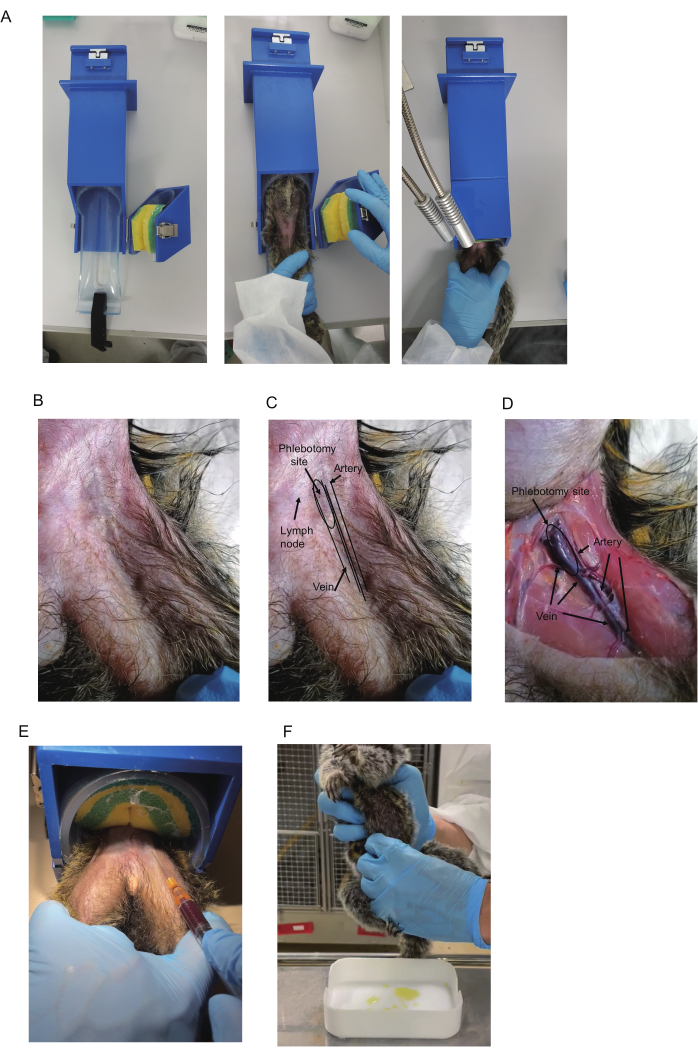
그림 1: 마모셋의 혈액 채취. (A) 혈액 채취에는 억제제가 사용됩니다. (B) 마모셋 허벅지 위쪽. (C) 대퇴골 삼각형과 혈관. 삼각형의 대퇴 동맥은 종종 볼 수 있으며 맥동을 보여줍니다. 대퇴 정맥의 파란색은 때때로 삼각형의 근위 영역(정맥 절개 부위로 표시됨)에서 볼 수 있습니다. 림프절도 파란색을 띱니다. 그러나 림프절은 림프절이 피부에 붙어 있기 때문에 움직일 수 있습니다. (D) 안락사된 동물의 허벅지의 해부학적 모습. 동맥, 정맥 및 정맥 절개술 부위가 표시됩니다. B-D에도 같은 동물이 표시되어 있습니다. (E) 구속구를 사용한 채혈. 마모셋의 다리를 잡고 있는 자세와 피를 뽑는 모습이 보인다. (F) 마모셋에서 소변 채취. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
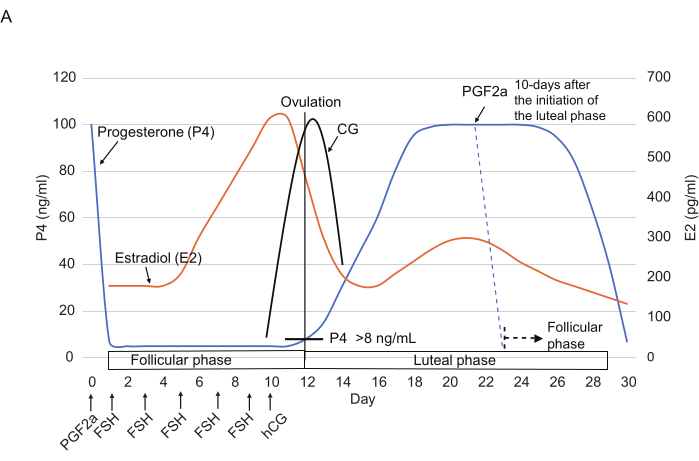
그림 2: 마모셋의 난소 주기 동안 P4, E2 및 CG 수준의 일반적인 패턴. FSH, hCG 및 PGF2α 주입 시점이 표시됩니다. 점선은 PGF2α 주입 후 예상되는 호르몬 패턴을 보여줍니다. 약어: P4 = 프로게스테론; E2 = 에스트라디올; CG = 융모성 성선 자극 호르몬; FSH = 난포 자극 호르몬; hCG = 인간 융모성 성선 자극 호르몬; PGF2α = 프로스타글란딘 F2α. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
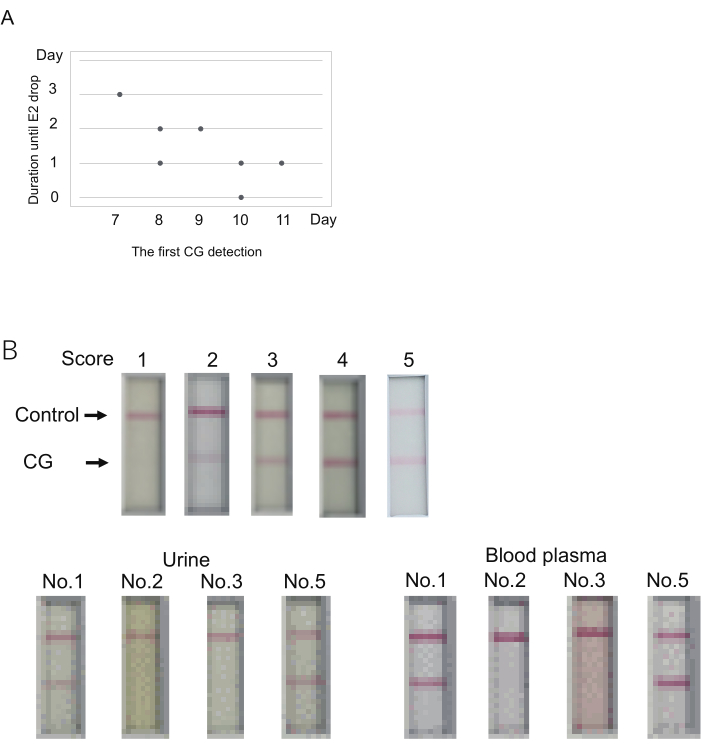
그림 3: 배란 발생을 예측하기 위한 CG 수치 측정. (A) CG 검출 첫날(점수 > 1)과 배란까지의 기간(E2 드롭) 사이의 가능한 관계. (B) 혈장은 면역크로마토그래피 CG 검사에 사용할 수 있습니다. 각 점수의 대표 결과(상단). 점수는 샘플 로딩 10분 후에 결정되었습니다. 점수 2는 5분 이내에 밴드가 없지만 10분 이내에 밴드가 나타나는 것을 나타냅니다. 혈액 채취는 소변 채취 직후에 수행되었습니다. 4개의 마모셋( 표 S4의 1, 2, 3, 5번)을 검사하였다. 여기에 사용된 샘플은 표 4에 이중 별표로 표시되어 있습니다. 혈장을 E2 측정에 사용된 희석 완충액에 의해 50%로 희석하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 본 연구에 사용된 동물. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 여포기 및 황체기의 기간. 상은 P4 수준(소낭선기 P4 ≤ 8, 황체기 P4 > 8)에 기초하여 결정하였다. 측정 사이에 위상 변화가 관찰되었을 때, 측정 날짜 사이의 중간점이 변화점으로 결정되었습니다. 두 변화점 사이의 기간은 여포기 또는 황체기로 간주되었습니다. 단일 단계의 기간 측정을 보장하기 위해 두 단계에 걸친 경우를 포함하여 동일한 단계에서 긴(≥7일) 간격 또는 두 번 ≥6일 간격으로 데이터를 분석에 사용하지 않았습니다. 동일한 단계에서 두 번의 측정이 수행된 경우에만 데이터가 사용되었습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 마모셋 1개에서 38일 동안의 P4 및 E2 측정 결과.이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: 배란일의 결정 및 예측. 배란의 흔적은 난소에서 출혈 부위나 파열 부위가 관찰되는 경우 존재하는 것으로 간주되었습니다. 난모세포/접합체는 E2 낙하 당일 난관에서 얻은 난모세포/접합체의 단계를 나타냅니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
정맥을 찾는 것은 혈액 채취에서 가장 중요한 단계입니다. 해부학적 관찰을 바탕으로 이 프로토콜은 마모셋의 혈액 채취를 위한 쉬운 장소로 대퇴골 삼각형의 근위 영역을 소개합니다. 이 영역을 사용하면 큰 정맥에서 혈액 샘플링을 쉽게 수행할 수 있습니다. 그러나 이 프로토콜을 사용하더라도 동맥 손상이 발생하는 경우가 있습니다. 동맥을 다쳤을 때는 혈종을 예방하기 위해 >5분 동안 압력을 가하여 출혈을 완전히 멈추는 것이 좋습니다. 또, 압력을 가하면서 얼음 조각을 사용하여 반점 부위를 냉각시키는 것도 효과적입니다. 혈종은 헤파린(예: Tensolvet 5.000 I.E. 겔)으로 치료할 수 있습니다. 대부분의 혈종은 헤파린과 0.05mL의 멜록시캠(0.5mg/mL, p.o.)으로 3-4일 연속 치료하면 사라집니다. 동맥은 허벅지의 근위 영역에서 정맥까지 측면으로 이어집니다. 말단 부위에서는 정맥과 동맥이 서로 더 가깝게 보였고 동맥이 정맥의 복부에 위치하여 더 많이 겹쳤습니다. 이러한 위치 관계에 기초하여, 허벅지의 근위 부위에서 혈액 채취를 하면 동맥 손상의 위험이 감소할 가능성이 있습니다.
또한 근위부의 대퇴 정맥은 두껍고 표면적으로 위치하여 바늘을 사용하여 쉽게 위치를 찾을 수 있습니다. 그러나 말단 부위에서 혈액을 채취하면 근위 부위를 그대로 두어 혈액 채취 중 정맥이 손상된 경우에도 동일한 다리의 근위 부위에서 즉시 반복적인 정맥 천자를 할 수 있다는 장점이 있습니다. 이는 손상된 부위의 말단 부위가 일반적으로 즉각적인 정맥 천자를 할 수 없기 때문입니다. 그러나 혈액 채취에 실패하면 다른 쪽 다리의 근위 부위에서 반복적인 샘플링을 수행할 수 있습니다.
마모셋의 순환 혈액 부피는 ~25mL(70mL/kg)23입니다. 350g의 마모셋은 2mL 혈액 샘플링 후 회복하는 데 1주일이 소요되며, 이는 전체 혈액량6의 7.5%에 해당한다. 대퇴 정맥에서 500-700 μL의 혈액을 어려움없이 수집 할 수 있습니다. 반복 샘플링이 필요한 경우 더 적은 양의 혈액을 채취하고 자동 분석기에 희석 완충액을 사용하는 것이 좋습니다.
마취는 일반적으로 혈액 샘플링에 사용되지 않지만 초보자의 경우 마취된 동물의 혈액 샘플링이 깨어 있는 동물보다 훨씬 쉬울 수 있습니다. 그러나 혈액 샘플링을 위해 마취를 사용할 때는 마취가 혈액 성분의 측정값에 영향을 미칠 수 있으므로 주의가 필요합니다. 난소 주기의 단계를 결정하기 위한 호르몬 측정과 관련하여, 알팍살론은 P424의 수치를 예상외로 더 높게 초래하는 것으로 보고되었다. 이는 P4 유도체인 알팍살론에 대한 항-P4 항체의 교차 반응에 의해 발생했습니다.
P4 및 E2 (스테로이드 호르몬)의 구조는 인간과 마모셋 사이에서 동일합니다. 따라서 인간 P4 및 E2용 상용 ELISA 키트는 마모셋 P4 및 E2에 사용할 수 있습니다. 인간 혈액 호르몬 측정을 위한 외주 서비스도 이용할 수 있습니다. 대조적으로, FSH, CG 및 Inhibin과 같은 폴리펩티드 호르몬에 대한 아미노산 서열에는 약간의 차이가 있습니다. 이러한 폴리펩티드 호르몬의 경우, 키트가 인간과 생쥐와 같은 다른 진화적 먼 종 모두에게 사용될 수 있다면 마모셋에도 효과가 있을 것입니다. Inhibin B 측정을 위해 Human/Mouse/Rat Inhibin B(Beta B subunit) 효소 면역분석 키트를 사용할 수 있습니다.
P4 수치의 증가는 배란(난포기에서 황체기로의 전환)의 특징입니다. 개인차에 따라 P4 수치만으로는 배란 날짜를 정확히 파악하기 어렵지만, >8ng/mL의 P4 수치를 배란 발생의 대략적인 지표로 사용할 수 있습니다. 배란일에 대한 보다 신뢰할 수 있는 지표는 E2 수준 3,17의 감소입니다. 배란된 난모세포/접합체는 실제로 E2 감소 당일 난관에서 관찰되었습니다(표 4). 따라서 E2를 측정하면 정확한 배란 날짜를 찾아낼 수 있습니다. 호르몬 수치 외에도 PGF2α 투여 후 일수에 대한 정보는 배란일을 예측하는 변수입니다(표 4). 마찬가지로, P4 및 E2 수치를 조합하여 사용하면 P4 수치가 급격히 감소하고 E2 수치가 가장 낮을 때 난포기로의 전환 시기를 식별하는 데 도움이 됩니다.
마모셋에서는 LH 대신 CG가 뇌하수체에서 방출되어 배란을 유도합니다. 또한 CG는 배아가 자궁내막에 부착되어 착상할 때 영양세포에서 배설됩니다. 마모셋은 기능적 LH 유전자가 없기 때문에 LH 대신 CG가 뇌하수체에서 분비되어 배란을 자극한다5. 한 연구에 따르면 배란을 나타내는 E2 및 CG 피크는12일 같은 날에 관찰됩니다. 또 다른 연구에서는 평균적으로 E2 피크(PGF2α 투여 후 8.6일)가 CG 피크(PGF2α 투여 후 9.3일)보다 선행한다고 보고했으며25 이는 CG 피크에 도달하기 전에 배란이 발생할 수 있음을 나타냅니다. CG는 E2와 달리 피크 직전에 펄스 방출됩니다. CG의 펄스 방출은 평균적으로 피크 ~ 1 일 전에 시작됩니다. 그러나 CG 레벨의 첫 번째 검출부터 E2 레벨의 강하까지 지속 시간에 큰 차이가 관찰되었습니다(그림 3A 및 표 4). 또한, CG는 오전과 오후 시료 모두에서 처음으로 검출되는 것으로 보고되었다25.
우리가 아는 한, 마모셋의 배란이 하루 중 특정 시간에 발생한다는 보고는 없습니다. 또한, 마모셋은 보통 한 번에 2개 또는 3개의 난모세포를 방출하기 때문에 모든 난모세포가 방출되는 일정 기간이 있을 수 있습니다. CG 수치 증가는 배란 전에 발생하기 때문에 CG 측정을 통해 배란일을 미리 예측할 수 있습니다. 이러한 정보는 배란일에 MII 난모세포 또는 0일 배아를 수집하는 데 특히 유용합니다. 따라서 혈액 P4/E2 수치와 CG 수치를 조합하여 측정하는 것이 유용합니다(그림 3B). 인간을 포함한 대부분의 영장류 종에서는 출산 후 한동안 배란이 일어나지 않습니다. 그러나 산후 배란은 마모셋에서 출산 후 ~10일 후에 발생합니다. 결과적으로, 다음 출산은 종종 이전 출산 후 ~ 155 일 후에 관찰됩니다. 이 순차적 임신은 쌍둥이의 출산과 함께 마모셋에서 높은 수준의 번식력을 가져옵니다.
호르몬 변동은 개인마다 다르며 일부는 일정한 주기가 없습니다. 일부 암컷 마모셋은 지속적으로 낮은 P4/E2 수치를 보이는데, 이는 배란이 부족함을 나타냅니다. 배란 주기의 부족은 미성숙, 건강 문제, 스트레스 또는 우성 생식 여성에 의한 배란 억제에 기인할 수 있습니다26,27. 호르몬 수치를 측정한 21마리의 마모셋(>2세) 중 3마리는 저자의 시설에서 규칙적인 배란 주기가 없는 것으로 나타났다. 원인을 이해하고 적절한 치료법을 개발하면 동물을 실험에 보다 효과적으로 사용할 수 있습니다. 황체기가 ~1개월로 연장되고 이와 관련된 높은 P4 수치가 관찰된 개체가관찰되었다 2. 저자의 시설에서는 동일한 개체에서 장기간의 황체기가 반복됩니다. 21 개의 마모셋 중 2 개가 이러한 이상을 보였다. 두 마리 중 한 마리는 단독으로 사육되었는데, 이 동물이 황체기가 연장되는 동안 임신했을 가능성은 배제되어 있었다. 다른 한 명은 방사선 치료에 의해 불임으로 추정되는 남성과 짝을 이루고 있었기 때문에, 그녀는 장기간의 황체기 동안 임신했을 가능성이 없다. 황체기가 길어진 경우에도 PGF2α 투여는 P4 수치를 낮추고 난소 주기를 재설정합니다. 성 호르몬을 측정하고 배란 주기 상태를 이해하면 실험과 번식에 동물을 효과적으로 사용하는 데 도움이 됩니다.
개인의 혈액 채취는 배란일 추정뿐만 아니라 진단 목적의 혈청학적 검사에도 사용됩니다. 마찬가지로, 호르몬 수치 측정은 배란일을 추정하는 것뿐만 아니라 사회적 상호 작용, 아동 발달 및 질병을 연구하는 데에도 사용됩니다. 미래에는 유전자 변형 마모셋을 만들기 위해 iPS 세포에서 난소와 고환을 개발할 것으로 예상됩니다. 적절한 호르몬 수치는 정상적인 발달에 중요합니다. 여기에 설명된 프로토콜은 마모셋에서 iPS 세포 유래 생식선을 만들기 위한 성호르몬의 측정 및 제어에 유용할 것입니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 프로토콜을 수립하고 마모셋의 일상적인 관리를 지원해 주신 Chunshen Shen, Hiroko Akutsu, Fumiyo Sugiki, Yuuna Hashimoto, Hina Naritomi, Yuuki Sakamoto, Mikiko Horigome에게 감사드립니다. Takayuki Mineshige는 원고에 대한 의견을 제공합니다. Yukiko Abe와 Aiba lab의 구성원들은 접합체 수집 기술을 공유합니다. CIEA는 40년 동안 키워온 마모셋 주택과 실험에 대한 정보를 공유합니다. 이 연구는 보조금 번호 JP19gm6310010, JP20gm6310010, JP21gm6310010 및 JP22gm6310010(AMED), JPMJPR228B(JST), 20H05764, 20H03177 및 22K18356(KAKENHI)의 보조금 번호에 따라 AMED, JST 및 KAKENHI의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
참고문헌
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유