Method Article
Prelievo di sangue e misurazione ormonale per determinare lo stadio del ciclo ovarico negli uistitì
In questo articolo
Riepilogo
Questo protocollo descrive il campionamento di sangue e urine per misurare i livelli di progesterone/estradiolo e gonadotropina corionica per determinare la fase del ciclo ovarico. I livelli ormonali vengono utilizzati per prevedere e determinare i tempi dell'ovulazione e gli ormoni vengono iniettati per regolare il ciclo ovarico e la crescita degli ovociti.
Abstract
Gli uistitì comuni sono piccole scimmie del Nuovo Mondo. Poiché molti dei loro meccanismi biologici sono simili a quelli degli esseri umani, gli uistitì sono potenzialmente utili per la ricerca medica e di biologia umana in una vasta gamma di campi, come le neuroscienze, la medicina rigenerativa e lo sviluppo. Tuttavia, c'è una mancanza di letteratura che descriva i metodi per molti esperimenti e procedure di base. Qui vengono descritti metodi dettagliati per determinare i livelli di ormoni sessuali (progesterone, estradiolo e gonadotropina corionica) negli uistitì. La misurazione di questi ormoni consente di prevedere la fase del ciclo ovarico, che in genere è di 26-30 giorni negli uistitì; Una determinazione accurata è essenziale per il prelievo di ovociti/zigoti al momento giusto e per la preparazione delle femmine ospiti per la generazione di uistitì geneticamente modificati.
Inoltre, la misurazione dei livelli di ormoni sessuali è utile per gli studi di endocrinologia, etologia, sviluppo precoce e biologia riproduttiva. Questo protocollo fornisce una descrizione dettagliata dei metodi per il prelievo di sangue dalla vena femorale, la separazione del plasma per la misurazione ormonale, la misurazione dei livelli di gonadotropina corionica utilizzando urina e plasma, il ripristino del ciclo ovarico utilizzando iniezioni di un analogo della prostaglandina F2α per abbreviare e sincronizzare il ciclo e promuovere la crescita follicolare e l'ovulazione iniettando l'ormone follicolo-stimolante e la gonadotropina corionica. Utilizzando questi protocolli, è possibile determinare le fasi del ciclo ovarico per la raccolta tempestiva di ovociti/zigoti.
Introduzione
L'uistitì comune (Callithrix jacchus) è una piccola scimmia del Nuovo Mondo con molte caratteristiche simili a quelle dell'uomo, e la durata del suo ciclo ovarico è di 26-30 giorni 1,2. Gli studi sullo sviluppo precoce e sulla generazione di uistitì geneticamente modificati richiedono il prelievo di ovociti e zigoti in fasi specifiche del ciclo ovarico. Pertanto, la determinazione accurata dello stadio è fondamentale e può essere stimata misurando i livelli ematici degli ormoni progesterone (P4) ed estradiolo (E2)2,3. Questi ormoni promuovono la crescita endometriale, necessaria per l'impianto. P4 è prodotto dal corpo luteo, che si forma nelle ovaie immediatamente dopo l'ovulazione. L'E2 è secreto dai follicoli ovarici in risposta all'ormone follicolo-stimolante (FSH) dal complesso ipotalamo-ipofisi nel cervello. I livelli di E2 aumentano man mano che il follicolo matura, raggiungendo il picco prima dell'ovulazione3. Alti livelli di E2 causano il rilascio pulsato dell'ormone luteinizzante (LH) attraverso il complesso ipotalamo-ipofisi nell'uomo; questo picco di LH induce l'ovulazione. Tuttavia, negli uistitì, il gene LH ha subito una degenerazione durante l'evoluzione, e l'ovulazione è invece indotta dal rilascio di gonadotropina corionica (CG), che ha una struttura simile a quella di LH, dalla ghiandola pituitaria 4,5.
Il ciclo ovarico può essere controllato con iniezioni di ormoni. Le iniezioni di FSH, nell'uomo, agiscono sui recettori ovarici dell'FSH e vengono utilizzate per promuovere la sintesi degli estrogeni e la crescita dei follicoli6. L'iniezione di CG umano (hCG) come sostituto dell'LH alla fine della fase follicolare viene utilizzata per stimolare l'ovulazione nell'uomo7. Le iniezioni di CG sono anche usate per trattare l'infertilità umana perché il CG stimola il corpo luteo all'inizio della gravidanza, con conseguente aumento della produzione di P4. Le iniezioni di prostaglandina F2α (PGF2α) ripristinano il ciclo ovarico8. Nei bovini domestici, l'iniezione di PGF2α viene utilizzata per accorciare la fase luteale e sincronizzare il ciclo dell'estro per la gestione riproduttiva.
Sebbene gli uistitì e gli esseri umani abbiano meccanismi biologici simili, che li rendono animali modello ideali, c'è una mancanza di letteratura che descriva i metodi di base per molte tecniche spesso utilizzate. Il prelievo di sangue è una delle tecniche più utilizzate 9,10,11,12. Tuttavia, i principianti a volte hanno difficoltà a trovare la vena. Pertanto, questo studio ha condotto analisi anatomiche della regione della vena femorale. Sulla base di osservazioni anatomiche, questo protocollo introduce la regione prossimale del triangolo femorale come un sito facile per la venipuntura.
Protocollo
Tutti i metodi che coinvolgono gli uistitì utilizzano elevati standard etici e di benessere e sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali presso il National Center for Child Health and Development. Gli animali utilizzati qui erano alloggiati in un solo alloggio o in coppia (una femmina e un maschio) con 12 ore di luce al giorno.
1. Prelievo di sangue dalla vena femorale
- Preparare una siringa da 1 ml (il tipo corto è facile da usare) con un ago da 25 G attaccato con la lama rivolta verso l'alto. Per evitare l'ostruzione del sangue, eparinizzare la siringa aspirando 200 μL di soluzione di eparina sodica non diluita nella siringa. Rivestire uniformemente l'interno della siringa tirandola su e giù più volte; Quindi, espellere la soluzione di eparina dalla siringa.
NOTA: Poiché spesso è necessario passare a una nuova siringa, preparare alcune siringhe eparinizzate aggiuntive. - Preparare tamponi assorbenti di cotone e alcol Accendi una lampada regolabile per illuminare l'area in cui verrà posizionato l'uistitì per il prelievo di sangue.
- Preparare il dispositivo di ritenuta (420 x 85 x 85 mm, Figura 1A), disponibile in commercio (vedere la tabella dei materiali per i dettagli). Per posizionare un uistitì nel dispositivo, aprire la parte di ritenzione con il nastro in spugna, che fissa gli uistitì. Inserire l'uistitì nel dispositivo di ritenuta rivolto verso l'alto.
NOTA: Gli uistitì sono generalmente calmi nei dispositivi di contenzione, il che può annullare la necessità di acclimatazione o addestramento alla contenzione. - Cattura l'uistitì; inserire l'uistitì nella parte cilindrica; e fissarlo premendo verso il basso il nastro di spugna. Posizionare la gamba da cui deve essere raccolto il sangue sopra l'altra (Figura 1A). Tenere le gambe usando la mano non dominante; Posiziona il medio e l'anulare all'interno di ciascuna gamba per fissarli e le altre dita all'esterno di ciascuna gamba per fissarli.
NOTA: Si consigliano guanti da morso quando si catturano gli uistitì. Se non è presente un dispositivo di contenzione, eseguire il prelievo di sangue sotto anestesia o con un'altra persona che trattiene l'uistitì. - Controlla se la vena femorale è visibile vicino alla base della coscia. In caso contrario, palpare per trovare l'arteria pulsante e usarla come punto di riferimento per verificare che la vena scorra al suo interno (Figura 1B-D).
NOTA: Si consiglia l'illuminazione della scrivania e la rasatura dei capelli per migliorare la visibilità. La visibilità può essere migliorata anche strofinando con tamponi imbevuti di alcol. I linfonodi nel triangolo si trovano spesso vicino alla vena e mostrano un colore blu scuro come una vena. Come distinguerli è descritto nella sezione Risultati rappresentativi. - Disinfettare il sito di puntura utilizzando un tampone imbevuto di alcol. Inserire l'ago con la lama rivolta verso l'alto con un angolo di 15°-20°. Per evitare che l'ago scivoli fuori dal vaso sanguigno durante la raccolta del sangue, stabilizzare la mano che tiene la siringa, ad esempio appoggiandola sull'altra mano.
- Tirare delicatamente indietro lo stantuffo per applicare una pressione negativa (Figura 1E). Spingere in avanti la punta dell'ago. Una volta che il sangue entra nella siringa, mantenere la posizione della punta dell'ago fino a quando non è stato raccolto il volume richiesto (500-700 μL).
- Quando il sangue non entra nella siringa, cambiare il sito di puntura. Se il sangue fuoriesce quando si estrae l'ago, interrompere l'emorragia applicando pressione sul sito di puntura per 3 minuti. Dopo aver fermato l'emorragia, riavviare la venipuntura.
- Se il sangue aspirato nella siringa smette di fluire durante il processo di prelievo, spingere lentamente la punta dell'ago in avanti e poi tirarla indietro per trovare il vaso sanguigno. Questo può ripristinare il flusso di sangue nella siringa. In caso contrario, estrarre l'ago ed eseguire l'iniezione venosa utilizzando una nuova siringa.
NOTA: Utilizzare la coscia sull'altra gamba quando è difficile raccogliere il sangue dallo stesso lato.
- Estrarre con cautela l'ago premendo leggermente sul sito di puntura con il mignolo. Quindi, utilizzando un batuffolo di cotone assorbente, applicare immediatamente una pressione sul sito di puntura per 3 minuti per fermare l'emorragia. Capovolgere la siringa per mescolare sangue ed eparina.
NOTA: Applicare una pressione più lunga (5 minuti) durante il raffreddamento quando viene prelevato il sangue arterioso e verificare attentamente la frequenza del sanguinamento per prevenire la formazione di ematoma, che a volte può provocare un esito fatale. - Dopo aver confermato che l'emorragia è cessata, rimuovere la cintura di spugna, tenere la vita dell'animale con una mano e ruotare l'animale in modo da poterlo tenere sotto le ascelle usando un'altra mano dal retro.
- Rimetti l'uistitì nella sua gabbia. Per ridurre lo stress e facilitare il prelievo ripetuto di sangue, fornisci all'uistitì il suo cibo preferito (ad esempio, biscotti, marshmallow o pan di spagna). Controllare l'insorgenza di ematoma di tanto in tanto.
NOTA: Quando l'ematoma viene rilevato nella fase iniziale, applicare una benda a pressione per prevenire la progressione dell'ematoma. Quando viene trovato dopo molto tempo, può essere necessaria la rimozione chirurgica dell'ematoma con legatura dell'arteria femorale e trasfusione di sangue 9,13. - Staccare l'ago dalla siringa per prevenire l'emolisi. Quindi, espellere lentamente il sangue raccolto lungo la parete interna di una microprovetta da 1,5 mL.
NOTA: Il sangue raccolto può essere conservato a 4 oC per un massimo di 24 ore prima della separazione del plasma per misurare i livelli di P4/E2.
2. Separazione del plasma e determinazione dei livelli ormonali
- Centrifugare il sangue in una provetta da 1,5 ml a 1.100 × g per 5 minuti a 4 oC.
- Trasferire il plasma separato (surnatante) dalla provetta da 1,5 mL in una nuova provetta/coppa, evitando accuratamente l'inclusione di cellule del sangue (sedimenti).
- Misurare i livelli di P4 ed E2 utilizzando un kit ELISA o un analizzatore automatico. Se la quantità di plasma non è sufficiente per l'analizzatore automatico, utilizzare una soluzione di diluizione del campione.
NOTA: Per la misurazione con un analizzatore automatico, sono necessari >175 μL di plasma per determinare solo un livello di P4 e >250 μL di plasma per determinare sia P4 che E2.
3. Misurazione del baricentro urinario per rilevare l'ovulazione e la gravidanza
NOTA: I livelli di CG negli uistitì possono essere misurati utilizzando un kit di test immunocromatografico sia per l'ovulazione che per la gravidanza. In caso di ovulazione, un risultato positivo può essere ottenuto 0-2 giorni prima dell'ovulazione. In caso di gravidanza, viene rilevato un risultato positivo dal 15° al 20° giorno circa al 100° giorno di gravidanza. Il test richiede una piccola quantità (90 μL) di urina (una goccia di urina è ~30 μL).
- Metodo del vassoio: se ci sono più di due animali nella stessa gabbia, sposta l'uistitì bersaglio (o gli altri animali) in un'altra gabbia il giorno prima. Metti un vassoio pulito sul fondo della gabbia la sera prima o prima dell'accensione. L'urina non viene drenata dalla vescica durante la notte. Pertanto, l'urina viene solitamente rilasciata dalla vescica poco dopo l'accensione.
NOTA: Entrare nella stanza al mattino prima dell'illuminazione può interrompere il ciclo del sonno della coorte. L'urina di solito può essere raccolta entro circa 30 minuti dall'accensione. - Metodo di spremitura: Preparare i vassoi lavati per la raccolta delle urine. Dopo aver individuato la vescica dell'uistitì, stringerla con cura dalla parte anteriore e da entrambi i lati utilizzando l'intera lunghezza delle dita (Figura 1F). Raccogli l'urina appena prima di illuminare la stanza al mattino.
NOTA: Se la raccolta delle urine non riesce a causa dell'assenza di urina nella vescica, attendere un po' e riprovare. Fare attenzione a non usare una forza eccessiva perché ciò ferirà l'animale. - Immediatamente dopo la raccolta, posizionare il campione di urina nel pozzetto del kit per il test immunocromatografico. Leggere il risultato dopo 10 minuti secondo le istruzioni del produttore.
4. Controllo e determinazione della fase del ciclo ovarico per il prelievo di ovociti, zigoti ed embrioni
- Raccolta di ovociti della vescicola germinale (GV) dalle ovaie
- Somministrare un'iniezione intramuscolare di 3 μL di 0,263 mg/mL di cloprostenolo (un analogo sintetico di PGF2α) diluito in 150 μL di soluzione fisiologica14 (Figura 2) per ripristinare il ciclo ovarico alla fine della fase luteale (cioè ≥10 giorni dopo l'inizio della fase luteale).
NOTA: Preparare la soluzione diluita in un volume maggiore può essere conveniente poiché il cloprostenolo diluito rimane stabile per almeno diverse settimane a +4 °C. - Il giorno successivo (giorno 1), confermare l'inizio della fase follicolare controllando che il livello di P4 sia diminuito.
NOTA: È stato riportato che l'iniezione di cloprostenolo riduce drasticamente i livelli di P4 (di solito <10 ng/mL) entro 24 ore3. - Dal giorno 1, iniettare FSH (25 UI, per via intramuscolare) una volta ogni 2 giorni per un totale di 5 volte (giorni 1, 3, 5, 7 e 9). Il giorno 10, iniettare hCG (75 UI, intramuscolare) nel pomeriggio.
- Raccogliere i GV dalle ovaie l'11° giorno mediante aspirazione follicolare in anestesia secondo la letteratura15,16.
NOTA: A volte, l'ovulazione avviene prima del previsto. Pertanto, si consiglia di controllare i livelli di CG a partire dall'8° giorno. Se il test CG è positivo, eseguire la raccolta GV in questo giorno.
- Somministrare un'iniezione intramuscolare di 3 μL di 0,263 mg/mL di cloprostenolo (un analogo sintetico di PGF2α) diluito in 150 μL di soluzione fisiologica14 (Figura 2) per ripristinare il ciclo ovarico alla fine della fase luteale (cioè ≥10 giorni dopo l'inizio della fase luteale).
- Raccolta di ovociti, zigoti ed embrioni precoci di metafase II (MII)
- Reimpostare il ciclo ovarico utilizzando il cloprostenolo come descritto al punto 4.1.1.
- Il giorno successivo (giorno 1), confermare l'inizio della fase follicolare controllando che il livello di P4 sia diminuito.
- Per la raccolta di zigoti ed embrioni, ospita le femmine di uistitì insieme ai maschi di uistitì per l'accoppiamento dal giorno 6.
- Dal 7° giorno, controlla i livelli di P4/E2 nel sangue e i livelli di CG nelle urine delle femmine. Il rilevamento della CG è un'indicazione dell'ovulazione entro pochi giorni (di solito il giorno successivo). Il giorno in cui i livelli di P4 aumentano e i livelli di E2 diminuiscono rispetto al giorno precedente, prelevare gli ovociti MII o gli zigoti embrionali del giorno 0 (E0) dagli ovidotti17,18.
- Per la raccolta degli embrioni, come descritto in letteratura, eseguire il lavaggio dagli ovidotti (E1-E3, 1-8 cellule)17,18 o dall'utero (E5-E10, 8 cellule-blastocisti)19,20,21,22 al momento opportuno, a seconda dello stadio target.
Risultati
I dettagli relativi agli animali utilizzati in questo studio sono elencati nella Tabella 1.
Analisi anatomiche della vena femorale
Le analisi anatomiche della vena femorale sono state eseguite utilizzando un uistitì comune maschio di 2 anni (I 7713M) sottoposto a eutanasia. Le vene e le arterie femorali si trovano nel triangolo femorale. Il triangolo femorale si forma ai confini tra la parete addominale e i muscoli della coscia (Figura 1B-D). Alla base della coscia, una grande vena attraversa il centro del triangolo rovesciato e un'arteria corre parallela all'esterno della vena. Nella regione inferiore, le vene e le arterie si assottigliano e si sovrappongono, con le arterie posizionate sopra le vene (Figura 1D).
Per il prelievo di sangue, la vena deve essere mirata perché una lesione arteriosa può causare un ematoma dell'arteria femorale, che può portare a shock cardiovascolare quando l'emorragia è grave13. Sebbene il sangue possa essere prelevato da qualsiasi parte della vena nel triangolo e nella sua area distale, si raccomanda la venipuntura dal sito prossimale del triangolo femorale a causa delle grandi dimensioni della vena e della sua apparentemente poca sovrapposizione con l'arteria. Inoltre, la vena nel sito prossimale è superficiale, consentendo una facile localizzazione utilizzando un ago. Poiché pulsa, l'arteria nel triangolo femorale è talvolta identificata visivamente o dalla palpazione e la vena corre proprio medialmente ad essa. Pertanto, l'osservazione della pulsazione dell'arteria aiuta a prevedere la posizione della vena.
Inoltre, di solito si osserva una colorazione blu indicativa della vena sotto la pelle nella parte superiore del triangolo (Figura 1B, C). Tuttavia, i linfonodi nel triangolo si trovano spesso vicino alla vena e mostrano un colore blu scuro, quindi il loro aspetto è simile. Fortunatamente, possono essere distinti per la loro mobilità: la vena è stazionaria e i linfonodi sono mobili. Pertanto, la pulsazione dell'arteria e il colore blu della vena sono due indizi principali utilizzati per localizzare la vena, anche se potrebbe essere necessario radersi i peli per visualizzarli.
Determinazione dello stadio del ciclo ovarico
I livelli di P4 ed E2 sono stati monitorati in sei femmine di uistitì (di età compresa tra 1 e 3 anni) per studiare la durata delle fasi follicolare e luteale. I risultati hanno mostrato una durata media di 11,58 giorni (n = 6 da quattro uistitì) e 16,8 giorni (n = 5 da tre uistitì) rispettivamente per le fasi follicolare e luteale (Tabella 2). Di seguito, la dinamica P4 ed E2 di uno (I6751F, 3 anni) dei sei uistitì è descritta in dettaglio. Il prelievo di sangue e le misurazioni ormonali in questo animale sono stati eseguiti ogni pochi giorni per 38 giorni (Tabella 3).
Fase luteale (giorni 1-10)
Il giorno di inizio della misurazione è stato impostato come giorno 1. Sulla base del livello di P4 (21 ng/mL), l'animale era probabilmente in fase luteale. Un alto livello di P4 è stato osservato dal giorno 1 al giorno 10 (≥21 ng/mL), suggerendo la fase luteale. Il giorno 12, è sceso bruscamente a 4 ng/mL. Questa significativa diminuzione indicava il passaggio dalla fase luteale a quella follicolare. Anche una diminuzione del livello di E2 dal giorno 10 (241 ng/mL) a 12 (189 ng/mL) ha supportato questa transizione.
Fase follicolare (giorni 12-22)
Dopo il passaggio alla fase follicolare, il livello di P4 è rimasto basso (4-6 ng/mL) fino al giorno 19 e poi è leggermente aumentato dal giorno 19 al 24 (giorno 19, 6 ng/mL; giorno 22, 8 ng/mL; giorno 24, 9 ng/mL). Al contrario, il livello di E2 è aumentato significativamente dal giorno 19 (94 ng/mL) al 22 (322 ng/mL) e poi è diminuito dal giorno 22 al giorno 24 (158 ng/mL). Sulla base dell'aumento di P4 e della diminuzione dei livelli di E2, si prevedeva che l'ovulazione si fosse verificata tra il 22° e il 24° giorno, passando dalla fase follicolare a quella luteale.
Fase luteale (giorni 24-36)
Dopo l'ovulazione, il livello di P4 è rimasto alto fino al giorno 36 e poi è sceso a 3 ng/mL il giorno 38. Pertanto, è probabile che il passaggio dalla fase luteale a quella follicolare sia avvenuto tra i giorni 36-38. Coerentemente con questa transizione, il livello di E2 è diminuito durante questo periodo (giorno 36, 2517 ng/mL; giorno 38, 73 ng/mL).
Previsione e determinazione dei tempi di ovulazione
Per esaminare la relazione tra il livello di CG nelle urine e la data dell'ovulazione, sono stati preparati sette uistitì (n. 1-7). Il cloprostenolo è stato iniettato per ripristinare il ciclo ovulatorio (giorno 0). Quindi, è stato eseguito il monitoraggio dei livelli di P4/E2 nel sangue e dei livelli di CG nelle urine dal giorno 7. L'urina è stata raccolta immediatamente dopo l'accensione. Il prelievo di sangue è stato eseguito essenzialmente al mattino. Si è ipotizzato che l'ovulazione si verifichi quando il livello di E2 è stato ampiamente abbassato rispetto a quello del giorno precedente, come riportato17. Quel giorno, la rottura follicolare è stata effettivamente osservata sulla superficie delle ovaie e la presenza di zigoti/ovociti negli ovidotti (Tabella 4).
La CG è stata rilevata per la prima volta durante i giorni da 7 a 11 (giorno 7, N = 1; giorno 8, N = 2; giorno 9, N = 1; giorno 10, N = 2; giorno 11, N = 1) (Tabella 4). Il forte calo dei livelli di E2 (indicazione dell'ovulazione) è stato osservato 0-3 giorni dopo il primo segnale CG. La durata dal primo rilevamento del CG alla diminuzione dell'E2 sembrava essere grande quando il primo rilevamento del CG era precedente (Figura 3A). Ad esempio, un animale (n. 1) ha mostrato un calo del segnale E2 3 giorni dopo il primo rilevamento del CG il giorno 7 (Tabella 4). Al contrario, la co-occorrenza del primo rilevamento di CG e del calo del segnale E2 è stata osservata in un animale (n. 2) il giorno 10. Pertanto, sebbene il primo rilevamento di CG e l'ovulazione siano stati osservati lo stesso giorno in uno dei cinque animali, l'ovulazione si è verificata entro pochi giorni dal primo rilevamento di CG.
Il kit per il test immunocromatografico per uistitì CG è progettato per utilizzare l'urina per i test. L'esame del livello di CG di solito accompagna la determinazione dei livelli di P4/E2 utilizzando il plasma sanguigno. Sarà utile se il plasma sanguigno, invece dell'urina, può essere utilizzato per il test CG. Per verificarlo, è stato esaminato il plasma sanguigno che è rimasto dopo la misurazione del livello di P4/E2 negli esperimenti di cui sopra. Il plasma sanguigno e l'urina sono stati raccolti dai quattro animali in uno dei giorni degli esperimenti di cui sopra (i giorni dell'esame sono stati indicati da doppi asterischi [**] nella Tabella 4). Utilizzando l'urina, due dei quattro animali hanno mostrato risultati positivi (punteggi 5 e 3) e gli altri due hanno mostrato risultati negativi (punteggio 1). Il plasma sanguigno ha mostrato essenzialmente gli stessi risultati dell'urina (Figura 3B). Il segnale più forte è stato ottenuto utilizzando il plasma sanguigno. Pertanto, quando si utilizza il plasma sanguigno, il giudizio deve essere espresso prima di 10 minuti, che è impostato per l'urina.
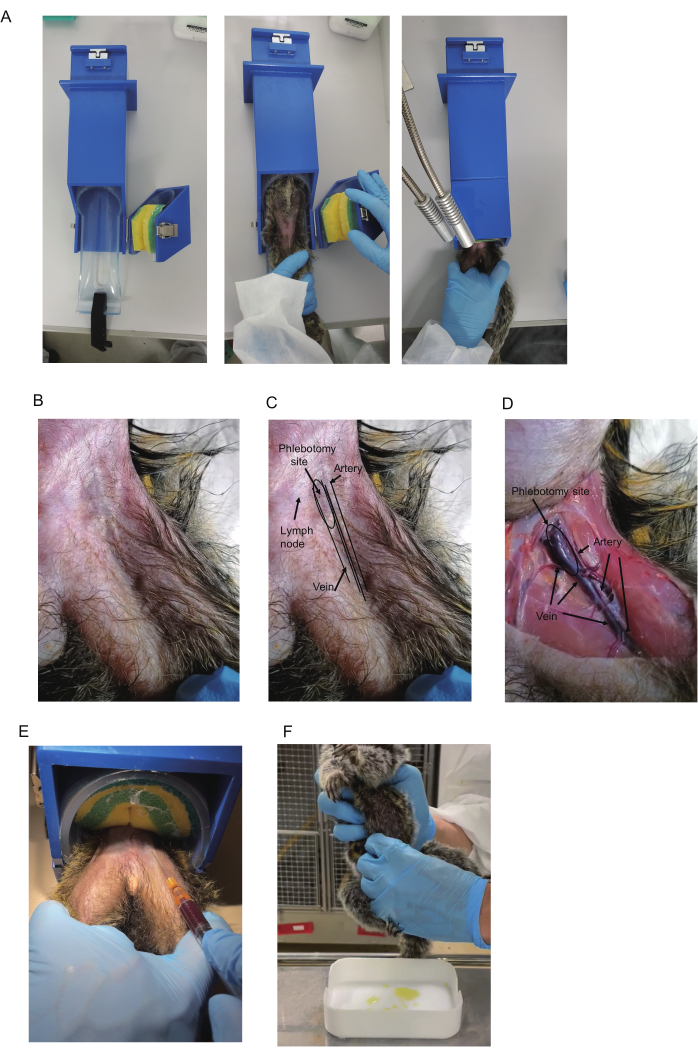
Figura 1: Prelievo di sangue dagli uistitì. (A) Per il prelievo di sangue viene utilizzato un sistema di contenzione. (B) Uistitì parte superiore della coscia. (C) Triangolo femorale e vasi sanguigni. L'arteria femorale nel triangolo è spesso visibile e mostra pulsazioni. Il colore blu della vena femorale è talvolta visibile nell'area prossimale del triangolo (indicata come sito di flebotomia). Anche i linfonodi mostrano un colore blu. Tuttavia, i linfonodi sono mobili poiché i linfonodi sono attaccati alla pelle. (D) Vista anatomica della coscia dell'animale soppresso. Sono indicati il sito dell'arteria, della vena e della flebotomia. Lo stesso animale è mostrato in B-D. (E) Raccolta del sangue mediante un sistema di contenzione. Vengono mostrate la posizione di tenuta delle zampe dell'uistitì e il sangue prelevato. (F) Raccolta di urina da un uistitì. Clicca qui per visualizzare una versione più grande di questa figura.
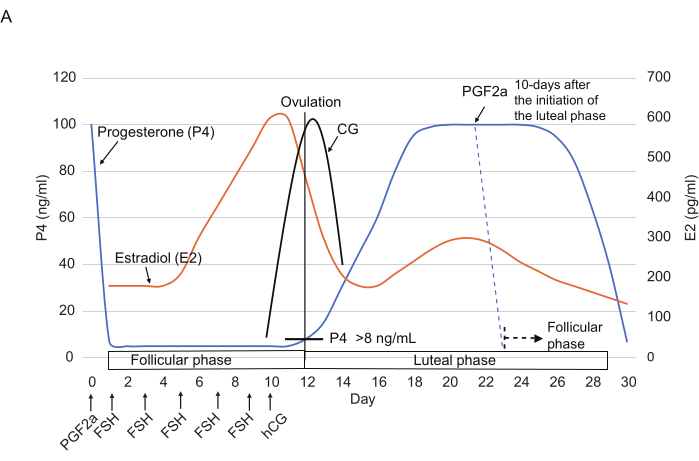
Figura 2: Modelli tipici dei livelli di P4, E2 e CG durante il ciclo ovarico negli uistitì. Sono indicati i punti temporali delle iniezioni di FSH, hCG e PGF2α. Le linee tratteggiate mostrano il modello ormonale previsto dopo l'iniezione di PGF2α. Abbreviazioni: P4 = progesterone; E2 = estradiolo; CG = gonadotropina corionica; FSH = ormone follicolo-stimolante; hCG = gonadotropina corionica umana; PGF2α = prostaglandina F2α. Clicca qui per visualizzare una versione più grande di questa figura.
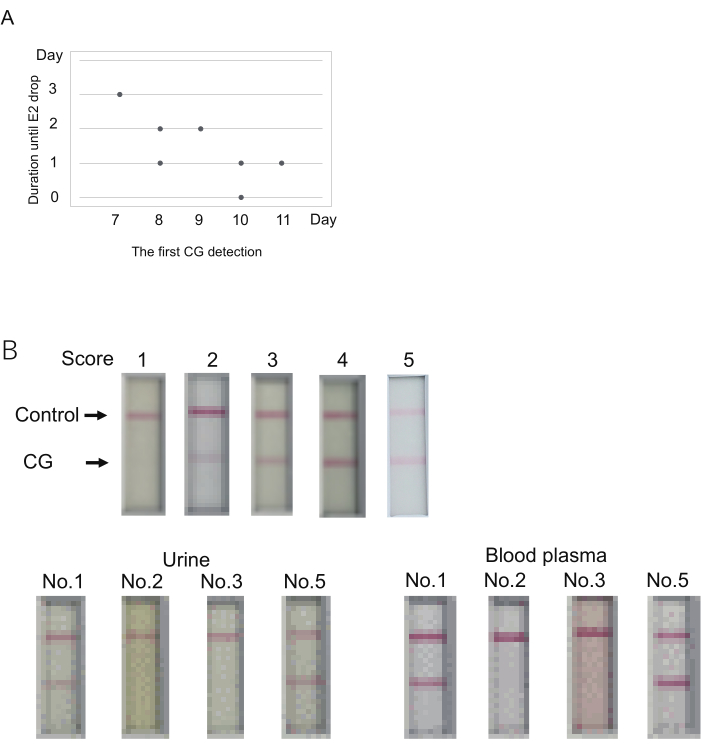
Figura 3: Determinazione del livello di CG per prevedere l'occorrenza dell'ovulazione. (A) La possibile relazione tra il primo giorno di rilevamento del CG (punteggio > 1) e la durata fino all'ovulazione (calo E2). (B) Il plasma sanguigno può essere utilizzato per i test CG immunocromatografici. Un risultato rappresentativo di ogni punteggio (in alto). Il punteggio è stato determinato 10 minuti dopo il caricamento del campione. Il punteggio 2 non rappresenta alcuna banda entro 5 minuti, ma la comparsa di una banda entro 10 minuti. La raccolta del sangue è stata eseguita subito dopo la raccolta delle urine. Sono stati esaminati quattro uistitì (n. 1, 2, 3, 5 nella tabella S4). I campioni utilizzati qui sono indicati come doppi asterischi nella Tabella 4. Il plasma sanguigno è stato diluito al 50% mediante tampone di diluizione utilizzato per la misurazione dell'E2. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Animali utilizzati in questo studio. Clicca qui per scaricare questa tabella.
Tabella 2: Durata delle fasi follicolare e luteale. La fase è stata determinata in base al livello di P4 (fase follicolare P4 ≤ 8, fase luteale P4 > 8). Quando è stato osservato un cambiamento di fase tra le misurazioni, il punto medio tra le date di misurazione è stato determinato come il punto di cambiamento. La durata tra i due punti di cambiamento è stata considerata come fasi follicolari o luteali. Per garantire la misurazione della durata di una singola fase, per le analisi non sono stati utilizzati i dati con un intervallo lungo (≥7 giorni) o due volte di intervalli di ≥6 giorni nella stessa fase, anche quando si estendono tra le due fasi. Solo quando due misurazioni sono state condotte nella stessa fase, i dati sono stati utilizzati. Clicca qui per scaricare questa tabella.
Tabella 3: Risultati delle misurazioni P4 ed E2 per 38 giorni in un uistitì.Clicca qui per scaricare questa tabella.
Tabella 4: Determinazione e previsione dei giorni ovulatori. Le tracce di ovulazione sono state considerate presenti se sono stati osservati siti di sanguinamento o siti di rottura nelle ovaie. Ovocita/zigote indica gli stadi dell'ovocita/zigote ottenuti dagli ovidotti il giorno della goccia di E2. Clicca qui per scaricare questa tabella.
Discussione
La localizzazione della vena è il passaggio più critico nella raccolta del sangue. Sulla base di osservazioni anatomiche, questo protocollo introduce l'area prossimale nel triangolo femorale come un sito facile per la raccolta del sangue negli uistitì. Utilizzando quest'area, è possibile eseguire facilmente il prelievo di sangue da una vena di grandi dimensioni. Tuttavia, anche utilizzando questo protocollo, a volte si verificano lesioni a un'arteria. Quando si ferisce un'arteria, si consiglia di arrestare completamente l'emorragia applicando una pressione per >5 minuti per prevenire l'ematoma. Inoltre, durante l'applicazione della pressione, è efficace anche il raffreddamento del sito punteggiato utilizzando un cubetto di ghiaccio. Gli ematomi possono essere trattati con eparina (ad esempio, Tensolvet 5.000 I.E. gel). La maggior parte degli ematomi scompare dopo 3-4 giorni consecutivi di trattamento con eparina e 0,05 ml di meloxicam (0,5 mg/mL, p.o.). L'arteria corre lateralmente alla vena nella zona prossimale della coscia. Nella zona distale, la vena e l'arteria sembravano più vicine l'una all'altra e si sovrapponevano in misura maggiore, con l'arteria situata ventrale alla vena. Sulla base di questa relazione posizionale, il prelievo di sangue dall'area prossimale della coscia ha probabilmente un rischio ridotto di lesioni arteriose.
Inoltre, la vena femorale nella regione prossimale è spessa e situata superficialmente, consentendo una facile localizzazione utilizzando un ago. Tuttavia, il prelievo di sangue dall'area distale ha il vantaggio di lasciare intatti i siti prossimali, consentendo un'immediata venipuntura ripetuta dall'area prossimale della stessa gamba, anche se la vena è danneggiata durante il prelievo di sangue. Questo perché l'area distale del sito danneggiato di solito non è disponibile per la venipuntura immediata. Tuttavia, quando il prelievo di sangue non ha successo, è possibile eseguire un campionamento ripetuto dal sito prossimale sull'altra gamba.
Il volume di sangue circolante negli uistitì è di ~25 ml (70 ml/kg)23. Un uistitì da 350 g richiede 1 settimana per riprendersi da un prelievo di sangue di 2 ml, equivalente al 7,5% del volume totale del sangue6. Dalle vene femorali si possono raccogliere senza difficoltà 500-700 μL di sangue. Quando è necessario un campionamento ripetuto, si consiglia di raccogliere piccole quantità di sangue e di utilizzare un tampone di diluizione per l'analizzatore automatico.
Sebbene l'anestesia non sia generalmente utilizzata per il prelievo di sangue, per i principianti il prelievo di sangue da animali anestetizzati può essere molto più semplice rispetto a quello da animali svegli. Tuttavia, è necessaria cautela quando si utilizza l'anestesia per il prelievo di sangue perché l'anestesia può influenzare i valori misurati dei componenti del sangue. In relazione alle misurazioni ormonali per determinare lo stadio del ciclo ovarico, è stato riportato che l'alfaxalone ha portato a livelli inaspettatamente più elevati di P424. Ciò è stato causato dalla cross-reattività dell'anticorpo anti-P4 contro l'alfaxalone, che è un derivato della P4.
Le strutture di P4 ed E2 (ormoni steroidei) sono identiche tra gli esseri umani e gli uistitì. I kit ELISA commerciali per l'uomo P4 ed E2 sono, quindi, disponibili per l'uistitì P4 ed E2. Sono disponibili anche servizi di outsourcing per la misurazione degli ormoni del sangue umano. Al contrario, ci sono lievi differenze nelle sequenze di aminoacidi per gli ormoni polipeptidici, come FSH, CG e inibina. Per questi ormoni polipeptidici, se un kit può essere utilizzato sia per gli esseri umani che per altre specie evolutive distanti, come i topi, funzionerà anche per gli uistitì. Per la misurazione dell'inibina B, è possibile utilizzare un kit per il dosaggio immunoenzimatico dell'inibina B (subunità Beta B) umano/topo/ratto.
Un aumento del livello di P4 è un segno distintivo dell'ovulazione (passaggio dalla fase follicolare a quella luteale). Sebbene le variazioni tra gli individui rendano difficile individuare la data di ovulazione dal solo livello di P4, un livello di P4 di >8 ng/mL può essere utilizzato come indicatore approssimativo del verificarsi dell'ovulazione. Un indicatore più affidabile della data di ovulazione è una diminuzione del livello E2 3,17. Ovociti/zigoti ovulati sono stati infatti osservati negli ovidotti il giorno della diminuzione di E2 (Tabella 4). Pertanto, la misurazione di E2 ci consente di individuare la data esatta dell'ovulazione. Oltre ai livelli ormonali, le informazioni sul numero di giorni dopo la somministrazione di PGF2α sono un predittore del giorno dell'ovulazione (Tabella 4). Allo stesso modo, l'uso combinatorio dei livelli di P4 ed E2 aiuta a identificare i tempi della transizione alla fase follicolare, quando i livelli di P4 diminuiscono drasticamente e i livelli di E2 sono al minimo.
Negli uistitì, il CG, invece dell'LH, viene rilasciato dalla ghiandola pituitaria per indurre l'ovulazione. Inoltre, il CG viene escreto dalle cellule del trofoblasto quando gli embrioni si attaccano e si impiantano nell'endometrio. Poiché gli uistitì mancano di un gene LH funzionale, il CG, invece dell'LH, viene rilasciato dalla ghiandola pituitaria per stimolare l'ovulazione5. Uno studio ha riportato che i picchi di E2 e CG, indicativi dell'ovulazione, si osservano lo stesso giorno12. Un altro studio ha riportato che, in media, i picchi E2 (8,6 giorni dopo la somministrazione di PGF2α) precedono i picchi CG (9,3 giorni dopo la somministrazione di PGF2α)25, indicando che l'ovulazione può verificarsi prima di raggiungere i picchi CG. La CG, a differenza dell'E2, viene rilasciata a impulsi poco prima del suo picco. Il rilascio a impulsi della CG inizia, in media, ~1 giorno prima del suo picco. Tuttavia, è stata osservata una grande variazione nella durata dal primo rilevamento del livello di CG al calo del livello di E2 (Figura 3A e Tabella 4). Inoltre, è stato segnalato che la CG è stata rilevata per la prima volta sia nei campioni mattutini che pomeridiani25.
Per quanto ne sappiamo, non ci sono segnalazioni di ovulazione negli uistitì che si verificano in un particolare momento della giornata. Inoltre, gli uistitì di solito rilasciano due o tre ovociti contemporaneamente, quindi potrebbe esserci un certo periodo durante il quale tutti gli ovociti vengono rilasciati. Poiché l'aumento dei livelli di CG si verifica prima dell'ovulazione, la misurazione del CG consente di prevedere in anticipo la data di ovulazione. Tali informazioni sono particolarmente utili per la raccolta di ovociti MII o embrioni del giorno 0 il giorno dell'ovulazione. Pertanto, è utile una misurazione combinatoria dei livelli ematici di P4/E2 e dei livelli di CG (Figura 3B). Nella maggior parte delle specie di primati, compresi gli esseri umani, l'ovulazione non si verifica per un po' di tempo dopo il parto. Tuttavia, l'ovulazione postpartum si verifica negli uistitì ~10 giorni dopo il parto. Di conseguenza, la consegna successiva viene spesso osservata ~155 giorni dopo la consegna precedente. Questa gravidanza sequenziale, insieme al parto di gemelli, si traduce in un alto livello di fecondità negli uistitì.
Le fluttuazioni ormonali variano da individuo a individuo e alcune non hanno un ciclo costante. Alcune femmine di uistitì mostrano livelli bassi costanti di P4/E2, il che indica una mancanza di ovulazione. La mancanza di un ciclo ovulatorio può essere attribuita all'immaturità, ai problemi di salute, allo stress o all'inibizione dell'ovulazione da parte delle femmine riproduttive dominanti26,27. Tre dei 21 uistitì (>2 anni) che misuravano i livelli ormonali mostravano la mancanza di un ciclo ovulatorio regolare nella struttura dell'autore. La comprensione delle cause e lo sviluppo di trattamenti appropriati consentiranno un uso più efficace degli animali negli esperimenti. Sono stati osservati individui con una fase luteale prolungata di ~ 1 mese e un alto livello di P4 associato2. Nella struttura dell'autore, una fase luteale prolungata si ripete negli stessi individui. Due dei 21 uistitì mostravano questa anomalia. Uno dei due animali era in cumulo singolo, escludendo la possibilità che l'animale fosse incinta durante la fase luteale prolungata. L'altra è accoppiata con un maschio presumibilmente infertile mediante radioterapia, e quindi è improbabile che sia incinta durante la fase luteale prolungata. Anche in una fase luteale prolungata, la somministrazione di PGF2α abbassa il livello di P4 e ripristina il ciclo ovarico. La misurazione degli ormoni sessuali e la comprensione dello stato del ciclo di ovulazione aiutano l'uso efficace degli animali negli esperimenti e nell'allevamento.
Il prelievo di sangue da individui viene utilizzato non solo per la stima della data di ovulazione, ma anche per i test sierologici a scopo diagnostico. Allo stesso modo, la misurazione dei livelli ormonali viene utilizzata non solo per stimare il giorno dell'ovulazione, ma anche per studiare l'interazione sociale, lo sviluppo del bambino e le malattie. In futuro, per la produzione di uistitì geneticamente modificati, si prevede lo sviluppo di ovaie e testicoli da cellule iPS. Livelli ormonali appropriati dovrebbero essere importanti per il normale sviluppo. Il protocollo qui descritto sarà utile per la misurazione e il controllo degli ormoni sessuali per la produzione di gonadi derivate da cellule iPS negli uistitì.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Vorremmo ringraziare Chunshen Shen, Hiroko Akutsu, Fumiyo Sugiki, Yuuna Hashimoto, Hina Naritomi, Yuuki Sakamoto e Mikiko Horigome per il loro supporto nella creazione di questo protocollo e nella cura quotidiana degli uistitì; Takayuki Mineshige per i commenti sul manoscritto; Yukiko Abe e i membri del laboratorio Aiba per aver condiviso le tecniche di raccolta degli zigoti; CIEA per aver condiviso le informazioni sulle abitazioni e gli esperimenti degli uistitì che hanno coltivato in 40 anni. Questa ricerca è stata supportata da AMED, JST e KAKENHI nell'ambito delle sovvenzioni n. JP19gm6310010, JP20gm6310010, JP21gm6310010 e JP22gm6310010 (AMED), JPMJPR228B (JST), 20H05764, 20H03177 e 22K18356 (KAKENHI).
Materiali
| Name | Company | Catalog Number | Comments |
| AIA-360 | Tosoh Corporation | 0019945 | Hormone measurement (P4/E2) |
| AIA-PACK DILUENT CONCENTRATE | Tosoh Corporation | 0020956 | Hormone measurement (P4/E2) |
| AIA-PACK SUBSTRATE SET II | Tosoh Corporation | 0020968 | Hormone measurement (P4/E2) |
| AIA-PACK WASH CONCENTRATE | Tosoh Corporation | 0020955 | Hormone measurement (P4/E2) |
| CMS-1 | CLEA Japan | Marmoset food | |
| Estrumate | MSD Animal Health | PGF2alpha analog (cloprostenol) | |
| Gonal-f Subcutaneous Injection 150 | Merck Biopharma Co., Ltd. | FSH | |
| Gonatropin for intramuscular injection 1000 | ASKA Pharmaceutical Co., Ltd. | 872413 | hCG |
| Heparin sodium injection solution 5,000 units/5 mL | Mochida Pharmaceutical Co., Ltd. | 224122458 | Blood collection |
| Immunochromatographic Test Kit for Detection of Common Marmoset Chorionic Gonadotropin (Dual Checker) | CLEA Japan, Inc. | Determining CG level | |
| Low-profile double-arm microscope illumination LPF-SD | SHIOKAZE GIKEN | Desk lamp for blood collection | |
| Marmoset blood collection restraint device | JIC Japan | JM-1006 | Blood collection http://www.jic-japan.jp/prd/marmoset/prd016.html email: vi@jic-japan.jp |
| Metacam 0.05% | Boehringer Ingelheim Animal Health Japan Co., Ltd. | Hematoma treatment | |
| Sample Cup, 3 mL, PS, for Tosoh 360 and AIA-600 II, 1000/Bag | Globe Scientific | 110913 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 | Tosoh Corporation | 0025224 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 CALIBRATOR SET | Tosoh Corporation | 0025324 | Hormone measurement (P4/E2) |
| ST AIA-PACK iE2 SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025524 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII | Tosoh Corporation | 0025240 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII CALIBRATOR SET | Tosoh Corporation | 0025340 | Hormone measurement (P4/E2) |
| ST AIA-PACK PROGIII SAMPLE DILUTING SOLUTION | Tosoh Corporation | 0025540 | Hormone measurement (P4/E2) |
| Syringe with 25 G (0.50 x 25 mm) needle | TERUMO | SS-01T2525 | Blood collection |
| Tensolvet 5.000 I.E. gel. | Dechra Pharmaceuticals | 14033492 | Hematoma treatment |
| TOSOH MULTI-CONTROL SET | Tosoh Corporation | 0015965 | Hormone measurement (P4/E2) |
Riferimenti
- Kholkute, S. D. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). Primates. 25 (1), 123-126 (1984).
- Harding, R. D., Hulme, M. J., Lunn, S. F., Henderson, C., Aitken, R. J. Plasma progesterone levels throughout the ovarian cycle of the common marmoset (Callithrix jacchus). J Med Primatol. 11 (1), 43-51 (1982).
- Gilchrist, R. B., Wicherek, M., Heistermann, M., Nayudu, P. L., Hodges, J. K. Changes in follicle-stimulating hormone and follicle populations during the ovarian cycle of the common marmoset. Biol Reprod. 64 (1), 127-135 (2001).
- Gromoll, J., et al. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 69 (1), 75-80 (2003).
- Müller, T., et al. Chorionic gonadotrophin beta subunit mRNA but not luteinising hormone beta subunit mRNA is expressed in the pituitary of the common marmoset (Callithrix jacchus). J Mol Endocrinol. 32 (1), 115-128 (2004).
- Pacchiarotti, A., et al. Ovarian stimulation protocol in IVF: an up-to-date review of the literature. Curr Pharm Biotechnol. 17 (4), 303-315 (2016).
- Ezcurra, D., Humaidan, P. A review of luteinising hormone and human chorionic gonadotropin when used in assisted reproductive technology. Reprod Biol Endocrinol. 12, 95 (2014).
- Lopez-Gatius, F. Ovarian response to prostaglandin F(2alpha) in lactating dairy cows: A clinical update. J Reprod Dev. 68 (2), 104-109 (2022).
- Marini, R. P., Wachtman, L. M., Tardif, S. D., Mansfield, K., Fox, J. G. . The Common Marmoset in Captivity and Biomedical Research. , (2018).
- Schultz-Darken, N. J. Sample collection and restraint techniques used for common marmosets (Callithrix jacchus). Comp Med. 53 (4), 360-363 (2003).
- Hopper, J., Kubik, M. Common marmosets. Handbook of Exotic Pet. , 27-42 (2020).
- Harlow, C. R., Hearn, J. P., Hodges, J. K. Ovulation in the marmoset monkey: endocrinology, prediction and detection. J Endocrinol. 103 (1), 17-24 (1984).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Summers, P. M., Wennink, C. J., Hodges, J. K. Cloprostenol-induced luteolysis in the marmoset monkey (Callithrix jacchus). J Reprod Fertil. 73 (1), 133-138 (1985).
- Takahashi, T., et al. Birth of healthy offspring following ICSI in in vitro-matured common marmoset (Callithrix jacchus) oocytes. PLoS One. 9 (4), e95560 (2014).
- Tomioka, I., Takahashi, T., Shimada, A., Yoshioka, K., Sasaki, E. Birth of common marmoset (Callithrix jacchus) offspring derived from in vitro-matured oocytes in chemically defined medium. Theriogenology. 78 (7), 1487-1493 (2012).
- Abe, Y., et al. Efficient marmoset genome engineering by autologous embryo transfer and CRISPR/Cas9 technology. Sci Rep. 11 (1), 20234 (2021).
- Summers, P. M., Shephard, A. M., Taylor, C. T., Hearn, J. P. The effects of cryopreservation and transfer on embryonic development in the common marmoset monkey, Callithrix jacchus. J Reprod Fertil. 79 (1), 241-250 (1987).
- Thomson, J. A., Kalishman, J., Hearn, J. P. Nonsurgical uterine stage preimplantation embryo collection from the common marmoset. J Med Primatol. 23 (6), 333-336 (1994).
- Hanazawa, K., et al. Minimally invasive transabdominal collection of preimplantation embryos from the common marmoset monkey (Callithrix jacchus). Theriogenology. 78 (4), 811-816 (2012).
- Ishibashi, H., et al. Efficient embryo transfer in the common marmoset monkey (Callithrix jacchus) with a reduced transfer volume: a non-surgical approach with cryopreserved late-stage embryos. Biol Reprod. 88 (5), 115 (2013).
- Kishimoto, K., et al. Establishment of novel common marmoset embryonic stem cell lines under various conditions. Stem Cell Res. 53, 102252 (2021).
- Diehl, K. H., et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes. J Appl Toxicol. 21 (1), 15-23 (2001).
- Daskalaki, M., Drummer, C., Behr, R., Heistermann, M. The use of alfaxalone for short-term anesthesia can confound serum progesterone measurements in the common marmoset: a case report. Primate Biol. 9 (2), 23-28 (2022).
- Hodges, J. K., Cottingham, P. G., Summers, P. M., Liang, Y. N. Controlled ovulation in the marmoset monkey (Callithrix jacchus) with human chorionic gonadotropin following prostaglandin-induced luteal regression. Fertil Steril. 48 (2), 299-305 (1987).
- Barrett, J., Abbott, D. H., George, L. M. Extension of reproductive suppression by pheromonal cues in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 90 (2), 411-418 (1990).
- Barrett, J., Abbott, D. H., George, L. M. Sensory cues and the suppression of reproduction in subordinate female marmoset monkeys, Callithrix jacchus. J Reprod Fertil. 97 (1), 301-310 (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon