Amministrazione composta III
Panoramica
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Università di Notre Dame, IN
Ci sono molte vie comunemente usate per la somministrazione di composti in topi e ratti di laboratorio. Tuttavia, alcuni protocolli possono richiedere l'uso di vie meno comunemente usate, tra cui iniezioni intratradermali, intranasali e intracranica. La formazione specializzata è essenziale affinché queste procedure vengano eseguite con successo. Potrebbe essere necessario fornire una giustificazione per questi percorsi per ottenere l'approvazione del Comitato istituzionale per la cura e l'uso degli animali (IACUC).
Principi
Le liniezioni intradermiche vengono consegnate negli strati esterni del derma, sotto lo strato superiore della pelle (l'epidermide). Questa via di iniezione è solitamente riservata alla valutazione dell'infiammazione, alla diagnostica del flusso sanguigno cutaneo o alle reazioni allergeniche a un antigene.
Sebbene spesso utilizzato per la somministrazione locale di vaccinazioni o spray decongestionante, la somministrazione intranasale può essere utilizzata anche per la somministrazione sistemica e del sistema nervoso centrale (SNC). La mucosa che riveste la cavità nasale ha un ricco apporto di vasi sanguigni e nervi che consentono un rapido assorbimento sistemico e un targeting diretto al SNC. Le sostanze composte da piccole molecole lipofile hanno un tasso di assorbimento molto maggiore rispetto a quelle contenenti molecole più grandi. 2
Sebbene l'anestesia non sia richiesta per questa procedura, può facilitare il corretto posizionamento del composto alle narici, garantendo un dosaggio accurato. È stato dimostrato che gli animali anestetizzati hanno una consegna cinque volte maggiore di un farmaco al cervello rispetto a un animale cosciente. 2 I ratti non non intestituiti sono molto resistenti alla somministrazione intranasale. Tuttavia, esiste uno studio che ha dimostrato tecniche di consegna efficaci per la somministrazione intranasale di ratti che si muovono liberamente. 3 Inoltre, gli animali attenti possono tentare di mordere la punta della pipetta o l'ago, rendendo difficile la consegna della sostanza.
I vantaggi della somministrazione intranasale sono che questa tecnica richiede un addestramento e un'abilità minimi e non è invasiva per l'animale. Tuttavia, a causa della possibilità di aerosolizzazione, si consiglia l'uso di un armadietto di biosicurezza e di una protezione per gli occhi, specialmente quando si lavora con un animale cosciente. Inoltre, per evitare di annegare gli animali, deve essere utilizzata la dose più piccola possibile. Se in qualsiasi momento durante questa procedura si vedono cianosi, respirazione della bocca o altri segni di angoscia nell'animale, la procedura deve essere interrotta immediatamente.
Le iniezioni intracranico in topi e ratti adulti impiegano l'uso di apparecchiature stereotassessica per garantire il corretto posizionamento e la profondità dell'iniezione. Tuttavia, nei topi da 3 a 28 giorni di età e nei ratti fino a 14 giorni di età, il cranio è abbastanza sottile da iniettare direttamente attraverso di esso; è troppo fragile per supportare il dispositivo stereotassico. I cuccioli di topo o di ratto devono essere lasciati con la madre fino alla procedura e devono essere restituiti a lei il prima possibile una volta completata la procedura. La cura postinjection include il monitoraggio continuo su una fonte di calore fino a quando non si osservano movimenti e comportamenti normali, compresa l'allattamento. Il motivo principale per utilizzare questa tecnica è quello di fornire agenti farmacologici al sistema nervoso centrale che richiedono l'attraversamento della barriera emato-encefalica, o per evitare gli effetti coinvolti nella via sistemica. 1
Procedura
1. Somministrazione intradermica
- La maggior parte delle iniezioni intradermiche sono composti a base acquosa. Le soluzioni devono essere tamponate fisiologicamente per avere un pH neutro, al fine di evitare necrosi tissutale nel sito di iniezione.
- La gamma di dimensioni dell'ago è di 25-30 gauge, la più piccola possibile.
- L'intervallo di dosaggio per sito di iniezione è di 50-100 μL. L'iniezione di volumi eccessivi può provocare necrosi nel sito di iniezione o perdite del composto fuori dal sito a causa della pressione.
- Per un posizionamento accurato dell'ago nello spazio intradermico, è necessario anestetizzare sia topi che ratti. L'anestesia per inalazione consente una rapida induzione e recupero; tuttavia, l'anestesia iniettabile ha il vantaggio di fornire ampio tempo per la preparazione dell'area e l'esecuzione dell'iniezione. 1
- Rimuovere i capelli nel sito di iniezione attraverso l'uso di una crema depilatoria o radendo l'area.
- Rimuovere accuratamente eventuali residui di crema depilatoria o detriti di capelli.
- Applicare un antisettico topico, come una soluzione di iodio, una soluzione di clorexidina o alcol.
- Procedure amministrative
- Allunga la pelle tesa tra il pollice e l'indice. Ciò fornisce stabilità alla pelle durante il posizionamento dell'ago.
- Posizionare la smussatura dell'ago sulla pelle.
- Inserire delicatamente l'ago nella pelle tra l'epidermide e il derma. Avanzare l'ago appena oltre la smussatura.
- Iniettare la sostanza lentamente. L'iniezione del composto creerà un bleb, o una piccola vescica, nella pelle.
- Pausa dopo l'iniezione per consentire alla pelle di allungarsi e regolarsi prima di ritirare l'ago.
- Precauzioni
- Non è necessario tirare indietro lo stantuffo.
- Se l'ago viene inserito nello spazio sottocutaneo, non si forma alcuna bleb. L'iniezione troppo profonda provoca un'iniezione sottocutanea.
- Evitare di pulire o pulire l'area, in quanto ciò può causare la fuoriuscita del composto dal sito di iniezione.
- Quando si eseguono iniezioni multiple, distanziarle in modo che le macchie non si sovrappongano.
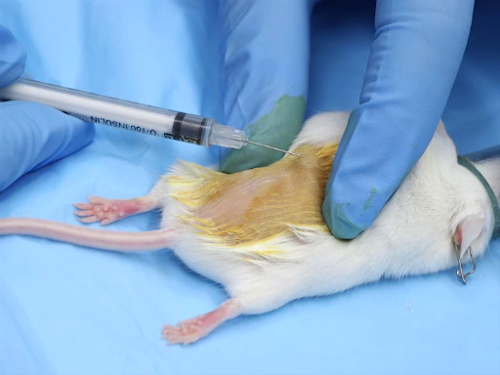
Figura 1. Iniezione intradermica nei topi.
2. Somministrazione intranasale
- Attrezzatura
- Utilizzare una pipetta per unità di micropipettaggio che può essere calibrata per fornire un volume accurato.
- Le punte delle pipette monouso devono essere utilizzate per evitare la contaminazione incrociata. Siringhe TB, aghi smussati e tubi flessibili possono anche essere utilizzati per il dosaggio.
- I volumi totali di iniezione per i ratti non devono superare i 40-100 μL e devono essere somministrati in gocce da 6-10 μL. Per i topi, il volume totale massimo è di 24 μL, dato in gocce di 3-4 μL.
- Somministrazione in animali coscienti
- La contenzione manuale negli animali coscienti richiede che la testa sia relativamente immobile in modo che la punta della pipetta o l'ago smussato possano essere posizionati abbastanza vicino alle narici per fornire il composto, ma non così vicino da colpire o lacerare il tessuto nasale.
- Trattenere l'animale e tenerlo in posizione verticale.
- Posizionare una piccola goccia di un composto liquido all'apertura nasale. L'animale dovrebbe inalare la goccia.
- Somministrare un volume aggiuntivo, alternando le narici fino a quando l'intero volume è stato dato.
- Quando si somministrano volumi maggiori, è importante non restringere il torace durante la contenzione. La compressione toracica impedisce alla capacità dell'animale di fare respiri sufficientemente profondi per attirare il liquido nei bronchi e nei polmoni.
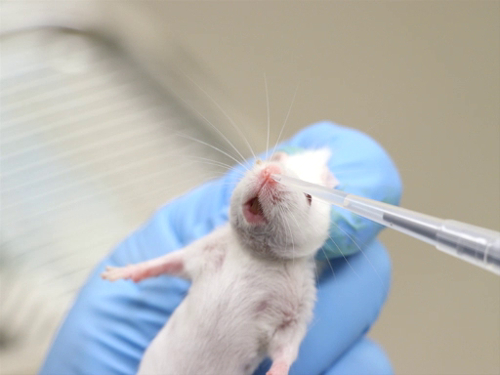
Figura 2. Somministrazione intranasale in topi coscienti.
- Somministrazione in animali incoscienti
- L'uso di anestetici per inalazione consente un animale immobilizzato durante l'avvicinamento e la consegna del composto. Ciò elimina la possibilità che l'animale morda l'attrezzatura di dosaggio, la perdita del composto a causa di scatti della testa e lesioni al tessuto nasale, agli occhi o alla pelle del viso dell'animale. L'animale ha anche meno probabilità di sbuffare e spruzzare il composto dalle narici al momento della somministrazione.
- Metti l'animale in posizione supina. La posizione della testa influenza il posizionamento della soluzione nelle narici. È stato dimostrato che la posizione ideale per la consegna del SNC è con l'animale supino; questo permette un migliore assorbimento. 2
- Somministrare metà del composto direttamente in un lato dell'apertura nasale, cronometrandolo con l'inalazione. Quindi, gira l'animale.
- Come sopra, somministrare l'altra metà del volume nell'altra apertura nasale.

Figura 3. Somministrazione intranasale in topi incoscienti.
3. Somministrazione intracranica in topi e ratti neonatali
- Topi o ratti devono essere anestetizzati per iniezioni intracranico.
| Topo | Ratto | ||
| Età (giorni) | Calibro dell'ago (g) | Età (giorni) | Calibro dell'ago (g) |
| 0-7 | 29-30 | 0-5 | 27-29 |
| 7-14 | 27 | 5-10 | 25-27 |
| 14-28 | 25 | 10-14 | 25 |
| Età (giorni) | Lunghezza ago (mm) | Età (giorni) | Lunghezza ago (mm) |
| 0-7 | 2 | 0-4 | 2-3 |
| 7-14 | 3 | 4-7 | 3 |
| 14-21 | 4 | 7-10 | 4 |
| 21-28 | 5 | 10-14 | 5 |
| Età (giorni) | Volume (μL) | Età (giorni) | Volume (μL) |
| 0-5 | < 20 | 1-3 | < 20 |
| 6-20 | < 60 | 4-10 | < 60 |
| 20-28 | < 100 | 11-14 | < 100 |
Tabella 1. Calibro dell'ago, lunghezza dell'ago e volume massimo di somministrazione intracranica secondo l'età di topi e ratti. 4
- Attrezzatura
- Determinare il misuratore dell'ago corretto e il volume massimo di somministrazione come da Tabella 1.
- Preparare una protezione dell'ago prima di anestetizzare l'animale.
NOTA: La profondità di iniezione dell'ago è controllata attraverso l'uso di una protezione creata con il cappuccio dell'ago.- Per creare la protezione, un ago viene misurato rispetto al cappuccio dell'ago e un segno viene posto sul cappuccio per indicare dove tagliare. Il taglio deve essere effettuato in modo che da 2 a 5 mm dell'ago siano esposti quando il cappuccio viene sostituito sull'ago.
- La lunghezza dell'ago esposto deve essere abbastanza lunga da penetrare nella pelle e nel cranio e raggiungere la profondità desiderata nel cervello.
- Le lunghezze degli aghi necessarie per topi e ratti sono elencate nella Tabella 1.
- È necessaria una fonte di riscaldamento per prevenire l'ipotermia nei cuccioli. Esistono diversi tipi: una piastra riscaldante elettrica impostata sul basso, una coperta d'acqua circolante o una sacca di calore a reazione chimica riutilizzabile.
- Limitazione
- I cuccioli di topo e ratto di 10 giorni o più giovani non richiedono anestesia per questa procedura. Tratteneteli manualmente tenendoli appena dietro la testa e tirando caudale la pelle per mettere una leggera pressione sulle spalle.
- Anestetizzare i cuccioli di età superiore ai 10 giorni con inalazione di isoflurano. Collegare una camera di induzione a un vaporizzatore di precisione o un barattolo a campana con un batuffolo di cotone imbevuto di isoflurano. Una volta che il cucciolo è immobilizzato, l'anestesia è efficace per circa 40 secondi, il che fornisce ampio tempo per l'iniezione.
- Tecnica di iniezione
- Aspirare la sostanza nella siringa e posizionare la guida del cappuccio/ago sull'ago.
- Il volume di iniezione raccomandato come volume massimo per topo o ratto neonatale è di 100 μL e quello per topi svezzati o anziani è fino a 300 μL.
- Per iniettare nella corteccia cerebrale dei neonati, inserire l'ago 5 mm dietro l'occhio, a circa 3 mm dalla linea mediana del cranio.
- Il sito di iniezione del topo di svezzamento è approssimativamente a metà strada tra l'occhio e l'orecchio e appena fuori dalla linea mediana.

Figura 4. Somministrazione intracranica in un cucciolo di topo.
Applicazione e Riepilogo
La somministrazione di composti negli animali può avere un effetto significativo sia sul benessere dell'animale che sull'esito dei dati sperimentali e sul valore scientifico. Il corretto metodo di consegna è essenziale per il successo dell'esperimento. Molti fattori devono essere considerati per determinare la via migliore, tra cui l'obiettivo scientifico dello studio, il pH della sostanza, il volume di dosaggio richiesto, la viscosità della sostanza e il benessere degli animali. La competenza tecnica è anche un requisito per tutti i metodi di iniezione.
Vai a...
Video da questa raccolta:

Now Playing
Amministrazione composta III
Lab Animal Research
31.7K Visualizzazioni

Tecniche di manipolazione e contenzione dei roditori
Lab Animal Research
176.0K Visualizzazioni

Procedure di assistenza di base
Lab Animal Research
28.1K Visualizzazioni

Fondamenti di allevamento e svezzamento
Lab Animal Research
35.9K Visualizzazioni

Identificazione dei roditori I
Lab Animal Research
55.1K Visualizzazioni

Identificazione dei roditori II
Lab Animal Research
25.7K Visualizzazioni

Amministrazione composta I
Lab Animal Research
101.4K Visualizzazioni

Amministrazione composta II
Lab Animal Research
35.2K Visualizzazioni

Somministrazione composta IV
Lab Animal Research
52.1K Visualizzazioni

Prelievo di sangue I
Lab Animal Research
172.8K Visualizzazioni

Astinenza di sangue II
Lab Animal Research
74.0K Visualizzazioni

Induzione e manutenzione dell'anestesia
Lab Animal Research
51.1K Visualizzazioni

Considerazioni per la chirurgia dei roditori
Lab Animal Research
22.6K Visualizzazioni

Necroscopia diagnostica e prelievo di tessuti
Lab Animal Research
58.5K Visualizzazioni

Raccolta di tessuti sterili
Lab Animal Research
35.0K Visualizzazioni