Astinenza di sangue II
Panoramica
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Università di Notre Dame, IN
La raccolta di sangue da topi e ratti per l'analisi può essere effettuata attraverso una varietà di metodi. Ogni metodo di raccolta ha variazioni nel tipo di ritenuta richiesta, nell'invasività della procedura e nella necessità di un anestetico generale. 1 Storicamente, l'uso della cavità del seno retro-orbitale è stato usato, ma non senza dibattito. La controversia relativa al potenziale danno tissutale, o addirittura alla cecità, causato da sanguinamenti retro-orbitali ha portato allo sviluppo di metodi di sanguinamento delle vene facciali e sottomandibolari nei topi. La raccolta di sangue dalla vena safena sia nei topi che nei ratti è un'altra tecnica che è stata sviluppata. Queste procedure non richiedono anestesia e quindi sono adatte quando l'uso di anestetici può confondere i risultati del sangue o altri dati.
Principi
C'è una vena facciale nel topo che corre dal plesso oculare attraverso la guancia e una vena sottomandibolare che corre lungo la mascella inferiore. Entrambi i vasi convergono nella vena giugulare appena sotto la linea della mascella, rendendoli facilmente accessibili. I campioni seriali possono essere prelevati da entrambe le navi alternando il lato utilizzato. Tuttavia, nessuna delle due parti dovrebbe essere usata più spesso di ogni 5-7 giorni. 2
È necessario prendere precauzioni durante l'esecuzione di un sanguinamento della vena facciale. Poiché il condotto uditivo si trova vicino alla vena facciale, se la punta della lancetta è diretta caudale, il canale verrà perforato. Ciò si tradurrà in un effetto sifone che causa il sangue a venire dall'orecchio. Nonostante questo, il sangue può ancora essere raccolto e il topo non subirà alcun danno permanente. Tuttavia, questo può far sì che l'animale scuota la testa, schizzando sangue nella gabbia.
Quando si sanguina dalla vena sottomandibolare, la profondità di inserimento dell'ago è fondamentale. Una profondità di inserimento superiore a 4-5,5 mm può causare traumi ai muscoli, ai nervi e ad altri vasi che si trovano nella testa, nel collo e nella cavità orale. Le complicazioni successive includono un'eccessiva emorragia con conseguente ipovolemia, annegamento causato dal fluido in bocca e danni alle strutture orali che interferiscono con mangiare e bere.
La moderazione dell'animale è fondamentale per un sanguinamento di successo sia per la vena facciale che per le procedure della vena sottomandibolare. Se la presa sulla collottola è troppo stretta, il flusso di sangue alla vena facciale può essere limitato. Ciò comporterà una riduzione del volume raccolto. I volumi di raccolta variano sia sulla vena facciale che sul sanguinamento della vena sottomandibolare. È imperativo limitare i volumi di raccolta in modo che non superino il volume massimo per la raccolta di sangue di sopravvivenza in conformità con le politiche istituzionali e un protocollo animale approvato. Garantire l'emostasi una volta raccolta la quantità desiderata impedirà una perdita di sangue aggiuntiva o eccessiva. 2
La raccolta di sangue dalla vena safena è un'altra valida alternativa per le emorragie seriali. La vena safena laterale è un vaso superficiale che corre dorsalmente, e poi lateralmente, attraverso l'articolazione tarsale. 3 Sebbene questa procedura possa essere esteticamente più accettabile del sanguinamento retro-orbitale, a causa della preparazione richiesta e dell'uso dell'anestesia per questo metodo, potrebbe effettivamente essere più stressante per l'animale. Le complicazioni che possono derivare da un sanguinamento safeno sono correlate al sito di puntura. Se la puntura dell'ago non è direttamente sulla nave, il sangue può pool in modo sottocutaneo, causando un ematoma. Lividi, possibili infezioni e favore dell'arto sono altri possibili problemi. Questo metodo richiede allenamento, ma è facilmente afferrato. I volumi raccolti con questo metodo sono compresi tra 10-150 μL, a seconda della frequenza di campionamento. 4 I campioni sono di qualità variabile in quanto possono contenere prodotti tissue. Non devono essere prelevati più di quattro campioni di sangue entro un periodo di 24 ore dalla stessa gamba.
La vena femorale è un'altra opzione per la raccolta del sangue su un ratto. La vena femorale corre sull'aspetto mediale della zampa posteriore dall'inguine all'articolazione del ginocchio prima di attraversare il ginocchio e diventare il safeno laterale, rendendolo facilmente accessibile. Sebbene questa procedura possa essere eseguita senza l'uso di un anestetico, richiede due persone una persona terrà la gamba nel punto in cui la gamba e l'addome si collegano per occludere la vena, mentre l'altra esegue la venipuntura e raccoglie il sangue.
Il vantaggio di utilizzare la vena femorale è che un volume maggiore viene raccolto più facilmente da esso che dalla vena safena. Tuttavia, poiché la vena femorale è grande, è soggetta alla formazione di ematomi. Questo può essere esacerbato da una presa troppo salda sulla gamba, che può causare ulteriori lividi. Con questo metodo di raccolta del sangue, vi è una variazione nella quantità di sangue raccolto a causa del sanguinamento dopo la rimozione dell'ago. È imperativo garantire l'emostasi per prevenire questa eccessiva perdita di sangue.
Procedura
1. Sanguinamento della vena facciale nei topi
- Attrezzatura
- La raccolta del sangue proviene da una cattura libera in un tubo di sangue o in un tubo di Eppendorf. In alcuni casi, è auspicabile raccogliere il sangue direttamente nei tubi dell'ematocrito.
- Le lancette della verga d'oro saranno selezionate in base alla dimensione appropriata per l'animale in base all'età e al sesso.
- Le lancette sono selezionate in base all'età / dimensione dei topi come segue:
Lancetta da 4 mm: topi di 3-4 settimane (meno di 15 grammi di peso corporeo)
Lancetta da 5 mm: topi femmina sotto le 10 settimane (meno di ~ 20 grammi di peso corporeo)
Lancetta da 5 mm: topi maschi sotto le 6 settimane (meno di ~ 20 grammi di peso corporeo)
Lancetta da 5 mm: per campioni a goccia singola (per strisci di sangue)
Lancetta da 5,5 mm: topi femmina per 10 settimane (oltre ~ 20 grammi di peso corporeo)
Lancetta da 5,5 mm: topi maschi per 6 settimane (oltre ~ 20 grammi di peso corporeo)
Lancetta da 5,5 mm: campioni di grandi dimensioni
- Le lancette sono selezionate in base all'età / dimensione dei topi come segue:
- Limitazione
- I topi sono trattenuti usando la tecnica dello scruffing.
- È importante ridurre al minimo il movimento da un lato all'altro della testa. Ciò garantisce una venipuntura accurata e sicura con la lancetta.
- Astinenza di sangue
- La lancetta di dimensioni adeguate è tenuta perpendicolare alla superficie della pelle.
- La punta della lancetta è leggermente inclinata, con la punta rivolta verso il naso.
- La lancetta è utilizzata al meglio in posizione verticale.
- Mentre si trattiene il mouse, individuare l'area approssimativa della vena facciale misurando la lunghezza dell'occhio sotto il canthus laterale e la larghezza dell'occhio caudale.
- Con la punta della lancetta, senti delicatamente il punto in cui termina la mascella.
- Per una migliore precisione nella perforazione della nave, posizionare il mouse in posizione laterale.
- Perfora la pelle fino alla spalla della lancetta a quel punto. Questo viene fatto con una spinta ferma e non come lanciare un dardo.
- Dopo la rimozione della lancetta, il sangue inizierà a fluire.
- Per aiutare il flusso sanguigno, posizionare il mouse con la testa più in basso rispetto al cuore.
- Raccogliere il sangue nel vaso di raccolta desiderato.
- Tamponare il sito di puntura e rilasciare la pressione sulla collottola per l'emostasi.
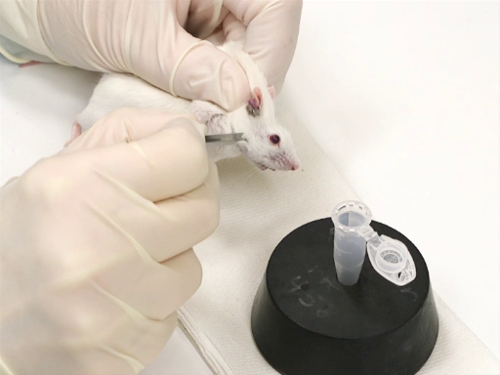
Figura 1. Sanguinamento della vena facciale nei topi.
2. Sanguinamento sottomandibolare nei topi: Sebbene molto simile alla tecnica per il sanguinamento della vena facciale, ci sono variazioni nell'attrezzatura e sottili differenze in questa procedura di sanguinamento.
- Attrezzatura
- La raccolta del sangue proviene da una cattura libera in un tubo di sangue o in un tubo di Eppendorf. In alcuni casi, è auspicabile raccogliere direttamente nei tubi dell'ematocrito.
- Gli aghi calibro 18-22 vengono selezionati in base alle dimensioni appropriate per l'animale in base all'età e al sesso.
- Gli aghi sono selezionati in base all'età / dimensione dei topi come segue:
Calibro 22: topi di 3-4 settimane (meno di 15 grammi di peso corporeo)
Calibro 20: topi femmina sotto le 10 settimane (meno di ~ 20 grammi di peso corporeo)
Calibro 20: topi maschi sotto le 6 settimane (meno di ~ 20 grammi di peso corporeo)
Calibro 20: per campioni a goccia singola (per strisci di sangue)
Calibro 18: topi femmina per 10 settimane (oltre ~ 20 grammi di peso corporeo)
Calibro 18: topi maschi per 6 settimane (oltre ~ 20 grammi di peso corporeo)
Calibro 18: campioni di grandi dimensioni
- Gli aghi sono selezionati in base all'età / dimensione dei topi come segue:
- Limitazione
- I topi sono trattenuti usando la tecnica dello scruffing.
- È importante ridurre al minimo il movimento da un lato all'altro della testa. Ciò garantisce una venipuntura accurata e sicura con l'ago.
- Astinenza di sangue
- L'ago è tenuto perpendicolare alla superficie della pelle.
- Mentre trattenete il mouse, individuare l'area approssimativa della vena sottomandibolare dal punto in cui una linea dall'angolo della bocca interseca una linea dal canthus laterale dell'occhio. Questo coincide con una piccola fossetta glabre trovata caudale all'angolo della bocca e leggermente al di sotto della linea della mascella.
- Per una migliore precisione nella perforazione della nave, posizionare il mouse in posizione laterale.
- Forare la pelle con la punta dell'ago in quel punto. Questo viene fatto con una spinta ferma e non come lanciare un dardo.
- L'ago non viene inserito oltre la punta della smussatura.
- Dopo la rimozione dell'ago, il sangue inizierà a fluire.
- Per aiutare il flusso sanguigno, posizionare il mouse con la testa più in basso rispetto al cuore.
- Raccogliere il sangue nel vaso di raccolta desiderato.
- Tamponare il sito di puntura e rilasciare la pressione sulla collottola per l'emostasi.

Figura 2. Sanguinamento della vena sottomandibolare nei topi.
3. Sanguinamento safeno
- Attrezzatura
- I coni di ritenuta flessibili in plastica trasparente possono essere utilizzati sia per il topo che per il ratto. Per i topi, i tubi conici in plastica da 50 milliliter modificati possono essere utilizzati per il contenimento. Per i ratti, possono essere utilizzati tubi di ritenuta in plexiglas modificati, con una fessura abbastanza larga da estendere la zampa posteriore.
- Quando si utilizza il cono di plastica, viene misurato rispetto alla lunghezza del corpo dell'animale e un foro ovale viene tagliato a livello della coscia.
- Un tubo conico può essere modificato per un topo per questo metodo di raccolta del sangue tagliando l'estremità del tubo per consentire un foro di respirazione. Una fessura viene tagliata dall'estremità del cappuccio del tubo larga circa 1/2 pollice e lunga 2 pollici. I bordi sono coperti con nastro di stoffa o levigati per la sicurezza degli animali.
- Un laccio emostatico viene prodotto utilizzando una siringa da 3 cc e una lunghezza di sutura non assorbibile 2-0. 3
- Triplo unguento antibiotico o vaselina bianca viene utilizzato come barriera a prova di umidità sulla pelle.
- Un ago calibro 22 è la dimensione preferita per la venipuntura.
- Il sangue viene raccolto direttamente nei tubi dell'ematocrito.
- Limitazione
- Coni flessibili in plastica
- Il topo o il ratto viene posto prima nel naso del cono.
- L'estremità del cono viene piegata e chiusa utilizzando una piccola clip legante per impedire all'animale di uscire dal cono di ritenuta.
- La zampa posteriore viene delicatamente tirata attraverso l'apertura ovale all'inguine.
- Tubo conico per topi
- Il mouse viene posizionato prima nel naso del tubo.
- La zampa posteriore viene delicatamente guidata nella fessura.
- Il dito medio è posizionato sopra l'estremità del tubo per impedire al mouse di uscire dal tubo.
- L'indice e il pollice stabilizzano la gamba del mouse.
- Tubo di ritenuta in plexiglas per ratti
- Il ratto viene posto nel naso del tubo prima.
- La zampa posteriore viene delicatamente guidata nella fessura.
- L'estremità del tubo è fissata per impedire al ratto di eseguire il backup e uscire dal tubo.
- L'indice e il pollice stabilizzano la gamba del ratto.
- Coni flessibili in plastica
- Astinenza di sangue
- I peli vengono rimossi dall'aspetto laterale della gamba dal garretto al soffocamento. Questo può essere fatto spennando, radendo o usando una crema depilatoria.
- Una volta rimossi i capelli, viene applicata una piccola quantità di unguento e distribuita in uno strato molto sottile sulla zona glagra.
- Il laccio emostatico viene applicato il più cranicamente possibile e stretto.
- Il vaso safeno che attraversa la superficie esterna della gamba dal ginocchio alla caviglia inizierà a riempirsi e diventerà sollevato e facile da visualizzare.
- L'ago è tenuto perpendicolare alla superficie della pelle direttamente sopra il vaso sanguigno. Forare la nave. Fare attenzione a non inserire l'ago in profondità nella gamba, per evitare di perforare il muscolo o colpire l'osso.
- Il sangue verrà permeato sulla superficie della gamba per la raccolta con il tubo dell'ematocrito.
- Una volta che il sangue è stato raccolto, allentare il laccio emostatico e applicare pressione sulla puntura per l'emostasi.
- Una volta che il sanguinamento si è fermato, rimuovere l'animale dalla ritenuta e riportarlo nella gabbia di casa.
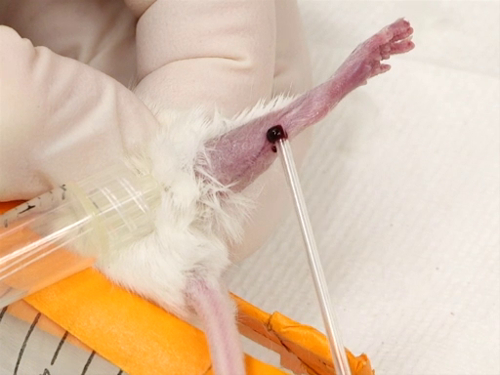
Figura 3. La vena safena sanguina nei topi.
4. Vena femorale per ratti
- Attrezzatura
- Il sangue viene raccolto in un tubo di ematocrito.
- Triplo unguento antibiotico è necessario per creare una barriera tra la pelle / capelli e la goccia di sangue.
- Un ago calibro 22 viene utilizzato per perforare la vena.
- Un piccolo tagliacapelli portatile con una lama larga circa 1 "viene utilizzato per tagliare i capelli dalla gamba.
- Limitazione
- I ratti sono trattenuti usando un cono di contenimento in plastica trasparente e flessibile.
- I coni di plastica sono misurati rispetto alla lunghezza del corpo e un foro ovale tagliato a livello della coscia. Il cono è tagliato in modo tale che la zampa posteriore possa essere esternata con accesso alla vena.
- Astinenza di sangue
- I capelli vengono rasati dalla superficie interna della gamba dall'inguine al ginocchio.
- L'unguento antibiotico triplo viene applicato in uno strato sottile nel sito di puntura.
- La persona di contenimento occlude la vena e tiene il ratto con la superficie interna della gamba rivolta verso il flebotomista.
- Utilizzare l'ago per perforare la vena. L'ago viene tenuto perpendicolarmente al vaso sanguigno e la puntura viene eseguita direttamente sulla vena.
- La puntura viene effettuata il più vicino possibile al ginocchio, consentendo un ulteriore campionamento anteriore al primo sito di raccolta del sangue.
- La nave è superficiale. Pertanto, la profondità della puntura non deve essere più profonda della lunghezza della smussatura dell'ago.
- Per aiutare il flusso sanguigno, posizionare il ratto con la gamba più bassa del cuore.
- Raccogli il sangue nei tubi dell'ematocrito mentre perla sulla superficie della pelle.
- Rilasciare la pressione sulla gamba e applicare pressione sul sito di puntura per ottenere l'emostasi.
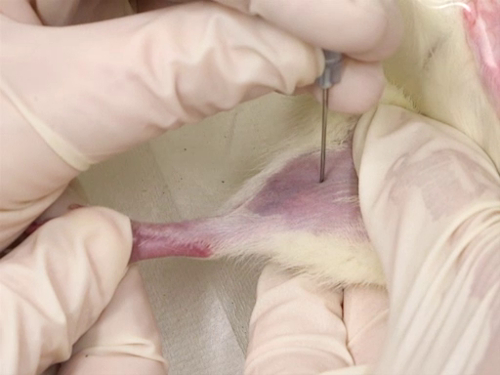
Figura 4. La vena femorale sanguina nei ratti.
Applicazione e Riepilogo
Il metodo di raccolta del sangue può causare una variazione nell'analisi del campione. Il livello di abilità del tecnico che esegue la raccolta dei campioni ha un impatto sulla qualità del campione e sul benessere dell'animale. L'uso di anestetici può anche influenzare la qualità del campione. I metodi qui descritti sono tutti eseguiti senza l'uso di anestesia, quindi quella variabile è stata eliminata. Inoltre, tutte queste tecniche possono essere utilizzate per il campionamento seriale con il minimo disagio per l'animale.
Riferimenti
- Fernandez, I., Arantza, P., Del Teso, N., Perez, V. and Rodriguez-Cuesta, J. 2010. Clinical biochemistry parameters in C57BL/6J mice after blood collection from the submandibular vein and retroorbital plexus. Journal of American Association of Laboratory Animal Science. 49:2. 202-210.
- Joslin, O.T. 2009. Blood collection techniques in exotic small animals. Journal of Exotic Pet Medicine. 18:2. 117-139.
- Hem, A., Smith, A.J. and Solberg, P. 1998. Saphenous vein puncture for blood sampling of the mouse, rat, hamster, gerbil, guinea pig, ferret and mink. Laboratory Animals. 32. 364-368.
- Diehl, K-H., Hull, R., Morton, D., Pfister, R. Rabemampianina, Y., Smith, D., Vidal, J-M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Astinenza di sangue II
Lab Animal Research
73.5K Visualizzazioni

Tecniche di manipolazione e contenzione dei roditori
Lab Animal Research
175.0K Visualizzazioni

Procedure di assistenza di base
Lab Animal Research
28.0K Visualizzazioni

Fondamenti di allevamento e svezzamento
Lab Animal Research
35.8K Visualizzazioni

Identificazione dei roditori I
Lab Animal Research
54.9K Visualizzazioni

Identificazione dei roditori II
Lab Animal Research
25.6K Visualizzazioni

Amministrazione composta I
Lab Animal Research
100.9K Visualizzazioni

Amministrazione composta II
Lab Animal Research
35.0K Visualizzazioni

Amministrazione composta III
Lab Animal Research
31.5K Visualizzazioni

Somministrazione composta IV
Lab Animal Research
51.8K Visualizzazioni

Prelievo di sangue I
Lab Animal Research
172.0K Visualizzazioni

Induzione e manutenzione dell'anestesia
Lab Animal Research
50.8K Visualizzazioni

Considerazioni per la chirurgia dei roditori
Lab Animal Research
22.5K Visualizzazioni

Necroscopia diagnostica e prelievo di tessuti
Lab Animal Research
58.2K Visualizzazioni

Raccolta di tessuti sterili
Lab Animal Research
34.9K Visualizzazioni