药物注射 III
Overview
来源: 凯斯图尔特, RVT, RLATG, CMAR;瓦莱丽. 施罗德, RVT, RLATG。圣母大学, 在
在实验室小鼠和大鼠中有许多常用的复合用药路线。然而, 某些协议可能需要使用不太常用的路线, 包括皮内、鼻腔和颅内注射。专业培训对于这些程序的成功执行至关重要。为获得机构动物保育和使用委员会 (IACUC) 批准, 可能需要提供这些路线的理由。
Principles
Intraderma linjections 被送到真皮的外层, 在上层皮肤层 (表皮) 下面。这一注射路线通常是为评估炎症, 皮肤血流诊断, 或过敏反应的抗原.
虽然经常用于局部接种疫苗或充血喷雾, 鼻腔管理也可用于全身和中枢神经系统 (CNS) 分娩。鼻腔内的粘膜具有丰富的血管和神经, 可以快速全身吸收并直接靶向中枢神经系统。由小的亲油性分子组成的物质比含有较大分子的吸收率高得多。 2
虽然此程序不需要麻醉, 但它可以帮助在鼻孔上正确放置该化合物, 确保准确的剂量。已经证明, 与有意识的动物相比, 麻醉动物对大脑的药物传递量增加了五倍。 2 麻醉鼠对鼻腔的管理非常有抵抗力。然而, 有一项研究表明, 有效的分娩技术的鼻腔管理自由运动的大鼠。 3 此外, 警报动物可能会尝试咬住吸管尖端或针头, 使物质的传递困难.
鼻腔管理的优点是, 这种技术需要最少的训练和技能, 它是无创性的动物。然而, 由于可能的雾化, 使用生物安全柜和眼睛保护建议, 特别是当与有意识的动物工作。此外, 为了避免淹没动物, 最小剂量的可能应该使用。如果在这个过程中的任何时候, 紫绀, 口腔呼吸, 或其他痛苦的迹象在动物看到, 程序应立即流产.
成年小鼠和大鼠的颅内注射采用立体定向设备, 以确保注射的正确定位和深度。然而, 在小鼠3到28天的年龄, 和大鼠14天的年龄, 头骨是薄足以直接通过它注射;它太脆弱了, 不能支持立体定位装置。鼠或鼠幼崽应留与母亲, 直到程序, 并应尽快返回给她的程序完成后。Postinjection 护理包括对热源的持续监测, 直到观察到正常的运动和行为, 包括护理。使用这种技术的主要原因是为中枢神经系统提供药理学药物, 这就需要越过血脑屏障, 或避免系统性途径的影响。 1
Procedure
1. 皮内管理
- 大多数皮内注射是基化合物。解决方案必须在生理学上进行缓冲, 以获得中性的 pH 值, 以避免注射部位出现组织坏死.
- 针的大小范围是25-30 计, 最小的可能.
- 每个注射场的剂量范围是50-100 和 #181; 注射过量可能导致注射部位坏死, 或由于压力而在现场漏出该化合物.
- 为了准确地将针放置到皮内空间, 必须对小鼠和老鼠进行麻醉。吸入麻醉可以快速诱导和恢复;然而, 注射麻醉的好处是提供充足的时间来准备该地区和执行注射。 1
- 通过使用脱毛的奶油或通过剃须区域来删除注射部位的毛发。
- 彻底清除任何残留的脱毛膏或毛发碎片.
- 应用外用防腐剂, 如碘溶液、洗必泰溶液或酒精.
- 管理过程
- 在拇指和食指之间拉伸皮肤绷紧。这为皮肤定位针时提供了稳定性.
- 将针锥放在皮肤上.
- 轻轻地将针插入表皮和真皮之间的皮肤。前进的针刚刚超越斜面.
- 慢慢地注入物质。注射的化合物将产生水泡, 或小水泡, 在皮肤.
- 在注射后暂停, 以允许皮肤在取出针头前进行拉伸和调整.
- 注意事项
- 不需要在柱塞上拉回.
- 如果针插入皮下间隙, 则不形成疱疹。注射太深导致皮下注射.
- 避免印迹或擦拭区域, 因为这会导致化合物从注射场泄漏.
- 在执行多次注入时, 请将其间距, 使泡不重叠.
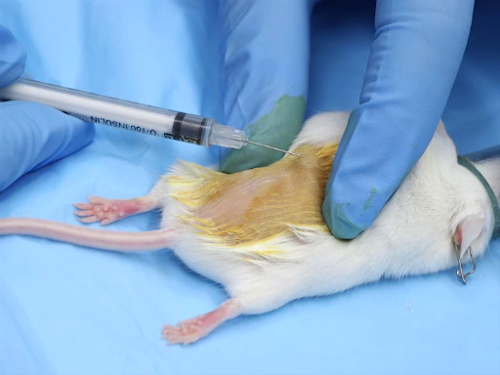
图1。小鼠皮内注射.
2. 鼻腔管理
- 设备
- 使用可校准的 micropipetting 单元吸管以提供精确的音量.
- 一次性吸管提示应用于避免交叉污染。TB 注射器、钝针和挠性导管也可用于配料.
- 大鼠总注射量不应超过40-100 和 #181; l, 应在6-10 和 #181 中给出; 我滴下对于小鼠, 最大总容积为24和 #181; l, 在3-4 和 #181 中给出; 我滴下.
- 有意识的动物管理
- 有意识动物中的手动约束要求头部相对静止, 以便将吸管尖端或钝针放在足够靠近鼻孔的位置以交付化合物, 但不那么接近用来戳或撕裂鼻腔组织.
- 抑制动物并将其保持在垂直位置.
- 在鼻腔开口处放置一小滴液体化合物。动物应该吸入水滴.
- 管理一个额外的卷, 交替鼻孔, 直到整个卷被给出.
- 在管理较大的卷时, 在限制时不收缩胸腔是很重要的。胸部压迫会阻碍动物进行足够深的呼吸, 使液体吸入支气管和肺部.
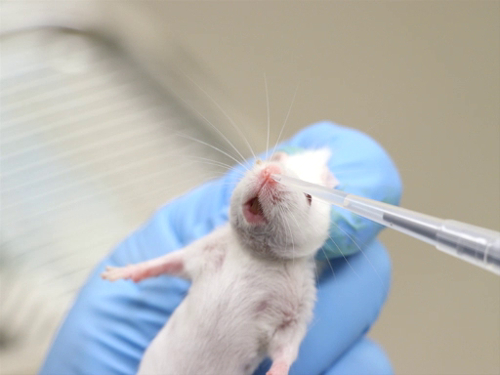
图2。有意识小鼠的鼻腔管理.
- 无意识动物中的管理使用吸入麻醉剂, 可以在该化合物的处理和交付过程中允许固定的动物。这就消除了动物咬药设备的可能性, 由于头部抽搐造成的化合物的损失, 以及动物和 #39; 鼻组织, 眼睛或脸部皮肤的损伤。该动物也不太可能吸吸和喷雾的化合物从鼻孔后管理.
- 将动物置于仰卧位。头部的位置会影响溶液在鼻孔中的放置。结果表明, 理想的中枢神经系统的位置是与动物仰卧;这样可以更好地吸收。 2
- 将一半的化合物直接插入鼻腔开口的一侧, 并定时吸入。然后, 把动物翻过来.
- 如上所示, 将另一半的音量管理到另一个鼻腔开口.

图3。无意识小鼠的鼻腔管理.
3. 新生鼠和老鼠的颅内管理
- 小鼠或大鼠必须麻醉颅内注射.
| 鼠标 | Rat | |||||
| 年龄 (天) | 针形计 (g) | 时间 (天) | 针计 (g) | |||
| 0-7 | 29-30 | 0-527-29 | ||||
| 7-14 | 27 | 25-27 | ||||
| 25 |
| 10-14 | 25 | | |||
| 时间 (天数) | 针长度 (mm) | 时间 (天) | 针长 (mm) | |||
| 0-7 | 2 | 2-3 | 0-4||||
| 3 | 4-7 | 3 | ||||
| 14-21 | 4 | 4 | ||||
| 5 | 10-14 | 5 | ||||
| 时间 (天) | 卷 (天) | 时间 (日期) (#181) | (和 #181;0-5 | 和 #60; 20 | #60; 20 | 、|
| 6-20 | #60; 60 | 4-10 | & #60; 60 | |||
| 20-28 | #60; 100 | 11-14 | #60; 100 | |||
表1。针规, 针长和根据小鼠和大鼠的年龄, 颅内管理的最大容积。 4
- 设备
- 根据 表 1 确定正确的针距和最大管理量.
- 在麻醉之前准备一个针头保护.
注: 针的注射深度是通过使用针帽所产生的护罩来控制的。- 要创建防护针, 可对针帽进行测量, 并在帽上放置一个标记以指示要剪切的位置。应作出削减, 使2至5毫米的针头被暴露时, 在针上更换的上限.
- 暴露的针头长度必须足够长才能穿透皮肤和头骨, 并达到大脑所需的深度.
- 鼠标和老鼠所需的针长度列在 表 1 中.
- 需要加热源来防止幼崽的体温过低。有几种类型: 电加热垫设置在低, 循环水毯, 或可重复使用的化学反应热袋.
- 限制
- 鼠标和大鼠幼崽10天或更小的年龄不需要麻醉这个程序。通过把它们放在头后, 并拉动皮肤尾, 以施加轻微的压力, 以手动方式抑制他们的肩膀.
- 麻醉幼崽超过10天的年龄与异氟醚吸入。将感应室连接到精密汽化器或用异氟醚浸泡棉球的钟罐中。一旦幼犬被固定, 麻醉是有效的大约40秒, 这为注射提供了充足的时间.
- 注塑技术
- 将物质放入注射器中, 并将瓶盖/针指南置于针头上.
- 推荐的注射量为每只新生鼠或大鼠的最大容积为100和 #181; 而对于断奶或年长的老鼠, 则为300和 #181; l.
- 注射入新生儿大脑皮层, 在眼球后插入5毫米的针, 大约3毫米的头骨的中线.
- 断奶小鼠的注射部位大约是眼睛和耳朵之间的一半, 而只是中线.

图4。颅内管理在老鼠的小狗.
Application and Summary
对动物的化合物进行管理可以对动物的福祉和实验数据的结果和科学价值产生重大影响。正确的分娩方式对实验的成功至关重要。必须考虑许多因素来确定最佳路线, 包括研究的科学目的、物质的 pH 值、所需的剂量量、物质的黏度以及动物的福祉。技术专长也是所有注塑方法的要求.
Tags
跳至...
此集合中的视频:

Now Playing
药物注射 III
Lab Animal Research
31.7K Views

啮齿动物的处理和克制技术
Lab Animal Research
176.1K Views

基本护理程序
Lab Animal Research
28.2K Views

育种和断奶的基本原理
Lab Animal Research
35.9K Views

啮齿动物识别 I
Lab Animal Research
55.1K Views

啮齿动物鉴定 (2)
Lab Animal Research
25.8K Views

药物注射 I
Lab Animal Research
101.4K Views

药物注射 II
Lab Animal Research
35.2K Views

药物注射 IV
Lab Animal Research
52.2K Views

血液采集 I
Lab Animal Research
172.9K Views

血液采集 II
Lab Animal Research
74.0K Views

麻醉诱导与维护
Lab Animal Research
51.1K Views

啮齿动物手术的考虑事项
Lab Animal Research
22.6K Views

诊断尸检和组织采集
Lab Animal Research
58.5K Views

无菌组织采集
Lab Animal Research
35.0K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。