Amministrazione composta I
Panoramica
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Università di Notre Dame, IN
Poiché molti protocolli di ricerca richiedono che una sostanza venga iniettata in un animale, la via di consegna e la quantità della sostanza devono essere determinate con precisione. Ci sono diverse vie di somministrazione disponibili nel topo e nel ratto. Quale via d'uso è determinata da diversi fattori della sostanza da iniettare: il pH della soluzione, il volume richiesto per il dosaggio desiderato e la viscosità della soluzione. Gravi danni ai tessuti possono verificarsi se una sostanza viene somministrata in modo errato. Questo video esamina i vari metodi di contenimento e i dettagli tecnici per le vie di iniezione più comunemente utilizzate.
Principi
Poiché molti dei composti di prova utilizzati nella ricerca biomedica sono nuove sostanze che non sono disponibili in commercio, è fondamentale una corretta preparazione della sostanza. Devono essere affrontate le preoccupazioni fondamentali di sterilità, viscosità e compatibilità fisiologica della formulazione del composto in esame e del mezzo o veicolo in cui è disciolto/sospeso. Una soluzione dosatrice, somministrata per via enterale o parentela, deve essere fisiologicamente tamponata al pH corretto affinché il composto sia correttamente assorbito e per prevenire lesioni tissutali. La viscosità di una soluzione può essere il fattore determinante della via di iniezione. Una sostanza troppo spessa per passare attraverso l'ago di piccolo calibro necessario per i siti di iniezione comunemente usati in un topo può richiedere una riformulazione per la somministrazione orale. Tutte le soluzioni che devono essere iniettate per via parentela devono essere sterili per evitare l'introduzione di agenti patogeni nell'animale. 1
La selezione dell'ago per iniezioni si basa sulla via di somministrazione, sulla viscosità della soluzione e sulle dimensioni dell'animale. In generale, dovrebbe essere scelto il calibro più piccolo possibile per amministrare la soluzione; questo di solito è calibro 22-30 nel mouse e calibro 20-25 per il ratto. La siringa da selezionare è di nuovo la più piccola possibile con le graduazioni corrette necessarie per un dosaggio accurato. 2,3,4
Esistono diverse vie per le iniezioni parenterali. Ai fini di questo video, vengono discusse le vie più comunemente utilizzate (sottocutanea [SQ], intraperitoneale [IP], endovenosa [IV] e intramuscolare [IM]). Altre tecniche di iniezione, come iniezioni intradermiche (ID), intracranica, intracardiaca, footpad, intranasale e endovenosa attraverso il plesso retro-orbitale sono trattate in un video diverso.
Il tasso di assorbimento dei composti varia in base al percorso. La via IV colloca la sostanza direttamente nel flusso sanguigno, eliminando qualsiasi tempo necessario per l'assorbimento. Una sostanza iniettata IM viene rapidamente assorbita a causa dell'abbondante numero di vasi all'interno del tessuto muscolare. Sebbene un'iniezione IP sia considerata somministrazione parenterale, il meccanismo di assorbimento è in realtà più simile al dosaggio orale. Il dosaggio sottocutaneo è un modo conveniente per somministrare un grande volume di liquido. Il tasso di assorbimento è più lento rispetto ad altre vie, fornendo un effetto sostenuto. La scelta del percorso è una componente essenziale del protocollo sperimentale. 4
La somministrazione sottocutanea colloca i materiali tra gli strati della pelle e il muscolo in uno spazio virtuale creato sollevando la pelle. Ciò consente l'iniezione sicura di volumi maggiori, poiché il fluido viene assorbito lentamente e il liquido in eccesso viene rapidamente escreto attraverso i reni. Ciò evita il sovraccarico di liquidi e l'edema polmonare, che può derivare da grandi volumi iniettati per via endovenosa. L'ago selezionato dovrebbe essere la dimensione più piccola possibile che consentirà la viscosità del materiale iniettato, generalmente un ago calibro 22-30 per topi e un ago calibro 22-25 per ratti. I volumi di iniezione variano da 0,1 ml a 0,5 ml per i topi e da 0,1 ml a 1,0 ml per i ratti, per sito di iniezione.
La via IP è comunemente usata nei roditori perché può essere utilizzata per la consegna di volumi maggiori rispetto a una via IV o IM. Tuttavia, l'assorbimento del materiale che viene somministrato IP è significativamente più lento di una via IM o IV. Si ritiene che le sostanze somministrate con questo metodo siano soggette al metabolismo epatico prima di entrare nel flusso sanguigno. 5 Ancora una volta, l'ago selezionato dovrebbe essere la dimensione più piccola possibile che consentirà la viscosità del materiale iniettato, generalmente un ago calibro 22-30 per topi e un ago calibro 22-25 per ratti. Per i topi, i volumi di iniezione variano da 0,05 ml a 1,0 ml per iniezione in base alle dimensioni del topo. Per i ratti, l'intervallo è compreso tra 0,1 ml e 1,5 ml per sito di iniezione.
Le iniezioni im, sebbene comunemente usate negli animali più grandi, hanno usi minimi nei topi e nei ratti a causa della loro piccola massa muscolare. L'iniezione impropria o ripetuta nel muscolo può causare danni ai nervi con conseguente paralisi o necrosi muscolare. L'ago selezionato dovrebbe essere la dimensione più piccola possibile che consentirà la viscosità del materiale iniettato, generalmente calibro 27-30. Per i topi, i volumi di iniezione vanno da 0,01 ml a un massimo di 0,05 ml per sito di iniezione per il muscolo gluteo. I volumi di iniezione per il gastrocnemio hanno un massimo di 0,05 ml. Al contrario, i volumi di iniezione nel ratto vanno da 0,01 ml a un massimo di 0,3 ml per sito di iniezione per il muscolo gluteo. I volumi di iniezione per il gastrocnemio hanno un massimo di 0,1 ml.
L'iniezione endovenosa è la via di somministrazione più efficace della sostanza, in quanto viene introdotta immediatamente nel sistema circolatorio. Tuttavia, con i recipienti sottodimensionati disponibili per il dosaggio IV nel mouse, la sua utilità è limitata. Se è necessaria una somministrazione endovenosa ripetuta, l'uso di porte di accesso vascolare o di altre attrezzature di dosaggio specializzate deve essere preso in considerazione per il benessere degli animali. L'ago selezionato dovrebbe essere la dimensione più piccola possibile che consentirà la viscosità del materiale iniettato, generalmente calibro 27-30. I volumi di iniezione vanno da 0,05 ml a un massimo di 0,5 ml per iniezione, in base alle dimensioni del topo.
| Rotta | Topo | Ratto | |||
| Calibro dell'ago (g) | Volume di iniezione (mL) | Calibro dell'ago (g) | Volume di iniezione (mL) | ||
| SC | 22–30 | 0.1–1.5 | 22–25 | 0.1–3.0 | |
| IP | 22–30 | 0.05–1.0 | 20–25 | 0.1–1.5 | |
| IM | 27–30 | 0,01–0,05 (gluteo/gastrocnemio) | 25–27 | 0,01-0,3 (gluteo)
0,01-0,1 (gastrocnemio) |
|
| IV | 27–30 | 0.05–0.5 | 22–25 | 0.05–4.0 | |
Tabella 1. Misuratore dell'ago appropriato e intervallo di volume di iniezione per topi e ratti a seconda della via.
Procedura
1. Iniezione sottocutanea
- Trattenere manualmente il mouse tramite la presa di ritenuta con una sola mano. Una volta afferrato, lasciare che il mouse riposi su un tavolo o su un'altra superficie sicura. Assicurati di evitare di esercitare pressione sul corpo del mouse.
- Appoggiare il tallone della mano sul tavolo per evitare un peso eccessivo sul mouse che può compromettere la respirazione. I topi possono anche essere trattenuti in un dispositivo commerciale. Per i ratti, è meglio usare un dispositivo di ritenuta commerciale.
- Afferra la pelle e tira verso l'alto per creare una tenda di pelle. Se si utilizza un dispositivo di ritenuta, potrebbe essere necessario un pince per afferrare la pelle attraverso la fessura sulla parte superiore.
- Inserire l'ago parallelo alla colonna vertebrale, diretto lontano dalla testa alla base della piega cutanea della tenda. Dirigere l'ago lontano dalla testa per evitare la possibilità di punture al cranio, poiché l'osso del cranio del topo è molto sottile. I ratti hanno la tendenza a rialzare la testa, il che potrebbe causare l'iniezione da inserire nei muscoli del collo.
- Inserire la smussatura dell'ago per consentire una leggera scivolata nella pelle. Si noti che l'ago viene inserito sotto le dita afferrando la pelle. Per migliorare la sicurezza durante l'iniezione di articoli biosciepi, la pelle viene afferrata con una pinza, eliminando così la possibilità di lesioni da aghi.
- Tirare indietro lo stantuffo per verificare il corretto posizionamento. Se l'aria viene aspirata nella siringa, indica che la punta dell'ago non è posizionata sotto la pelle e dovrà essere ritirata e riposizionata. Se c'è una ripressione quando lo stantuffo viene tirato indietro, indica il corretto posizionamento dell'ago e che l'iniezione può procedere.
- Iniettare la sostanza lentamente con un movimento costante. Per evitare la perdita dell'articolo di iniezione, fare una pausa dopo l'iniezione, ruotare leggermente l'ago sotto la pelle e pizzicare la pelle nel sito di iniezione mentre si preleva l'ago.
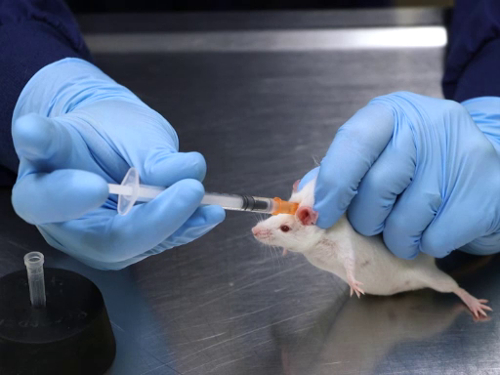
Figura 1. Iniezione sottocutanea nei topi.
2. Iniezione intraperitoneale
- Il metodo di ritenuta manuale con una sola mano viene utilizzato per questa tecnica di iniezione nei topi. Regola la mano in modo che sia posizionata abbastanza in alto sul collo per evitare che il mouse giri.
- Afferrare la pelle sciolta alla nuca tra il pollice e l'indice.
- Stabilizzare i quarti posteriori bloccando la pelle sciolta lungo la schiena tra il secondo, il terzo e il quarto dito e la base del pollice, oppure posizionando la coda tra il terzo e il quarto dito.
- L'iniezione IP nel ratto richiede due persone, una per trattenere il ratto e l'altra per eseguire l'iniezione.
- Afferrare il topo sulle spalle usando l'indice e il medio su ciascun lato del collo e il palmo sulla schiena. Il pollice e il terzo e il quarto dito dovrebbero circondare il torace per impedire il movimento in avanti o indietro. La posizione delle dita su ciascun lato del collo impedisce al ratto di girare la testa.
- Sollevare il ratto e girarlo per esporre l'addome ventrale.
- Stabilizzare i quarti posteriori afferrando saldamente i piedi e la coda ed estendendoli lontano dal corpo.
- Posizionare il topo o il ratto per esporre l'addome, assicurandosi che sia rivolto verso l'alto.
- Inclinare l'animale con la testa rivolta verso il basso con un angolo di circa 30°, per permettere all'intestino di cadere in avanti.
- I punti di riferimento dell'iniezione sono i seguenti:
- L'area da iniettare è delimitata cranicamente da una linea immaginaria che si estende orizzontalmente attraverso il corpo nella parte superiore dell'anca (da un fianco all'altro).
- La linea mediana è il bordo mediale, riconosciuto come il punto in cui si incontrano i capelli che crescono in direzioni opposte. Negli animali glatti, la linea mediana si estende in linea retta dallo xifoide all'ano.
- Il bordo laterale è una linea dalla parte superiore dell'anca al prepuzio nel maschio, e dalla parte superiore dell'anca e seguendo le tettareane nella femmina.
- Ciò fornisce un'area triangolare per un'iniezione sicura.
- Iniezione di un articolo all'interno dei punti di riferimento
- Inserire un ago perpendicolare alla colonna vertebrale, fuori dalla linea mediana, nel triangolo come descritto sopra. Posizionare l'ago con un angolo di 90 ° rispetto al piano del corpo consente un'iniezione sicura utilizzando entrambi i lati dell'addome. Ciò è particolarmente importante con iniezioni multiple, in quanto riduce al minimo il trauma tissutale consentendo l'alternanza dei siti di iniezione.
- Quando l'ago viene posizionato con un angolo di 90 °, "scoppia" nell'addome, consentendo una più facile determinazione della profondità. Questo è anche un segnale visivo e tattile che l'ago è posizionato correttamente.
- Aspirare la siringa per garantire il posizionamento all'interno della cavità peritoneale e non all'interno della vescica urinaria, dell'intestino o delle strutture vascolari.
- Evitare di iniettare caudally nel topo maschio per evitare di somministrare l'articolo nel sacco scrotale. Evitare di iniettare nella tettarella della femmina per prevenire traumi.

Figura 2. I punti di riferimento per l'iniezione intraperitoneale nei topi.
3. Iniezione intramuscolare
- La moderazione per questa tecnica per topi e ratti richiede due persone o l'uso di un tubo di ritenuta. Descritto qui è un metodo per una persona che utilizza un dispositivo di ritenuta.
- Posizionare l'animale nel dispositivo di ritenuta.
- Una volta che l'animale è nel tubo, afferrare la coda per posizionare l'animale con le zampe posteriori fuori dal tubo.
- Afferrare la pelle del fianco alla porzione cranica del femore per estendere la gamba e impedire al soffocamento di piegarsi.
- Posizionare il dispositivo di ritenuta in modo che si trovi sul tavolo con la testa dell'animale rivolta verso il basso o sdraiato sul tavolo puntato verso il corpo del tecnico per consentire la stabilizzazione del dispositivo durante l'iniezione.
- I punti di riferimento dell'iniezione sono i seguenti: sia il topo che la gamba del ratto sono piccoli con i muscoli glutei (i muscoli caudali della coscia) che comprendono la più grande massa muscolare nell'arto posteriore; la seconda massa muscolare più grande nell'arto posteriore è il gastrocnemio (il muscolo del polpaccio). L'iniezione è fatta dall'aspetto caudale della gamba.
- Individuare la massa muscolare glutea posteriore al femore. L'osso può essere palpato e il grande muscolo è facilmente ingialloso.
- Si noti che la linea mediana della gamba dall'aspetto posteriore va dalla punta del garretto alla coda. I capelli hanno spesso una cresta dove si uniscono, poiché crescono in direzioni opposte rispetto alle superfici laterali e interne.
- Le iniezioni vengono effettuate verso l'aspetto laterale della coscia dalla linea mediana. Ciò riduce la probabilità di danneggiare i nervi e i vasi sanguigni situati sulla superficie mediale della gamba.
- Le iniezioni fatte nel gastrocnemio sono fatte dall'aspetto posteriore e con un'attenta considerazione della posizione della vena safena laterale.
- Iniezione di un articolo all'interno dei punti di riferimento
- Inserire l'ago perpendicolarmente al femore fuori dalla linea mediana come descritto sopra, ad una profondità massima di 5 mm per il muscolo gluteo e un massimo di 3 mm per il gastrocnemio.
- Per evitare traumi al muscolo, deve essere impedito il movimento estraneo dell'ago nel tessuto. La siringa deve essere tenuta in modo da non richiedere il riposizionamento della mano per eseguire l'iniezione.
- Aspirare la siringa per garantire il posizionamento all'interno del muscolo e non in un vaso sanguigno.
- Iniettare il materiale con un movimento costante e fluido. Non iniettare rapidamente in modo da consentire una lenta espansione del muscolo. L'iniezione rapida causerà traumi tissutali.
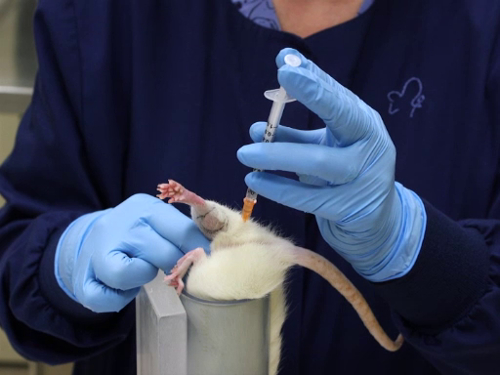
Figura 3. Iniezione intramuscolare nel muscolo gluteo nei ratti.
4. Iniezione endovenosa utilizzando la vena della coda
- La moderazione dell'animale dipende dal fatto che l'animale sia anestetizzato o sveglio.
- Utilizzare un tubo di ritenuta cilindrico per topi o ratti coscienti, ad eccezione degli animali glari o nudi. A causa della natura oleosa degli animali glari, è difficile riposizionarli e rimuoverli dai freni acrilici, poiché la loro pelle tende ad aderire alla plastica rigida. Pertanto, viene utilizzato un cono di plastica flessibile.
- Altri dispositivi di iniezione includono piattaforme illuminate, piattaforme riscaldate e coni di plastica rigida in cui il mouse è tenuto nel cono rigorosamente con tensione sulla coda.
- I topi anestetizzati potrebbero non aver bisogno di moderazione.
- Riscaldare tutto il corpo o solo la coda per garantire la vasodilatazione dei vasi di coda.
- Riscaldare tutto il corpo con una piastra riscaldante elettrica impostata sul mezzo o una coperta d'acqua circolante.
- Posizionare l'animale nel dispositivo di ritenuta, avvolto nella fonte di calore.
- Osservare attentamente l'animale e rimuoverlo dalla fonte di calore non appena i vasi sanguigni si dilatano. Il riscaldamento di tutto il corpo può anche essere ottenuto con l'uso di una lampada di calore diretta in una gabbia. Quando si utilizza una lampada di calore, gli animali devono essere osservati da vicino, poiché è facile surriscaldarli.
- Quando il riscaldamento di tutto il corpo non è fattibile, il riscaldamento della coda da solo può essere ottenuto utilizzando impacchi caldi da un asciugamano riscaldato, una bottiglia di acqua calda o immergendo la coda in acqua calda. Bisogna fare attenzione per evitare di bruciare la coda perché le bottiglie di acqua calda, gli asciugamani riscaldati e l'acqua calda non hanno controlli di temperatura. È comune che le fonti di calore siano inizialmente surriscaldate. Anche queste fonti di calore si raffreddano rapidamente.
- L'uso di olio di tessuto è un altro modo per migliorare la visualizzazione dei vasi.
- Immergere un applicatore con punta di cotone nell'olio di tessuto e applicare l'olio ben lontano dalla porzione della coda che viene afferrata per la stabilizzazione. L'olio di tessuto fa sì che i vasi appaiano più chiaramente definiti.
- Ci sono oli non tossici disponibili in commercio che contengono una sostanza chimica nella formulazione che crea riscaldamento della pelle e vasodilatazione con evaporazione. Questi oli vengono applicati e, dopo pochi istanti, quando i vasi sono visibili, l'olio in eccesso viene spazzato via con un batuffolo di cotone.
- Tutti gli oli possono rendere la coda più difficile da tenere.
- Quando si utilizzano oli, l'iniezione deve essere effettuata immediatamente dopo la visualizzazione dei vasi.
- I punti di riferimento dell'iniezione sono i seguenti:
- Le vene laterali della coda si trovano ai lati della coda. Ci sono anche vasi che corrono lungo le linee medie dorsali e ventrali della coda che non sono adatti per scopi di iniezione.
- L'animale nel limitatore può essere ruotato in modo che i vasi laterali siano rivolti verso l'alto per facilitare l'iniezione. In alternativa, la coda può essere ruotata per portare i vasi in una posizione più accettabile per l'iniezione.
- Le navi sono molto superficiali. Diventano più superficiali quando raggiungono la base della coda.
- L'iniezione di un articolo nella vena della coda richiede abilità. Per evitare traumi al vaso sanguigno, deve essere impedito il movimento estraneo dell'ago. La siringa viene tenuta in un modo che non richiede il riposizionamento della mano per eseguire l'iniezione.
- Posizionare la coda in modo che la nave sia visibile e tenuta sotto tensione. Non applicare una tensione eccessiva alla coda, o la nave può essere allungata e il flusso sanguigno diminuito.
- Posizionare l'ago direttamente sopra la nave il più lontano possibile.
- Applicare una leggera pressione e far scorrere l'ago nella coda parallelamente alle vertebre. Evitare di inclinare l'ago verso il basso, poiché l'ago trascinerà la nave. L'ago deve essere visibile nel vaso in quanto è avanzato di almeno 2 mm nel lume.
- Iniettare il materiale con un movimento lento e fluido per evitare la rottura della nave.
- Prestare particolare attenzione alla coda durante l'iniezione. Se inserito correttamente nel recipiente, il materiale di iniezione che scorre nel recipiente viene percepito senza resistenza. Il vaso sanguigno dovrebbe sbollentare mentre il sangue viene spinto fuori dal materiale di iniezione.
- Se l'ago non è nella nave, ci sarà una forte resistenza durante l'iniezione. Se iniettato con forza, il materiale riempirà lo spazio sottocutaneo e la coda si gonfierà. Fermarsi immediatamente, poiché il materiale progettato per essere iniettato per via endovenosa può essere caustico ai tessuti circostanti. Prelevare l'ago e tentare un'altra iniezione più cranica sulla coda.
- Dopo aver effettuato con successo l'iniezione, prelevare l'ago e applicare pressione sul sito di iniezione per assicurare una buona emostasi prima di riportare l'animale nella gabbia.
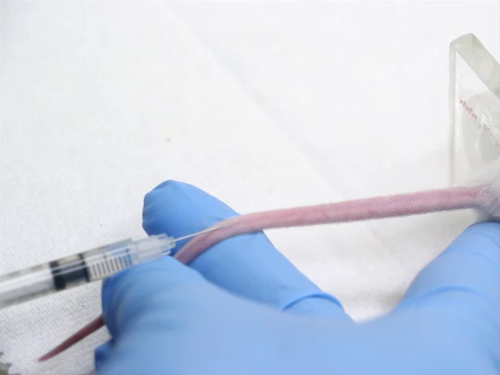
Figura 4. Iniezione della vena della coda nei topi.
Applicazione e Riepilogo
La somministrazione di sostanze è un componente comune dei protocolli sperimentali che utilizzano animali. Quando si sceglie una via di consegna, molti fattori devono essere deliberati, tra cui la competenza tecnica di quegli individui responsabili del dosaggio degli animali, le dimensioni dell'animale, la viscosità del fluido e la quantità da somministrare. Un'attenta considerazione di questi fattori migliorerà il benessere dell'animale e il risultato complessivo dell'esperimento.
Vai a...
Video da questa raccolta:

Now Playing
Amministrazione composta I
Lab Animal Research
101.3K Visualizzazioni

Tecniche di manipolazione e contenzione dei roditori
Lab Animal Research
175.9K Visualizzazioni

Procedure di assistenza di base
Lab Animal Research
28.1K Visualizzazioni

Fondamenti di allevamento e svezzamento
Lab Animal Research
35.9K Visualizzazioni

Identificazione dei roditori I
Lab Animal Research
55.1K Visualizzazioni

Identificazione dei roditori II
Lab Animal Research
25.7K Visualizzazioni

Amministrazione composta II
Lab Animal Research
35.2K Visualizzazioni

Amministrazione composta III
Lab Animal Research
31.7K Visualizzazioni

Somministrazione composta IV
Lab Animal Research
52.1K Visualizzazioni

Prelievo di sangue I
Lab Animal Research
172.8K Visualizzazioni

Astinenza di sangue II
Lab Animal Research
74.0K Visualizzazioni

Induzione e manutenzione dell'anestesia
Lab Animal Research
51.1K Visualizzazioni

Considerazioni per la chirurgia dei roditori
Lab Animal Research
22.6K Visualizzazioni

Necroscopia diagnostica e prelievo di tessuti
Lab Animal Research
58.5K Visualizzazioni

Raccolta di tessuti sterili
Lab Animal Research
35.0K Visualizzazioni