複合行政 III
概要
ソース: ケイ ・ スチュワート、RLATG、RVT CMAR;ヴァレリー A. シュレーダー、RVT、RLATG。ノートルダムのノートルダム大学
実験用マウスおよびラットの複合管理の多くの一般的に使用されるルートがあります。ただし、特定のプロトコルでは、皮内、鼻腔内、および頭蓋内注射を含む使用頻度の低いルートの使用を必要があります。これらの手順を正常に実行するため専門のトレーニングが欠かせません。これらのルートのための正当化は、制度的動物ケアおよび使用委員会 (IACUC) の承認を得るために提供する必要があります。
原則
Intraderma linjections は、表皮層 (表皮) の下にある真皮の外側の層に配信されます。この注射ルートは通常の抗原に対するアレルギー反応や皮膚血流診断、炎症の評価のため予約されています。
あまり予防接種または充血除去剤のスプレーのローカル配信のために使用、鼻腔内投与は全身および中央神経系 (CNS) 配信の使用もできます。ラインの鼻腔粘膜は血管や急速な全身への吸収を可能にする、直接標的に中枢神経系を神経の豊富な供給。小さな脂溶性の分子から成る物質があるより大きい分子が含まれているものよりもはるかに大きい吸収率。2
麻酔はこの手順に必要な正確な投薬を確保、鼻孔に化合物の適切な配置も容易に可能します。それは、麻酔下の動物意識動物に比べて脳に薬の 5 倍より配信していることが実証されています。2無麻酔ラット経鼻投与に非常に耐性があります。しかし、効果的な配信テクニックの自由行動ラットの鼻腔内投与を実証研究があります。3また、アラート動物がピペット チップや針、物質の配信が困難で噛まないようにしてみてください。
鼻腔内投与の利点は、この方法で必要最小限のトレーニングとスキル、それは動物に非侵襲的ことです。ただし、エアロゾル化の可能性があるためバイオ セーフティ キャビネットと目の保護の使用をお勧め、特に理性的な動物の場合。さらに、動物を溺死を避けるため、可能な限り最小の線量を使用ください。このプロシージャ チアノーゼ時、口呼吸、または苦痛の他の徴候は動物に見られる、手順がすぐに中断されます。
アダルト マウスおよびラットの頭蓋内注射の適切な位置を確保するため脳定位固定装置を使用し、注入の深さを採用します。しかし、マウスの年齢・ ラットを 3 に 28 日で 14 日齢、頭蓋骨はそれから直接注入するに十分に薄いです脳定位固定装置のデバイスをサポートするあまりにも壊れやすいです。マウスまたはラットの子犬は、プロシージャと彼らが返されます彼女にできるだけ早く手続きが完了するまで母と左する必要があります。注射後のケアは、通常運動となどの看護動作まで熱のソースを継続的に監視含まれています。この手法を使用する主な理由は、血液脳関門に交差する、または全身の経路に関与する効果を避けるためを必要とする中枢神経系の薬理学的エージェントを提供することです。1
手順
1. 皮内投与
- 最も皮内注射は、水性化合物です。解決策は、注射部位の組織の壊死を避けるために中性の pH を持っている生理学的バッファーする必要があります。
- 針のサイズ範囲は、25-30 ゲージ、可能な最小です。
- 注射部位あたりの線量範囲は 50-100 μ L. 注入する過剰なボリュームは注射部位または化合物の圧力のためサイトからの漏洩で壊死に 。
- 針の皮内の空間に正確に配置、マウスやラットを麻酔する必要は。吸入麻酔は、急速な誘導と回復。ただし、注射麻酔の領域の準備のための十分な時間を提供して注射を実行する利点があります。1
- 注射部位周辺を剃毛、脱毛クリームを使用することで髪を削除します。
- 徹底的に任意の残留の脱毛クリームや髪の残骸を削除します。
- ヨード、クロルヘキシジン液剤、アルコールなどの局所消毒薬をつけます。
- 管理手順
- 親指と人差し指の間にピンと張った肌をストレッチします。これは針を位置決めするとき皮膚に安定性を提供します。
- 針ベベルを皮膚の上に置きます。
- 優しく、表皮と真皮の間の皮膚に針を挿入します。ベベルを指し示す針を進めます。
- 物質をゆっくりと注入します。化合物の注入は、皮膚に水疱、または小水疱が作成されます。
- 皮膚のストレッチし、針を撤回する前に調整を許可する注入後一時停止します。
- 注意事項
- プランジャーを手前に引く必要はありません。
- 針を皮下組織に挿入する場合、水疱が形成されません。皮下注射の結果あまりにも深くに注入します。
- 注射部位から漏れ化合物を引き起こすことができるしみや、区域を拭くことを避けてください。
- 複数の注射を実行すると、宇宙に、鉱物が重複しないようにします。
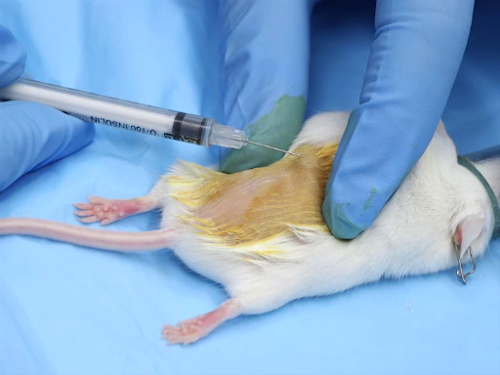
図 1。皮内注射マウス。
2. 鼻腔内投与
- 機器
- 正確なボリュームを提供する校正することができます micropipetting ユニット ピペットを使用します。
- 使い捨てのピペット チップを使用して、クロス汚染を避けるためにください。TB 注射器、鈍針やフレキシブル チューブは、投薬の使用もできます。
- ラットの総注入量 40-100 μ L を超えないし、6-10 μ L が値下がりしましたに与えられる必要があります。マウス、最大容量は 24 μ L、3-4 μ L 滴で与えられます。
- 意識した動物の管理
- 意識した動物のマニュアルの束縛ピペット チップまたは鈍針配置できる化合物を提供する鼻孔に十分近いので、比較的不動ですが突くか鼻のティッシュを裂くので近くにない頭であることが必要です。
- 動物を抑制し、垂直方向の位置でそれを保持します。
- 鼻のオープニングで化合物の液体の小滴を配置します。動物は、液滴を吸い込む必要があります。
- 全体のボリュームを与えられているまで、鼻孔を交互、追加のボリュームを管理します。
- 大きなボリュームを管理している場合ない拘束中に胸を圧迫することが重要です。胸骨圧迫は、気管支や肺に液体を引くため十分に深い呼吸をする動物の能力を妨げます。
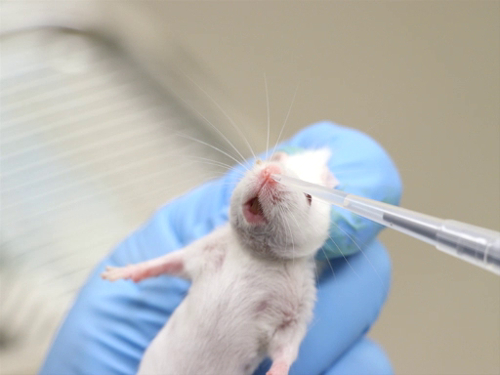
図 2。意識下マウスにおける鼻腔内投与。
- 意識不明動物の管理
- 吸入麻酔薬を使用するアプローチと化合物の配信中に固定化した動物のできます。これは注入装置、ヘッド、顔の皮膚や目、鼻の組織動物の傷害のけいれんによる化合物の損失を噛む動物の可能性を排除します。動物はまた鼻息し、管理に鼻孔から化合物をスプレーしにくいです。
- 仰臥位に動物を配置します。頭の位置は、鼻孔のソリューションの配置を影響します。中枢神経系配信のための理想的な位置は、仰臥位の動物が示されています。これによりより良い吸収。2
- 鼻の開口部、吸入のタイミングの 1 つの側面に直接化合物の半分を管理します。その後、動物を裏返します。
- 上記のように、管理、その他、ボリュームの半分他の鼻の開口部に。

図 3。無意識のマウスの鼻腔内投与。
3。新生児マウスおよびラットの頭蓋内圧亢進の管理
- マウスやラットは、頭蓋内注射用麻酔する必要があります。
| マウス | ラット | ||
| 期間 (日数) | 針のゲージ (g) | 期間 (日数) | 針のゲージ (g) |
| 0-7 | 29-30 | 0-5 | 27-29 |
| 7-14 | 27 | 5-10 | 25-27 |
| 14-28 | 25 | 10-14 | 25 |
| 期間 (日数) | 針の長さ (mm) | 期間 (日数) | 針の長さ (mm) |
| 0-7 | 2 | 0-4 | 2-3 |
| 7-14 | 3 | 4-7 | 3 |
| 14-21 | 4 | 7-10 | 4 |
| 21-28 | 5 | 10-14 | 5 |
| 期間 (日数) | (Μ l) | 期間 (日数) | (Μ l) |
| 0-5 | < 20 | 1-3 | < 20 |
| 6-20 | < 60 | 4-10 | < 60 |
| 20-28 | < 100 | 11-14 | < 100 |
表 1。針のゲージ、針の長さ、マウスおよびラットの年齢に従って頭蓋内投与の最大ボリューム。4
- 機器
- 正しい針のゲージと最大の表 1に従って投与量を決定します。
- 動物の麻酔前にニードル ガードを準備します。
注記: 針の注入深さは、ニードル キャップで作成されたガードを使用して制御されます。- 針、ニードル キャップいらずでガードを作成して、カットする場所を示すキャップにマーク表示されます。カットは 2 ~ 5 mm の針は、針のキャップを交換するときにさらされているようにすべきであります。
- 皮膚や頭蓋骨を貫通し、脳の目的の深さに達するのために随分露出針の長さがある必要があります。
- マウスおよびラットに必要な針の長さは、表 1に示します。
- 加熱源が仔ラットの低体温症を防ぐために必要です。いくつかの種類があります: 低、循環水毛布、または再利用可能な化学反応の熱ポーチに電気加熱パッドを設定します。
- 拘束
- マウスおよびラットの子犬 10 日は、この手順で麻酔を必要は。頭の後ろにちょうどそれらを持ち、尾肩にわずかな圧力をかけるため皮膚を引いて手動でそれらを抑制します。
- 麻酔子犬イソフルラン吸入と年齢の 10 日間。イソフルランを浸した綿球を誘導室を精度の気化器やガラスベル ジャーに接続します。一度子犬を固定すると、麻酔は、効果的な約 40 秒間注入のための十分な時間を提供します。
- 注入法
- 注射器に物質を描画し、針にキャップ/注射針ガイドを配置します。
- 注入量として 100 μ L であり、最大 300 μ L、離乳や古いマウスの新生児マウスまたはラットごとの最大数量をお勧めします。
- 新生児の大脳皮質を注入するには、目、頭蓋骨の正中線から約 3 mm の後ろ 5 mm 針を挿入します。
- 幼マウスの注射部位は、眼と耳の間と正中線のすぐそばの約半分の方法です。

図 4。頭蓋内投与マウスの子犬。
申請書と概要
動物に化合物の管理は、動物の両方の健康と実験データと科学的価値の結果に大きな影響を持つことができます。配信の適切な方法は、実験の成功に不可欠です。研究の科学的な目的、物質、必要な投与量、物質の粘度と動物の健康の pH を含む最適なルートを決定する多くの要因を考慮されなければなりません。技術的専門知識はまたすべて注入法のための要件です。
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
複合行政 III
Lab Animal Research
31.7K 閲覧数

齧歯動物の処理と抑制技術
Lab Animal Research
175.9K 閲覧数

基本的なケア手順
Lab Animal Research
28.1K 閲覧数

繁殖と離乳の基本
Lab Animal Research
35.9K 閲覧数

齧歯動物識別私
Lab Animal Research
55.1K 閲覧数

齧歯動物識別 II
Lab Animal Research
25.7K 閲覧数

化合物の管理私
Lab Animal Research
101.3K 閲覧数

複合管理 II
Lab Animal Research
35.2K 閲覧数

化合物の管理 IV
Lab Animal Research
52.1K 閲覧数

撤退の血私
Lab Animal Research
172.8K 閲覧数

血液回収 II
Lab Animal Research
74.0K 閲覧数

麻酔導入とメンテナンス
Lab Animal Research
51.1K 閲覧数

齧歯動物の外科に関する考慮事項
Lab Animal Research
22.6K 閲覧数

剖検診断と組織の収穫
Lab Animal Research
58.5K 閲覧数

滅菌のティッシュの収穫
Lab Animal Research
35.0K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved