1. Administração intradérmica
- A maioria das injeções intradérmicas são compostos aquosos. As soluções devem ser fisiologicamente tamponadas para ter um pH neutro, a fim de evitar necrose tecidual no local da injeção.
- A faixa de tamanho da agulha é de 25-30, a menor possível.
- A faixa de dose por local de injeção é de 50-100 μL. A injeção de volumes excessivos pode resultar em necrose no local da injeção ou vazamento do composto para fora do local devido à pressão.
- Para uma colocação precisa da agulha no espaço intradérmico, é necessário anestesiar tanto ratos quanto ratos. A anestesia por inalação permite uma rápida indução e recuperação; no entanto, a anestesia injetável tem a vantagem de fornecer tempo suficiente para a preparação da área e realizar a injeção. 1
- Remova o cabelo no local da injeção através do uso de um creme depilatório ou raspando a área.
- Remova completamente qualquer creme depilatório residual ou detritos capilares.
- Aplique um antisséptico tópico, como uma solução de iodo, solução de clorexidina ou álcool.
- Procedimentos administrativos
- Estique a pele esticada entre o polegar e o dedo indicador. Isso proporciona estabilidade à pele ao posicionar a agulha.
- Coloque a agulha em cima da pele.
- Insira suavemente a agulha na pele entre a epiderme e a derme. Avance a agulha logo depois do bisel.
- Injete a substância lentamente. A injeção do composto criará uma bolha, ou pequena bolha, na pele.
- Faça uma pausa após a injeção para permitir que a pele se estique e ajuste antes de retirar a agulha.
- Precauções
- Puxar para trás no êmbolo não é necessário.
- Se a agulha for inserida no espaço subcutâneo, nenhuma sangria será formada. Injetar muito profundamente resulta em uma injeção subcutânea.
- Evite borrar ou limpar a área, pois isso pode fazer com que o composto vaze do local da injeção.
- Ao realizar múltiplas injeções, espaça-as para que os blebs não se sobreponham.
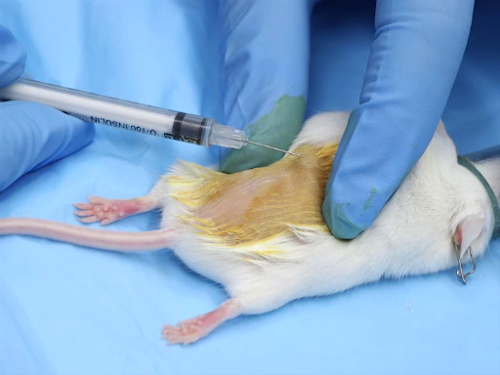
Figura 1. Injeção intradérmica em camundongos.
2. Administração Intranasal
- Equipamento
- Use uma pipeta de unidade de micropipetamento que pode ser calibrada para fornecer um volume preciso.
- As pontas de pipeta descartáveis devem ser usadas para evitar contaminação cruzada. Seringas de tb, agulhas cegas e tubos flexíveis também podem ser usados para dosagem.
- Os volumes totais de injeção para ratos não devem exceder 40-100 μL, e devem ser dados em gotas de 6-10 μL. Para camundongos, o volume total máximo é de 24 μL, dado em quedas de 3-4 μL.
- Administração em animais conscientes
- A contenção manual em animais conscientes requer que a cabeça seja relativamente imóvel para que a ponta da pipeta ou a agulha cega possa ser colocada perto o suficiente das nares para entregar o composto, mas não tão perto a fim de cutucar ou dilacerar o tecido nasal.
- Contenha o animal e segure-o em uma posição vertical.
- Coloque uma pequena gota de um composto líquido na abertura nasal. O animal deve inalar a gota.
- Administre um volume adicional, alternando nares até que todo o volume tenha sido dado.
- Ao administrar volumes maiores, é importante não restringir o peito durante a contenção. A compressão torácica impede a capacidade do animal de respirar fundo o suficiente para atrair o líquido para os brônquios e pulmões.
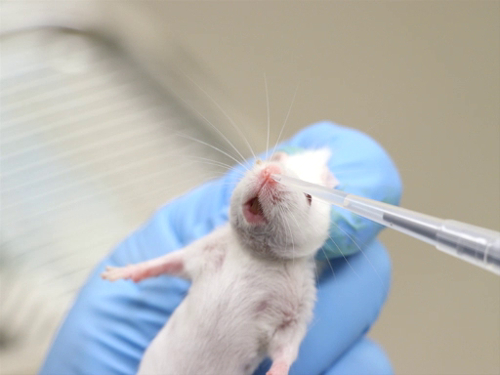
Figura 2. Administração intranasal em camundongos conscientes.
- Administração em animais inconscientes
- O uso de anestésicos de inalação permite um animal imobilizado durante a abordagem e entrega do composto. Isso elimina a possibilidade de o animal morder o equipamento de dosagem, a perda do composto devido ao empurrão da cabeça e lesão no tecido nasal do animal, olhos ou pele facial. O animal também é menos propenso a cheirar e pulverizar o composto das nares após a administração.
- Coloque o animal na posição supina. A posição da cabeça influencia a colocação da solução nas nares. Foi demonstrado que a posição ideal para a entrega do CNS é com o supino animal; isso permite uma melhor absorção. 2
- Administre metade do composto diretamente em um lado da abertura nasal, cronometrando-o com inalação. Então, vire o animal.
- Como acima, administre a outra metade do volume na outra abertura nasal.

Figura 3. Administração intranasal em ratos inconscientes.
3. Administração intracraniana em camundongos e ratos neonatais
- Camundongos ou ratos devem ser anestesiados para injeções intracranianas.
| Rato |
Rato |
| Idade (dias) |
Medidor de agulha (g) |
Idade (dias) |
Medidor de agulha (g) |
| 0-7 |
29-30 |
0-5 |
27-29 |
| 7-14 |
27 |
5-10 |
25-27 |
| 14-28 |
25 |
10-14 |
25 |
| Idade (dias) |
Comprimento da agulha (mm) |
Idade (dias) |
Comprimento da agulha (mm) |
| 0-7 |
2 |
0-4 |
2-3 |
| 7-14 |
3 |
4-7 |
3 |
| 14-21 |
4 |
7-10 |
4 |
| 21-28 |
5 |
10-14 |
5 |
| Idade (dias) |
Volume (μL) |
Idade (dias) |
Volume (μL) |
| 0-5 |
<20 |
1-3 |
<20 |
| 6-20 |
<60 |
4-10 |
<60 |
| 20-28 |
<100 |
11-14 |
<100 |
Mesa 1. Medidor de agulha, comprimento da agulha e volume máximo de administração intracraniana conforme a idade de ratos e ratos. 4
- Equipamento
- Determine o medidor de agulha correto e o volume máximo de administração conforme a Tabela 1.
- Prepare um protetor de agulha antes de anestesiar o animal.
NOTA: A profundidade de injeção da agulha é controlada através do uso de um protetor que é criado com a tampa da agulha.
- Para criar o protetor, uma agulha é medida contra a tampa da agulha, e uma marca é colocada na tampa para indicar onde cortar. O corte deve ser feito para que 2 a 5 mm da agulha sejam expostos quando a tampa for substituída na agulha.
- O comprimento da agulha exposta deve ser longo o suficiente para penetrar na pele e no crânio, e alcançar a profundidade desejada no cérebro.
- Os comprimentos da agulha necessários para ratos e ratos estão listados na Tabela 1.
- Uma fonte de aquecimento é necessária para prevenir hipotermia nos filhotes. Existem vários tipos: uma almofada de aquecimento elétrica em baixo, uma manta de água circulante ou uma bolsa de calor de reação química reutilizável.
- Restrição
- Filhotes de rato e rato com 10 dias ou mais não requerem anestesia para este procedimento. Contê-los manualmente segurando-os logo atrás da cabeça e puxando a pele caudally para colocar leve pressão sobre os ombros.
- Anesthetize filhotes com mais de 10 dias de idade com inalação de isoflurano. Conecte uma câmara de indução a um vaporizador de precisão ou um pote de sino com uma bola de algodão encharcada com isoflurano. Uma vez que o filhote é imobilizado, a anestesia é eficaz por cerca de 40 segundos, o que proporciona tempo suficiente para a injeção.
- Técnica de injeção
- Desenhe a substância na seringa e coloque a tampa/agulha sobre a agulha.
- O volume de injeção recomendado como o volume máximo por rato ou rato neonatal é de 100 μL, e que para desmamar ou camundongos mais velhos é de até 300 μL.
- Para injetar no córtex cerebral de recém-nascidos, insira a agulha 5 mm atrás do olho, aproximadamente 3 mm fora da linha média do crânio.
- O local de injeção do rato desmamar é aproximadamente a meio caminho entre o olho e a orelha, e apenas fora da linha média.

Figura 4. Administração intracraniana em um filhote de rato.


















