Wirkstoffverabreichung III
Überblick
Quelle: Kay Stewart, RVT, RLATG, Anus; Valerie A. Schroeder, RVT, RLATG. University of Notre Dame, IN
Es gibt viele häufig verwendete Routen für zusammengesetzte Verwaltung bei Mäusen und Ratten. Bestimmte Protokolle erfordern jedoch den Einsatz von weniger häufig verwendete Routen, einschließlich intradermale, intranasale und intrakranielle Injektionen. Fachausbildung ist essentiell für diese Verfahren erfolgreich durchgeführt werden. Begründung für diese Strecken müssen bereitgestellt werden, um institutionelle Animal Care und Nutzung Committee (IACUC) Zustimmung zu gewinnen.
Grundsätze
Intraderma Linjections sind in den äußeren Schichten der Dermis, unterhalb der oberen Hautschicht (Epidermis) geliefert. Diese Injektion Route ist in der Regel für die Beurteilung der Entzündung, kutane Blut fließen Diagnostika oder allergische Reaktionen auf ein Antigen reserviert.
Obwohl häufig für die lokale Übermittlung von Impfungen oder abschwellende Spray verwendet, kann intranasale Verabreichung auch für systemische und zentralen Nervensystem (ZNS) Lieferung verwendet werden. Die Schleimhaut, die die Nasenhöhle Linien verfügt über ein reichhaltiges Angebot an Blutgefäßen und Nerven, die erlauben eine schnelle systemische Absorption und direkte Ausrichtung auf das ZNS. Bestehend aus lipophile niedermolekulare Substanzen haben eine weitaus größere Absorptionsrate als diejenigen, die größere Moleküle enthalten. 2
Obwohl Anästhesie nicht für dieses Verfahren erforderlich ist, kann es die richtige Platzierung der Verbindung in die Nasenlöcher, eine exakte Dosierung erleichtern. Es wurde nachgewiesen, dass narkotisierten Tiere um das Fünffache größere Lieferung von Medikamenten an das Gehirn im Vergleich zu einem bewussten Tier haben. 2 unanesthetized Ratten sind sehr resistent gegen intranasale Verabreichung. Allerdings gibt es eine Studie, die effektive Bereitstellung Techniken für intranasale Verabreichung von frei beweglichen Ratten gezeigt. 3 Zusätzlich können alert Tiere versuchen, an der Pipettenspitze oder Nadel, erschwert die Lieferung des Stoffes zu beißen.
Vorteile für intranasale Verabreichung sind, dass diese Technik nur wenig Training und Geschick erfordert, und es ist eine nichtinvasive Technik für das Tier. Jedoch wird durch die Möglichkeit der Aerosolization, die Benutzung von einem Biosafety Kabinett und Auge geraten, besonders beim Arbeiten mit einer bewussten Tier. Um zu vermeiden, die Tiere ertrinken, sollte darüber hinaus die kleinste Dosis möglich verwendet werden. Wenn während dieser Prozedur Zyanose jederzeit Mundatmung oder andere Zeichen der Bedrängnisses in das Tier gesehen, sollte das Verfahren sofort abgebrochen werden.
Intrakranielle Injektionen bei Erwachsenen Mäusen und Ratten beschäftigen die Verwendung von stereotaktischen Ausrüstung, um die korrekte Platzierung zu gewährleisten und Tiefe der Injektion. Jedoch bei Mäusen 3 bis 28 Tage alt und Ratten bis zu 14 Tage alt, der Schädel ist dünn genug, um Spritzen direkt durch sie; Es ist zu empfindlich, um der stereotaktischen Gerät unterstützen. Die Maus oder Ratte Welpen sollten mit der Mutter bleiben, bis das Verfahren, und sie Ihr so bald wie möglich zurückgegeben werden soll sobald der Vorgang abgeschlossen ist. Postinjection Pflege beinhaltet kontinuierliche Überwachung auf eine Wärmequelle bis normale Bewegung und Verhalten, einschließlich Krankenpflege, eingehalten werden. Der Hauptgrund für diese Technik verwenden soll pharmakologische Agenten auf das zentrale Nervensystem, die die Blut - Hirn-Schranke zu überqueren, oder um die Auswirkungen der systemischen Route beteiligt erfordern. 1
Verfahren
(1) intradermale Verabreichung
- Die intradermale Injektionen sind wässrige-basierte Verbindungen. Die Lösungen müssen physiologisch gepuffert werden, um einen neutralen pH-Wert haben zur Vermeidung von Gewebsnekrosen an der Injektionsstelle.
- Die Nadel-Größenbereich ist 25-30 gauge, die kleinstmögliche.
- Der Dosisbereich Pro Injektionsstelle ist 50-100 µL. Gatterschalters übermäßige Mengen Nekrosen an der Injektionsstelle oder Leckage der Verbindung von der Seite wegen des Drucks führen können.
- Für die genaue Platzierung der Nadel in die intradermale Raum ist es notwendig, um Mäuse und Ratten zu betäuben. Inhalation Anästhesie ermöglicht eine schnelle Einarbeitung und Erholung; injizierbare Anästhesie hat jedoch den Vorteil der Bereitstellung von ausreichend Zeit für die Vorbereitung des Bereichs und Durchführung der Injektion. 1
- Entfernen Sie die Haare an der Einstichstelle durch den Einsatz einer Enthaarungscreme oder durch das Rasieren der Gegend.
- Entfernen Sie restliche Enthaarungscreme und Haar Schmutz gründlich.
- Ein aktuelles Antiseptikum, z. B. eine Jodlösung, Chlorhexidin-Lösung oder Alkohol anwenden.
- Verwaltungsverfahren
- Spannen Sie die Haut straff zwischen Daumen und Zeigefinger. Dies sorgt für Stabilität auf die Haut bei der Positionierung der Nadelöhrs.
- Legen Sie die Nadel Fase oben auf der Haut.
- Sanft legen Sie die Nadel in die Haut zwischen der Epidermis und der Dermis. Die Nadel direkt hinter die abgeflachte Kante voraus.
- Die Substanz langsam zu injizieren. Injektion der Verbindung schafft eine Blase oder kleine Blase, in der Haut.
- Pause nach der Injektion, lassen Sie die Haut zu dehnen und anpassen, bevor die Nadel zurückziehen.
- Vorsichtsmaßnahmen
- Es ist nicht notwendig, den Kolben zurückziehen.
- Wenn die Nadel in den subkutanen Raum eingesetzt wird, ist keine Blase gebildet. Injektion zu tief führt eine subkutane Injektion.
- Vermeiden Sie beflecken oder Abwischen der Gegend, wie, dass die Verbindung zum Austreten aus der Injektionsstelle verursachen können.
- Wenn Sie mehrere Injektionen durchführen, Raum sie so, dass die Blebs nicht überschneiden.
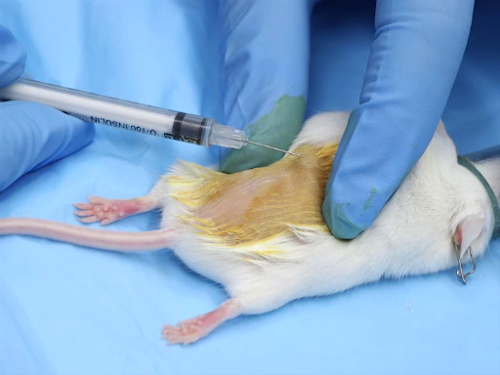
Abbildung 1. Intradermale Injektion bei Mäusen.
(2) intranasale Verabreichung
- Ausrüstung
- Verwenden Sie eine Micropipetting-Einheit-Pipette kalibriert werden kann, um eine genaue Volumen liefern.
- Einweg-Pipettenspitzen sollte verwendet werden, um Kreuzkontaminationen zu vermeiden. TB-Spritzen, stumpfe Nadeln und Schläuche können auch für die Dosierung verwendet werden.
- Insgesamt Injektionsvolumina für Ratten sollte nicht mehr als 40-100 µL und sollte in 6 bis 10 µL Tropfen gegeben werden. Bei Mäusen ist die maximale Gesamtmenge 24 µL, in 3 bis 4 µL Tropfen gegeben.
- Verwaltung in bewusste Tiere
- Manuelle Zurückhaltung bei bewussten Tieren erfordert, dass der Kopf relativ unbeweglich, so dass die Pipettenspitze oder stumpfen Nadel nahe genug, um die Nasenlöcher, die Verbindung zu liefern platziert werden kann, aber nicht so nah, poke oder zerreißt das Nasengewebe.
- Zurückhalten Sie des Tieres und halten Sie ihn in eine vertikale Position.
- Legen Sie einen kleinen Tropfen einer Flüssigkeit bei der nasalen Eröffnung zusammengesetzte. Das Tier sollte das Tröpfchen einatmen.
- Verwalten Sie ein zusätzliches Volumen, Nasenlöcher abwechselnd, bis das gesamte Volumen gegeben hat.
- Wenn größere Mengen zu verwalten, ist es wichtig, nicht die Brust während Zurückhaltung verengen. Brust-Kompression behindert die Fähigkeit des Tieres, ausreichend tiefe Atemzüge, die Flüssigkeit in die Bronchien und Lungen zu ziehen.
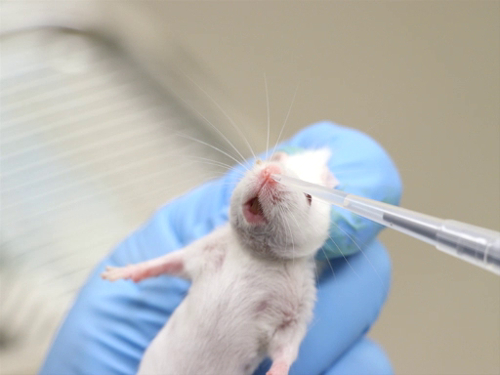
Abbildung 2. Intranasale Verabreichung in bewusste Mäuse.
- Verwaltung im Unbewussten Tiere
- Inhalation Anästhetika ermöglicht ein immobilisierten Tier während der Ansatz und die Lieferung der Verbindung. Dies verhindert, dass das Tier beißen die Dosierausrüstung, den Verlust der Verbindung durch Rucken des Kopfes und der Verletzung von Nasengewebe, Augen oder Haut des Tieres. Das Tier ist auch weniger wahrscheinlich, snort und sprühen Sie die Verbindung aus den Nasenlöchern auf Verwaltung.
- Legen Sie das Tier in die Rückenlage. Die Position des Kopfes hat Einfluss auf die Platzierung der Lösung in die Nasenlöcher. Es hat sich gezeigt, dass die ideale Position für die CNS Lieferung mit dem Tier Rückenlage; Dies ermöglicht eine bessere Absorption. 2
- Verwalten Sie die Hälfte der Verbindung direkt in eine Seite der nasalen Öffnung, mit Inhalation timing. Schalten Sie das Tier über.
- Wie oben beschrieben, Verwalten der anderen Hälfte des Volumens in die nasale Öffnung.

Abbildung 3. Intranasale Verabreichung im Unbewussten Mäuse.
3.Intrakranielle Verabreichung bei neugeborenen Mäusen und Ratten
- Mäuse oder Ratten müssen für intrakranielle Injektionen betäubt.
| Maus | Ratte | ||
| Alter (Tage) | Nadelstärke (g) | Alter (Tage) | Nadelstärke (g) |
| 0-7 | 29-30 | 0-5 | 27-29 |
| 7-14 | 27 | 5-10 | 25-27 |
| 14-28 | 25 | 10-14 | 25 |
| Alter (Tage) | Nadel-Länge (mm) | Alter (Tage) | Nadel-Länge (mm) |
| 0-7 | 2 | 0-4 | 2-3 |
| 7-14 | 3 | 4-7 | 3 |
| 14-21 | 4 | 7-10 | 4 |
| 21-28 | 5 | 10-14 | 5 |
| Alter (Tage) | Volumen (µL) | Alter (Tage) | Volumen (µL) |
| 0-5 | < 20 | 1-3 | < 20 |
| 6-20 | < 60 | 4-10 | < 60 |
| 20-28 | < 100 | 11-14 | < 100 |
Tabelle 1. Nadelstärke, Nadel Länge und maximaler Lautstärke der intrakraniellen Verwaltung gemäß Alter von Mäusen und Ratten. 4
- Ausrüstung
- Bestimmen der richtigen Nadelstärke und maximale Lautstärke der Verwaltung gemäß Tabelle 1.
- Bereiten Sie einen Nadelschutz vor das Tier zu betäuben.
Hinweis: Die Injektion Tiefe der Nadel wird durch den Einsatz einer Wache gesteuert, die mit die Nadelschutzkappe erstellt wird.- Um die Wache zu erstellen, wird eine Nadel gegen die Nadelschutzkappe gemessen, und eine Marke befindet sich auf der Kappe um anzugeben, wo zu schneiden. Der Schnitt sollte erfolgen, so dass 2 bis 5 mm der Nadel werden ausgesetzt, wenn die Kappe auf den Nadel ersetzt wird.
- Die Länge der freiliegenden Nadel muss lang genug sein, dringen in die Haut und Schädel, und die gewünschte Tiefe in das Gehirn zu erreichen.
- Die Nadellängen benötigt für Mäuse und Ratten sind in Tabelle 1aufgeführt.
- Eine Wärmequelle ist erforderlich, um Unterkühlung in die Welpen zu verhindern. Es gibt verschiedene Arten: ein elektrisches Heizkissen auf Low, eine zirkulierende Wasser Decke oder eine wiederverwendbare chemische Reaktion Wärme Beutel gesetzt.
- Zurückhaltung
- Maus und Ratte Welpen benötigen 10 Tage alt oder jünger nicht Anästhesie für dieses Verfahren. Zügeln sie manuell durch sie nur hinter dem Kopf halten und ziehen die Haut kaudal, leichten Druck über die Schultern.
- Welpen mehr als 10 Tage alt mit Isofluran Inhalation zu betäuben. Legen Sie eine Induktion Kammer auf eine Präzision Vaporizer oder eine Glasglocke mit einem Wattebausch, getränkt mit Isofluran. Sobald der Welpe immobilisiert ist, wirkt die Narkose für ca. 40 Sekunden die bietet genügend Zeit für die Injektion.
- Injektionstechnik
- Ziehen Sie den Stoff in die Spritze und halten Sie die Kappe/Nadel-Führung über die Nadel.
- Das Injektionsvolumen empfohlen, da das maximale Volumen pro Neugeborenen Maus oder Ratte 100 µL beträgt und das Absetzer oder ältere Mäuse für bis zu 300 µL ist.
- Stechen Sie in der Hirnrinde des Neugeborenen zu injizieren die Nadel 5 mm hinter dem Auge, ca. 3 mm von der Mittellinie des Schädels.
- Die Absetzer Maus Injektionsstelle ist etwa auf halbem Weg zwischen dem Auge und Ohr und direkt an der Mittellinie.

Abbildung 4. Intrakranielle Verwaltung in einem Maus-Welpen.
Anwendung und Zusammenfassung
Die Verwaltung der Verbindungen in Tiere kann eine erhebliche Wirkung auf sowohl das Wohlbefinden des Tieres und die Ergebnisse der experimentellen Daten und wissenschaftlichen Wert haben. Die richtige Methode der Lieferung ist entscheidend für den Erfolg des Experiments. Viele Faktoren müssen berücksichtigt werden, um die beste Route, einschließlich das wissenschaftliche Ziel der Studie, der pH-Wert des Stoffes, das gewünschte Dosiervolumen, die Viskosität des Stoffes und das Wohlergehen der Tiere zu bestimmen. Technische Expertise ist auch eine Voraussetzung für alle Injektionsmethoden.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Wirkstoffverabreichung III
Lab Animal Research
31.7K Ansichten

Umgang mit Nagetieren und Fixierungstechniken
Lab Animal Research
175.9K Ansichten

Grundlegende Pflegeverfahren
Lab Animal Research
28.1K Ansichten

Grundlagen der Zucht und Entwöhnung
Lab Animal Research
35.9K Ansichten

Identifizierung von Nagetieren I
Lab Animal Research
55.1K Ansichten

Identifizierung von Nagetieren II
Lab Animal Research
25.7K Ansichten

Wirkstoffverabreichung I
Lab Animal Research
101.3K Ansichten

Wirkstoffverabreichung II
Lab Animal Research
35.2K Ansichten

Wirkstoffverabreichung IV
Lab Animal Research
52.1K Ansichten

Blutentnahme I
Lab Animal Research
172.8K Ansichten

Blutentnahme II
Lab Animal Research
74.0K Ansichten

Einleiten und Aufrechterhalten der Anästhesie
Lab Animal Research
51.1K Ansichten

Überlegungen zur Nagetierchirurgie
Lab Animal Research
22.6K Ansichten

Diagnostische Nekropsie und Gewebeentnahme
Lab Animal Research
58.5K Ansichten

Sterile Gewebeentnahme
Lab Animal Research
35.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten