Considerazioni per la chirurgia dei roditori
Panoramica
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Università di Notre Dame, IN
La Guida per la cura e l'uso degli animali da laboratorio1 impone che la chirurgia di sopravvivenza dei roditori sia eseguita in modo asettico. La tecnica asettica utilizza pratiche specifiche che riducono al minimo la contaminazione del sito chirurgico, compresa la preparazione del paziente, la preparazione del chirurgo, la sterilizzazione di strumenti e altre forniture e l'uso di un ambiente pulito e controllato. La pianificazione prechirurgica, il monitoraggio intraoperatorio e l'assistenza postoperatoria sono essenziali per il successo del recupero degli animali dagli interventi chirurgici di sopravvivenza.
Principi
Le procedure chirurgiche sono classificate come sopravvivenza o non sopravvissute e maggiori o minori. La chirurgia di sopravvivenza è una procedura chirurgica eseguita su un animale vivo completamente anestetizzato che dovrebbe riprendersi completamente sia dall'anestesia che dalla procedura. La chirurgia non chirurgica o terminale è una procedura chirurgica che si conclude con l'eutanasia dell'animale prima del suo recupero dall'anestesia. La chirurgia maggiore comporta l'esposizione o la penetrazione di una cavità corporea - sia la cavità toracica che la cavità addominale - o un intervento chirurgico che causerà una compromissione fisica o fisiologica permanente, come l'amputazione di un arto. La chirurgia minore non penetra in una cavità corporea o causa una carenza permanente, come l'impianto sottocutaneo di un transponder. Tutti gli interventi chirurgici richiedono che l'animale sia adeguatamente anestetizzato e trattato umanamente. 2
Procedura
1. Pianificazione prechirurgica
Sebbene le linee guida non richiedano che gli interventi chirurgici ai roditori vengano eseguiti in una struttura chirurgica dedicata, l'area utilizzata deve essere igienizzata con un disinfettante per superfici dure appropriato, che deve essere utilizzato in conformità con le concentrazioni e i tempi di contatto elencati dal produttore. L'area dovrebbe anche essere mantenuta libera da disordine e non essere nella linea diretta dei condotti di alimentazione e scarico, poiché le correnti d'aria potrebbero contribuire all'ipotermia dell'animale. L'accesso alla stanza dovrebbe essere limitato quando vengono condotte procedure chirurgiche. Un'area per la preparazione chirurgica (in particolare per la rimozione dei peli dell'animale), e per il recupero e la cura postoperatoria, dovrebbe anche essere designata e nelle immediate vicinanze, se non all'interno della sala operatoria. In generale, se gli interventi chirurgici vengono eseguiti di routine in un'area specifica, l'area non deve essere utilizzata per altre attività.
I preparati preoperatori dovrebbero includere un esame fisico del paziente chirurgico per identificare eventuali condizioni di salute di base che possono interferire con l'intervento chirurgico. Poiché i roditori hanno un tasso metabolico così elevato e riserve di grasso molto limitate, non dovrebbero essere a digiuno prima dell'intervento chirurgico. Lo stato di idratazione dell'animale deve essere valutato mediante un test di elasticità cutanea. La pelle sopra le spalle viene sollevata delicatamente. In un animale normalmente idratato, la pelle ricadrà rapidamente in posizione, mentre in un animale disidratato, la pelle non tornerà immediatamente nella sua posizione normale. Dovrebbe anche essere notato l'aspetto generale, come la postura e le condizioni del pelo. Un animale che mostra una postura curva, o ha un pelo trasandato, può covare una malattia. L'esame deve essere eseguito poco prima della somministrazione dell'anestesia e qualsiasi condizione anomala deve essere annotata sulla tabella dell'animale. 2 Infine, per prepararli all'intervento chirurgico devono essere fatte considerazioni sull'anatomia e la fisiologia del ratto o del topo.
2. Piattaforma
Entrambe le specie hanno un elevato rapporto superficie/volume corporeo che le rende suscettibili all'ipotermia durante le procedure chirurgiche, specialmente quando la chirurgia espone la cavità corporea. Gli sforzi per prevenire l'ipotermia includono l'uso di una piattaforma chirurgica riscaldata.
La piattaforma utilizzata per la chirurgia dei roditori, che di solito è costruita in acciaio inossidabile o plastica dura, deve essere coperta con un materiale isolante o una fonte di calore supplementare per evitare che il calore corporeo dell'animale fuoriesca durante la procedura. Le fonti di calore supplementari includono cuscinetti riscaldanti a circolazione d'acqua, coperte per il riscaldamento forzato dell'aria, lampade di calore o uno strato di imbottitura in schiuma che copre la piattaforma chirurgica. Le piattaforme chirurgiche con una fonte di calore integrata sono disponibili in commercio. Tutte le piattaforme devono essere di un materiale facilmente disinfettato e impermeabile all'umidità.
Altri metodi per prevenire l'ipotermia includono l'uso di isolanti di massa, il posizionamento di materiali isolanti tra l'animale e la piattaforma chirurgica e l'utilizzo di fonti di calore esterne. 3 Gli isolatori di massa intrappolano l'aria all'interno di una matrice di fibre, producendo "aria ferma" che circonda l'animale. Le coperte di acqua calda circolanti possono essere utilizzate sotto il paziente. Questa apparecchiatura è disponibile in varie dimensioni, dal roditore all'equino, e consente un supporto termico preciso con termostati integrati.
Le fonti di riscaldamento attivate chimicamente possono essere utilizzate una sola volta o riutilizzabili. Un tipo è costituito da un sacchetto di plastica riempito con una soluzione chimica e un disco metallico, che quando viene premuto crea una reazione esotermica. Ciò fa sì che il liquido si solidifichi e rilasci calore. Generalmente, hanno una quantità limitata di calore e sono adatti solo per procedure brevi. Altre fonti di riscaldamento chimico sono disponibili come solidi a temperatura ambiente, ma quando riscaldati, diventano liquidi. Quando un animale viene posizionato sul pad, il liquido rilascia calore e il contenuto del pad si solidifica mentre si raffredda. Questi possono rilasciare calore per un periodo molto più lungo. Come vantaggio, non possono superare la temperatura di attivazione (~ 39 ° C), eliminando così la necessità di un termostato.
Le confezioni d'acqua sono disponibili come bottiglie di acqua calda costituite da un sacchetto di gomma o silicone con tappo. Le confezioni vengono riempite con acqua calda che poi emette calore sulla superficie esterna. Il pacco perderà gradualmente calore man mano che l'acqua si raffredda. Una versione più moderna è costituita da un foglio di plastica con tessuto permeabile all'acqua aderente alla parte superiore. Lo spazio tra è riempito con una polvere idrofila, che assorbe acqua e si gonfia. Può essere utilizzato sia come fonte di calore che come fonte di raffreddamento. A seconda della qualità dei materiali, può essere riutilizzato e riscaldato in un forno a microonde o immerso in acqua calda.
Devono essere prese precauzioni quando si utilizzano fonti di calore esterne. La temperatura corporea deve essere monitorata con una sonda rettale o un termometro posizionato accanto all'animale sulla fonte di calore. Tutte le fonti di calore esterne devono essere controllate per i difetti prima dell'uso.
3. Rimozione dei peli
Il sito chirurgico deve essere preparato per ridurre al minimo la contaminazione dell'incisione. I capelli devono essere strettamente tagliati o rimossi con una crema depilatoria chimica, che scioglie i capelli al follicolo. 2,3 Sebbene il taglio dei capelli possa talvolta essere eseguito su un animale cosciente con moderazione manuale, l'applicazione della crema depilatoria deve essere eseguita solo su un animale anestetizzato per prevenire l'ingestione del prodotto, danni agli occhi e rimozione dei peli in eccesso. La rasatura con un rasoio è un'opzione se non ci sono alternative. Questo metodo richiede abilità tecnica, tempo extra e pazienza per prevenire le lacerazioni alla pelle. Il campo chirurgico deve essere sufficientemente ampio da consentire l'incisione e la sutura senza inclusione della pelliccia nella ferita chirurgica, ma il più piccolo possibile da evitare l'esacerbazione dell'ipotermia.
- Ritaglio
- I capelli possono essere tagliati utilizzando tagliatrici elettriche o a batteria, preferibilmente con una lama chirurgica A40. La larghezza della lama dovrebbe essere considerata. Una lama standard da 2" può essere utilizzata per i ratti, mentre una lama da 1/2-1" è più appropriata per i topi.
- I capelli sono tagliati contro la direzione della crescita. Allunga la pelle per stabilizzarla, poiché i roditori hanno un attaccamento allentato della pelle al muscolo sottostante.
- Bisogna fare attenzione per evitare di graffiare o tagliare la pelle. L'estremità piatta della lama viene posizionata sulla pelle quando si tagliano i capelli. La lama non deve mai essere usata con i denti perpendicolari alla pelle.
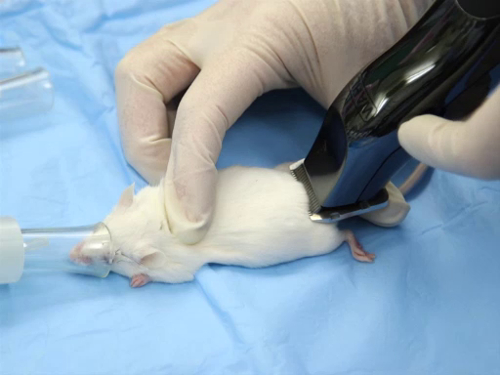
Figura 1. La posizione corretta di un tagliacapelli durante la rasatura.
- Creme o lozioni depilatorie chimiche
- Applicare il prodotto nell'area del sito chirurgico.
- Dopo 10 minuti, la pelle deve essere completamente risciacquata e pulita da tutte le tracce del depilatorio per evitare irritazioni o ustioni chimiche alla pelle.
4. Scrub chirurgico
Le soluzioni di scrub chirurgico da utilizzare dovrebbero: 1) ridurre sostanzialmente i microbi presenti sulla pelle e contenere una preparazione antimicrobica non irritante; 2) possiedono un ampio spettro di proprietà antimicrobiche; 3) essere ad azione rapida; e 4) hanno un'attività persistente e cumulativa.
Le due soluzioni di scrub detergente comunemente usate sono clorexidine e iodofori. Le soluzioni di clorexidina sono efficaci contro batteri e virus anche in presenza di materia organica. Al contrario, gli iodofori hanno una vasta gamma di azione microbicida, ma la loro efficacia è ridotta in presenza di materiale organico; l'attività residua è inferiore a quella delle clorexidine.
I risciacqui utilizzati tra gli scrub sono acqua sterile o alcool. Le soluzioni a base alcolica contenenti il 60-95% di alcol hanno una grande azione antimicrobica attraverso la denaturazione delle proteine. 2 Tuttavia, l'alcol può essere un forte irritante per la pelle. L'acqua sterile è efficace nel risciacquare l'area, ma non ha proprietà antimicrobiche.
- Utilizzare una spugna di garza inumidita per rimuovere i detriti grossolani tra cui capelli e peli.
- La soluzione detergente antisettica imbevuta su una garza viene applicata sulla pelle a partire dal sito di incisione. La disinfezione dovrebbe iniziare lungo la linea di incisione ed estendersi verso l'esterno in uno schema circolare.
- Il risciacquo antisettico viene quindi applicato a partire dal sito di incisione. La pelle viene pulita in uno schema circolare a spirale dalla linea di incisione alla periferia del campo chirurgico per rimuovere la soluzione detergente.
- Questo viene ripetuto tre volte.
- Dopo un risciacquo finale, una garza sterile viene posizionata sul campo chirurgico. Questa garza può essere bagnata con alcol o iodio. La garza verrà rimossa una volta che l'animale viene trasportato e posto in posizione su una piattaforma chirurgica o sul tavolo chirurgico / panca.
Le aree del corpo in cui non vengono utilizzati i metodi di lavaggio chirurgico standard includono gli occhi, la bocca e l'area anale. Poiché la superficie dell'occhio sarebbe danneggiata se venissero utilizzate soluzioni di scrub, uno scrub chirurgico viene eseguito solo sulle palpebre dopo aver instillato un unguento protettivo nell'occhio. In alcune situazioni, una soluzione salina fisiologicamente equilibrata viene utilizzata per lavare l'occhio per rimuovere i detriti grossolani e per diluire eventuali batteri a un livello accettabile per un intervento chirurgico. La bocca si rivela anche difficile da pulire sufficientemente per la chirurgia. Può essere risciacquato con una soluzione salina fisiologicamente equilibrata per diluire eventuali batteri; tuttavia, è importante evitare l'uso di troppa soluzione salina, che potrebbe causare l'aspirazione del fluido. Gengive, denti e lingua possono essere puliti con un antisettico non tossico. Tuttavia, l'applicazione di soluzioni alle mucose può comportare un assorbimento sistemico. Gli interventi chirurgici nell'area anale, come la riduzione chirurgica dei prolassi rettali, non sono considerati interventi chirurgici puliti. L'uso di alcune soluzioni antisettiche può aumentare il danno tissutale e prevenire o prolungare la guarigione. L'uso di una soluzione salina fisiologicamente equilibrata per lavare l'area pulita dai detriti grossolani è il metodo preferito di preparazione chirurgica. 2,4
5. Posizionamento
Il posizionamento del paziente per le procedure addominali comporta il fissaggio degli arti dell'animale prono sulla piattaforma con nastro adesivo o legatura. Quando si utilizza una legatura per estendere gli arti, bisogna fare attenzione a evitare che la circolazione ai piedi sia compromessa, per evitare un'eccessiva tensione sugli arti e un allungamento estremo degli arti che potrebbe compromettere le articolazioni e per evitare l'impedimento della respirazione. Le cravatte dovrebbero essere a rilascio rapido con solo un mezzo anello di aggancio sopra l'arto. Alcune piattaforme disponibili in commercio sono dotate di retrazione degli arti incorporata che consiste in ganci o anelli di filo di acciaio inossidabile o catena a sfera, che possono essere regolati in base alle dimensioni dell'animale. Se si utilizza del nastro, deve essere aderito a superfici asciutte.
6. Drappeggio
Una volta che l'animale è preparato e posizionato sulla piattaforma chirurgica, i teli chirurgici vengono utilizzati per prevenire la contaminazione del materiale di sutura e per mantenere un campo sterile nel sito chirurgico. I drappi possono essere un materiale di stoffa riutilizzabile, un materiale monouso di carta o un materiale adesivo plastico usa e getta.
Le tende di carta usa e getta hanno una matrice di fibra intrecciata per la resistenza che consente il taglio in qualsiasi forma o dimensione, incluso il taglio di una fenestrazione o l'apertura nel drappo, senza strappare o sfilacciare i bordi tagliati. Sono anche repellenti all'umidità. I teli monouso possono essere acquistati preconfezionati e presterilizzati in una varietà di dimensioni e forme. Le tende di stoffa non sono progettate per essere tagliate dal chirurgo per creare una fenestrazione. Sono acquistati con una fenestrazione del bordo pretagliata e rilegata. Le tende di stoffa richiedono il lavaggio e la sterilizzazione. Se curati bene, le tende di stoffa possono durare per anni, il che le rende un investimento economico.
Sia le tende di carta che di stoffa sono tenute in posizione con morsetti per asciugamani attraverso la pelle dell'animale se si tratta di un roditore più grande, come un topo adulto. Per i roditori più piccoli, il drappo non è apposto sulla pelle, il che richiede vigilanza e cura da parte del chirurgo per non rimuovere o spostare il drappo una volta posizionato sull'animale.
I teli adesivi sono trasparenti o opachi. Le tende trasparenti sono preferite per gli interventi chirurgici dei roditori, in quanto consentono la visualizzazione diretta dell'animale. Alcuni teli di plastica sono una combinazione di plastica e carta, con l'area di plastica direttamente sopra l'animale e l'area di carta che definisce il campo sterile esteso. La porzione del drappo che si trova direttamente sopra il sito di incisione chirurgica è progettata per aderire all'area dell'incisione. Il chirurgo può quindi tagliare direttamente attraverso la plastica quando si effettua l'incisione cutanea. L'involucro di plastica sterilizzato è stato accettato come materiale economico e utile per gli interventi chirurgici dei roditori. Bisogna fare attenzione per evitare la costrizione del movimento per la respirazione quando l'involucro è posizionato intorno al paziente. L'involucro conserverà il calore corporeo, consentirà la visualizzazione del paziente e fornirà una barriera all'umidità tra il campo sterile e l'animale. Può anche servire per aiutare nel posizionamento e nella tenuta dell'animale per l'intervento chirurgico al posto della fissazione degli arti.
I teli di qualsiasi tipo devono essere accuratamente spiegati per evitare il contatto con aree, attrezzature e personale non sterili; non dovrebbero mai essere spiegati scuotendo o agitando.
- Drappeggi di carta: nel metodo Single Drape, il drappo viene aperto per consentire il taglio della fenestrazione se non è pretagliato.
- Il chirurgo posizionerà il drappo sopra l'animale tenendo le mani sul lato del drappo che non toccherà il paziente.
- Il drappo viene regolato in modo che il campo chirurgico sia visibile attraverso la fenestrazione.
- Il drappo è tenuto in posizione con morsetti per asciugamani attraverso la pelle dell'animale nel caso di ratti più grandi.
- Carta o plastica con una finestra adesiva
- Un drappo con una finestra adesiva richiede la desquamazione dell'area della carta per consentire all'area adesiva di aderire al campo chirurgico.
- Quando si apre il drappo sterile, l'area adesiva è generalmente la regione più alta ed è facilmente accessibile al chirurgo.
- Una volta scoperto l'adesivo, il drappo viene accuratamente aperto e ruotato in modo che il lato appiccicoso sia rivolto verso l'animale.
- È imperativo che il drappo sia posizionato correttamente, poiché una volta che l'adesivo entra in contatto con l'animale non sarà in grado di essere regolato.
- Il chirurgo deve premere delicatamente l'adesivo sul campo chirurgico per creare un sigillo con la pelle.
- Tende di stoffa
- I teli di stoffa feneurta non devono essere tagliati, quindi è responsabilità del chirurgo selezionare un drappo con un'apertura sufficientemente grande per esporre adeguatamente l'area chirurgica, ma non così grande da consentire l'esposizione di eventuali superfici corporee non rasate e impreparate.
- Il drappo è accuratamente aperto per rivelare la fenestrazione.
- Il chirurgo posizionerà il drappo sopra l'animale, mantenendo le mani sul lato del drappo che non toccherà il paziente.
- Il drappo viene regolato in modo che il campo chirurgico sia visibile attraverso la fenestrazione.
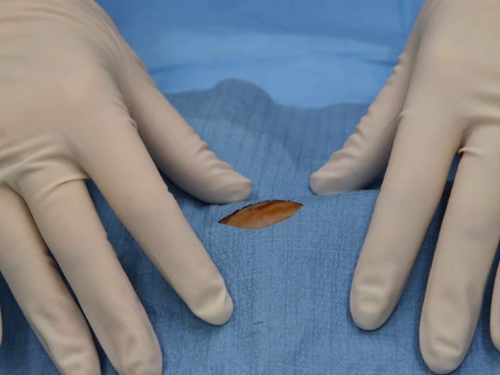
Figura 2. Campo chirurgico visibile attraverso la fenetrazione di un drappo correttamente posizionato.
- Tende adesive: un materiale economico e utile per gli interventi chirurgici dei roditori. 5
- Il drappo deve essere estratto dal rotolo in modo da garantire che la sezione utilizzata rimanga sterile.
- L'assistente chirurgico apre la scatola e tira fuori una lunghezza dell'involucro, facendo attenzione a evitare di toccarlo alla scatola o a qualsiasi altra superficie.
- Il chirurgo afferra l'involucro su ciascun lato e l'assistente taglia l'estremità che stanno tenendo lontano (circa 3-4 pollici).
- Dopo aver scartato il bordo tagliato, l'assistente taglia anche la sezione dal resto del rotolo.
- Il chirurgo afferra un lato dell'involucro e lo posiziona sopra l'animale.
- Le proprietà dell'involucro gli consentono di aderire a tutte le superfici.
- Il chirurgo preme il film sull'animale e crea un campo sterile.
- Non è necessario utilizzare morsetti per asciugamani o preoccuparsi che il drappo si sposti.
- Bisogna fare attenzione ad evitare la costrizione del movimento per la respirazione. L'involucro conserverà il calore corporeo, consentirà la visualizzazione del paziente e fornirà una barriera all'umidità tra il campo sterile e l'animale.
7. Monitoraggio intraoperatorio
I pazienti anestetizzati devono essere monitorati per la temperatura corporea, la respirazione e la frequenza cardiaca fino a quando non sono completamente recuperati.
La temperatura corporea può essere monitorata direttamente o indirettamente. Per il monitoraggio diretto, è necessario utilizzare una sonda rettale progettata specificamente per i roditori. I termometri rettali per piccoli animali, a mercurio o digitali, sono troppo grandi per l'uso in topi e ratti senza danni allo sfintere anale e ai tessuti rettali. Nei ceppi sensibili, il loro uso potrebbe precipitare il prolasso rettale. Il monitoraggio indiretto consiste nel posizionare un termometro accanto all'animale o sotto il corpo su una fonte di riscaldamento esterna. Anche se questo non fornirà una temperatura corporea esatta, può indicare l'efficacia della fonte di calore e consentire regolazioni per ridurre o aumentare il calore secondo necessità.
È difficile auscultare la frequenza cardiaca e contare le respirazioni su piccoli roditori senza attrezzature specializzate.
La maggior parte del monitoraggio è visivo e indicherà solo la presenza o l'assenza di respirazioni toraciche o addominali. Le frequenze cardiache sono valutate come presenti o assenti mediante palpazione o osservazione visiva del movimento fine della parete toracica. Questo potrebbe non essere possibile durante un intervento chirurgico a causa del drappeggio e delle piccole dimensioni dell'animale.
Un ulteriore monitoraggio può essere effettuato attraverso l'uso di elettrocardiogrammi (ECG) e pulsossimetri. Gli ECG valutano lo stato cardiaco di un roditore durante l'anestesia e l'intervento chirurgico. Il pulsossimetro utilizza la rifrazione della luce rossa e infrarossa per misurare l'ossigeno nel sangue arterioso. Questa tecnologia è stata adattata per l'uso nei roditori che usano la coda o una zampa. Entrambi i tipi di misurazioni non invasivhe in corso dei segni vitali del paziente sono facilmente accessibili con un'interruzione minima del campo chirurgico.
8. Monitoraggio postoperatorio
Si dovrebbe prendere in considerazione l'utilizzo di una piastra riscaldante sotto la gabbia di recupero post-operatorio. Inoltre, l'analgesia preventiva e postoperatoria deve essere fornita quando possibile. Le disposizioni di analgesia sono più efficaci nel ridurre l'intensità della stimolazione dolorosa quando somministrata prima dell'evento doloroso. I vantaggi dell'uso preventivo di analgesici includono la riduzione dell'intensità della stimolazione dolorosa, il miglioramento del livello di comfort dell'animale dopo l'intervento chirurgico, la riduzione della quantità di anestesia necessaria per mantenere un piano chirurgico e un recupero più agevole dall'anestesia una volta conclusa la procedura. I farmaci preventivi e postoperatori comunemente usati sono mostrati nella Tabella 1. 6
| Classe di droga | Nome | Dosaggio | Frequenza |
| Farmaco antinfiammatorio non steroideo (sostanza non controllata) | Ketoprofene | 2-5 mg/kg di topi SC 5 mg/kg di ratti SC |
ogni 12–24 ore ogni 12–24 ore |
| Farmaco antinfiammatorio non steroideo (sostanza non controllata) | Flunixin meglumina | 2,5 mg/kg di topi SC | ogni 12–24 ore |
| Farmaco antinfiammatorio non steroideo (sostanza non controllata) | Meloxicam | Topi PO da 5-10 mg/kg o topi SC da 1-2 mg/kg 5-10 mg/kg PO o 1-2 mg/kg SC o PO ratti |
ogni 12–24 ore ogni 24 ore ogni 12–24 ore ogni 24 ore |
| Farmaco antinfiammatorio non steroideo (sostanza non controllata) | Acetaminofene | 50 mg/kg SC/IP o 100 mg/kg di PO per ratti | ogni 8–12 ore |
| Oppioide (sostanza controllata) | Butorfanolo | 0,5-3,0 mg/kg SC o 0,2-2 mg/kg di topi IP 2,0 mg/kg SC 0,2-2 mg/kg di ratti IP |
ogni 4 ore ogni 2-4 ore ogni 4 ore ogni 2-4 ore |
| Oppioide (sostanza controllata) | Buprenorfina | 0,05-2,5 mg/kg di topi SC o IP 0,01 – 0,5 mg/kg di ratti SC |
ogni 6–12 ore ogni 8–12 ore |
| Oppioide (sostanza controllata) | Ossimorfone | 0,2-0,5 mg/kg di topi SC 0,2-0,5 mg/kg di ratti SC |
ogni 6–12 ore ogni 6–12 ore |
Tabella 1. Farmaci preventivi e postoperatori comunemente usati.
Applicazione e Riepilogo
Attraverso l'uso della tecnica asettica, l'incidenza dell'infezione postchirurgica è notevolmente ridotta. Ridurre al minimo il trauma tissutale durante la procedura, prendere precauzioni per prevenire l'ipotermia, controllare il dolore e il disagio postoperatorio e l'uso di integratori alimentari fino a quando l'animale non è in grado di deambulare normalmente ridurrà l'entità delle risposte metaboliche negative al processo chirurgico e aumenterà la probabilità di un intervento chirurgico di sopravvivenza di successo.
Vai a...
Video da questa raccolta:

Now Playing
Considerazioni per la chirurgia dei roditori
Lab Animal Research
22.6K Visualizzazioni

Tecniche di manipolazione e contenzione dei roditori
Lab Animal Research
175.9K Visualizzazioni

Procedure di assistenza di base
Lab Animal Research
28.1K Visualizzazioni

Fondamenti di allevamento e svezzamento
Lab Animal Research
35.9K Visualizzazioni

Identificazione dei roditori I
Lab Animal Research
55.1K Visualizzazioni

Identificazione dei roditori II
Lab Animal Research
25.7K Visualizzazioni

Amministrazione composta I
Lab Animal Research
101.3K Visualizzazioni

Amministrazione composta II
Lab Animal Research
35.2K Visualizzazioni

Amministrazione composta III
Lab Animal Research
31.7K Visualizzazioni

Somministrazione composta IV
Lab Animal Research
52.1K Visualizzazioni

Prelievo di sangue I
Lab Animal Research
172.8K Visualizzazioni

Astinenza di sangue II
Lab Animal Research
74.0K Visualizzazioni

Induzione e manutenzione dell'anestesia
Lab Animal Research
51.1K Visualizzazioni

Necroscopia diagnostica e prelievo di tessuti
Lab Animal Research
58.5K Visualizzazioni

Raccolta di tessuti sterili
Lab Animal Research
35.0K Visualizzazioni