Champignons filamenteux
Vue d'ensemble
Source : Laboratoires du Dr Ian poivre et Dr Charles Gerba - Université de l’Arizona
Auteur mettant en évidence : Bradley Schmitz
Les champignons sont des organismes eucaryotes hétérotrophes et à l’exception des levures, sont aérobies. Ils sont abondants dans les sols de surface et sont importants pour leur rôle dans le cycle des éléments nutritifs et la décomposition des matières organiques et les contaminants organiques. Blanc de champignons (phanerochaete chryosporium) par exemple, (Figure 1) sont connus pour dégrader des composés aromatiques de la pourriture.

La figure 1. Blanc de pourriture sur le bouleau.
Principles
Les sols contiennent généralement des millions de champignons par gramme, donc le sol est généralement dilué à l’aide d’une série de dilutions. Une série de dilution est faite en suspendant une quantité donnée de sol dans une solution de dispersion, tels que de l’eau désionisée. Les aliquotes des suspensions sont ensuite transférées à la nouvelle solution, jusqu'à ce que la suspension est suffisamment diluée pour permettre des colonies fongiques discrètes à croître sur les géloses. (Figure 2)
Après l’inoculation sur plusieurs boîtes de gélose répétées, les boîtes sont incubées à 25 ° C. Après que les colonies de champignons macroscopiques sont formés, ils sont comptés, comme illustré à la Figure 3. L’hypothèse étant qu’une colonie fongique est dérivé d’un organisme, le terme d' Unités formant colonies (UFC) est utilisée en fin de compte, les résultats exprimés en termes d’UFC par gramme de sol sec du four.
Comtes de fongiques cultivables normales d’un sol fertile sont de l’ordre de 106-106 « propagules fongiques » (spores, hyphes ou fragments d’hyphes) par gramme de sol sec. Dénombrements cultivables ont été utilisés pour l’énumération des organismes depuis le XIXe siècle. Ils continuent d’être utilisés aujourd'hui, car ils sont peu coûteux à réaliser, nécessite peu de travail, sont rapides et sont assez reproductibles. Toutefois, ils souffrent d’un certain nombre d’erreurs qui doivent être considérés lorsqu’on évalue les résultats. Le plus important de ces erreurs est le fait que beaucoup d’organismes n'est pas culture sur plaques de médias.

Figure 2. Dilution et la technique de placage. Ici, la suspension de sol dilué est incorporée directement dans le milieu gélosé, plutôt que de surface appliqué à l’instar de l’électrodéposition de propagation. De environnement & Pollution Science, 2ème éd., Academic Press, San Diego, CA
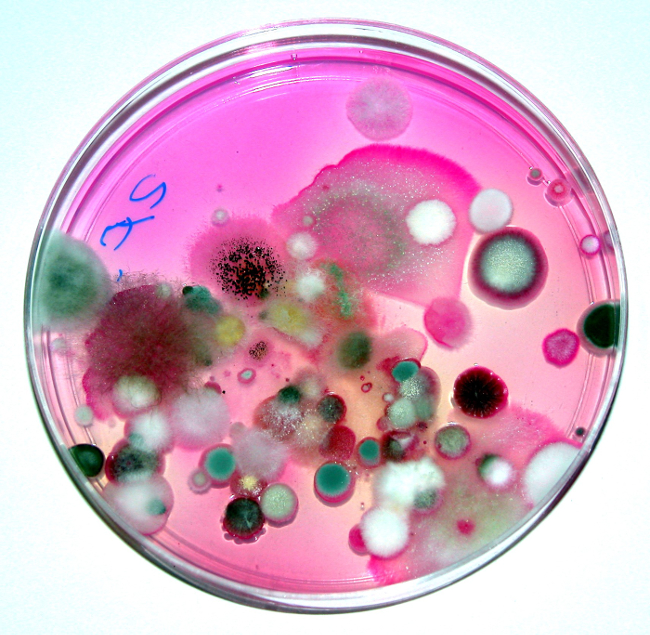
Figure 3. Sur le sol des champignons isolés d’un sol de surface cultivé dans une boîte de Pétri contenant du Rose Bengale Agar. Photo courtoisie K.L. Josephson. De environnement & Pollution Science, 2ème éd., Academic Press, San Diego, Californie.
Procédure
1. préparation des échantillons du sol
- Tout d’abord, déterminer la teneur en eau initiale du sol par une nuit de séchage d’une quantité connue de la terre humide, réexaminant et le sol sec. L’équation pour déterminer la teneur en eau initiale du sol est :

(Équation 1)
où :
MC = teneur en eau
W = poids net
D = poids sec - Calculer la quantité d’eau qui doit être ajoutée à 25 g de sol pour augmenter la teneur en humidité du sol à 10 % sur la base du poids sec.
- Ensuite, ajoutez la quantité d’eau à 25 g du sol.
- Couvrir le récipient d’une pellicule plastique et percer le film plusieurs fois avec une sonde pour permettre l’aération pendant l’incubation. Fixez le film avec une bande élastique.
- Peser le sol, puis envelopper Incuber l’échantillon à la température ambiante pendant une semaine.
2. l’incubation et l’Inoculation champignon
- Après que l’incubation est terminée, peser l’échantillon de sol avec l’enveloppe et la bande de caoutchouc. Calculer la perte de poids en raison de la perte d’humidité.
- Calculer la teneur en humidité du sol nouveau.
- Ensuite, préparer une série de dilution au 1/10 des sols tel qu’illustré à la Figure 2. Cela se traduira par des dilutions de 10-1 (bouteille à), 10-2 (tube B), 10-3 (tube C), 10-4 (tube D) et 10-5 (tube E) g de sol par des suspensions de mL.
- Préparer stérile Rose Bengale-streptomycine géloses. Le Rose Bengale et streptomycine inhibent la croissance bactérienne. Pour les sols très fertiles où les populations microbiennes du sol sont élevées, les dilutions choisies devraient être plus élevées, c'est-à-dire, 10-3, 10-4et 10-5, g de sol par plaque.
- À chacun de la 10-3 assiettes, ajouter 0,1 mL de la dilution tube 10-2, et réparties sur la surface de la gélose à l’aide d’une flamme ethanol stérilisé épandeur de verre. Parce qu’une quantité de 0,1 mL est plaquée, ce qui rend l' efficace dilution 10-3. Répétez ces étapes pour toutes les dilutions.
- Incuber les plaques à température ambiante pendant une semaine.
3. colonie comptant et l’examen par microscopie
- Faire des comptages de colonies à un seul et même dilution de chaque sol. Les plaques qui sont comptées devraient avoir des colonies dénombrables discrets. Recouvert de plaques ne devraient pas être comptées. De même, les plaques avec moins de 10 colonies ne devraient pas être comptées. Notez et décrire les caractéristiques culturelles de trois différentes colonies.
- Préparer pression ruban (ruban transparent) bâtis sur des lames de microscope détaillée étude utilisant la procédure suivante :
- Déposer une goutte de lactophénol montage fluide au centre d’une lame de verre propre
- Coupez une bande de ruban de cellophane clair environ 3 cm de long du rouleau de stock. Pour éviter de contaminer la surface adhésive, utiliser la pince lors de la manipulation de la bande. Une aiguille dissection aidera à libérer le ruban de la pince.
- Le côté adhésif du ruban adhésif est appliqué à la surface d’une colonie de champignon sporulant. Prendre soin d’éviter une pression excessive sur la bande ou une masse trop dense d’hyphes et les spores seront recueillies.
- Retirez la bande de contact avec la colonie de champignon et appliquez-le, côté adhésif vers le bas, la goutte de liquide de montage sur la lame de verre. Frottez doucement la bande avec un instrument lisse et plat à bulles d’air express.
- Examiner le support de bande au microscope sous l’objectif à immersion d’huile avec de l’huile.
- Identifier les deux genres de champignons différents, à l’aide de la clé d’identification fongique fournis (Figure 4).

La figure 4. « « « « Clé d’identification fongique.
Résultats
Dénombrement des colonies
Le nombre de colonies fongiques par gramme de sol est égal au nombre de colonies dénombrées sur la plaque, multipliée par l’inverse de la dilution. Par exemple, si 46 colonies sont dénombrées à une dilution de 10-5, puis l’UFC par gramme de sol est de 46 x 105 ou 4,6 x 106.
Identification de trois différents genres fongiques
Les champignons peuvent être identifiés au microscope par l’examen des organes de fructification et spores. Une clé d’identification de champignons peut faciliter ce processus. (Figure 4) Les types de champignons communs observés incluent Penicillium et Aspergillus.
Applications et Résumé
Dilution et le placage des champignons du sol peuvent servir comme une indication de la santé d’un sol. Normalement, un sol fertile « sain » aura 105 à 106 champignons par gramme de sol. Il peut également être utilisé pour isoler les cultures pures de certains champignons, évaluées par la suite pour des propriétés spécifiques, telles que la capacité de dégrader les composés organiques. Ceux-ci peuvent être préjudiciables à l’instar des champignons de pourriture blanche ou bénéfique lorsque toxiques organiques sont dégradés par biodégradation. Autres utilisations des cultures pures de champignons comprennent l’isolement des champignons pour les antibiotiques. Par exemple, le premier antibiotique était jamais la pénicilline, produite par le champignon terricole Penicillium. Cela a été découvert par Sir. Alexander Fleming en 1929.
References
- Pepper, I.L., Gerba, C.P., Brusseau, M. Environmental & Pollution Science, 2nd Ed. Academic Press, San Diego, CA. (2006).
- Pepper, I.L., Gerba, C.P. Environmental Microbiology, A Laboratory Manual, 2nd Ed. Academic Press, Boston, MA. (2005).
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Champignons filamenteux
Environmental Microbiology
57.3K Vues

Détermination de la teneur en humidité du sol
Environmental Microbiology
359.3K Vues

Technique aseptique en sciences de l'environnement
Environmental Microbiology
126.4K Vues

Coloration de Gram des bactéries provenant de sources environnementales
Environmental Microbiology
100.2K Vues

Visualisation des micro-organismes du sol grâce aux lames de contact et à la microscopie
Environmental Microbiology
42.2K Vues

Extraction d'ADN communautaire à partir de colonies bactériennes
Environmental Microbiology
28.8K Vues

Détection des micro-organismes environnementaux avec la réaction en chaîne par polymérase et l'électrophorèse sur gel
Environmental Microbiology
44.5K Vues

Analyse d'ARN d'échantillons environnementaux à l'aide de la RT-PCR
Environmental Microbiology
40.4K Vues

Quantification des micro-organismes et des virus environnementaux à l'aide de la qPCR
Environmental Microbiology
47.8K Vues

Analyse de la qualité de l'eau via des organismes indicateurs
Environmental Microbiology
29.5K Vues

Isolement des bactéries fécales à partir des échantillons d'eau par filtration
Environmental Microbiology
39.3K Vues

Détection de bactériophages dans des échantillons environnementaux
Environmental Microbiology
40.7K Vues

Culture et dénombrement des bactéries dans un échantillon de sol
Environmental Microbiology
184.3K Vues

Analyse de la courbe de croissance bactérienne et ses applications environnementales
Environmental Microbiology
295.9K Vues

Dénombrement des algues via une méthodologie de culture
Environmental Microbiology
13.8K Vues