Culture et dénombrement des bactéries dans un échantillon de sol
Vue d'ensemble
Source : Laboratoires du Dr Ian poivre et Dr Charles Gerba - Université de l’Arizona
Les auteurs mettant en évidence : Bradley Schmitz et Luisa Ikner
Sols superficiels sont un mélange hétérogène de particules inorganiques et organiques qui se combinent ensemble pour former des agrégats secondaire. Au sein et entre les agrégats sont vides ou pores qui contiennent à la fois visuellement de l’air et l’eau. Ces conditions créent un écosystème idéal pour les bactéries, donc tous les sols contiennent de vastes populations de bactéries, généralement plus 1 million par gramme de sol.
Les bactéries sont les plus simples de micro-organismes, appelées procaryotes. Au sein de ce groupe de procaryote, il existe les microbes filamenteux appelés actinomycètes. Actinomycètes sont en fait des bactéries, mais ils sont fréquemment considérés comme un groupe unique au sein de la classification des bactéries en raison de leur structure filamenteuse, qui se compose de plusieurs cellules enchaînent aux hyphes de forme. Cette expérience utilise des médias affaire de glycérol qui choisissent des colonies actinomycète, au cours de la dilution et le placage. En général, les actinomycètes sont environ 10 % de la population bactérienne totale. Bactéries et actinomycètes sont trouvent dans chaque environnement sur terre, mais l’abondance et la diversité de ces microbes dans le sol est sans pareil. Ces microbes sont également essentiels pour la vie humaine et l’affect, ce que les gens de mangent, boivent, respirent ou touchent. En outre, il y a des espèces de bactéries qui peuvent infecter les personnes et causer des maladies, et il existe des bactéries qui peuvent produire des produits naturels capables de guérir les gens. Actinomycètes sont particulièrement importantes pour la production d’antibiotiques, tels que la streptomycine. Les bactéries sont critiques pour les nutriments cyclisme, la croissance des plantes et la dégradation des contaminants organiques.
Les bactéries sont très diversifiées en termes de nombre d’espèces qui peuvent être trouvés dans le sol, en partie parce qu’ils sont physiologiquement et métaboliquement diverses. Les bactéries peuvent être hétérotrophe, ce qui signifie qu’ils utilisent des composés organiques, comme le glucose, pour l’alimentation et l’énergie, ou autotrophe, ce qui signifie qu’ils utilisent des composés inorganiques, tels que le soufre élémentaire, pour l’alimentation et l’énergie. Ils peuvent aussi être aérobies, en utilisant de l’oxygène pour la respiration, ou anaérobie, utilisant combiné formes d’oxygène, tels que le nitrate ou le sulfate, respire. Certaines bactéries peuvent utiliser de l’oxygène ou combiner des formes d’oxygène et sont appelés anaérobies facultatifs.
Principles
Énumérer le nombre de bactéries présentes dans un échantillon de sol consiste à utiliser la dilution et la méthodologie de placage. Cette méthode utilise agar comme médium pour la croissance bactérienne, un processus appelé, « technologie cultivable ». En raison du grand nombre de bactéries présentes dans les sols, un petit échantillon de sol est en série dilué dans l’eau, avant d’être plaqué sur la gélose dans un plat de Pétri. En règle générale, une petite quantité de sol contenu dans 0,1 à 1 mL de la suspension de sol dilué est « spread » sur la surface de la gélose. Les plaques contiennent agar, qui est fondu quand chaud, mais solides lorsqu’elles sont refroidies. En plus de l’agar, nutriments, tels que la levure de peptone ou d’un produit commercialement disponible en R2A, sont ajoutés au milieu pour permettre la croissance des bactéries hétérotrophes.
Dilution et le placage est une technologie relativement simple et peu coûteuse pour le dénombrement des bactéries du sol. Cependant, il y a plusieurs inconvénients à la technique. Quelques erreurs et hypothèses liées avec des essais de dilution et le placage courantes sont les suivantes : il est supposé que chaque bactérie de sol unique donne naissance à une colonie, mais en réalité une colonie peut-être découler d’un massif de cellules, ce qui entraîne une sous-estimation du véritable comte cultivable. Au cours de la dilution en série du sol, les particules de sol peuvent sédimenter (chute vers le bas), donc le vrai aliquote du sol n’est pas transmis dans la dilution suivante. Beaucoup de microbes du sol est viable mais non cultivable. Les bactéries en croissance lentes vous risquez pas dans des colonies visibles dans un laps de temps raisonnable (1 à 2 semaines).
En outre, les bactéries anaérobies ne se développent pas dans des conditions aérobies, et bactéries qui poussent sont sélectionnés pour par les nutriments ajoutés au milieu. Ainsi R2A choisit pour les bactéries hétérotrophes, tandis que le soufre élémentaire sélectionne pour les comburants soufre autotrophes. Globalement, on estime que seulement 0,1 à 1 % de toutes les bactéries du sol peuvent être cultivées. Par conséquent, dilution et ensemencement de bactéries telluriques ne représente que bactéries cultivables et sous-estime la population vrai sol viable d’un à deux ordres de grandeur. Un exemple de colonies de bactéries hétérotrophes qui ont résulté de placage et de la dilution de sol est illustré à la Figure 1. Il est à noter qu’environ 1 million de cellules bactériennes sont nécessaires pour une colonie soit visible à le œil nu.
Cette expérience démontre la dilution et la méthodologie utilisée pour énumérer le nombre de bactéries dans un échantillon de sol de placage. Plus précisément, les deux milieux est utilisés : un est conçu pour toutes les bactéries et l’autre qui sélectionne des actinomycètes. Une fois que les colonies bactériennes ont cultivé sur la gélose, isoler les cultures pures des colonies sélectionnées en utilisant une technique de plaque de strie. Ces cultures pures peuvent alors être analysées et caractérisés pour les fonctions et caractéristiques spécifiques.
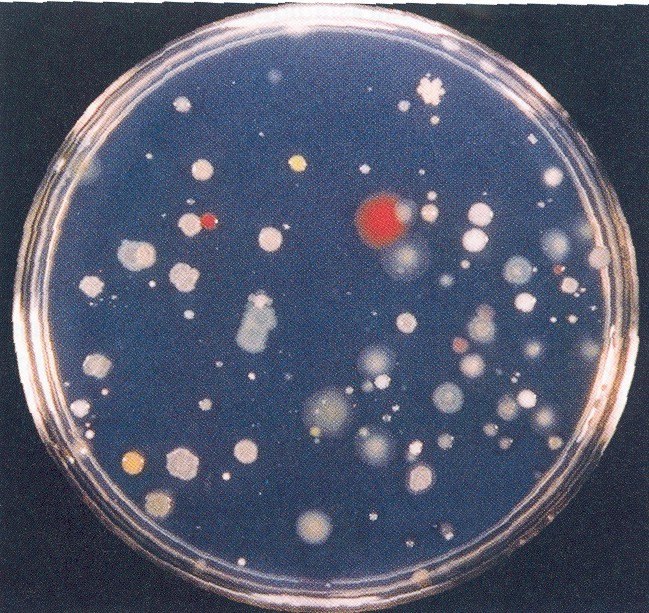
Figure 1. Les colonies hétérotrophes sur un R2une gélose. Un certain nombre de colonies isolées dont la morphologie diversifiée apparus après dilution et d’enrichissement du sol. Autorisation d’utilisation accordée par Academic Press.
Procédure
1. préparation des Dilutions de sol
- Pour commencer la procédure, peser 10 g d’échantillon de sol et ajouter à 95 mL d’eau désionisée. Bien agiter la suspension et qualifier de « A ».
- Avant que le sol s’affaisse, prélever 1 mL de la suspension avec une pipette stérile et transférez-la sur un blanc 9-mL d’eau désionisée. Vortex soigneusement et l’étiquette « B ».
- Répétez cette étape de dilution trois fois, chaque fois avec 1 mL de la suspension précédente et un 9-mL désionisée vide. Ces étiquettes séquentiellement comme tubes C, D et E. Cela se traduit par des dilutions de 10-1 par le biais de 10-5 grammes / mL de sol
2. faire répandre des plaques pour Culture bactérienne
- Pour agrandir les colonies bactériennes, prendre trois boîtes de gélose de levure-peptone préparés à l’avance et étiquette les échantillons C, D et E. Vortex C, D et E et pipette 0,1 mL dans chaque assiette. Cela augmente la valeur de la dilution en outre, d’un facteur dix (C = 10-3, D = 10-4, E = 10-5).
- Ensuite, trempez un épandeur de verre dans l’éthanol. Placez le séparateur dans une flamme pendant quelques secondes à s’enflammer et brûler de l’éthanol. Cela va stériliser l’épandeur.
- Maintenez l’épandeur au-dessus de la première plaque jusqu'à ce que la flamme s’éteint. Ouvrir la plaque rapidement, maintient le couvercle fermer par. Touchez le séparateur à l’agar loin de l’inoculum (Inoculum = utilisés pour commencer une culture de cellules) se refroidir et s’étend ensuite la chute d’inoculum autour de la surface de la gélose jusqu'à disparaissent des traces de liquide. Replacez le couvercle de la plaque.
- Re-flamme de l’épandeur et répétez le processus avec la plaquette suivante, travailler rapidement pour ne pas contaminer l’agar avec organismes aéroportés
- Incuber les boîtes de bactéries à la température ambiante pendant 1 semaine. Assurez-vous que les plaques sont inversées au cours de l’incubation pour éviter les gouttes d’humidité par condensation de tomber sur la surface de la gélose.
3. la fabrication des plaques de propagation pour actinomycètes
- Pour cultiver des actinomycètes, prendre trois plaques de glycérol-caséine préparés à l’avance et les qualifier de B, C et D. en utilisant les techniques décrites précédemment, insérer la plaque 0,1 mL de la suspension, B, C et D. Les dilutions inférieures sont utilisées car les actinomycètes sont généralement présentes sous forme de 1/10ème de la population bactérienne (B = 10-2, C = 10-3, D = 10-4).
- Incuber les boîtes d’actinomycètes (inversés) à température ambiante pendant 2 semaines.
4. bactérien et comtes d’actinomycètes
- Après incubation, examiner toutes les plaques de bactéries avec soin et notez les différences dans la forme et la taille de la colonie. Lorsqu’il est cultivé sur la gélose, bactéries produisent des colonies visqueux, allant de l’incolore à orange vif, jaune ou rose. En revanche, actinomycètes colonies sont calcaires, ferme, coriace et casseront sous pression, où autres colonies bactériennes seront salir. Cela permet aux colonies à se distinguer par le toucher avec une anse stérile.
- Compter et noter le nombre de colonies bactériennes, y compris les actinomycètes. Ne compter que plaques avec 30-200 colonies par boîte.
5. isolement des Cultures pures
- Sélectionner l’un des plaques des colonies bactériennes individuelles. Plus de colonies peuvent être sélectionnés, s’il y a un intérêt particulier dans le sol. Utiliser une plaque de grande dilution, car il a tendance à avoir des colonies pures qui sont séparés de bien. Choisissez seulement les colonies qui sont bien séparées des colonies voisines et look morphologiquement distincts les uns des autres.
- Stériliser la boucle en plongeant dans de l’alcool et il flamber. Rapidement ouvrir la boîte de Pétri d’intérêt et appuyer sur la boucle à un point apparent dans l’agar pour la refroidir. Ensuite, retirer une petite quantité d’une colonie d’intérêt sur la boucle.
- Prendre une plaque de peptone-levure fraîche, faire une strie de quelques centimètres long sur un côté. Stériliser et refroidir à nouveau, puis faire une rayure qui traverse le streak initial que sur la première passe. Répétez cette procédure deux fois plus de la même manière. Cette « dilution » trainage se traduit par des cellules sur la boucle étant séparés l’un de l’autre. Placer la plaque dans un endroit sombre à incuber à température ambiante pendant deux semaines.
Résultats
Un échantillon de 10 g de sol ayant une teneur en humidité de 20 % sur la base du poids sec est analysé pour les bactéries cultivables viables par dilution et techniques de placage. Les dilutions sont faites comme indiqué dans le tableau 1. 1 mL de solution E est verser plaqué sur un milieu approprié et entraîne 200 colonies bactériennes.

Mais, pour 10 g de terre humide,
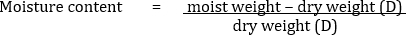
Par conséquent,

| Étape | Dilution | |
| 10 g de sol (poids/volume) | 95 mL de solution saline (solution A) | 10-1 |
| 1 mL de solution (volume/volume) | 9 mL de solution saline (solution B) | 10-2 |
| 1 mL de solution B (volume/volume) | 9 mL de solution saline (solution C) | 10-3 |
| 1 mL de solution C (volume/volume) | 9 mL de solution saline (solution D) | 10-4 |
| 1 mL de solution D (volume/volume) | 9 mL de solution saline (solution E) | 10-5 |
Tableau 1: Dilution et enrichissement des échantillons.
Applications et Résumé
Il y a deux applications fondamentales de dilution et le placage des bactéries du sol. La première application est le dénombrement des bactéries cultivables dans un sol particulier. La quantification du nombre de bactéries du sol donne une indication sur la santé des sols. Par exemple, s’il y a 106 à 108 bactéries cultivables présents par gramme de sol, cela serait considéré un certain nombre en bonne santé. A numéro inférieur à 106 gramme indique la santé des sols plus pauvres, qui peut-être être dues à un manque de nutriments que l'on trouve dans les sols de la matière organique ; stress abiotique imposées par les valeurs de pH de sol extrêmes (pH < 5 ou > 8) ; ou toxicité imposées par des contaminants inorganiques ou organiques anthropiques.
La seconde application majeure est la visualisation et l’isolement des cultures pures de bactéries. Les cultures pures par la suite peuvent être caractérisés et évalués pour des caractéristiques spécifiques qui peuvent être utiles dans des applications médicales ou environnementales. On peut citer : la production d’antibiotiques ; biodégradation des composés organiques toxiques ; ou des rhizobiums spécifiques utiles pour la fixation de l’azote par les cultures de légumineuses, comme les pois ou les haricots.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Culture et dénombrement des bactéries dans un échantillon de sol
Environmental Microbiology
184.7K Vues

Détermination de la teneur en humidité du sol
Environmental Microbiology
359.6K Vues

Technique aseptique en sciences de l'environnement
Environmental Microbiology
126.5K Vues

Coloration de Gram des bactéries provenant de sources environnementales
Environmental Microbiology
100.4K Vues

Visualisation des micro-organismes du sol grâce aux lames de contact et à la microscopie
Environmental Microbiology
42.4K Vues

Champignons filamenteux
Environmental Microbiology
57.4K Vues

Extraction d'ADN communautaire à partir de colonies bactériennes
Environmental Microbiology
28.9K Vues

Détection des micro-organismes environnementaux avec la réaction en chaîne par polymérase et l'électrophorèse sur gel
Environmental Microbiology
44.6K Vues

Analyse d'ARN d'échantillons environnementaux à l'aide de la RT-PCR
Environmental Microbiology
40.4K Vues

Quantification des micro-organismes et des virus environnementaux à l'aide de la qPCR
Environmental Microbiology
47.9K Vues

Analyse de la qualité de l'eau via des organismes indicateurs
Environmental Microbiology
29.6K Vues

Isolement des bactéries fécales à partir des échantillons d'eau par filtration
Environmental Microbiology
39.4K Vues

Détection de bactériophages dans des échantillons environnementaux
Environmental Microbiology
40.8K Vues

Analyse de la courbe de croissance bactérienne et ses applications environnementales
Environmental Microbiology
296.2K Vues

Dénombrement des algues via une méthodologie de culture
Environmental Microbiology
13.8K Vues